
- •ВВЕДЕНИЕ
- •1. Классы неорганических соединений
- •2. ХИМИЧЕСКИЙ ЭКВИВАЛЕНТ
- •3. СТРОЕНИЕ АТОМА И ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА
- •4. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
- •7. ЭНЕРГЕТИКА ХИМИЧЕСКИХ ПРОЦЕССОВ
- •8. СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ И РАВНОВЕСИЕ
- •9. РАСТВОРЫ
- •10. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ. ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ. ЭЛЕКТРОЛИЗ. КОРРОЗИЯ МЕТАЛЛОВ
- •11. ЖЕСТКОСТЬ ВОДЫ
- •БИБЛИОГРАФИЧЕСКИЙ СПИСОК
- •ПРИЛОЖЕНИЕ
29.Уксусная кислота и алюминий.
30.Азотная кислота (разбавленная) и железо.
7. ЭНЕРГЕТИКА ХИМИЧЕСКИХ ПРОЦЕССОВ
7.1. Вычислите изменение стандартной энтальпии реакции rΗ То используя данные приложения 2.
1.2Mg (к) + CO2 (г) = CO (г) + Zn (к);
2.C6H12O6 (к) + 6O2 (г) = 6CO2 (г) + 6H2O (г);
3.CaO (к) + H2O (ж) = Ca(OH)2 (к);
4.CaO (к) + CO2 (г) = CaCO3 (к);
5.CO2 (г) + C (к) = 2CO (г);
6.Ca(OH)2 (к) + CO2 (г) = CaCO3 (к) + H2O (ж);
7.N2O (г) + 2H2O (г) = NH4NO3 (к);
8.3Fe2O3 (к) + CO (г) = 2Fe3O4 (к) + CO2 (г);
9.Fe3O4 (к) + CO (г) = 3FeO (к) + CO2 (г);
10.4NH3 (г) + 5O2 (г) = 4NO (г) + 6H2O (г);
11.NH4NO3 (к) = N2O (г) + 2H2O (г);
12.C2H5OH (г) = C2H4 (г) + H2O (г);
13.2SO2 (г) + O2 (г) = 2SO3 (г);
14.PbO2 (к) + Pb (к) = 2PbO (к);
15.Cr2O3 (к) + Al (к) = 2Cr (к) + Al2O3 (к);
16.Fe2O3 (к) + 3CO (г) = 2Fe (к) + 3CO2 (г);
17.2NiO (к) + Al (к) = 3Ni (к) + Al2O3 (к);
18.Fe3O4 (к) + C (к) = 3FeO (к) + CO (г);
19.SnO2 (к) + Sn (к) = 2SnO (к);
29
20.3C2H2 (г) = C6H6 (ж);
21.C2H6 (г) + 7½O2 (г) = 2CO2 (г) + 3H2O (г);
22.C6H6 (г) + 15½O2 (г) = 6CO2 (г) + 3H2O (г);
23.C6H12O6 (к) = C2H5OH (ж) + 2CO2 (г);
24.4HCl (г) + O2 (г) = 2Cl2 (г) + 2H2O (г);
25.2H2S (г) + 3O2 (г) = 2SO2 (г) + 2H2O (ж);
26.2NO (г) + 3O2 (г) = 2 NO2 (г);
27.2CO2 (г) + 3H2O (г) = C2H5OH (ж) + 3O2 (г);
28.SO2 (г) + 2H2S (г) = 3S (к) + 2H2O (ж);
29.4NH3 (г) + 3O2 (г) = 2N2 (г) + 6H2O (ж);
30.CO (г) + H2O (г) = CO2 (г) + H2 (г).
Экзоили эндотермическая данная реакция?
7.2.Вычислите изменение стандартного изобарно-
изотермического потенциала rGТо реакции предыдущего задания, согласно следствию из закона Гесса.
7.3. Вычислите энтальпию образования f Η о298 соединения, выделенного цветом в уравнении реакции, используя указанный в термохимическом уравнении тепловой эффект реакции rΗ То и данные приложения 2.
1. |
H2O2 (ж) = H2O (ж) + ½O2 (г); |
rΗ То = -98,48 кДж/моль; |
2. |
2CO (г)+ O2 (г) = 2CO2 (г); |
rΗ То = -566,02 кДж/моль; |
3.P2O5 (г) + 3CaO (к) = Ca3(PO4)2 (к); rΗ То = -727,70 кДж/моль;
4.8Al (к) + 3Fe3O4 (к) = 4Al2O3 (к) + 9Fe (к); rΗ То = -3186,70 кДж/моль;
30
5.Fe2O3 (к) + 3CO (г) = 2Fe (к) + 3CO2 (г); rΗ То = -27,71 кДж/моль;
6.C2H6 (г) + 7½O2 (г) = 2CO2 (г) + 3H2O (ж); rΗ То = -1559,87 кДж/моль;
7. |
NH4Cl (к) = NH3 (г) + HCl (г); |
rΗ То = +176,9 кДж/моль; |
8. |
CaCO3 (к) = CaO (к) + CO2 (г); |
rΗ То = +177,39 кДж/моль; |
9. |
MgO (к) + CO2 (г) = MgCO3 (к); |
rΗ То = -101,46 кДж/моль; |
10.2PbS (к) +3O2 (г) = 2PbO (к) + 2SO2 (г); rΗ То = -840,96 кДж/моль;
11.CH3OH (ж) + 3½O2 (г) = CO2 (г) + 2H2O (ж); rΗ То = -726,49 кДж/моль;
12. |
ZnSO4 (к) = ZnO (к) + SO3 (г); rΗ То = +234,00 кДж/моль; |
13. |
C2H5OH (ж) + 3O2 (г) = 2CO2 (г) + 3H2O (ж); |
rΗ То = -1416,94 кДж/моль; |
|
14. |
CaO (к) + H2O (ж) = Ca(OH)2 (к); rΗ То = -65,26 кДж/моль; |
15.SO2 (г) + 2H2S (г) = 3S (к) + 2H2O (ж); rΗ То = -234,48 кДж/моль;
16.4NH3 (г) + 3O2 (г) = 2N2 + 6H2O (ж);
rΗ То = -1530,28 кДж/моль;
17.PbO2 (к) + H2 (г) = PbO (к) + H2O (г); rΗ То = -182,84 кДж/моль;
18.Al2O3 (к) + 3SO3 (г) = Al2(SO4)3 (к);
rΗ То = -573,40 кДж/моль;
31
19. |
2SO2 (г) + O2 (г) = SO3 (г); rΗ То = -196,60 кДж/моль; |
|
20. |
CaC2 (г) + 2H2O (ж) = Ca(OH)2 (к) + C2H2 (г); |
|
rΗ То = -125,07 кДж/моль; |
|
|
21. |
SnO2 (к) + Sn (к) = 2SnO (к); rΗ То = +8,80 кДж/моль; |
|
22. |
NH4NO3 (к) = N2O (г) + 2H2O (ж); |
rΗ То = -36,73 кДж/моль; |
23. |
SiO2 (к) + 2Mg (к) = 2MgO (к) + Si (к); |
|
rΗ То = +343,18 кДж/моль; |
|
|
24. |
2HI (г) + S (к) = I2 (к) + H2S (г); |
rΗ То = -72,03 кДж/моль; |
25.C6H6 (ж) + 15½O2 (г) = 6CO2 (г) + 3H2O (ж); rΗ То = -3267,62 кДж/моль;
26.CuO (к) + 2HCl (г) = CuCl2 (к) + H2O (г);
rΗ То = -97,84 кДж/моль;
27.2H2S (г) + 3O2 (г) = 2H2O (г) + 2SO2 (г); rΗ То = -1037,18 кДж/моль;
28.4NH3 (г) + 5O2 (г) = 4NO (г) + 6H2O (г); rΗ То = -904,80 кДж/моль;
29. |
2H2O (ж) + O2 (г) = 2H2O2 (ж); rΗ То = +196,96 кДж/моль; |
30. |
4NO2 (г) + 2H2O (ж) = 4HNO3 (ж); rΗ То = -255,88 кДж/моль; |
7.4. Для реакции, указанной в задаче 7.3, вычислить изменение энтропии r SТо реакции (приложение 2) и используя ее тепловой эффект, указанный в уравнении, рассчитать изменение изобарноизотермического потенциала rGТо реакции в стандартных условиях. При каких условиях возможна данная реакция?
8. СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ И РАВНОВЕСИЕ
32
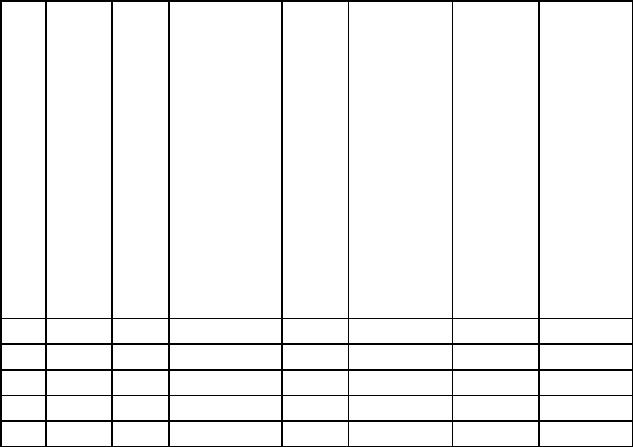
8.1. Химическая реакция протекает по уравнению
аА + bB → cC. Пользуясь таблицей 8.1, рассчитайте, на сколько процентов изменится скорость реакции ко времени τ по сравнению с начальной?
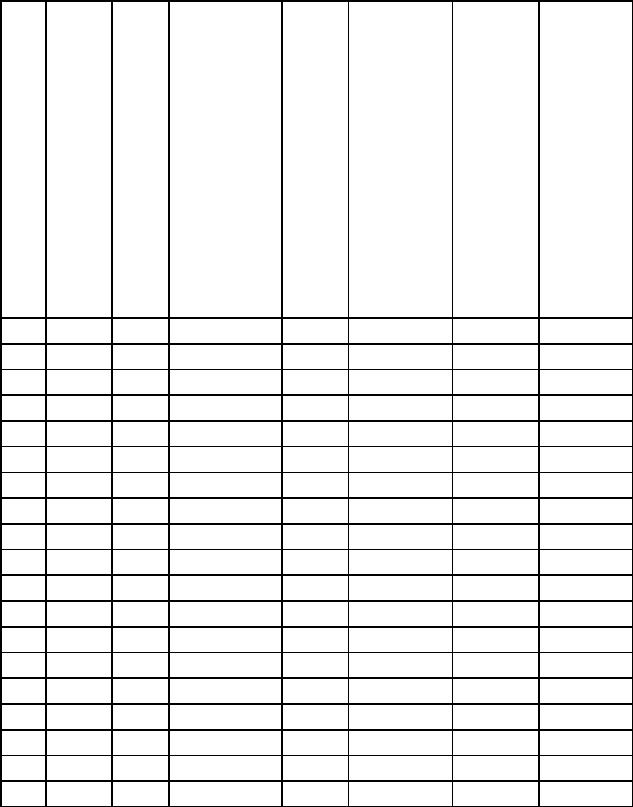
Таблица 8.1
Данные для расчета задачи 8.1.
№
1.
2.
3.
4.
5.
Константа скорости реакции, К |
Стехиометрический коэффициент, a |
0,9 |
2 |
0,1 |
3 |
0,2 |
2 |
0,3 |
3 |
0,4 |
2 |
концентрациякомпонента |
А, |
моль/л, |
|
Начальная |
0 |
А |
|
0,2
2,0
1,9
1,8
1,7
bкоэффициент,
Стехиометрический2 1
2
2
2
концентрациякомпонента |
В, |
моль/л, |
|
Начальная |
0 |
B |
|
1,2
1,0
1,2
1,1
1,3
А, моль/лКонцентрация компонента А, |
B, моль/лКонцентрация компонента В, |
0,1 |
0,9 |
1,8 |
0,9 |
1,7 |
1,1 |
1,6 |
1,0 |
1,5 |
1,2 |
33
№
6.
7.
8.
9.
 10.
10. 
 11.
11. 
 12.
12. 
 13.
13. 
 14.
14. 
 15.
15. 
 16.
16. 
 17.
17. 
 18.
18. 
 19.
19. 
 20.
20. 
 21.
21. 
 22.
22. 
 23.
23. 
 24.
24. 
Константа скорости реакции, К |
Стехиометрический коэффициент, a |
0,5 |
1 |
0,6 |
3 |
0,7 |
2 |
0,8 |
3 |
0,9 |
2 |
1,0 |
1 |
1,0 |
1 |
0,9 |
2 |
0,8 |
3 |
0,7 |
2 |
0,6 |
3 |
0,5 |
1 |
0,4 |
2 |
0,3 |
3 |
0,2 |
2 |
0,1 |
3 |
0,6 |
3 |
0,1 |
2 |
0,5 |
1 |
концентрациякомпонента |
А, |
моль/л, |
|
Начальная |
0 |
А |
|
1,6
1,5
1,4
1,4
1,6
1,8
1,1
1,2
1,1
1,3
1,4
1,6
1,5
1,7
1,8
1,3
1,0
1,2
1,3
bкоэффициент,
Стехиометрический3 1
2
3
2
3
3
2
2
3
2
3
2
2
3
2
1
3
2
концентрациякомпонента |
В, |
моль/л, |
|
Начальная |
0 |
B |
|
1,4
1,6
1,5
1,7
1,8
1,3
1,8
1,6
1,4
1,4
1,5
1,3
1,6
1,9
1,8
1,7
1,2
1,3
1,4
Продолжение табл. 8.1
А, моль/лКонцентрация компонента А, |
B, моль/лКонцентрация компонента В, |
1,4 |
1,2 |
1,3 |
1,2 |
1,2 |
1,1 |
1,2 |
1,0 |
1,4 |
1,3 |
1,6 |
1,4 |
1,0 |
1,6 |
1,1 |
1,4 |
1,0 |
1,2 |
1,2 |
1,2 |
1,3 |
1,3 |
1,5 |
1,1 |
1,4 |
1,4 |
1,6 |
1,7 |
1,7 |
1,6 |
1,2 |
1,5 |
0,9 |
1,1 |
1,1 |
1,2 |
1,2 |
1,3 |
34
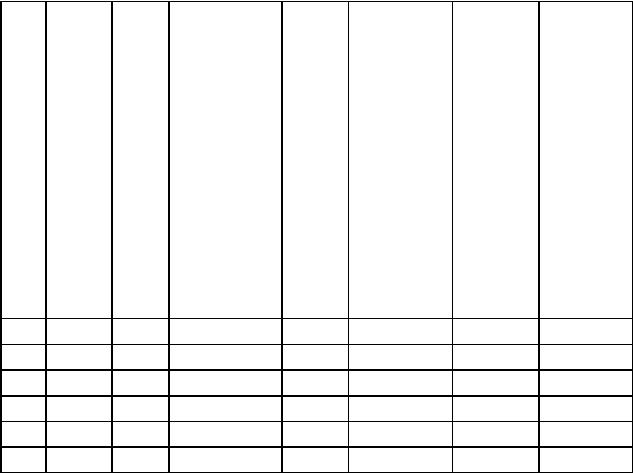
Окончание табл. 8.1
|
К |
№ |
реакции,скорости |
|
|
25. |
Константа |
0,8 |
|
26. |
0,4 |
27. |
0,6 |
28. |
0,3 |
29. |
0,8 |
30. |
1,0 |
Стехиометрический коэффициент, a
2
2
1
3
2
2
концентрациякомпонента |
А, |
моль/л, |
|
Начальная |
0 |
А |
|
1,4
1,5
0,2
1,5
0,2
1,4
Стехиометрический коэффициент, b
3
3
2
2
2
3
концентрациякомпонента |
В, |
моль/л, |
|
Начальная |
0 |
B |
|
1,5
1,6
0,8
1,6
0,4
1,5
А, моль/лКонцентрация компонента А, |
B, моль/лКонцентрация компонента В, |
1,0 |
0,9 |
1,3 |
1,2 |
0,1 |
0,6 |
1,3 |
1,2 |
0,1 |
0,2 |
1,0 |
0,9 |
8.2. Рассчитайте, во сколько раз возрастет скорость реакции при повышении температуры на Δto, если температурный коэффициент скорости реакции равен γ:
№ Δto |
γ |
№ Δto |
γ |
№ Δto |
γ |
|||
1. |
15 |
2,0 |
11. |
55 |
2,0 |
21. |
25 |
2,0 |
2. |
20 |
2,2 |
12. |
50 |
2,2 |
22. |
30 |
2,2 |
3. |
25 |
2,4 |
13. |
45 |
2,4 |
23. |
35 |
2,4 |
4. |
30 |
2,6 |
14. |
40 |
2,6 |
24. |
40 |
2,6 |
5. |
35 |
2,8 |
15. |
35 |
2,8 |
25. |
45 |
2,8 |
6. |
40 |
3,0 |
16. |
30 |
3,0 |
26. |
50 |
3,0 |
7. |
45 |
3,2 |
17. |
25 |
3,2 |
27. |
55 |
3,2 |
8. |
50 |
3,4 |
18. |
20 |
3,4 |
28. |
60 |
3,4 |
9. |
55 |
3,6 |
19. |
15 |
3,6 |
29. |
20 |
3,6 |
10. |
60 |
3,8 |
20. |
20 |
3,8 |
30. |
30 |
3,8 |
35
8.3. Постройте график зависимости изменения скорости реакции от температуры ( vv1 = f (t) ), используя температурный
коэффициент скорости реакции γ предыдущей задачи и четыре значения температуры – 0, 20, 30, 40 оС.
8.4. Напишите выражение константы равновесия для реакции.
1.2NH3 (г) N2 (г) + 3H2 (г);
2.CaO (к) + CO2 (г) CaCO3 (к);
3.2H2S (г) + 3O2 (г) 2H2O (г) + 2SO3 (г);
4.N2O4 (г) 2NO2 (г);
5.2CH3OH (ж) + 3O2 (г) 4H2O (г) + 2CO2 (г);
6.2H2O (г) 2H2 (г) + O2 (г);
7.NH3 (г) + HCl (г) NH4Cl (к);
8.MgO (к) + H2 (г) H2O (ж) + Mg (к);
9.CaO (к) + H2O (ж) Ca(OH)2 (к);
10.C (к) + CO2 (г) 2CO (г);
11.Al2O3 (к) + 3SO3 (г) Al2(SO4)2 (к);
12.4HCl (г) + O2 (г) 2Cl2 (г) + 2H2O (г);
13.NH4NO3 (к) N2O (г) + 2H2O (г);
14.2NO (г) + O2 (г) 2NO2 (г);
15.4Fe (к) + 3O2 (г) 2Fe2O3 (к);
16.C2H5OH (ж) C2H4 (г) + H2O (г);
17.CS2 (ж) + 3O2 (г) CO2 (г) + 2SO2 (г);
18.2ZnS (к) + 3O2 (г) ZnO (к) + 2SO2 (г);
19.4NH3 (г) + 3O2 (г) 2N2 (г) + 6H2O (г);
36
20.2SO2 (г) + 3O2 (г) 2SO3 (г);
21.2ZnSO4 (к) ZnO (к) + 2SO3 (г);
22.CO2 (г) 2CO (г) + ½O2 (г);
23.3C2H4 (г) 3CH4 (г)+ 2C2H2 (г);
24.NH4HCO3 (к) NH3 (г) + CO2 (г) + H2O (г);
25.C2H4 (г) 2C (к) + 2H2 (г);
26.2P (к) + 5½O2 (г) 2P2O5 (к);
27.(NH4)2Cr2O7 (к) N2 (г) + Cr2O3 (к) + 4H2O (г);
28.N2 (г) + 2H2O (ж) NH4NO2 (к);
29.PCl5 (г) PCl3 (г) + Cl2 (г);
30.2H2S (г) + O2 (г) 2H2O (г) + S (к).
8.5. В каком направлении сместится равновесие в системе:
а) при повышении давления; б) при повышении температуры.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Тепловой эффект |
№ |
|
|
|
|
|
Равновесная реакция |
химической реакции, |
|||||||||
1. |
|
|
|
|
2 |
|
|
2 |
|
|
|
|
|
|
|
r Η То |
|
|
|
|
|
|
|
|
|
|
|
|
|
< 0 |
|||
2. |
S (к) + H (г) 2H S (г); |
|
2 |
< 0 |
||||||||||||
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|||
3. |
C (к) + H O (г) CO (г) + H (г); |
< 0 |
||||||||||||||
|
|
|
|
|
|
|
2 |
|
|
2 |
(г); |
|
||||
4. |
2CO (г) + O (г) 2CO |
|
|
(г); |
> 0 |
|||||||||||
|
|
|
3 |
|
|
|
|
|
|
|
|
|
2 |
|||
5. |
CaCO (к) CaO (к) + CO |
|
< 0 |
|||||||||||||
COCl |
2 |
(г) |
|
|
|
|
|
|
2 |
|
|
|||||
6. |
|
CO (г) + Cl (г); |
|
< 0 |
||||||||||||
|
|
|
|
2 |
|
|
4 |
(г); |
|
|
||||||
7. |
C (к) + H |
(г) CH |
|
|
< 0 |
|||||||||||
N |
2 |
(г) + 3F |
2 |
|
3 |
|
(г); |
|
|
|||||||
8. |
2 |
|
(г) 2NF |
|
|
|
> 0 |
|||||||||
N |
|
|
|
|
2 |
|
2 |
|
(г); |
|
||||||
9. |
|
(г) + 3H (г) 2NH |
|
|
|
|
< 0 |
|||||||||
2 5 |
|
|
|
|
2 4 |
|
|
|
|
|
2 |
|
||||
|
C H OH (ж) C H (г) + H O (г); |
Тепловой эффект |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
№ |
|
|
|
|
|
Равновесная реакция |
химической реакции, |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
r Η То |
37
