
Репетиционные_тесты_по_химии_2009 _
.pdfа) 3s и 4s б) 3s и 3p в) 3p и 3d г) 3s и 3d
5-70. Расположите элементы в порядке усиления металлических свойств
а) 1s22s22p63s23p4 |
в) 1s22s22p63s23p1 |
б) 1s22s22p63s23p0 |
г) 1s22s22p63s13p0 |
5-71. Расположите элементы в порядке усиления металлических свойств
а) Э+2 = 1s22s22p63s03p0 |
в) Э–3 = 1s22s22p63s23p6 |
б) Э+3 = 1s22s22p63s03p0 |
г) Э–1 = 1s22s22p63s23p6 |
_*_ _*_ _*_
5-72. Число неспаренных электронов в ионе Co+3, находящемся в основном со-
стоянии, равно |
|
|
|
а) 6 |
б) 5 |
в) 4 |
г) 2 |
5-73. Атомы изотопов одного элемента отличаются числом |
|||
а) протонов |
б) нейтронов |
в) электронов |
г) позитронов |
5-74. Атом углерода в основном состоянии содержит |
___ неспаренных элек- |
||
трона(ов) |
|
|
|
а) 4 |
б) 3 |
в) 2 |
г) 0 |
5-75. Оксид-иону соответствует электронная конфигурация |
|||
а)1s22s22p5 |
б) 1s22s22p6 |
в) 1s22s22p4 |
г) 1s22s22p0 |
5-76. Хлорид-иону соответствует электронная конфигурация |
|||
1) 1s22s22p63s23d6 |
|
2) 1s22s22p63s23p4 |
|
3) 1s22s22p63s23p6 |
|
4) 1s22s22p63s23d5 |
|
5-77. Ядро изотопа фосфора 15Р31 содержит ___ нейтронов |
|||
а) 16 |
б) 15 |
в) 31 |
г) 46 |
5-78. Относительная величина электроотрицательности элементов уменьшается
в ряду |
|
|
|
а) P, Si, Al |
б) Cl, I, Br |
в) Se, S, O |
г) B, C, N |
5-79. С кислотами и щелочами взаимодействует оксид |
|
||
а) лития |
б) бериллия |
в) магния |
г) бора |
5-80. Среди галогенов наиболее сильным окислителем является |
|||
а) фтор |
б) хлор |
в) бром |
г) иод |
5-81. В ряду HF – HCl – HBr – HI сила кислот |
|
||
а) не изменяется |
|
в) возрастает |
|
б) изменяется неоднозначно |
г) уменьшается |
|
|
|
|
50 |
|
5-82. Наиболее выраженными кислотными свойствами обладает водный рас-
твор |
|
|
|
а) HCl |
б) HI |
в) HBr |
г) HF |
5-83. Формула высшего оксида элемента, образующего водородное соединение
ЭН2, имеет вид |
|
|
|
а) ЭО4 |
б) ЭО3 |
в) ЭО2 |
г) ЭО |
5-84. Формула водородного соединения элемента, образующего высший оксид
Э2О7, имеет вид |
|
|
|
а) H2Э |
б) НЭ |
в) ЭН4 |
г) ЭН3 |
5-85. Элементы, находящиеся в одной группе и подгруппе, обладают одинаковым числом
а) электронов |
в) валентных электронов |
б) протонов |
г) энергетических уровней |
5-86. В группах с увеличением порядкового номера электроотрицательность элементов
а) увеличивается |
|
в) уменьшается |
|
б) не изменяется |
|
г) изменяется периодически |
|
5-87. Наиболее сильной кислотой является |
|
||
а) HClO3 |
б) HClO4 |
в) HClO |
г) HClO2 |
5-88. В периоде с увеличением порядкового номера элементов металлические свойства
а) ослабевают |
|
в) не изменяются |
|
б) усиливаются |
|
г) изменятся периодически |
|
5-89. Радиус атомов уменьшается в ряду элементов |
|
||
а) Br, F, Cl |
б) Se, S, O |
в) Li, Na, K |
г) P, Si, Al |
5-90. Кислотные свойства оксидов в ряду SO3 – SeO3 – TeO3 |
|||
а) изменяются неоднозначно |
в) возрастают |
|
|
б) убывают |
|
г) не изменяются |
|
5-91. Кислотный характер имеют оксиды, образованные металлами а) со степенью окисления равной или выше +4 б) со степенью окисления ниже +4 в) главных подгрупп г) с любой степенью окисления
5-92. Для элементов одного периода характерно одинаковое число
51
а) свободных электронных пар |
в) валентных электронов |
б) неспаренных электронов |
г) энергетических уровней |
5-93. Формула водородного соединения элемента, образующего высший оксид
Э2О5, имеет вид |
|
|
|
а) ЭН |
б) ЭН3 |
в) ЭН5 |
г) ЭН2 |
5-94. На внешнем энергетическом уровне атома элемента, образующего высший гидроксид состава НЭО4, содержится ____ электронов.
а) 4 |
б) 7 |
в) 5 |
г) 6 |
||
5-95. Растворы щелочей реагируют с |
|
|
|
||
а) C |
б) Mn |
в) Zn |
г) N2 |
||
5-96. Положительный заряд имеет |
|
|
|
||
1) |
электрон |
|
3) |
протон |
|
2) |
анион |
|
4) |
позитрон |
|
5-97. Отрицательный заряд имеет |
|
|
|
||
1) |
протон |
|
3) |
электрон |
|
2) |
нейтрон |
|
4) |
катион |
|
5-98. Кислотные свойства оксидов элементов в высшей степени окисления в периоде с увеличением порядкового номера
1) |
уменьшаются |
3) |
зависят от условий реакции |
||
2) |
не меняются |
4) |
увеличиваются |
|
|
5-99. Массу покоя не имеет |
|
|
|
||
1) |
протон |
3) |
нейтрон |
|
|
2) |
фотон |
4) |
электрон |
|
|
5-100. Электронов на d-подуровне в устойчивом состоянии не имеет атом |
|||||
1) |
стронция |
3) |
радия |
|
|
2) |
кальция |
4) |
бария |
|
|
5-101. |
Число неспаренных электронов в основном состоянии атома азота равно |
||||
а) 6 |
б) 5 |
в) 4 |
г) 3 |
||
5-102. Для электрона, находящегося на d-орбитали, невозможно значение кван-
тового числа |
|
а) n = 4 |
в) m = 2 |
б) s = ½ |
г) l = 1 |
52
5-103. Химическому элементу, образующему соединение с водородом состава ЭН4, соответствует электронная конфигурация внешнего энергетического уров-
ня атома |
|
|
|
а) ns2np1 |
б) ns2np2 |
в) ns1np3 |
г) ns2np5 |
5-104. В ряду H2S H2Se H2Te термическая устойчивость соединений
а) возрастает |
в) не изменяется |
б) изменяется периодически |
г) убывает |
5-105. Согласно принципу Паули а) в атоме не может быть двух электронов в одинаковых квантовых состояниях
б) полная энергия атома в основном состоянии минимальна
в) электронный подуровень 3d заполняется после подуровня 3p г) на 2p-подуровне не может быть больше 2 электронов
5-106. В ряду химических элементов Cl Br I атомные радиусы
а) убывают |
в) изменяются периодически |
б) возрастают |
г) не изменяются |
5-107. Квантовое число m характеризует запас энергии, связанный с а) собственным магнитным моментом электрона б) формой электронной орбитали
в) ориентацией электронной орбитали в пространстве г) размером электронной орбитали
5-108. Элемент, образующий кислоту с химической формулой НЭО4, находится в ___ группе периодической системы.
а) V б) VII в) IV г) VI
5-109. Главное квантовое число n характеризует а) форму электронной орбитали б) собственный магнитный момент электрона
в) ориентацию электронной орбитали в пространстве г) общий запас энергии электрона на энергетическом уровне
5-110. Элемент, образующий кислоту с химической формулой H2ЭO4, находится в главной подгруппе ___ группы периодической системы.
а) VII б) 1V в) V г) VI
5-111. Атомы одного и того же элемента, обладающие различными значениями
атомных масс, называются |
|
а) изотопами |
в) изоэлектронными |
б) изомерами |
г) изобарами |
53
5-112. В периоде с |
увеличением порядкового номера электроотрицательность |
элементов |
|
а) увеличивается |
в) изменяется периодически |
б) не изменяется |
г) уменьшается |
5-113. В ряду химических элементов N O F электроотрицательность |
|
а) убывает |
в) изменяется периодически |
б) не изменяется |
г) возрастает |
5-114. Гидроксиды, способные проявлять как кислотные, так и основные свой-
ства, называются |
|
а) амфотерными |
в) несолеобразующими |
б) двойными |
г) безразличными |
5-115. Максимально высокое значение главного квантового числа основного
состояния атома свинца равно |
|
|
|
а) 5 |
б) 6 |
в) 4 |
г) 7 |
5-116. Максимально высокое значение главного квантового числа основного состояния атома серебра равно
а) 5 |
б) 6 |
в) 4 |
г) 7 |
5-117. В ряду Mg(OH)2 Ca(OH)2 |
Sr(OH)2 |
сила оснований |
|
а) изменяется периодически |
в) возрастает |
||
б) не изменяется |
|
г) убывает |
|
5-118. В ядре природного изотопа 27 Al находится |
|||
а) 14 протонов |
|
в) 27 протонов |
|
б) 14 нейтронов |
|
г) 13 нейтронов |
|
5-119. Кислотные свойства оксидов элементов в высшей степени окисления в группе с увеличением порядкового номера
а) зависят от условий реакции |
в) уменьшаются |
б) не изменяются |
г) увеличиваются |
5-120. Наибольшее число неспаренных электронов в основном состоянии со-
держит атом |
|
|
а) фосфора |
в) хлора |
|
б) кремния |
г) алюминия |
|
5-121. Положительный заряд имеет |
||
1) |
электрон |
3) протон |
2) |
анион |
4) нейтрон |
5-122. Наиболее сильным основанием является
54
а) Mg(OH)2 |
б) Ba(OH)2 |
в) Cu(OH)2 |
г) Sr(OH)2 |
5-123. С кислотами и щелочами взаимодействует оксид |
|
||
а) бора |
|
в) алюминия |
|
б) магния |
|
г) лития |
|
5-124. Химическому элементу с формулой высшего оксида Э2О3 соответствует конфигурация внешнего энергетического уровня атома
а) ns2np3 |
б) ns2np4 |
в) ns2np2 |
г) ns2np1 |
5-125. Спиновое квантовое число может принимать значения |
|
||
а) 0 … (n – 1) |
|
в) -l … 0 … +l |
|
б) 1, 2, 3, … |
|
г) 1/2 |
|
Тема 6. Химическая связь
6-1. Атомы в молекуле удерживают силы: |
|
|||
а) гравитационные |
|
|
в) магнитные |
|
б) электрические |
|
|
г) ядерные |
|
6-2. Ионная связь осуществляется в молекуле |
|
|||
а) O2 |
б) H2O |
в) Li2 |
г) NaCl |
|
6-3. Ковалентная неполярная связь осуществляется в молекуле |
||||
а) H2 |
б) H2S |
|
в) Na2 |
г) KCl |
6-4. Ковалентная полярная связь осуществляется в молекуле |
||||
а) CaCl2 |
б) O2 |
|
в) Li2 |
г) HCl |
6-5. Характеристики химической связи |
|
|
||
а) энергия ионизации |
в) валентный угол |
д) сродство к электрону |
||
б) длина связи |
|
г) энергия связи |
|
|
6-6. Металлические связи образуются в твердых веществах между |
||||
а) атомами металлов |
|
в) атомами металлов и неметаллов |
||
б) атомами неметаллов |
|
г) молекулами воды |
||
6-7. Вещество, имеющее высокую температуру плавления, блеск, ковкость, теплопроводность, электропроводность и пластичность, образовано связью
а) ковалентной полярной |
г) металлической |
б) ковалентной неполярной |
д) водородной |
в) ионной |
|
6-8. Валентность – это |
|
|
55 |
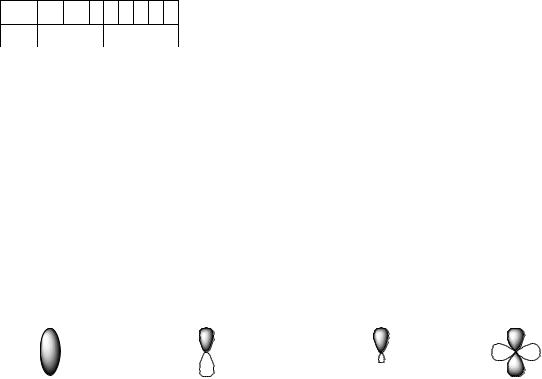
а) число неспаренных электронов в атоме б) число электронов на внешнем электронном слое атома
в) число химических связей, образованных атомом г) формальный заряд атома в молекуле
6-9. Ковалентные связи образуются между |
|
|||
а) молекулами простых веществ |
в) атомами металлов и неметаллов |
|||
б) атомами неметаллов |
г) между молекулами воды |
|||
6-10. Водородные связи образуются между |
|
|||
а) атомами металлов |
в) атомами металлов и неметаллов |
|||
б) атомами неметаллов |
г) между молекулами воды |
|||
6-11. Прочность химической связи зависит от |
|
|||
а) длины связи |
г) дипольного момента |
|||
б) кратности связи |
д) насыщаемости связи |
|||
в) валентного угла |
|
|
||
6-12. Валентность атома по обменному механизму равна |
||||
|
|
|
|
|
s |
p |
d |
|
|
а) 1 |
|
б) 2 |
в) 3 |
г) 4 |
6-13. Наиболее короткой является связь |
|
|
||
а) K – Cl |
б) K – Br |
в) K – I |
г) K – F |
|
6-14. Наиболее длинной является связь |
|
|
||
а) Na – Cl |
б) Na – Br |
в) K – I |
г) Na – F |
|
6-15. Последовательность соединений по возрастанию энергии связи |
||||
а) Na – I |
б) Na – Br |
в) Na – Cl |
г) Na – F |
|
6-16. Гибридная орбиталь: |
|
|
||
а) |
|
б) |
в) |
г) |
6-17. Ковалентная связь – это связь, которая возникает в результате электростатического притяжения между а) общей электронной парой и положительно заряженными ядрами атомов
б) электронами и катионами, находящимися в узлах кристаллической решетки в) атомом водорода и атомом сильно электроотрицательного элемента г) катионом металла и анионом неметалла
56
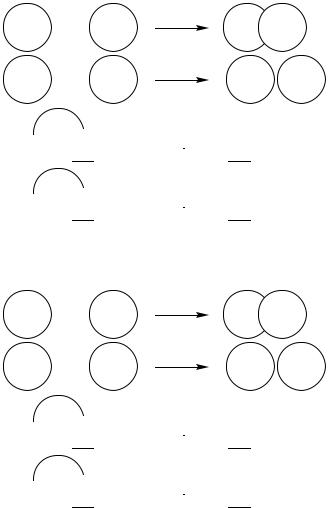
6-18. Образование молекулы по обменному механизму показано на рисунке
а)
+
б) |
|
|
|
|
+ |
+ |
- |
+ |
- |
в)
г)
A +
+ 
 B
B  A
A
 B
B
A+ + 
 B
B  A
A B
B
6-19. Образование молекулы по донорно-акцепторному механизму показано на
рисунке |
|
|
|
|
а) |
+ |
|
|
|
|
|
|
|
|
б) |
|
|
|
|
+ |
+ |
- |
+ |
- |
в)
г)
A +
+ 
 B
B  A
A
 B A+ +
B A+ + 

 B
B  A
A B
B
6-20. Последовательность возрастания энергии связи |
|
|||||||
а) K – I |
б) K – Br |
|
|
в) K – Cl |
г) K – F |
|||
6-21. Атом будет проявлять |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
||||
|
|
|
s |
p |
|
|
||
а) донорные свойства |
|
|
в) донорно-акцепторные свойства |
|||||
б) акцепторные свойства |
|
|
г) дипольные свойства |
|||||
6-22. Атом алюминия в возбужденном состоянии может проявлять |
||||||||
а) донорно-акцепторные свойства |
в) акцепторные свойства |
|||||||
б) донорные свойства |
|
|
г) электроноакцепторные свойства |
|||||
6-23. Соответствие формулы соединения и вида химической связи: |
||||||||
1) |
KCl |
а) |
ионная |
|
||||
2) |
H2 |
б) |
ковалентная неполярная |
|||||
3) |
HCl |
в) |
ковалентная полярная |
|||||
4) |
Zn |
г) |
металлическая |
|
||||
|
|
д) |
водородная |
|
||||
|
|
|
|
57 |
|
|
|
|
6-24. Донорно-акцепторная связь имеется в |
|
|||
а) NH3 |
б) NH4+. |
в) CO2 |
г) O2 |
|
6-25. |
Атом углерода в молекуле CH4 имеет гибридизацию |
|
||
а) sp |
|
б) s2p |
в) sp2 |
г) sp3 |
6-26. |
Атом бериллия в молекуле BeCl2 |
имеет гибридизацию |
|
|
а) sp |
|
б) sp2 |
в) sp3 |
г) s2p |
_*_ _*_ _*_
6-27. Вещества, содержащие только ковалентные полярные химические связи, приведены в ряду
а) F2, H2SO4,, P2O5 |
в) PF5, Cl2O7, NH4Cl |
б) NO2, SOCl2, CH3COOH |
г) H3PO4, BF3,CH3COONH4 |
6-28. Неполярной является молекула |
|
а) угловая SO2 |
в) пирамидальная PH3 |
б) тетраэдрическая CF4 |
г) линейная HCN |
6-29. Реакция между растворами аммиака и хлороводорода относится к
____взаимодействию. |
|
|
|
а) окислительно-восстановительному |
в) донорно-акцепторному |
||
б) каталитическому |
|
г) кислотно-основному |
|
6-30. В узлах кристаллической решетки хлорида кальция находятся |
|||
а) атомы Ca и молекулы Cl2 |
в) атомы Ca и Cl |
|
|
б) ионы Ca2+ и Cl– |
|
г) молекулы CaCl2 |
|
6-31. Молекулами, в которых все связи ковалентные, являются |
|||
а) CO2, H2S |
б) NaCl, SO2 |
в) NH4Cl, P2O5 |
г) K2SO4, NH3 |
6-32. Степень ионности связи возрастает в ряду |
|
||
а) CO2, N2O5, SO2 |
|
б) K2O, Na2O, Li2O |
|
в) P2O5, SO3, Cl2O7 |
|
г) SiO2, Al2O3, MgO |
|
6-33. Число –связей одинаково в молекулах |
|
||
а) H2SO4 и H3PO4 |
|
в) CO2 и C2H2 |
|
б) Cl2O7 и P2O5 |
|
г) CH3COOH и CO2 |
|
6-34. Кратная связь содержится в молекуле |
|
||
а) кислорода |
б) сероводорода |
в) этанола |
г) водорода |
6-35. В молекуле аммиака все связи |
|
|
|
а) ковалентные полярные |
в) ковалентные неполярные |
||
|
|
58 |
|
б) донорно-акцепторные г) ионные
6-36. Наиболее прочная связь между элементами в молекуле, формула которой
а) H2S |
б) H2Se |
в) H2O |
г) H2Te |
|
6-37. |
Молекула углекислого газа имеет _____ строение. |
|
||
а) линейное |
|
в) плоское треугольное |
||
б) угловое |
|
г) тетраэдрическое |
|
|
6-38. |
Формула вещества с молекулярной кристаллической решеткой имеет |
|||
а) NH3 |
б) KCl |
в) CaH2 |
г) CaO |
|
6-39. |
Тетраэдрическое строение молекулы имеет |
|
||
а) CH4 |
б) NH3 |
в) BF3 |
г) H2O |
|
6-40. Вещество, в молекуле которого содержатся 2 – и 2 –связи, имеет формулу
а) NO2 |
б) CO2 |
в) C2H4 |
г) H2SO4 |
|
6-41. |
Степень ионности связей возрастает в ряду |
|
||
а) CCl4, NaCl, MgCl2 |
в) BH3, BeH2, LiH |
|
||
б) Na2O, MgO, Al2O3 |
г) H2O, CH4, CaH2 |
|
||
6-42. |
В молекуле углекислого газа в образовании связей участвуют ___ элек- |
|||
тронов. |
|
|
|
|
а) 7 |
|
б) 6 |
в) 5 |
г) 8 |
6-43. |
В молекуле сероводорода химическая связь |
|
||
а) ковалентная неполярная |
в) водородная |
|
||
б) донорно-акцепторная |
г) ковалентная полярная |
|||
6-44. Вещества с атомной кристаллической решеткой обладают а) высокой температурой плавления б) низкой твердостью в) высокой электропроводностью
г) низкой температурой плавления
6-45. Только полярные ковалентные связи содержит молекула вещества, формула которой
а) H2SO4 |
б) Na2SO4 |
в) CaO |
г) F2 |
6-46. Ионная связь образуется между элементами |
|
||
а) P и O |
|
в) H и C |
|
б) K и Cl |
|
г) C и O |
|
|
|
59 |
|
