
Лекция 1 - конспект
.pdf
ЛЕКЦИЯ 1
ОРГАНИЗАЦИОННАЯ ЧАСТЬ
ПРИВЕТСТВИЕ
Всем доброе утро, меня зовут Юлия, я учусь на 1 курсе аспирантуры ФАКИ МФТИ и в этом семестре я буду вести у вас курс материаловедения.
Давайте немножко теперь поговорим об организационной части занятий.
МЕТОДЫ КОНТРОЛЯ И ЗАЧЁТ
Во-первых, у нас есть журнал посещений, в котором мы будем отмечаться каждую неделю. И посещения – это 50% от итоговой оценки, т.е. если вы будете ходить на все лекции, то 6 вам обеспечена.
В конце каждой пары будет проводиться небольшой тест буквально из 2–3 вопросов по теме текущего занятия. Результаты этих тестов – это ещё 20% от итоговой оценки.
Т.е. посещая все занятия и успешно решая тесты, вы спокойно себе обеспечиваете 7. Ну и, если вдруг кто-то что-то пропустил, заболел, или не набрал до желаемой оценки, у нас будут два занятия 8 и 15 мая, специально отведённые под устные доклады в виде презентаций. Темы презентаций я сообщу чуть позже. Презентация – это ещё 20% от итоговой оценки.
1

ПРЕДМЕТ МАТЕРИАЛОВЕДЕНИЯ
В общей учебной дисциплине Материаловедение главным объектом изучения является материал. Поэтому, прежде чем дать определение науки материаловедение, необходимо выяснить значение понятия материал. Чтобы раскрыть смысл этого понятия, целесообразно вначале обратиться к основному фундаментальному понятию окружающего нас мира – «материя».
Материя – объективно существующая реальность в виде различных форм и уровней организации объектов окружающего нас мира, характеризуемая массой и энергией, а также другими производными характеристиками (пространство, время, дискретность, непрерывность, типы связей элементов и т.д.).
Вещество – форма существования материи, которая характеризуется массой покоя и, следовательно, дискретностью, т.е. возможностью существования в виде отдельных частиц (тел).
Материал – вид вещества или совокупность нескольких его типов, предназначенные для получения продукции в виде сырья для изделий.
Конструкционный материал – любой вид материала, предназначенный для изготовления деталей машин и приборов, конструкций, подвергающийся различным технологическим воздействиям.
Для получения основных материалов востребованы те природные, синтетические или искусственные химические вещества (железные руды, оксиды, углеводороды и др.), которые обладают нужными свойствами или могут их приобрести в процессе технологической обработки.
Материалы, используемые человеком, можно разделить на три группы:
металлические материалы,
неметаллические материалы,
композиционные материалы.
Внутри каждой группы существует многообразие подгрупп в зависимости от структуры, агрегатного состояния и состава материалов.
Структура (строение) материала – это взаимное расположение и связь составных частей, или внутренне устройство материала.
Обычно различают несколько уровней структурной организации материалов: атомный, нано–, микро–, мезо– и макроуровни.
Состав – совокупность частей или структурных составляющих (атомов, веществ) материальной системы, образующих единое целое.
Свойства – качественная или количественная характеристика материалов, определяющая их общность и различие.
Различают следующие основные свойства материалов:
химические,
физические,
механические,
технологические,
эксплуатационные (служебные).
Теперь можно перейти к определению материаловедения как науки.
2

Материаловедение – наука, изучающая фундаментальные связи между составом, строением и свойствами материалов и закономерности их изменения под воздействием конструк- тивно–технологических и эксплуатационных факторов. Основная цель изучения этих закономерностей заключается в прогнозировании структуры и свойств материалов, разработке способов управления ими, а также принципов выбора и создания материалов с заданными свойствами.
Значение материаловедения в развитии мировой цивилизации всегда было и продолжает оставаться основополагающим. Более того, влияние новых материалов, создаваемых человеком, на научно–технический прогресс постоянно увеличивается. Новые материалы являются стимулом для появления и развития новых технических решений и высокоэффективных технологий. Достаточно привести такие примеры, как алюминиевые сплавы и композиционные материалы в авиакосмической технике, жаропрочные и жаростойкие материалы в теплоэнергетике, сверхпроводники и аморфные сплавы в электро- и радиотехнике, полупроводниковые материалы и жидкие кристаллы в электронике, сплавы с эффектом памяти формы в медицине и др.
В настоящее время бурно развиваются наноматериаловедение и нанотехнологии, позволяющие получать новые материалы, новые структуры и их комбинации с необычайно высокими физико-механическими и служебными свойствами.
ИСТОРИЯ
Теоретической основой материаловедения являются соответствующие разделы физики и химии, однако наука о материалах развивается в основном экспериментальным путём. Материаловедение является поистине интернациональной наукой, её теоретические основы были заложены трудами учёных разных стран. Среди них необходимо выделить американца Джозайи Уилларда-Гиббса (1839 – 1903 гг.) – основоположника физической химии.
Д.К. Чернов (1839 –1921 гг.) открыл в 1868 г. критические точки в сталях, заложив тем самым научные основы термической обработки. Значительный вклад в развитие материаловедения внесли русские учёные П.П. Аносов (1799 – 1851 гг.) и Д.И. Менделеев (1834 – 1907 гг.), англичанин Роберт Аустен (1843 – 1902 гг.), немец А. Мартенс (1850 – 1914 гг.).
XX век ознаменовался крупными достижениями в теории и практике материаловедения: были созданы высокопрочные материалы для деталей и инструментов, разработаны композиционные материалы, открыты сверхпроводники, открыты и использованы свойства полупроводников. Одновременно совершенствовались способы упрочнения деталей термической и химикотермической обработкой.
Условия работы современных машин и приборов выдвигают требования прочности и стойкости материалов в широком интервале температур – от -269 °С у сжиженного гелия до 1000 °С и выше при динамических нагрузках, в вакууме и в горячих потоках активных газов.
Решение важнейших технических задач, связанных с экономным расходом материалов, уменьшением массы машин и приборов во многом зависит от развития материаловедения.
3

КРИСТАЛЛИЧЕСКОЕ СТРОЕНИЕ МЕТАЛЛОВ
АМОРФНЫЕ И КРИСТАЛЛИЧЕСКИЕ ТЕЛА
Втвердых телах атомы могут размещаться в пространстве двумя способами:
1.Беспорядочное расположение атомов, когда они не занимают определенного места друг относительно друга. Такие тела называются аморфными. Аморфные вещества обладают формальными признаками твердых тел, т.е. они способны сохранять постоянный объем и форму. Однако они не имеют определенной температуры плавления или кристаллизации.
Аморфные тела в отличие от жидкостей имеют пониженную подвижность частиц. Аморфное состояние можно зафиксировать во многих органических и неорганических веществах ускоренным охлаждением из жидкого состояния. Однако при повторном нагреве, длительной выдержке 20…25 °С, а в некоторых случаях при деформации нестабильность аморфного твёрдого тела проявляется в частичном или полном переходе в кристаллическое состояние.
Примерами такого перехода могут служить помутнение неорганических стёкол при нагреве, частичная кристаллизация плавленого янтаря при нагреве, а также резины при растяжении, сопровождающаяся упрочнением.
Свойства кристаллов зависят от электронного строения атомов и характера взаимодействия их в кристалле, от пространственного расположения частиц, химического состава. Все эти детали строения кристаллов описывает понятие «структура».
2.Упорядоченное расположение атомов, когда атомы занимают в пространстве вполне определенные места. Такие вещества называются кристаллическими.
Атомы совершают относительно своего среднего положения колебания с частотой около 1013 Гц.. Амплитуда этих колебаний пропорциональна температуре.
Благодаря упорядоченному расположению атомов в пространстве, их центры можно соединить воображаемыми прямыми линиями. Совокупность таких пересекающихся линий представляет пространственную решетку, которую называют кристаллической решеткой.
Внешние электронные орбиты атомов соприкасаются, так что плотность упаковки атомов в кристаллической решетке весьма велика.
Кристаллические твердые тела состоят из кристаллических зерен - кристаллитов. В соседних зернах кристаллические решетки повернуты относительно друг друга на некоторый угол.
В кристаллитах соблюдаются ближний и дальний порядки. Это означает наличие упорядоченного расположения и стабильности как окружающих данный атом ближайших его соседей (ближний порядок), так и атомов, находящихся от него на значительных расстояниях вплоть до границ зерен (дальний порядок).
4

а) |
б) |
Рис. 1.1. Расположение атомов в кристаллическом (а) и аморфном (б) веществе
Вследствие диффузии отдельные атомы могут покидать свои места в узлах кристаллической решетки, однако при этом упорядоченность кристаллического строения в целом не нарушается.
ЭЛЕМЕНТЫ КРИСТАЛЛОГРАФИИ
КРИСТАЛЛИЧЕСКАЯ РЕШЁТКА
В кристалле частицы (ионы, атомы, молекулы) сближены до соприкосновения и располагаются различно, но закономерно по разным направлениям. Для упрощения пространственное изображение заменяют схемами, отмечая точками центры тяжести частиц.
Если в кристалле провести три направления x, y, z, не лежащих в одной плоскости, то расстояния между частицами, расположенными по этим направлениям, в общем случае неодинаковы и соответственно равны a, b, c.
Плоскости, параллельные координатным плоскостям, находящиеся на расстоянии a, b, c разбивают кристалл на множество параллелепипедов, равных и параллельно ориентированных. Наименьший параллелепипед называют элементарной ячейкой. Последовательное перемещение его образует пространственную кристаллическую решётку. Вершины параллелепипеда называют узлами пространственной решётки. С этими узлами совпадают центры тяжести частиц, из которых построен кристалл.
5

Для описания элементарной ячейки кристаллической решётки используют шесть величин: три отрезка, равные расстояниям a, b, c до ближайших частиц по осям координат, и три угла α, β, γ между этими отрезками. Размер элементарной ячейки кристаллической решётки оценивают отрезки a, b, c. Их называют периодами решётки.
Вбольшинстве случаев решётки имеют сложное строение, так как частицы находятся не только в узлах, но и на гранях или в центре решётки. О степени сложности судят по числу частиц, приходящихся на одну элементарную ячейку. В простой пространственной решётке всегда на одну ячейку приходится одна частица. В каждой ячейке имеется восемь вершин, но каждая частица в вершине относится, в свою очередь, к восьми ячейкам. Таким образом, от узла на долю каждой ячейки приходится 1 / 8 объёма, а всего узлов в ячейке восемь, следовательно, на ячейку приходится одна частица.
Всложной пространственной решётке на одну ячейку всегда приходится больше одной частицы. На объёмно-центрированную ячейку приходятся две частицы: одна от вершин и другая центрирующая, которая относится только к данной ячейке. В гранецентрированной ячейке имеются четыре частицы: одна от вершин и три от шести центрированных плоскостей, так как частица, находящаяся в центре плоскости, относится одновременно к двум ячейкам.
Система, период и число частиц, приходящихся на элементарную ячейку, полностью определяют расположение частиц в кристалле. Дополнительными характеристиками кристаллической решётки являются координационное число и коэффициент компактности.
Число ближайших равноудалённых частиц определяет координационное число К. Например, в решётке объёмно-центрированного куба (ОЦК) для каждого атома число таких соседей будет равно восьми (К8). Для простой кубической решётки координационное число будет 6 (К6), для гранецентрированной кубической решётки (ГЦК) – 12 (К12).
Отношение объёма всех частиц, приходящихся на одну элементарную ячейку, ко всему объёму элементарной ячейки определяет коэффициент компактности. Для простой кубической решётки его значение равно 0.52, для ОЦК – 0.68 и для ГЦК – 0.74.
Оставшееся пространство образуют поры, которые подразделяют на октаэдрические и тетраэдрические. Радиус октаэдрической поры составляет 0.41, а тетраэдрической поры – лишь 0.22 радиуса частицы.
Для многих металлов характерна плотная упаковка частиц.
На первый слой шаров, обозначенных А, в лунки 1 накладывается второй слой шаров, обозначенных В. Для следующего слоя шаров возможны два варианта: если шары укладываются над первым слоем, то решётка получается гексагональная плотноупакованная (ГП); если третий слой шаров С укладывается на второй над лунками 2 и только четвёртый слой повторяет первый слой шаров А, то получается ГЦК решётка.
Шестигранная призма изображает ГП кристаллическую решётку. Однако элементарной ячейкой здесь является элемент, выделенный жирными линиями. В нём a b c ; 90 ;
120 . Исходя из чисто геометрических соображений, можно определить отношение перио-
дов c/a, если частицы обладают сферической симметрией. Оно равно 1.633.
При отклонении частиц от сферической симметрии возможно образование гексагональных структур с отношением периодов, отличающихся от 1.633, а также ОЦК структур.
6
КРИСТАЛЛОГРАФИЧЕСКИЕ ИНДЕКСЫ
По параллельным направлениям свойства одинаковы, поэтому достаточно указать для всего семейства параллельных прямых одно направление, проходящее через начало координат. Это даёт возможность задать направление прямой только одной точкой, так как другой всегда является начало координат. Такой точкой является узел кристаллической решётки, занимаемый частицей. Координаты этого узла выражают целыми числами u, v, w в единицах отрезков a, b, c, заключают в квадратные скобки [u, v, w] и называют индексами направления.
Положение плоскости в пространстве определяется отрезками, отсекаемыми плоскостью по координатным осям. Эти отрезки выражают целыми числами m, n, p в единицах отрезков a, b, c. Принято за индексы плоскостей брать обратные отрезки: h 1/ m ; k 1/ n ; l 1 / p . Три числа (h, k, l), заключённые в круглые скобки, называют индексами плоскости. Если плоскость отсекает по осям отрицательные отрезки, то это отмечают знаком «минус» над соответствующим индексом.
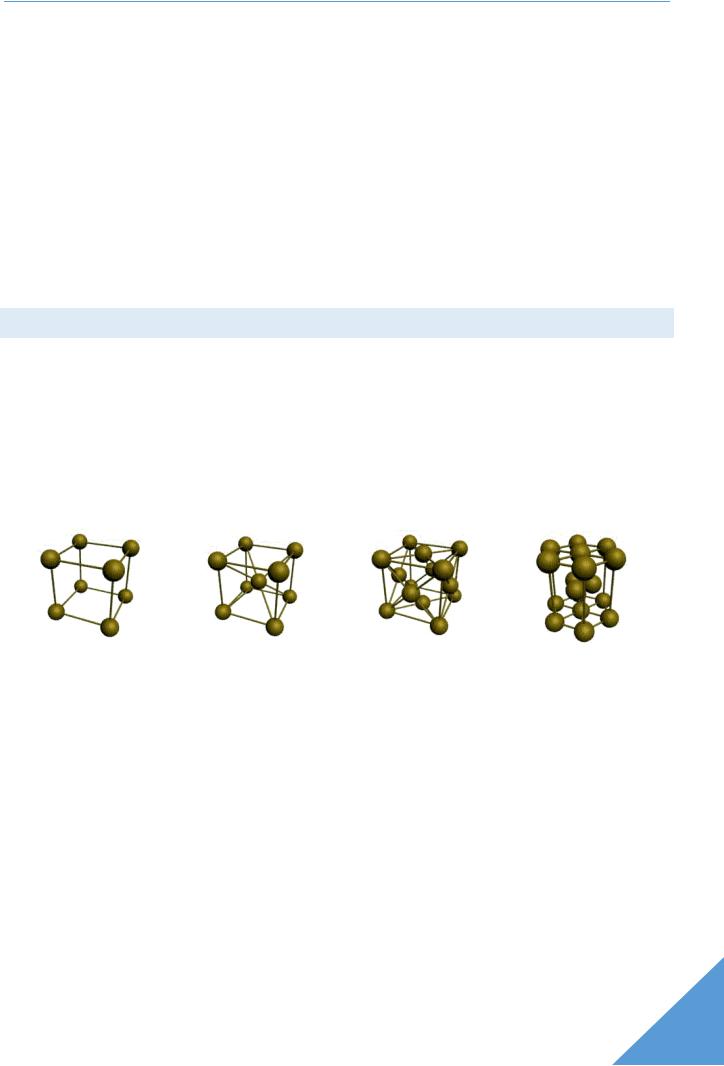
ОСНОВНЫЕ ТИПЫ КРИСТАЛЛИЧЕСКИХ РЕШЕТОК
Все металлы являются кристаллическими телами, имеющими определенный тип кристаллической решетки, состоящей из малоподвижных положительно заряженных ионов, между которыми движутся свободные электроны (так называемый электронный газ). Такой тип струк-
туры называется металлической связью.
Тип решетки определяется формой элементарного геометрического тела, многократное повторение которого по трем пространственным осям образует решетку данного кристаллического тела.
|
объемно-центрирован- гранецентрированная |
гексагональная плот- |
|
кубическая |
ная кубическая (ОЦК) |
кубическая (ГЦК) |
ноупакованная (ГП) |
(1 атом на ячейку) |
(2 атома на ячейку) |
(4 атома на ячейку) |
(6 атомов на ячейку) |
а) |
б) |
в) |
г) |
Рис. 1.2. Основные типы кристаллических решеток металлов
Металлы имеют относительно сложные типы кубических решеток - объемно центрированная (ОЦК) и гранецентрированная (ГЦК) кубические решетки.
Основу ОЦК-решетки составляет элементарная кубическая ячейка (рис. 1.2, б), в которой положительно заряженные ионы металла находятся в вершинах куба, и еще один атом в центре его объема, т. е. на пересечении его диагоналей. Такой тип решетки в определенных диапазонах температур имеют железо, хром, ванадий, вольфрам, молибден и др. металлы.
7

У ГЦК-решетки (рис. 1.2, в) элементарной ячейкой служит куб с центрированными гранями. Подобную решетку имеют железо, алюминий, медь, никель, свинец и др. металлы.
Третьей распространенной разновидностью плотноупакованных решеток является гексагональная плотноупакованная (ГПУ, рис. 1.2, г). ГПУ-ячейка состоит из отстоящих друг от друга на параметр с параллельных центрированных гексагональных оснований. Три иона (атома) находятся на средней плоскости между основаниями.
У гексагональных решеток отношение параметра с/а всегда больше единицы. Такую решетку имеют магний, цинк, кадмий, берилий, титан и др.
Компактность кристаллической решетки или степень заполненности её объема атомами является важной характеристикой. Она определяется такими показателями как параметр решетки, число атомов в каждой элементарной ячейке, координационное число и плотность упаковки.
Параметр решетки - это расстояние между атомами по ребру элементарной ячейки. Параметры решетки измеряется в нанометрах (1 нм = 10-9 м = 10 Å). Параметры кубических решеток характеризуются длиной ребра куба и обозначаются буквой а.
Для характеристики гексагональной решетки принимают два параметра - сторону шестигранника а и высоту призмы с. Когда отношение с/а = 1,633, то атомы упакованы наиболее плотно, и решетка называется гексагональной плотноупакованной (рис. 1.2 г). Некоторые металлы имеют гексагональную решетку с менее плотной упаковкой атомов (с/а > 1,633). Например, для цинка с/а = 1,86, для кадмия с/а = 1,88.
Параметры а кубических решеток металлов находятся в пределах от 0,286 до 0,607 нм. Для металлов с гексагональной решеткой а лежит в пределах 0,228-0,398 нм, а с в пределах
0,357- 0,652 нм.
Параметры кристаллических решеток металлов могут быть измерены с помощью рентгеноструктурного анализа.
При подсчете числа атомов в каждой элементарной ячейке следует иметь в виду, что каждый атом входит одновременно в несколько ячеек. Например, для ГЦК-решетки, каждый атом, находящийся в вершине куба, принадлежит 8 ячейкам, а атом, центрирующий грань, двум. И лишь атом, находящийся в центре куба, полностью принадлежит данной ячейке.
Таким образом, ОЦК- и ГЦК-ячейки содержат соответственно 2 и 4 атома.
Под координационным числом понимается количество ближайших соседей данного
атома.
8

Рис. 1.3. Координационное число в различных кристаллических решетках для атома А: а)объёмно-центрированная кубическая (К8);
б)гранецентрированная кубическая (К12); в) гексагональная плотноупакованная (Г12)
ВОЦК решетке (рис. 1.3, а) атом А (в центре) находится на наиболее близком равном расстоянии от восьми атомов, расположенных в вершинах куба, т. е. координационное число этой решетки равно 8 (К8).
ВГЦК решетке (рис. 1.3, б) атом А (на грани куба) находится на наиболее близком равном расстоянии от четырех атомов /, 2, 3, 4, расположенных в вершинах куба, от четырех атомов 5, 6, 7, 8, расположенных на гранях куба, и, кроме того, от четырех атомов 9, 10, 11, 12, принадлежащих расположенной рядом кристаллической ячейке. Атомы 9, 10, 11, 12 симметричны атомам 5, 6, 7, 8. Таким образом, ГЦК решетки координационное число равно 12 (К12).
ВГПУ решетке при с/а = 1,633 (рис. 1.3, в) атом А в центре шестигранного основания призмы находится на наиболее близком равном расстоянии от шести атомов /, 2, 3, 4, 5, 6, размещенных в вершинах шестигранника, и от трех атомов 7, 8, 9, расположенных в средней плоскости призмы. Кроме того, атом А оказывается на таком же расстоянии еще от трех атомов 10, 11, 12, принадлежащих кристаллической ячейке, лежащей ниже основания. Атомы 10, 11, 12симметричны атомам 7, 8, 9.
Следовательно, для ГПУ решетки координационное число равно 12 (Г12).
Плотность упаковки представляет собой отношение суммарного объема, занимаемого собственно атомами в кристаллической решетке, к ее полному объему. Различные типы кристаллических решеток имеют разную плотность упаковки атомов. В ГЦК решетке атомы занимают 74 % всего объема кристаллической решетки, а межатомные промежутки («поры») 26 %. В ОЦК решетке атомы занимают 68 % всего объема, а «поры» 32 %. Компактность решетки зависит от особенностей электронной структуры металлов и характера связи между их атомами.
От типа кристаллической решетки сильно зависят свойства металла.
9

КРИСТАЛЛОГРАФИЧЕСКИЕ НАПРАВЛЕНИЯ И ПЛОСКОСТИ
Упорядоченность кристаллического строения в пространственной решетке позволяет выделить отдельные кристаллографические направления и плоскости.
Кристаллографические направления - это характерные прямые линии, выходящие из точки отсчета, вдоль которых в кристаллической решетке располагаются атомы. Точками отсчета, могут служить вершины куба, а кристаллографическими направлениями - его ребра и диагонали, а также диагонали граней (рис. 1.4, а).
Рис. 1.4. Кристаллографические направления и плоскости в кристаллической решетке: а) основные направления и их обозначение; б), в), г) основные плоскости и их обозначение
Кристаллографическими плоскостями являются, например, плоскости граней кубов (рис. 1.4, б), а также их различные диагональные плоскости вместе с находящимися на них атомами (рис. 1.4, в, г). Для ГПУ-решеток кристаллографическими плоскостями могут быть плоскости оснований (рис. 1.2, г).
Для определения индекса какого-либо направления необходимо найти индекс ближайшего к данной точке отсчета атома, находящегося на данном направлении. Например, индекс ближайшего атома вдоль оси ОХ обозначается цифрами 100 (рис. 1.4, а). Эти цифры представляют собой координаты упомянутого атома относительно точки О, выраженные через количество параметров вдоль осей OX, OY и OZ соответственно.
Индексы направления ОХ и параллельных ему направлений обозначаются [100]. Соответственно направления OY и OZ обозначаются [010] и [001]. Кристаллографические направления вдоль диагоналей граней XOZ, XOY и YOZ обозначают [101], [110] и [011]. Пользуясь указанной методикой, можно определить индекс любого направления. Например, индекс направления вдоль диагонали куба выразится так: [111].
Для определения индекса кристаллографической плоскости необходимо вначале найти координаты ближайших точек ее пересечения с осями координат, проведенными из точки отсчета О. Затем взять обратные им величины и записать их в круглых скобках в обычной последовательности. Например, координатами точек пересечения с осями координат ближайшей плоскости, параллельной плоскости XOY, выраженными через параметры решеток, являются числа Ґ, Ґ, 1 (см. рис. 1.4, б). Поэтому индекс этой плоскости можно записать в виде (001).
Индексами плоскостей, параллельных плоскостям XOZ и YOZ, окажутся выражения (010) и (100) (рис. 1.4, б). Индекс вертикальной диагональной плоскости куба выразится через (110), (рис. 1.2, в), а индекс наклонной плоскости, пересекающейся со всеми тремя осями координат на удалении одного параметра, примет вид (111) (см. рис. 1.4, г).
10
