
- •Вопрос 1: перемещение,скорость материальной точки, вычесление пути
- •Вопрос 2 нормальное и тангенциальное ускорение
- •Вопрос 3: кинематика вращательного движения
- •Вопрос 12:. Уравнение динамики вращательного движения твердого тела
- •Вопрос 13:момент инерции тела
- •Вопрос 15: кинематика гармонических колебаний
- •Вопрос 16:динамика гармонических колебаний
- •Вопрос 23: сложение колебаний с близкими периодами. Биение
- •Вопрос 25 образование и распространение волн. Уравнение волны
- •29. Основное уравнение мкт
- •30.Распределение Максвелла
- •31. Барометрическая формула. Распределение Больцмана
- •34. Диффузия в газах
- •35. Вязкость газов
- •36. Первое начало термодинамики
- •38.Теплоемкость многоатомных и одноатомных молекул
- •39. Применение первого начала термодинамики к изопроцессам
- •41. Адиабатический процесс
- •43. Энтропия
- •44. Цикл Карно
- •48. Внутренняя энергия реального газа
- •49. Жидкое состояиие. Поверхностное натяжение жидкости
- •50. Строение и свойства твёрдых тел.
38.Теплоемкость многоатомных и одноатомных молекул
Так
как энергия одной молекулы идеального
газа ![]() ,
товнутренняя
энергия одного моля идеального
газа равна:
,
товнутренняя
энергия одного моля идеального
газа равна:
|
|
|
|
|
то есть
|
|
|
|
(4.3.1) |
Внутренняя энергия произвольного количества газа:
|
|
|
|
(4.3.2) |
Её изменение:
|
|
|
|
|
Теплоёмкости одноатомных газов СV и СР
|
|
|
|
|
где теплоемкость при постоянном объеме СV – величина постоянная, от температуры не зависит. Учитывая физический смысл R для изобарических процессов, можно записать:
|
|
|
|
(4.3.3) |
Тогда теплоемкость при постоянном давлении для одноатомных газов:
|
|
|
или |
|
Полезно знать соотношение:
|
|
|
где γ - коэффициент
Пуассона, ![]() Так как
Так как ![]() , то
, то![]() .
Из этого следует, что
.
Из этого следует, что
|
|
|
|
(4.3.5) |
Кроме того, ![]() ,
гдеi –
число степеней свободы молекул.
Подставив в выражение для внутренней
энергии, получим:
,
гдеi –
число степеней свободы молекул.
Подставив в выражение для внутренней
энергии, получим:
|
|
|
|
|
Так как ![]() ,
товнутреннюю
энергию можно найти по формуле
,
товнутреннюю
энергию можно найти по формуле
|
|
|
|
(4.3.6) |
То, что ![]() ,
хорошо подтверждается на опыте с Ne, He,
Ar, Kr, парами одноатомных
металлов.
Теплоемкости
многоатомных газов
,
хорошо подтверждается на опыте с Ne, He,
Ar, Kr, парами одноатомных
металлов.
Теплоемкости
многоатомных газов
Опыты с двухатомными газами, такими как азот, кислород и др., показали, что
|
|
|
|
|
Для водяного пара и других многоатомных газов (СН3, СН4 и так далее)
|
|
|
|
|
Таким образом, молекулы многоатомных газов нельзя рассматривать как материальные точки. Необходимо учитывать вращательное движение молекул и число степеней свободы этих молекул. Числом степени свободы (i) называется число независимых переменных, определяющих положение тела в пространстве. Положение одноатомной молекулы, как и материальной точки, задаётся тремя координатами, поэтому она имеет три степени свободы (рис. 4.3).
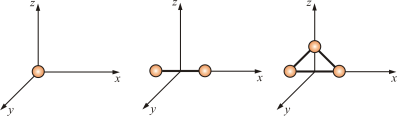
Многоатомная молекула может ещё и вращаться. Например, у двухатомных молекул вращательное движение можно разложить на два независимых вращения, а любое вращение можно разложить на три вращательных движения вокруг взаимно перпендикулярных осей. Но для двухатомной молекулы вращение вокруг её собственной оси не изменит её положение в пространстве, а момент инерции относительно этой оси равен нулю (рис. 4.3). Таким образом, у двухатомных молекул пять степеней свободы (i = 5), а у трёхатомных шесть степеней свободы (i = 6).
При
взаимных столкновениях молекул возможен
обмен их энергиями и превращение энергии
вращательного движения в энергию
поступательного движения и обратно.
Таким путём было установлено равновесие
между значениями средних энергий
поступательного и вращательного
движения молекул. Больцман
доказал,
что для не слишком низких температурсредняя
энергия ![]() ,
приходящаяся на одну степень свободы,
равна
,
приходящаяся на одну степень свободы,
равна![]()
