
Khimia_Laboratorny_praktikum_Kuziv_E_M
.pdfпротекающие с выделением энергии, называются экзотермическими, с поглощением – эндотермическими.
Все опыты по определению тепловых эффектов химических реакций проводятся в калориметрах различных конструкций, которые представляют собой как можно лучше изолированный от теплообмена с окружающей средой сосуд с мешалкой и термометром. Простейший калориметр состоит из двух стаканов – внутреннего и внешнего; во внутренний стакан опускаются термометр и мешалка. Во всех опытах условно примем плотности растворов равными 1 г/см3, а теплоѐмкости растворов – 4,184 Дж/г·К.
Для данной лабораторной работы вам потребуются следующие реактивы:
1.Магний Mg;
2.Гидроксид натрия NaOH;
3.Серная кислота Н2SO4.
Вопросы для допуска к выполнению лабораторной работы:
1.Что называется энтальпией (теплотой) образования химического соединения?
2.Чему равны энтальпии образования простых веществ?
3. Какие термодинамические параметры считаются стандартными?
Опыт №1. Определение теплового эффекта реакции нейтрализации
Реакция нейтрализации является экзотермической, так как происходит с выделением теплоты.
Методика опыта. Во внутренний стакан калориметра наливаем 20 см3 раствора серной кислоты Н2SO4 с молярной концентрацией эквивалентов 1 моль/дм3. Запишите начальную температуру данного раствора. Затем добавляем 20 см3 раствора гидроксида натрия NaOH с молярной концентрацией эквивалентов 1 моль/дм3. Запишите максимальную температуру реакции.
30

В ходе опыта происходит следующая реакция:
Н2SO4 + 2 NaOH = Na2SO4 + 2 H2O
Тепловой эффект реакции нейтрализации рассчитываем по формуле:
Н 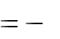
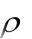 V
V 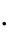 C
C 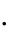 t 100
t 100 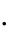 0,001,
0,001,
где ρ – плотность раствора, г/см3; V – объѐм раствора, см3;
С – удельная теплоѐмкость раствора, Дж/г·К; t – разность температур, °С;
100 – коэффициент пересчѐта на один моль взятой кислоты; 0,001 – коэффициент пересчѐта Дж в кДж.
Запишите расчѐт теплового эффекта реакции нейтрализации по вышеуказанной формуле.
Запишите расчѐт теоретического значения теплового эффекта реакции нейтрализации Нтеор по первому следствию из закона Гѐсса: сначала в общем виде, а затем с подставленными табличными значениями энтальпий образования веществ (см. приложение Б).
Относительную ошибку опыта рассчитываем по формуле:
|
Х |
|
Нтеор |
Нопытн |
|
100% |
|
|
|
Н |
|
, |
|||||
|
|
|
|
|
|
|
||
|
|
|
теор |
|
|
|
|
|
где Нтеор – теоретическое значение величины теплового эффекта, кДж; |
||||||||
Нопытн |
– значение величины теплового эффекта, полученное |
|||||||
в ходе опыта, кДж. |
|
|
|
|
|
|
||
Запишите |
расчѐт |
величины |
относительной |
ошибки опыта |
||||
по вышеуказанной формуле. |
|
|
|
|
|
|||
Сделайте |
вывод о |
тепловом |
эффекте |
|
реакции |
|
нейтрализации |
|
и укажите, с какой ошибкой он был найден в данном случае.
31

Опыт №2. Определение теплового эффекта реакции взаимодействия металла с кислотой
Реакция взаимодействия металла с кислотой является экзотермической, так как происходит с выделением теплоты.
Методика опыта. Во внутренний стакан калориметра помещаем небольшое количество гранулированного магния Mg и наливаем 2,5 см3 раствора серной кислоты H2SO4 с молярной концентрацией эквивалентов 1 моль/дм3.
Запишите, чему была равна температура кислоты на момент начала реакции и какая максимальная температура была достигнута
входе реакции.
Входе опыта происходит следующая реакция:
Mg + H2SO4 = MgSO4 + H2↑
Тепловой эффект реакции взаимодействия металла с кислотой рассчитываем по формуле:
Н 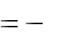
 V
V 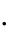 C
C 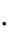 t
t  800
800  0,001,
0,001,
где ρ – плотность раствора кислоты, г/см3; V – объѐм раствора кислоты, см3;
С – удельная теплоѐмкость раствора, Дж/г·К; t – разность температур, °С;
800 – коэффициент пересчѐта на один моль взятой кислоты; 0,001 – коэффициент пересчѐта Дж в кДж.
Запишите расчѐт теплового эффекта реакции взаимодействия металла с кислотой по вышеуказанной формуле.
Запишите расчѐт теоретического значения теплового эффекта реакции взаимодействия металла с кислотой Нтеор по первому следствию из закона Гѐсса: сначала в общем виде, а затем с подставленными табличными значениями энтальпий образования веществ (см. приложение Б).
Относительную ошибку опыта рассчитываем по формуле:
32

|
Х |
|
|
Нтеор |
Нопытн |
|
100% |
|
|
|
Н |
|
, |
||||
|
|
|
|
|
|
|
||
|
|
|
|
теор |
|
|
||
где Нтеор – теоретическое значение величины теплового эффекта, кДж; |
||||||||
Нопытн |
– значение величины теплового эффекта, полученное |
|||||||
в ходе опыта, кДж. |
|
|
|
|
|
|||
Запишите |
расчѐт |
величины |
относительной ошибки опыта |
|||||
по вышеуказанной формуле. |
|
|
|
|
|
|||
Сделайте вывод о тепловом эффекте реакции взаимодействия металла с кислотой и укажите, с какой ошибкой он был найден в данном случае.
Вопросы для защиты лабораторной работы:
1. Что такое энтальпия (тепловой эффект) химической реакции?
2. Как называются химические реакции, протекающие с выделением теплоты?
3. Как называются химические реакции, протекающие с поглощением теплоты?
4. Формулировка закона Гѐсса.
5. Первое следствие из закона Гѐсса.
6. Как рассчитать тепловой эффект реакции по значениям энтальпий образования вступающих в реакцию и образующихся веществ?
7. Второе следствие из закона Гѐсса.
Рекомендуемая литература:
1.Н.Л. Глинка. «Общая химия». Главы «Превращения энергии при химических реакциях», «Термохимия», «Термохимические расчеты», «Термодинамические величины. Внутренняя энергия и энтальпия», Стандартные термодинамические величины. Химико-термодинамические расчеты».
2.Е.М. Рыбалкин, О.Ю. Ковалик. «Химия. Учебное наглядное пособие». Глава «Химическая термодинамика».
33
3. П.Г. Пермяков, М.Х. Ахметов, С.В. Зенцова. «Основные закономерности протекания химических процессов в газообразных и конденсированных системах. Учебное пособие». Глава «Химическая термодинамика».
4. Р.М. Белкина, Р.И. Славкина, В.Ф. Горюшкин. «Энергетика химических процессов. Задания для практических занятий».
Лабораторная работа №7
Электролитическая диссоциация
Электролитическая диссоциация – это процесс распада электролита на ионы в растворах и расплавах.
Все электролиты делятся на сильные и слабые. Сильные электролиты практически полностью диссоциируют на ионы. Диссоциация слабых электролитов – процесс обратимый, в растворах слабых электролитов устанавливается равновесие между ионами и недиссоциированными молекулами.
Отношение |
числа молекул электролита, |
распавшихся |
на ионы, |
||
к общему числу |
растворенных |
молекул, |
называется |
степенью |
|
диссоциации электролита. Сила |
кислот |
и |
гидроксидов |
связана |
|
со степенью их диссоциации: чем больше |
степень диссоциации, тем |
||||
сильнее соответствующая кислота или гидроксид. |
|
|
|||
Химические взаимодействия в растворах электролитов записывают в виде ионно-молекулярных уравнений. Правило составления таких уравнений состоит в следующем: все малорастворимые, летучие вещества
ислабые электролиты записывают в виде молекул, а сильные, легко растворимые – в виде ионов. Обязательным условием протекания ионообменных процессов является удаление из раствора тех или иных ионов, например, вследствие образования слабодиссоциирующих веществ
ивеществ, выделяющихся из раствора в виде осадка или газа.
Для данной лабораторной работы вам потребуются следующие реактивы:
1.Гидроксид калия КOH;
2.Гидроксид кальция Са(ОН)2;
34
3.Фосфорная кислота Н3РО4;
4.Соляная кислота HCl;
5.Карбонат натрия Na2CO3;
6.Карбонат кальция СаСО3;
7.Нитрат калия KNO3;
8.Сульфат натрия Na2SO4;
9.Хлорид аммония NH4Cl;
10.Хлорид кальция CaCl2;
11.Хлорид бария ВаCl2;
12.Хлорид кобальта CoCl2;
13.Хлорид меди CuCl2;
14.Индикатор фенолфталеин.
Вопросы для допуска к выполнению лабораторной работы:
1.Какие вещества являются электролитами?
2.Вещества каких классов неорганических соединений относятся
кэлектролитам?
3. Что такое электролитическая диссоциация?
4. Что такое катионы и анионы?
5. Что такое степень электролитической диссоциации?
6. Что такое константа электролитической диссоциации?
7. Какие реакции относятся к ионообменным?
Опыт №1. Диссоциирующее действие воды
Вода оказывает диссоциирующее действие на молекулы веществ; его можно обнаружить, например, в том случае, если молекулы в спиртовом растворе, где они находятся в недиссоциированном состоянии, и ионы в водном растворе имеют различную окраску.
Методика опыта. В пробирку наливаем 2 мл спиртового раствора хлорида кобальта CoCl2 и добавляем 2 мл дистиллированной воды. Окраска раствора изменяется с синей на розовую.
Составьте уравнение диссоциации хлорида кобальта.
Сделайте вывод о данном способе обнаружения диссоциирующего действия воды.
35
Опыт №2. Действие одноимѐнного иона на диссоциацию гидроксида кальция
В растворах слабых электролитов увеличение концентрации одного из ионов данного электролита уменьшает степень диссоциации электролита.
Методика опыта. В пробирку наливаем 2-3 мл раствора гидроксида кальция Са(ОН)2 и добавляем каплю индикатора фенолфталеина; раствор окрашивается в красный цвет. Затем добавляем 2 мл раствора хлорида кальция CaCl2; окраска фенолфталеина ослабевает. Для сравнения проведем аналогичный опыт, добавив вместо раствора хлорида кальция такое же количество воды, чтобы убедиться, что простое разбавление раствора не вызывает такое ослабление окраски.
Сделайте вывод о влиянии одноимѐнного иона на диссоциацию слабого электролита.
Опыт №3. Сравнение химической активности кислот
Методика опыта. В одну пробирку наливаем 3 мл раствора соляной кислоты HCl, в другую – такое же количество раствора фосфорной кислоты Н3РО4. В обе пробирки вносим по одинаковому кусочку мела (карбоната кальция СаСО3). Наблюдается выделение газообразного вещества, которое более бурное и продолжительное в пробирке с раствором соляной кислоты.
Составьте уравнение взаимодействия карбоната кальция с соляной кислотой в молекулярном, а также полном и сокращѐнном ионномолекулярном виде.
Составьте уравнение взаимодействия карбоната кальция с фосфорной кислотой в молекулярном и ионно-молекулярном виде.
Сделайте вывод, какая кислота более сильная.
Опыт №4. Сравнение химической активности гидроксидов
Методика опыта. В две пробирки наливаем по 3 мл раствора хлорида меди CuCl2 и добавляем в одну 2 мл раствора гидроксида калия КOH, а в другую 2 мл насыщенного раствора гидроксида
36
кальция Са(ОН)2. В первой пробирке выпадает голубой осадок, во второй наблюдается незначительное помутнение раствора.
Составьте уравнение взаимодействия хлорида меди с гидроксидом калия в молекулярном, а также полном и сокращѐнном ионномолекулярном виде.
Составьте уравнение взаимодействия хлорида меди с гидроксидом кальция в молекулярном, а также полном и сокращѐнном ионномолекулярном виде.
Сделайте вывод, какой гидроксид более сильный.
Опыт №5. Ионообменные процессы
Ионообменные процессы протекают до конца в случае выпадения осадка, выделения газообразного вещества или образования слабого электролита.
Методика опыта. |
|
А) В пробирку наливаем 2-3 |
мл раствора хлорида бария ВаCl2 |
и добавляем небольшое количество |
раствора сульфата натрия Na2SO4 |
до выпадения осадка сульфата бария белого цвета.
Составьте уравнение взаимодействия хлорида бария с сульфатом натрия в молекулярном, а также полном и сокращѐнном ионномолекулярном виде.
Б) В пробирку наливаем 2-3 мл раствора карбоната натрия Na2CO3 и добавляем 1-2 мл раствора соляной кислоты HCl. Наблюдается выделение газообразного вещества.
Составьте уравнение взаимодействия карбоната натрия с соляной кислотой в молекулярном, а также полном и сокращѐнном ионномолекулярном виде.
В) В пробирку наливаем 2-3 мл раствора хлорида аммония NH4Cl и добавляем такое же количество раствора гидроксида калия КOH. Ощущается характерный запах аммиака.
37
Составьте уравнение взаимодействия хлорида аммония с гидроксидом калия в молекулярном, а также полном и сокращѐнном ионно-молекулярном виде.
Г) В пробирку наливаем 2-3 мл раствора нитрата калия KNO3 и добавляем такое же количество раствора сульфата натрия Na2SO4. Изменений не наблюдается.
Сделайте вывод об условиях протекания ионообменных процессов.
Вопросы для защиты лабораторной работы:
1. Чем объясняется электропроводность растворов электролитов?
2. Какое значение имеет вода в процессе электролитической диссоциации?
3. Почему водопроводная вода проводит электрический ток, а дистиллированная нет?
4. Чем отличаются ионы, содержащиеся в кристаллической решѐтке вещества, от ионов, содержащихся в растворе этого же вещества?
5. Чем различаются сильные и слабые электролиты?
6. В молекулах каких электролитов (сильных или слабых) ионы связаны прочно, а в каких слабо?
7. Чему равна степень диссоциации сильных и слабых электролитов? 8. От чего зависит степень электролитической диссоциации?
9. Как можно увеличить или уменьшить степень диссоциации слабого электролита?
10. От чего зависит константа электролитической диссоциации?
11. В каких случаях ионообменные реакции протекают необратимо? 12. Как составляются ионно-молекулярные уравнения?
Рекомендуемая литература:
1.Н.Л. Глинка. «Общая химия». Главы «Теория электролитической диссоциации», «Процесс диссоциации», «Степень диссоциации. Сила электролитов», «Константа диссоциации», «Свойства кислот, оснований
исолей с точки зрения теории электролитической диссоциации», «Ионномолекулярные уравнения», «Смещение ионных равновесий».
2.Е.М. Рыбалкин, О.Ю. Ковалик. «Химия. Учебное наглядное пособие». Главы «Растворы электролитов. Электролитическая диссоциация», «Ионно-молекулярные уравнения реакций».
38
3.П.Г. Пермяков, С.В. Зенцова. «Истинные растворы неэлектролитов и электролитов. Методические указания и контрольные задания». Глава «Свойства растворов электролитов».
4.Р.М. Белкина, С.В. Зенцова. «Растворы. Методические указания». Главы «Электролиты и неэлектролиты», «Ионные уравнения».
5.Р.И. Славкина. «Химия. Методические рекомендации». Глава «Ионные уравнения».
Лабораторная работа №8
Гидролиз солей
Гидролиз – это взаимодействие вещества с водой, при котором составные части вещества соединяются с составными частями воды. При этом образуется молекула или ион слабого электролита и изменяется реакция среды.
Гидролизу могут подвергаться соли, в составе которых есть катион или анион, соответствующий слабому гидроксиду или слабой кислоте. Соли, образованные сильными гидроксидами и сильными кислотами, гидролизу не подвергаются, так как ни один из ионов соли не будет связывать молекулы воды с образованием слабого электролита.
Протекает гидролиз в основном только по первой ступени. Для процессов гидролиза так же можно записывать ионно-молекулярные и сокращѐнные ионные уравнения, руководствуясь общими правилами записи ионообменных процессов.
Для данной лабораторной работы вам потребуются следующие реактивы:
1.Карбонат натрия Na2CO3;
2.Гидрокарбонат натрия NaНСO3;
3.Сульфат алюминия Al2(SO4)3;
4.Сульфит натрия Na2SO3;
5.Хлорид алюминия AlCl3;
6.Хлорида цинка ZnCl2;
7.Хлорид олова SnCl2;
8.Индикатор фенолфталеин;
9.Индикатор лакмус.
39
