
Khimia_Laboratorny_praktikum_Kuziv_E_M
.pdfМетодика опыта. В пробирку наливаем 4-5 мл насыщенного раствора гидроксида кальция Са(ОН)2 и пропускаем через него углекислый газ СО2 до выпадения осадка карбоната кальция белого цвета.
Составьте уравнение взаимодействия гидроксида кальция с углекислым газом в молекулярном и ионно-молекулярном виде.
Сделайте вывод о данном способе получения солей.
Вопросы для защиты лабораторной работы:
1. Взаимодействием каких неорганических веществ между собой можно получать соли?
2. Соли каких кислот могут быть получены непосредственным взаимодействием простых веществ, входящих в состав соли?
3. Соли каких металлов можно получить взаимодействием металла с разбавленной кислотой?
4. Как из нормальной соли можно получить кислую соль? 5. Как из кислой соли можно получить нормальную соль? 6. Как из нормальной соли можно получить основную соль? 7. Как из основной соли можно получить нормальную соль?
Рекомендуемая литература:
1. Н.Л. Глинка. «Общая химия». Глава «Важнейшие классы
иноменклатура неорганических веществ».
2.Е.М. Рыбалкин, О.Ю. Ковалик. «Химия. Учебное наглядное пособие». Глава «Соли».
3.Р.И. Славкина, В.Д. Иванова, Р.М. Белкина. «Классификация неорганических соединений. Методические указания и контрольные задания». Глава «Соли».
4.Р.И. Славкина. «Химия. Методические рекомендации». Глава «Ионные уравнения».
20
Лабораторная работа №4
Свойства солей
Соли могут взаимодействовать со следующими классами неорганических соединений: кислотами – более активными, чем кислота, которой образована данная соль; щѐлочами – если в результате реакции получается нерастворимый гидроксид; солями – если один из продуктов реакции выпадает в осадок. Кроме того, соли могут взаимодействовать с металлами, более активными, чем металл, входящий в состав соли.
Для данной лабораторной работы вам потребуются следующие реактивы:
1.Цинк Zn;
2.Гидроксид калия КOH;
3.Серная кислота H2SO4;
4.Карбонат натрия Na2CO3;
5.Нитрат висмута Bi(NO3)3;
6.Сульфат магния MgSO4;
7.Сульфат меди CuSO4;
8.Хлорид кобальта СоCl2.
Вопросы для допуска к выполнению лабораторной работы:
1.Какие неорганические вещества относятся к классу солей?
2.Как классифицируются соли?
3.Как формируются названия солей?
4.Взаимодействием каких неорганических веществ между собой можно получать соли?
Опыт №1. Взаимодействие нитрата висмута с серной кислотой
Соли могут взаимодействовать с более сильными кислотами с образованием солей данных кислот.
Методика опыта. В пробирку наливаем 3-4 мл раствора нитрата висмута Bi(NO3)3 и добавляем по каплям раствор серной кислоты H2SO4 до выпадения осадка сульфата висмута белого цвета.
21
Составьте уравнение взаимодействия нитрата висмута с серной кислотой в молекулярном, а также полном и сокращѐнном ионномолекулярном виде.
Сделайте вывод о данном свойстве солей.
Опыт №2. Взаимодействие хлорида кобальта с гидроксидом калия
Соли могут взаимодействовать со щѐлочами с образованием нерастворимых гидроксидов.
Методика опыта. В пробирку наливаем 3-4 мл раствора хлорида кобальта СоCl2 и добавляем по каплям раствор гидроксида калия КOH до выпадения осадка гидроксида кобальта синего цвета.
Составьте уравнение взаимодействия хлорида кобальта с гидроксидом калия в молекулярном, а также полном и сокращѐнном ионно-молекулярном виде.
Сделайте вывод о данном свойстве солей.
Опыт №3. Взаимодействие сульфата магния с карбонатом натрия
Соли могут взаимодействовать между собой с образованием новых солей при условии, что один из продуктов реакции выпадает в осадок.
Методика опыта. В пробирку наливаем 2-3 мл раствора сульфата магния MgSO4 и добавляем по каплям раствор карбоната натрия Na2CO3 до выпадения осадка карбоната магния белого цвета.
Составьте уравнение взаимодействия сульфата магния с карбонатом натрия в молекулярном, а также полном и сокращѐнном ионно-молекулярном виде.
Сделайте вывод о данном свойстве солей.
22
Опыт №4. Взаимодействие сульфата меди с цинком
Соли могут взаимодействовать с металлами, более активными, чем тот металл, который входит в состав соли, с образованием солей данного металла.
Методика опыта. В пробирку наливаем 0,5 мл раствора сульфата меди CuSO4 и 2 мл воды для получения сильно разбавленного раствора сульфата меди бледно-голубой окраски. Затем вносим в пробирку кусочек цинка Zn. Постепенно окраска раствора становится менее интенсивной, а на цинке появляется бурый налет металлической меди.
Составьте уравнение взаимодействия сульфата меди с цинком в молекулярном, а также полном и сокращѐнном ионно-молекулярном виде.
Сделайте вывод о данном свойстве солей.
Вопросы для защиты лабораторной работы:
1.С какими неорганическими веществами могут взаимодействовать соли? Какие продукты получаются в результате этих реакций?
2.В каком случае соли могут взаимодействовать с металлами?
3.В каком случае соли могут взаимодействовать с кислотами?
4.В каком случае две соли могут взаимодействовать между собой
собразованием двух других солей?
5. Какие продукты получаются при взаимодействии соли со щѐлочью?
6.Какие соли могут разлагаться при нагревании?
7.С неорганическими соединениями какого класса не могут взаимодействовать соли?
Рекомендуемая литература:
1. Р.И. Славкина. «Химия. Методические рекомендации». Глава «Ионные уравнения».
23
Лабораторная работа №5
Эквивалент
Эквивалентом вещества называется такое его количество, которое соединяется с 1 молем атомов водорода или замещает его в химических взаимодействиях.
Молярная масса эквивалента вещества – это масса одного эквивалента вещества; она рассчитывается как молярная масса вещества, делѐнная на эквивалентное число вещества.
Согласно закону эквивалентов вещества взаимодействуют между собой в количествах, пропорциональных их эквивалентам. Поэтому молярную массу эквивалента любого вещества можно найти, исходя из взаимодействия с другим веществом, молярная масса эквивалента которого известна.
Для данной лабораторной работы вам потребуются следующие реактивы:
1.Алюминий Al;
2.Соляная кислота НCl;
3.Карбонат кальция СаСО3.
Вопросы для допуска к выполнению лабораторной работы:
1.Формулировка закона эквивалентов.
2.Что такое эквивалент?
3.Что такое эквивалентное число?
4.Как найти эквивалентное число простого вещества?
5.Как найти эквивалентное число оксида?
6.Как найти эквивалентное число гидроксида?
7.Как найти эквивалентное число кислоты?
8.Как найти эквивалентное число соли?
24

Опыт №1. Определение молярной массы эквивалента алюминия
В реакциях, протекающих с выделением газа, молярную массу эквивалента вещества можно определить объѐмным методом – по объѐму выделяющего газа.
Методика опыта. В пробирку наливаем 5-6 мл раствора соляной кислоты НCl и на край пробирки помещаем навеску алюминия Al таким образом, чтобы металл не соприкасался с кислотой. Затем соединяем пробирку с прибором для определения объѐма газа – он состоит из двух стеклянных заполненных водой трубок, соединѐнных между собой по типу сообщающихся сосудов. Отметив уровень воды в трубке, с которой соединена пробирка, сбрасываем навеску металла в кислоту. В ходе реакции выделяется газообразное вещество, и уровень воды в трубке, с которой соединена пробирка, понижается. Когда уровень воды в трубке стабилизируется, заканчиваем опыт.
В ходе опыта происходит следующая реакция:
2 Al + 6 HCl = 2 AlCl3 + 3 H2↑
Запишите исходные данные для расчѐта молярной массы эквивалента алюминия по следующему образцу:
Исходные данные:
Масса навески – m, г;
Объѐм выделившегося водорода – V, мл; Температура опыта – t, °С; Атмосферное давление – P, мм рт. ст.; Упругость водяных паров – h, мм рт. ст.
Приводим объѐм выделившегося водорода к нормальным условиям по формуле:
V0 |
V |
(P |
h) Т 0 |
||||
|
|
|
|
|
|
|
|
|
Р |
|
(Т |
0 |
t) , |
||
|
|
|
|||||
|
0 |
|
|
|
|||
где V – объѐм выделившегося водорода, мл; Р – атмосферное давление, мм рт.ст.;
25
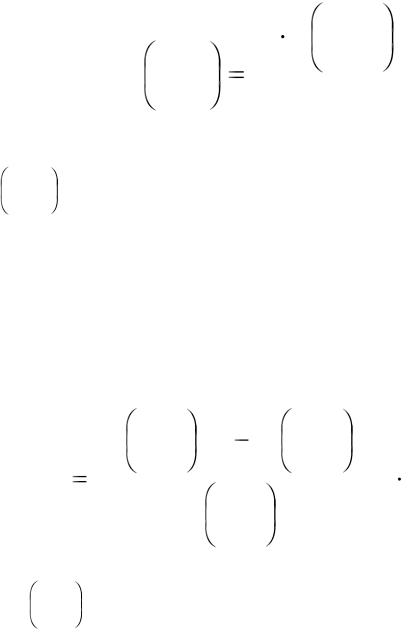
t – температура опыта, °С;
h – упругость водяных паров при температуре опыта, мм рт.ст; Т0 – температура, соответствующая нормальным условиям, К; Р0 – давление, соответствующее нормальным условиям, мм рт.ст.
Запишите расчѐт приведения объѐма выделившегося водорода к нормальным условиям по вышеуказанной формуле с учѐтом полученных исходных данных.
Рассчитываем молярную массу эквивалента алюминия по формуле:
|
|
|
|
|
|
m V |
|
1 |
H2 |
||
|
|
М |
1 |
Al |
2 |
||||||
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|||
|
|
3 |
|
, |
|||||||
|
|
|
|
|
|||||||
|
|
|
|
|
V0 |
||||||
где m – масса навески, г; |
|
|
|
|
|
|
|||||
V |
1 |
Н 2 – молярный объѐм эквивалента водорода, мл/моль; |
|||||||||
2 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
||
V0 – объѐм выделившегося водорода в пересчѐте на нормальные условия, мл.
Запишите расчѐт молярной массы эквивалента алюминия по вышеуказанной формуле.
Относительную ошибку опыта рассчитываем по формуле:
|
|
|
|
|
М |
1 |
Al |
|
|
М |
|
1 |
Al |
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
Х |
|
|
|
3 |
теор |
3 |
опыт |
|
100% |
||||||
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
М 1 Al |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
, |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
3 |
теор |
|
|
|
||||
где М |
1 |
Al |
|
|
– |
|
теоретическое значение |
|
молярной массы |
|||||||
|
|
|
|
|
||||||||||||
|
3 |
теор |
|
|
|
|
|
|
|
|
|
|
|
|||
эквивалента алюминия, г/моль;
26
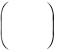
М |
1 |
|
Al |
– значение молярной массы эквивалента |
|
3 |
|||||
|
|
опыт |
|||
алюминия, полученное в ходе опыта, г/моль.
Запишите расчѐт величины относительной ошибки опыта по вышеуказанной формуле.
Сделайте вывод о данном методе определения молярной массы эквивалента вещества и укажите, с какой ошибкой она была найдена в данном случае.
Опыт №2. Определение молярной массы эквивалента карбоната кальция
Молярную массу эквивалента вещества можно определять по количеству данного вещества, прореагировавшего с точно известным количеством другого вещества.
Методика опыта. В пробирку помещаем навеску мрамора (карбоната кальция СаСО3) и добавляем 4 мл (0,004 дм3) раствора соляной кислоты HCl с молярной концентрацией эквивалентов 0,5 моль/дм3.
В ходе опыта происходит следующая реакция:
СаСО3 + 2 HCl = CaCl2 + CO2↑ + H2O
После того, как выделение газа прекратится, оставшийся кусочек мрамора промываем, высушиваем и взвешиваем.
Рассчитываем массу карбоната кальция, вступившего в реакцию с соляной кислотой, по формуле:
m(CaCO3) = m1 – m2,
где m1 – начальная масса навески, г; m2 – конечная масса навески, г.
Запишите расчѐт массы карбоната кальция, вступившего в реакцию с соляной кислотой, по вышеуказанной формуле.
27
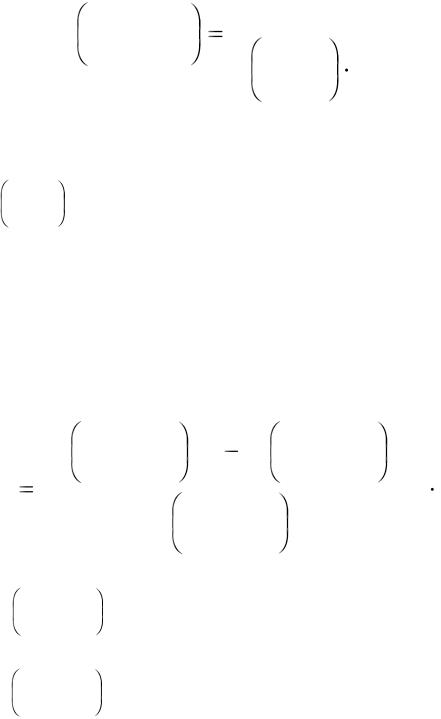
Рассчитываем молярную массу эквивалента карбоната кальция по формуле:
|
|
М |
|
1 |
CaCO3 |
|
|
|
m(СаСО3 ) |
|
|
|
|
2 |
|
1 |
|
, |
|||||
|
|
|
|
|
|
||||||
|
|
|
|
|
|
С |
|
|
HCl |
V (НCl) |
|
|
|
|
|
|
1 |
|
|||||
где m(СаСО3) – масса карбоната кальция, вступившего в реакцию |
|||||||||||
с соляной кислотой, г; |
|
|
|
|
|
|
|
||||
C |
1 |
HCl |
– |
молярная концентрация |
эквивалентов раствора |
||||||
|
|||||||||||
1 |
|
|
|
|
|
|
|
|
|
||
соляной кислоты, моль/дм3;
V(HCl) – объѐм соляной кислоты, дм3.
Запишите расчѐт молярной массы эквивалента карбоната кальция по вышеуказанной формуле.
Относительную ошибку опыта рассчитываем по формуле:
|
|
|
|
М |
1 |
CaCO |
|
|
М |
1 |
CaCO |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
2 |
3 |
|
|
|
2 |
|
3 |
|
|
|
|
|
Х |
|
|
|
|
теор |
|
|
|
опыт |
|
100% |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
М |
1 |
CaCO |
|
|
|
|
, |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
2 |
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
теор |
|
|
|
|
|
||
где M |
1 |
CaCO |
– теоретическое значение молярной массы |
|||||||||||||
|
||||||||||||||||
|
2 |
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
теор |
|
|
|
|
|
|
|
|
|
|
|
эквивалента карбоната кальция, г/моль;
М |
1 |
CaCO |
– значение молярной массы эквивалента |
|
|||
|
2 |
3 |
|
|
|
опыт |
карбоната кальция, полученное в ходе опыта, г/моль.
Запишите расчѐт величины относительной ошибки опыта по вышеуказанной формуле.
28
Сделайте вывод о данном методе определения молярной массы эквивалента вещества и укажите, с какой ошибкой она была найдена в данном случае.
Вопросы для защиты лабораторной работы:
1. От чего зависит эквивалентное число химического взаимодействия?
2. Как найти эквивалентное число ионообменного процесса?
3. Как найти эквивалентное число окислительно-восстановительного процесса?
4. Что такое фактор эквивалентности?
5. Как найти молярную массу эквивалента вещества?
6. Как найти молярную массу эквивалента вещества, участвующего в реакции?
7. Как найти количество вещества эквивалентов?
8. Как рассчитать молярный объѐм эквивалента газообразного вещества?
9. Какие объѐмы займут при нормальных условиях один эквивалент водорода и один эквивалент кислорода?
Рекомендуемая литература:
1.Н.Л. Глинка. «Общая химия». Глава «Эквивалент. Закон эквивалентов».
2.Е.М. Рыбалкин, О.Ю. Ковалик. «Химия. Учебное наглядное пособие». Глава «Эквивалент».
3.Р.М. Белкина, В.Д. Иванова. «Эквивалент. Эквивалентная масса. Задания для практических занятий».
Лабораторная работа №6
Тепловые эффекты химических реакций
Тепловым эффектом химической реакции называется суммарное количество тепловой энергии, выделяющейся или поглощающейся системой в ходе реакции при проведении еѐ в условиях постоянной температуры и постоянного давления. Химические взаимодействия,
29
