
Экзаменационные вопросы по биологической химии
для студентов лечебного, педиатрического и медико-профилактического факультетов
√1. Предмет и задачи биологической химии. Обмен веществ и энергии, иерархическая структурная организация и самовоспроизведение как важнейшие признаки живой материи.
√2. Гетеротрофные и аутотрофные организмы: различия по питанию и источникам энергии. Катаболизм и анаболизм.
√3. Многомолекулярные системы (метаболические цепи, мембранные процессы, системы синтеза биополимеров, молекулярные регуляторные системы) как основные объекты биохимического исследования.
√4. Уровни структурной организации живого. Биохимия как молекулярный уровень изучения явлений жизни. Биохимия и медицина (медицинская биохимия).
√5. Основные разделы и направления в биохимии: биоорганическая химия, динамическая и функциональная биохимия, молекулярная биология.
√6. История изучения белков. Представление о белках как важнейшем классе органических веществ и структурно-функциональном компоненте организма человека.
√7. Аминокислоты, входящие в состав белков, их строение и свойства. Пептидная связь. Первичная структура белков.
√8. Зависимость биологических свойств белков от первичной структуры. Видовая специфичность первичной структуры белков (инсулины разных животных).
√9. Конформация пептидных цепей в белках (вторичная и третичная структуры). Слабые внутримолекулярные взаимодействия в пептидной цепи; дисульфидные связи.
√10.Основы функционирования белков. Активный центр белков и его специфическое взаимодействие с лигандом как основа биологической функции всех белков. Комплементарность взаимодействия молекул белка с лигандом. Обратимость связывания.
√11. Доменная структура и её роль в функционировании белков. Яды и лекарства как ингибиторы белков.
√12.Четвертичная структура белков. Особенности строения и функционирования олигомерных белков на примере гемсодержащего белка - гемоглобина.
√13.Лабильность пространственной структуры белков и их денатурация. Факторы, вызывающие денатурацию.
√14.Шапероны - класс белков, защищающий другие белки от денатурации в условиях клетки и облегчающий формирование их нативной конформации.
√15.Многообразие белков. Глобулярные и фибриллярные белки, простые и сложные. Классификация белков по их биологическим функциям и по семействам: (сериновые протеазы, иммуноглобулины).
√16.Иммуноглобулины, особенности строения, избирательность взаимодействия с антигеном. Многообразие антигенсвязывающих участков Н- и L-цепей. Классы иммуноглобулинов, особенности строения и функционирования.
√17.Физико-химические свойства белков. Молекулярный вес, размеры и форма, растворимость, ионизация, гидратация.
√18.Методы выделения индивидуальных белков: осаждение солями и органическими растворителями, гель-фильтрация, электрофорез, ионообменная и аффинная хроматография.
√19.Методы количественного измерения белков. Индивидуальные особенности белкового состава органов. Изменения белкового состава органов при онтогенезе и болезнях.
√20.История открытия и изучения ферментов. Особенности ферментативного катализа. Специфичность действия ферментов. Зависимость скорости ферментативных реакций от температуры, рН, концентрации фермента и субстрата.
√21 .Классификация и номенклатура ферментов. Изоферменты. Единицы измерения активности и количества ферментов.
√22.Кофакторы ферментов: ионы металлов и коферменты. Коферментные функции витаминов (на примере витаминов В6, РР, В2).
√23.Ингибиторы ферментов. Обратимое и необратимое ингибирование. Конкурентное ингибирование. Лекарственные препараты как ингибиторы ферментов.
√24.Регуляция действия ферментов: аллостерические ингибиторы и активаторы. Каталитический и регуляторный центры. Четвертичная структура аллостерических ферментов и кооперативные изменения конформации протомеров фермента.
√25.Регуляция активности ферментов путем фосфорилирования и дефосфорилирования. Участие ферментов в проведении гормонального сигнала.
√26.Различия ферментного состава органов и тканей. Органоспецифические ферменты. Изменение ферментов в процессе развития.
√27.Изменение активности ферментов при болезнях. Наследственные энзимопатии. Происхождение ферментов крови и значение их определения при болезнях.
√28.Применение ферментов для лечения болезней. Применение ферментов как аналитических реагентов при лабораторной диагностике (определении глюкозы, этанола, мочевой кислоты и т.д.). Иммобилизованные ферменты.
√29.Обмен веществ: питание, метаболизм и выделение продуктов метаболизма. Органические и минеральные компоненты пищи. Основные и минорные компоненты.
√30.Основные пищевые вещества: углеводы, жиры, белки, суточная потребность, переваривание; частичная взаимозаменяемость при питании.
√31 .Незаменимые компоненты основных пищевых веществ. Незаменимые аминокислоты; пищевая ценность различных пищевых белков. Линолевая кислота - незаменимая жирная кислота.
√32.История открытия и изучения витаминов. Классификация витаминов. Функции витаминов.
√ЗЗ. Алиментарные и вторичные авитаминозы и гиповитаминозы. Гипервитаминозы. Примеры.
√34.Минеральные вещества пищи. Региональные патологии, связанные с недостаточностью микроэлементов в пище и воде.
√35.Понятие о метаболизме и метаболических путях. Ферменты и метаболизм. Понятие о регуляции метаболизма. Основные конечные продукты метаболизма у человека.
√36.Исследования на целых организмах, органах, срезах тканей, гомогенатах, субклеточных структурах и на молекулярном уровне.
√37.Эндэргонические и экзэргонические реакции в живой клетке. Макроэргические соединения. Примеры.
√З8.Дегидрирование субстрата и окисление водорода (образование Н2О) как источник энергии для синтеза АТФ. НАД- и ФАД-зависимые дегидрогеназы, убихинон-дегидрогеназа, цитохромы и цитохромоксидаза.
√39.Окислительное фосфорилирование, коэффициент Р/О. Строение митохондрий и структурная организация дыхательной цепи. Трансмембранный электрохимический потенциал.
√40.Регуляция цепи переноса электронов (дыхательный контроль). Разобщение тканевого дыхания и окислительного фосфорилирования. Терморегуляторная функция тканевого дыхания.
√41.Нарушения энергетического обмена: гипоэнергетические состояния как результат гипоксии, гипо-, авитаминозов и других причин. Возрастная характеристика энергетического обеспечения организма питательными веществами.
√42.Образование токсических форм кислорода, механизм их повреждающего действия на клетки. Механизмы устранения токсичных форм кислорода.
√43.Катаболизм основных пищевых веществ - углеводов, жиров, белков. Понятие о специфических путях катаболизма и общих путях катаболизма.
√44.Окислительное декарбоксилирование пировиноградной кислоты. Последовательность реакций. Строение пируватдекарбоксилазного комплекса.
√45.Цикл лимонной кислоты: последовательность реакций и характеристика ферментов. Связь между общими путями катаболизма и цепью переноса электронов и протонов.
√46.Механизмы регуляции цитратного цикла. Анаболические функции цикла лимонной кислоты. Реакции, пополняющие цитратный цикл.
√47.Основные углеводы животных, их содержание в тканях, биологическая роль. Основные углеводы пищи. Переваривание углеводов.
√48.Глюкоза как важнейший метаболит углеводного обмена. Общая схема источников и путей расходования глюкозы в организме.
√49. Аэробный распад — основной путь катаболизма глюкозы у человека и других аэробных организмов. Последовательность реакций до образования пирувата (аэробный гликолиз).
√50.Распространение и физиологическое значение аэробного распада глюкозы. Использование глюкозы для синтеза жиров в печени и в жировой ткани.
√51 .Анаэробный распад глюкозы (анаэробный гликолиз). Гликолитическая оксиредукция, пируват как акцептор водорода. Субстратное фосфорилирование. Распространение и физиологическое значение этого пути распада глюкозы.
√52. Биосинтез глюкозы (глюконеогенез) из аминокислот, глицерина и молочной кислоты. Взаимосвязь гликолиза в мышцах и глюконеогенеза в печени (цикл Кори).
√53. Представление о пентозофосфатном пути превращений глюкозы. Окислительные реакции (до стадии рибулозо-5-фосфата). Распространение и суммарные результаты этого пути (образование пентоз, НАДФН и энергетика).
√54. Свойства и распространение гликогена как резервного полисахарида. Биосинтез гликогена. Мобилизация гликогена.
√55. Особенности обмена глюкозы в разных органах и клетках: эритроциты, мозг, мышцы, жировая ткань, печень.
√56. Представление о строении и функциях углеводной части гликолипидов и гликопротеинов. Сиаловые кислоты.
√57. Наследственные нарушения обмена моносахаридов и дисахаридов: галактоземия, непереносимость фруктозы и дисахаридов. Гликогенозы и агликогенозы.
√58. Важнейшие липиды тканей человека. Резервные липиды (жиры) и липиды мембран (сложные липиды). Жирные кислоты липидов тканей человека.
√59. Незаменимые факторы питания липидной природы. Эссенциальные жирные кислоты: ω-3- и ω-6-кислоты как предшественники синтеза эйкозаноидов.
√60.Биосинтез жирных кислот, регуляция метаболизма жирных кислот.
√61.Химизм реакций β-окисления жирных кислот, энергетический итог.
√62. Биосинтез и использование кетоновых тел в качестве источников энергии.
√бЗ.Пищевые жиры и их переваривание. Всасывание продуктов переваривания. Нарушение переваривания и всасывания. Ресинтез триацилглицеринов в стенке кишечника.
√64.Образование хиломикронов и транспорт жиров. Роль апопротеинов в составе хиломикронов. Липопротеинлипаза.
√65.Биосинтез жиров в печени из углеводов. Структура и состав транспортных липопротеинов крови.
√66. Депонирование и мобилизация жиров в жировой ткани. Регуляция синтеза и мобилизации жиров. Роль инсулина, глюкагона и адреналина.
√67.Основные фосфолипиды и гликолипиды тканей человека (глицерофосфолипиды, сфингофосфолипиды, гликоглицеролипиды, гликосфиголипиды). Представление о биосинтезе и катаболизме этих соединений.
√68.Нарушение обмена нейтрального жира (ожирение), фосфолипидов и гликолипидов. Сфинголипидозы.
√69.Строение и биологические функции эйкозаноидов. Биосинтез простагландинов и лейкотриенов.
√70.Холестерин как предшественник ряда других стероидов. Представление о биосинтезе холестерина. Написать ход реакций до образования мевалоновой кислоты. Роль гидроксиметилглутарил-КоА-редуктазы.
√71.Синтез желчных кислот из холестерина. Конъюгация желчных кислот, первичные и вторичные желчные кислоты. Выведение желчных кислот и холестерина из организма.
√72.ЛПНП и ЛПВП - транспортные, формы холестерина в крови, роль в обмене холестерина. Гиперхолестеринемия. Биохимические основы развития атеросклероза.
√73. Механизм возникновения желчнокаменной болезни (холестериновые камни). Применение хенодезокеихолевой кислоты для лечения желчнокаменной болезни.
√74. Общая схема источников и путей расходования аминокислот в тканях. Динамическое состояние белков в организме.
√75. Переваривание белков. Протеиназы - пепсин, трипсин, химотрипсин; проферменты протеиназ и механизмы их превращения в ферменты. Субстратная специфичность протеиназ. Экзопептидазы и эндопептидазы.
√76. Диагностическое значение биохимического анализа желудочного и дуоденального сока. Дать краткую характеристику состава этих соков.
√77. Протеиназы поджелудочной железы и панкреатиты. Применение ингибиторов протеиназ для лечения панкреатитов.
√78. Трансаминирование: аминотрансферазы; коферментная функция витамина В6. Специфичность аминотрансфераз.
√79. Аминокислоты, участвующие в трансаминировании; особая роль глутаминовой кислоты. Биологическое значение реакций трансаминирования. Определение трансаминаз в сыворотке крови при инфаркте миокарда и болезнях печени.
√80. Окислительное дезаминирование аминокислот; глутаматдегидрогеназа. Непрямое дезаминирование аминокислот. Биологическое значение.
√81. Основные источники аммиака в организме. Роль глутамата в обезвреживании и транспорте аммиака. Глутамин как донор амидной группы при синтезе ряда соединений.
√82. Глутаминаза почек; образование и выведение солей аммония. Активация глутаминазы почек при ацидозе.
√83. Биосинтез мочевины. Связь орнитинового цикла с ЦТК. Происхождение атомов азота мочевины. Нарушения синтеза и выведения мочевины. Гипераммонемии.
√84. Обмен безазотистого остатка аминокислот. Гликогенные и кетогенные аминокислоты. Синтез глюкозы из аминокислот. Синтез аминокислот из глюкозы.
√85. Трансметилирование. Метионин и S-аденозилметионин. Синтез креатина, адреналина и фосфатидилхолинов.
√86. Метилирование ДНК. Представление о метилировании чужеродных и лекарственных соединений.
√87. Источники и образование одноуглеродных групп. Тетрагидрофолиевая кислота и цианкобаламин и их роль в процессах трансметилирования.
√88. Антивитамины фолиевой кислоты. Механизм действия сульфаниламидных препаратов.
√89. Обмен фенилаланина и тирозина. Фенилкетонурия; биохимический дефект, проявление болезни, методы предупреждения, диагностика и лечение.
√90. Алкаптонурия и альбинизм: биохимические дефекты, при которых они развиваются. Нарушение синтеза дофамина, паркинсонизм.
√91. Декарбоксилирование аминокислот. Структура биогенных аминов (гистамин, серотонин, γ-аминомасляная кислота, катехоламины). Функции биогенных аминов.
√92. Дезаминирование и гидроксилирование биогеных аминов (как реакции обезвреживания этих соединений).
√93. Нуклеиновые кислоты, химический состав, строение. Первичная структура ДНК и РНК, связи, формирующие первичную структуру.
√94. Вторичная и третичная структура ДНК. Денатурация, ренативация ДНК. Гибридизация, видовые различия первичной структуры ДНК.
√95. РНК, химический состав, уровни структурной организации. Типы РНК, функции. Строение рибосомы.
√96. Строение хроматина и хромосомы.
√97. Распад нуклеиновых кислот. Нуклеазы пищеварительного тракта и тканей. Распад пуриновых нуклеотидов.
√98. Представление о биосинтезе пуриновых нуклеотидов; начальные стадии биосинтеза (от рибозо-5-фосфата до 5-фосфорибозиламина).
√99. Инозиновая кислота как предшественник адениловой и гуаниловой кислот.
√100. Представление о распаде и биосинтезе пиримидиновых нуклеотидов.
√101. Нарушения обмена нуклеотидов. Подагра; применение аллопуринола для лечения подагры. Ксантинурия. Оротацидурия.
√102. Биосинтез дезоксирибонуклеотидов. Применение ингибиторов синтеза дезоксирибонуклеотидов для лечения злокачественных опухолей.
√103. Биосинтез ДНК, субстраты, источники энергии, матрица, ферменты. Понятие о репликативном комплексе. Этапы репликации.
√104. Синтез ДНК и фазы клеточного деления. Роль циклинов и циклинзависимых протеиназ в продвижении клетки по клеточному циклу.
√105. Повреждение и репарация ДНК. Ферменты ДНК-репарирующего комплекса.
√106. Биосинтез РНК. РНК полимеразы. Понятие о мозаичной структуре генов, первичном транскрипте, посттранскрипционном процессинге.
√107. Биологический код, понятия, свойства кода, коллинеарность, сигналы терминации.
√108. Роль транспортных РНК в биосинтезе белков. Биосинтез аминоацил-т-РНК. Субстратная специфичность аминоацил-т-РНК-синтетаз.
√109. Последовательность событий на рибосоме при сборке полипептидной цепи. Функционирование полирибосом. Посттрансляционный процессинг белков.
√110. Адаптивная регуляция генов у про- и эукариотов. Теория оперона. Функционирование оперонов.
√111. Понятие о клеточной дифференцировке. Изменение белкового состава клеток при дифференцировке (на примере белкового состава полипептидных цепей гемоглобина).
√112. Молекулярные механизмы генетической изменчивости. Молекулярные мутации: типы, частота, значение.
√113. Генетическая гетерогенность. Полиморфизм белков в популяции человека (варианты гемоглобина, гликозилтрансферазы, группоспецифических веществ и др).
√114. Биохимические основы возникновения и проявления наследственных болезней (разнообразие, распространение).
√115. Основные системы межклеточной коммуникации: эндокринная, паракринная, аутокринная регуляция.
√116. Роль гормонов в системе регуляции метаболизма. Клетки-мишени и клеточные рецепторы гормонов.
√117. Механизмы передачи гормональных сигналов в клетки.
√118. Классификация гормонов по химическому строению и биологическим функциям.
√119. Строение, синтез и метаболизм иодтиронинов. Влияние на обмен веществ. Изменение метаболизма при гипо- и гипертиреозе. Причины и проявление эндемического зоба.
√120. Регуляция энергетического метаболизма, роль инсулина и контринсулярных гормонов в обеспечении гомеостаза.
√121. Изменения метаболизма при сахарном диабете. Патогенез основных симптомов сахарного диабета.
√122. Патогенез поздних осложнений сахарного диабета (макро- и микроангиопатии, нефропатия, ретинопатия, катаракта). Диабетическая кома.
√123. Регуляция водно-солевого обмена. Строение и функции альдостерона и вазопрессина.
√124. Система ренин-ангиотензин-альдостерон. Биохимические механизмы возникновения почечной гипертонии, отеков, дегидратации.
√125. Роль гормонов в регуляции обмена кальция и фосфатов (паратгормон, кальцитонин). Причины и проявления гипо- и гиперпаратироидизма.
√126. Строение, биосинтез и механизм действия кальцитриола. Причины и проявление рахита.
√127. Строение и секреция кортикостероидов. Изменения катаболизма при гипо- и гиперкортицизме.
√128. Регуляция синтезами секреции гормонов по принципу обратной связи.
√129. Половые гормоны: строение, влияние на обмен веществ и функции половых желез, матки и молочных желез.
√130. Гормон роста, строение, функции.
√131. Метаболизм эндогенных и чужеродных токсических веществ: реакции микросомального окисления и реакции конъюгации с глутатионом, глюкуроновой кислотой, серной кислотой.
√132. Металлотионеин и обезвреживание ионов тяжелых металлов. Белки теплового шока.
√133. Токсичность кислорода: образование активных форм кислорода (супероксид анион, перекись водорода, гидроксильный радикал).
√134. Повреждение мембран в результате перекисного окисления липидов. Механизмы защиты от токсического действия кислорода: неферментативные (витамины Е, С, глутатион и др.) и ферментативные (супероксиддисмутаза, каталаза, глутатионпероксидаза).
√135. Биотрансформация лекарственных веществ. Влияние лекарств на ферменты, участвующие в обезвреживании ксенобиотиков.
√136. Основы химического канцерогенеза. Представление о некоторых химических канцерогенах: полициклические ароматические углеводороды, ароматические амины, диоксиды, митоксины, нитрозамины.
√137. Особенности развития, строения и метаболизма эритроцитов.
√138. Транспорт кислорода и диоксида углерода кровью. Гемоглобин плода (HbF) и его физиологическое значение.
√139. Полиморфные формы гемоглобинов человека. Гемоглобинопатии. Анемические гипоксии.
√140. Биосинтез гема и его регуляция. Нарушения синтеза тема. Порфирии.
√141. Распад гема. Обезвреживание билирубина. Нарушения обмена билирубина—желтухи: гемолитическая, обтурационная, печеночно-клеточная. Желтуха новорожденных.
√142. Диагностическое значение определения билирубина и других желчных пигментов в крови и моче.
√143. Обмен железа: всасывание, транспорт кровью, депонирование. Нарушение обмена железа: железодефицитная анемия, гемохроматоз.
√144. Основные белковые фракции плазмы крови и их функции. Значение их определения для диагностики заболеваний. Энзимодиагностика.
√145. Свертывающая система крови. Этапы образования фибринового сгустка. Внутренний и внешний пути свертывания и их компоненты.
√146. Принципы образования и последовательность фукционирования ферментных комплексов прокоагулянтного пути. Роль витамина К в свертывании крови.
√147. Основные механизмы фибринолиза. Активаторы плазминогена как тромболитические средства. Основаные антикоагулянты крови: антитромбин III, макроглобулин, антиконвертин. Гемофилии.
√148. Клиническое значение биохимического анализа крови.
√149. Основные мембраны клетки и их функции. Общие свойства мембран: жидкостность, поперечная асимметрия, избирательная проницаемость.
√150. Липидный состав мембран (фосфолипиды, гликолипиды, холестерин). Роль липидов в формировании липидного бислоя.
√151. Белки мембран - интегральные, поверхностные, «заякоренные». Значение посттрансляционных модификаций в образовании функциональных мембранных белков.
√152. Механизмы переноса веществ через мембраны: простая диффузия, первично-активный транспорт (Nа+-К+-АТФаза, Са2+-АТФаза), пассивный симпорт и антипорт, вторично-активный транспорт.
√153. Трансмембранная передача сигнала. Участие мембран в активации внутриклеточных регуляторных систем - аденилатциклазной и инозитолфосфатной в передаче гормонального сигнала.
√154. Коллаген: особенности аминокислотного состава, первичной и пространственной структуры. Роль аскорбиновой кислоты в гидоксилировании пролина и лизина.
√155. Особенности биосинтеза и созревания коллагена. Проявления недостаточности витамина С.
√156. Особенности строения и функции эластина.
√157. Гликозаминогликаны и протеогликаны. Строение и функции. Роль гиалуроновой кислоты в организации межклеточного матрикса.
√158. Адгезивные белки межклеточного матрикса: фибронектин и ламинин, их строение и функции. Роль этих белков в межклеточных взаимодействиях и развитии опухолей.
√159. Структурная организация межклеточного матрикса. Изменения соединительной ткани при старении, коллагенозах. Роль коллагеназы при заживлении ран. Оксипролинурия.
√160. Важнейшие белки миофибрилл: миозин, актин, актомиозин, тропомиозин, тропонин, актинин. Молекулярная структура миофибрилл.
√161. Биохимические механизмы мышечного сокращения и расслабления. Роль градиента одновалентных ионов и ионов кальция в регуляции мышечного сокращения и расслабления.
√162. Саркоплазматические белки: миоглобин, его строение и функции. Экстрактивные вещества мышц.
√163. Особенности энергетического обмена в мышцах. Креатинфосфат.
√164. Биохимические изменения при мышечных дистрофиях и денервации мышц. Креатинурия.
√165. Химический состав нервной ткани. Миелиновые мембраны: особенности состава и структуры.
√166. Энергетический обмен в нервной ткани. Значение аэробного распада глюкозы.
√167. Биохимия возникновения и проведения нервного импульса. Молекулярные механизмы синаптической передачи.
√168. Медиаторы: ацетилхолин, катехоламины, серотонин, γ-аминомаслянная кислота, глутаминовая кислота, глицин, гистамин.
√169. Нарушения обмена биогенных аминов при психических заболеваниях. Предшественники катехоламинов и ингибиторы моноаминооксидазы в лечении депрессивных состояний.
√170. Физиологически активные пептиды мозга.
Необходимо знать!!!
Биохимические показатели биологических жидкостей человека
1. Аминный азот сыворотки крови
2. Общий белок сыворотки крови
3. Альбумины сыворотки крови
4. Глобулины сыворотки крови
5. Альбумино-глобулиновый коэффициент сыворотки крови
6. Остаточный азот сыворотки крови и его компоненты
7. Мочевина сыворотки крови
8. Мочевина мочи
9. Глюкоза крови
10. Порог почечной проницаемости для глюкозы (кровь)
11. Сиаловые кислоты (сыворотка)
12. Кетоновые тела сыворотки крови
13. Общие липиды сыворотки крови
14. Липоротеины общие сыворотки крови
15. Общий холестерин сыворотки крови
16. Общий билирубин сыворотки крови
17. рН крови
18. Буферные основания (плазма крови)
19. Сдвиг буферных оснований
20. Креатинин (моча)
21. Общая кислотность желудочного сока (его составные части)
22. Амилаза сыворотки крови
23. Трансаминазы (АсАТ и АлАТ) сыворотки крови
24. Щелочная фосфатаза сыворотки крови
25. Кальций сыворотки крови
26. Хлориды (кровь)
1. Предмет и задачи биологической химии. Обмен веществ и энергии, иерархическая структурная организация и самовоспроизведение как важнейшие признаки живой материи.
Биологическая химия —это наука о молекулярной сущности жизни. Она изучает химическую природу веществ, входящих в состав живых организмов, их превращения, а также связь этих превращений с деятельностью клеток, органов и тканей и организма в целом. Из этого определения вытекает, что биохимия занимается выяснением химических основ важнейших биологических процессов и общих путей и принципов превращений веществ и энергии, лежащих в основе разнообразных проявлений жизни. Таким образом, главной задачей биохимии является установление связи между молекулярной структурой и биологической функцией химических компонентов живых организмов.
Наиболее важными и приоритетными фундаментальными направлениями научных исследований в биохимии и молекулярной биологии являются генетическая инженерия и биотехнология, которым придается исключительное значение. Усилия ученых сосредоточены на создании и производстве препаратов для медицины (гормоны, ферменты, моноклональные антитела, биоактивные пептиды, вакцины, интерферон, простагландины и др.), сельского хозяйства (регуляторы роста растений, феромоны для борьбы с вредителями растений), промышленности (пищевые и вкусовые добавки). Эта новая технология может решать ряд важных проблем в медицине (пренатальная диагностика болезней, генотерапия и др.).
В настоящее время перед биологической наукой поставлена задача — обеспечить преимущественное развитие научных исследований по следующим основным направлениям: разработка методов генетической и клеточной инженерии, создание на их основе новых процессов для биотехнологических производств с целью получения принципиально новых пород животных, форм растений с ценными признаками; разработка новых методов и средств диагностики, лечения и профилактики наследственных заболеваний; разработка научных основ инженерной энзимологии; разработка и внедрение новых биокатализаторе в (в том числе иммобилизованных) и оптимизация с их помощью биотехнологических процессов получения химических и пищевых продуктов; исследования структуры и функции биомолекул клетки; изучение молекулярных и клеточных основ иммунологии, а также генетики микроорганизмов и вирусов, вызывающих заболевания человека и животных, создание методов и средств диагностики, лечения и профилактики этих заболеваний; исследования молекулярно-биологиче-ских механизмов канцерогенеза, природы онкогенов и онкобелков, их роли в малигнизации клеток и создание на этой основе методов диагностики и лечения опухолевых заболеваний человека; исследования проблем биоэнергетики, питания, психики и молекулярных основ памяти и деятельности мозга. Таким образом, можно наметить следующие главные направления развития исследований в области биологической химии на ближайшую и отдаленную перспективу, так называемые горизонты биохимии:
1. Дифференцировка клеток высших организмов (эукариот).
2. Организация и механизм функционирования генома.
3. Регуляция действия ферментов и теория энзиматического катализа.
4. Процессы узнавания на молекулярном уровне.
5. Молекулярные основы соматических и наследственных заболеваний человека.
6. Молекулярные основы злокачественного роста.
7. Молекулярные основы иммунитета.
8. Рациональное питание.
9. Молекулярные механизмы памяти.
10. Биосинтез белка.
11. Биологические мембраны и биоэнергетика.
Основное назначение биологической химии сводится к тому, чтобы решать на молекулярном уровне задачи фундаментальные, общебиологические, включая проблему зависимости человека от экосистемы, которую необходимо не только понимать, но защищать и научиться разумно ею пользоваться.
Важнейшим признаком всего живого является обмен веществ. Обмен веществ обеспечивает присущее живому организму как системе динамическое равновесие, при котором взаимно уравновешиваются синтез и разрушение, размножение и гибель. В основе реакций обмена веществ лежат физико-химические взаимодействия между атомами и молекулами, подчиняющиеся единым для живой и неживой материи законам. Сказанное означает, что сама возможность существования жизни, в первооснове своей, сводится к элементарным актам физико-химических процессов. Обмен веществ состоит из двух противоположных, одновременно протекающих процессов. Первый — анаболизм — объединяет все реакции, связанные с синтезом необходимых веществ, их усвоением и использованием для роста, развития и жизнедеятельности организма. Второй — катаболизм — включает реакции, связанные с распадом веществ, их окислением и выведением из организма продуктов распада. В целом же, обмен веществ представляет собой комплекс биохимических и энергетических процессов, обеспечивающих использование пищевых веществ для нужд организма и удовлетворения его потребностей в пластических и энергетических веществах.
Живой организм – сложная, упорядоченная иерархическая структурная организация. Уровень организации живой материи повышается в ходе эволюции. Формирование каждой следующей ступени иерархии уровней происходит на основе предыдущей, которая структурно в неё входит. Существует множество теорий о структурной организации живой материи. Наиболее известная из них оценивает иерархию по критерию масштабности. Согласно ей, жизнь имеет следующие уровни организации:
Молекулярный уровень - отражает особенности химизма живого вещества, а также механизмы и процессы передачи генной информации
Клеточный и субклеточный уровни - отражают особенности специализации клеток, а также внутриклеточные структуры. На этом уровне происходят процессы жизнедеятельности (обмен веществ, питание, дыхание, раздражимость и т. д.)
Организменный и органно-тканевый уровни - отражают признаки отдельных особей, их строение, физиологию, поведение, а также строение и функции органов и тканей живых существ
Популяционно-видовой уровень - образуется свободно скрещивающимися между собой особями одного и того же вида, совокупность особей одного вида
Уровень биогеоценозов - структуры, состоящие из участков Земли с определенным составом живых и неживых компонентов, представляющих единый природный комплекс – экосистему
Биосферный - вся совокупность живых организмов Земли вместе с окружающей их природной средой
Еще одним качеством, благодаря которому возможна жизнь - это свойство живых организмов к самовоспроизведению. Самовоспроизведение свойственно целым организмам, отдельным их органам, тканям, клеткам, клеточным включениям и многим органеллам. Самовоспроизведение осуществляется посредством вегетативного, полового и бесполого размножений, у животных - путем деления, живорождения, яйцерождения и яйцеживорождения. В основе самовоспроизведения лежит образование новых молекул и структур, которое обусловлено информацией, заложенной в нуклеиновой кислоте ДНК,. Самовоспроизведение тесно связано с явлением наследственности: любое живое существо рождает себе подобных, путем реализации механизма матричного синтеза ДНК.
2. Гетеротрофные и аутотрофные организмы: различия по питанию и источникам энергии. Катаболизм и анаболизм.
Живые клетки постоянно нуждаются в органических и неорганических веществах, а также в химической энергии, которую они получают преимущественно из АТФ (АТР). По способу удовлетворении этих потребностей организмы подразделяются на автотрофные и гетеротрофные. Автотрофные организмы, к которым принадлежат растения и многие микроорганизмы, могут синтезировать органические молекулы из неорганических предшественников в процессах хемо- и фотосинтеза . Автотрофы обеспечивают существование все других организмов на планете.
Гетеротрофы, например животные и грибы, зависят от получения органических веществ с пищей. Так как большая часть этих питательных веществ (белки, углеводы, нуклеиновые кислоты и липиды) не могут утилизироваться непосредственно, они сначала разрушаются до более мелких фрагментов катаболическим путем . Возникающие метаболиты (в совокупности их называют иногда «пулом метаболитов») затем катаболизируются с высвобождением свободной энергии или используются в анаболических путях для синтеза более сложных молекул.
Процесс обмена веществ определяется двумя сопряженными процессами: анаболизма и катаболизма.
Анаболизм - совокупность химических процессов синтеза собственных органических соединений из полученных питательных веществ, идущий с потреблением энергии. В результате такого обмена из питательных веществ, поступающих в организм, строятся свойственные организму структурные молекулы, которые, в свою очередь, идут уже на создание новых функциональных единиц живого организма, что является основой ассимиляции.
Катаболизм - процесс метаболического распада, разложения на более простые вещества или окисления какого-либо вещества, обычно протекающий с высвобождением энергии в виде тепла и в виде АТФ. Катаболические реакции лежат в основе диссимиляции: утраты сложными веществами своей специфичности для данного организма в результате распада до более простых.
3. Многомолекулярные системы (метаболические цепи, мембранные процессы, системы синтеза биополимеров, молекулярные регуляторные системы) как основные объекты биохимического исследования.
Как известно, биохимия - это наука изучающая химическую основу жизни как таковой. В её рамках изучаются все основные молекулярные процессы жизнедеятельности организма.
Метаболические цепи - процессы последовательных превращений исходного вещества, приводящие к образованию некоторого продукта. Все метаболические пути можно подразделить на анаболические и катаболические. Метаболическая цепь, состоящая из реакций, протекающих внутри одной системы, называется внутренней. Метаболическая цепь, реакции которой протекают в разных системах, называется межсистемной. Одно и то же вещество может участвовать в различных превращениях. В подобных случаях наблюдается пересечение различных метаболических цепей. Следствием такого пересечения является возникновение метаболической сети биологической системы. Понимание функционирования одного звена цепи позволяет проводить корректировку нарушений протекания определенного биохимического процесса в организме.
Мембранные процессы – это физико-химические процессы, происходящие на поверхности клеточных мембран. К ним относят: процессы активного транспорта веществ, проведение и передача биопотенциалов, рецепция и др. Изучение природы мембранных процессов позволяет на клеточном уровне понимать характер протекающих процессов жизнедеятельности и их патологию.
Система синтеза биополимеров – совокупность ферментативных механизмов, которые обеспечивают воспроизведение специфических для данного организма видов высокомолекулярных соединений. Биополимеры играют важнейшую роль во всех процессах жизнедеятельности организма. Поэтому особенно важно понимать суть процессов их воспроизведения.
Молекулярные регуляторные системы - системы, направленные на поддержание гомеостаза. Данная системы включают в себя ряд биохимических процессов. Нарушение хотя бы одного звена в системе поддержания гомеостаза, способно вызвать необратимые изменения, которые могут привести к гибели организма.
4. Уровни структурной организации живого. Биохимия как молекулярный уровень изучения явлений жизни. Биохимия и медицина (медицинская биохимия).
Жизнь имеет следующие уровни организации:
Молекулярный уровень - отражает особенности химизма живого вещества, а также механизмы и процессы передачи генной информации
Клеточный и субклеточный уровни - отражают особенности специализации клеток, а также внутриклеточные структуры. На этом уровне происходят процессы жизнедеятельности (обмен веществ, питание, дыхание, раздражимость и т. д.)
Организменный и органно-тканевый уровни - отражают признаки отдельных особей, их строение, физиологию, поведение, а также строение и функции органов и тканей живых существ
Популяционно-видовой уровень - образуется свободно скрещивающимися между собой особями одного и того же вида, совокупность особей одного вида
Уровень биогеоценозов - структуры, состоящие из участков Земли с определенным составом живых и неживых компонентов, представляющих единый природный комплекс – экосистему
Биосферный - вся совокупность живых организмов Земли вместе с окружающей их природной средой
Молекулярный уровень выступает основой для всей жизнедеятельности любого организма на планете, это уровень функционирования биологических макромолекул - биополимеров: нуклеиновых кислот, белков, полисахаридов, липидов, стероидов. На молекулярном уровне происходят различные процессы жизнедеятельности живых организмов: обмен веществ, превращение энергии, формирование биопотенциалов клетки. С помощью молекулярного уровня осуществляется передача наследственной информации, образуются отдельные органоиды, происходят ферментативные процессы. Понимание химических процессов, происходящих в организме – является одной из ключевых задач биологической химии, поэтому она выступает на молекулярном уровне организации живого.
Биохимия оказывает все более глубокое воздействие на медицину. Так, например, определение активности ферментов играет в настоящее время важную роль в клинической диагностике. Содержание определенных ферментов в сыворотке крови может служить ценным критерием при диагностике недавно перенесенного инфаркта миокарда. Кроме того, биохимия постепенно создает основу для рационального назначения лекарственных препаратов. Исключительную важность представляет выяснение молекулярных механизмов некоторых заболеваний, например серповидно-клеточной анемии или большого числа врожденных нарушений метаболизма, исследованных к настоящему времени. Быстрое развитие биохимии в последние годы позволило исследователям приступить к изучению самых острых, коренных проблем биологии и медицины.
5. Основные разделы и направления в биохимии: биоорганическая химия, динамическая и функциональная биохимия, молекулярная биология.
Биохимия включает в себя:
Биоорганическая химия - изучает вещества, лежащие в основе процессов жизнедеятельности, в непосредственной связи с познанием их биологической функции. Основные объекты БОХ — биополимеры, превращения которых составляют химическую сущность биологических процессов, и биорегуляторы, которые химически регулируют обмен веществ. БОХ занимается получением этих веществ в химически чистом состоянии, установлением строения, синтезом, выяснением зависимостей между строением и биологическими свойствами, изучением химических аспектов механизма биологического действия биополимеров, а также природных и синтетических биорегуляторов. Характерная особенность БОХ. — использование всего комплекса химических и физических методов индивидуализации веществ и выяснение их строения.
Динамическая биохимия - раздел биохимии, изучающий обмен веществ в организме от момента поступления в него питательных веществ до образования конечных продуктов обмена, механизмы нейтрализации токсических продуктов, выведения их из организма и регуляции скорости соответствующих превращений.
Функциональная биохимия - раздел биохимии, изучающий химические превращения, лежащие в основе функций органов, тканей и организма в целом.
Молекулярная биология - наука, ставящая своей задачей познание природы явлений жизнедеятельности путём изучения биологических объектов и систем на уровне, приближающемся к молекулярному, а в ряде случаев и достигающем этого предела. Конечной целью при этом является выяснение того, каким образом и в какой мере характерные проявления жизни, такие, как наследственность, воспроизведение себе подобного, биосинтез белков, возбудимость, рост и развитие, хранение и передача информации, превращения энергии, подвижность и т. д., обусловлены структурой, свойствами и взаимодействием молекул биологически важных веществ, в первую очередь двух главных классов высокомолекулярных биополимеров.
6. История изучения белков. Представление о белках как важнейшем классе органических веществ и структурно-функциональном компоненте организма человека.
Белки были выделены в отдельный класс биологических молекул в XVIII веке в результате работ французского химика Антуана Фуркруа и других учёных, в которых было отмечено свойство белков коагулировать (денатурировать) под воздействием нагревания или кислот. В то время были исследованы такие белки, как альбумин («яичный белок»), фибрин (белок из крови) и глютен из зерна пшеницы.
Голландский химик Геррит Мульдер провёл анализ состава белков и выдвинул гипотезу, что практически все белки имеют сходную эмпирическую формулу.
Термин «протеин» для обозначения подобных молекул был предложен в 1838 году шведским химиком Якобом Берцелиусом . Мульдер также определил продукты разрушения белков — аминокислоты и для одной из них (лейцина) с малой долей погрешности определил молекулярную массу — 131 дальтон.
В 1836 Мульдер предложил первую модель химического строения белков. Основываясь на теории радикалов он сформулировал понятие о минимальной структурной единице состава белка, C16H24N4O5, которая была названа «протеин», а теория — «теорией протеина» . По мере накопления новых данных о белках теория стала неоднократно подвергаться критике, но до конца 1850-х несмотря на критику ещё считалась общепризнанной.
К концу XIX века было исследовано большинство аминокислот, которые входят в состав белков. В 1894 году немецкий физиолог Альбрехт Коссель выдвинул теорию, согласно которой именно аминокислоты являются основными структурными элементами белков.
В начале XX века немецкий химик Эмиль Фишер экспериментально доказал, что белки состоят из аминокислотных остатков, соединённых пептидными связями. Он же осуществил первый анализ аминокислотной последовательности белка и объяснил явление протеолиза. Сложность выделения чистых белков затрудняла их изучение. Поэтому первые исследования проводились с использованием тех полипептидов, которые могли быть очищены в большом количестве, то есть белковкрови,куриныхяиц, различныхтоксинов, а также пищеварительных/метаболическихферментов, выделяемых после забоя скота.
Идея о том, что вторичная структура белков — результат образования водородных связей между аминокислотами, была высказана Уильямом Астбери в 1933 году, но Лайнус Полинг считается первым учёным, который смог успешно предсказать вторичную структуру белков. Позднее Уолтер Каузман, опираясь на работы Кая Линдерстрём-Ланга, внёс весомый вклад в понимание законов образования третичной структуры белков и роли в этом процессе гидрофобных взаимодействий.
В 1949 году Фред Сенгер определил аминокислотную последовательность инсулина, продемонстрировав таким способом, что белки — это линейные полимеры аминокислот, а не их разветвлённые (как у некоторых сахаров) цепи, коллоиды или циклолы.
Первые структуры белков, основанные на дифракции рентгеновских лучей на уровне отдельных атомов были получены в 1960-х годах и с помощью ЯМР в 1980-х годах.
В XXI веке исследование белков перешло на качественно новый уровень, когда исследуются не только индивидуальные очищенные белки, но и одновременное изменение количества и посттрансляционных модификаций большого числа белков отдельных клеток, тканей или организмов.
Белки́ (протеи́ны, полипепти́ды]) — высокомолекулярные органические вещества, состоящие из соединённых в цепочку пептидной связью α-аминокислот. Для живых организмов характерны широкое разнообразие белковых структур и их высокая упорядоченность; последняя существует во времени и пространстве. Удивительная способность живых организмов к воспроизведению себе подобных также связана с белками. Сократимость, движение – непременные атрибуты живых систем – имеют прямое отношение к белковым структурам мышечного аппарата. Наконец, жизнь немыслима без обмена веществ, постоянного обновления составных частей живого организма, т.е. без процессов анаболизма и катаболизма (этого удивительного единства противоположностей живого), в основе которых лежит деятельность каталитически активных белков – ферментов.
Таким образом, белки (белковые вещества) составляют основу и структуры, и функции живых организмов. Подсчитано, что в природе примерно 1010–1012 различных белков, обеспечивающих существование около 106 видов живых организмов различной сложности организации начиная от вирусов и кончая человеком. Каждый организм характеризуется уникальным набором белков. Фенотипические признаки и многообразие функций обусловлены специфичностью объединения этих белков, во многих случаях в виде над- и мультимолекулярных структур, в свою очередь определяющих ультраструктуру клеток и их органелл.
7. Аминокислоты, входящие в состав белков, их строение и свойства. Пептидная связь. Первичная структура белков.
α-Аминокислоты представляют собой производные карбоновых кислот, у которых один водородный атом, у α-углерода, замещен на аминогруппу (—NH2).

Аминокислоты будут отличаться друг от друга химической природой радикала R, представляющего группу атомов в молекуле аминокислоты, связанную с α-углеродным атомом и не участвующую в образовании пептидной связи при синтезе белка. Почти все α-амино- и α-карбоксильные группы участвуют в образовании пептидных связей белковой молекулы, теряя при этом свои специфические для свободных аминокислот кислотно-основные свойства. Поэтому все разнообразие особенностей структуры и функции белковых молекул связано с химической природой и физико-химическими свойствами радикалов аминокислот. Именно благодаря им белки наделены рядом уникальных функций, не свойственных другим биополимерам, и обладают химической индивидуальностью. В состав белков входят 20 природных аминокислот.
Кислотно-основные свойства. Эти свойства аминокислот определяют многие физико-химические и биологические свойства белков. На этих свойствах основаны, кроме того, почти все методы выделения и идентификации аминокислот. Аминокислоты легко растворимы в воде. Они кристаллизуются из нейтральных водных растворов в форме биполярных (амфотерных) ионов, а не в виде недиссоциированных молекул. В связи с этим, они могут проявлять как основные, так и кислотные свойства, что зависит еще от природы входящего в их состав радикала.
Стереохимия аминокислот. Важнейшим свойством аминокислот, освобождающихся в процессе гидролиза природных белков в условиях, исключающих рацемизацию, является их оптическая активность. Это свойство связано с наличием в молекуле всех природных аминокислот (за ислючением глицина) в α-положении асимметрического атома углерода. Стереохимию аминокислот принято оценивать не по оптическому вращению, а исходя из абсолютной конфигурации всех четырех замещающих групп, расположенных вокруг асимметрического атома углерода в вершинах модели тетраэдра. Абсолютную конфигурацию аминокислот принято соотносить стереохимически с соединением, произвольно взятым для сравнения, а именно с глицериновым альдегидом, также содержащим асимметрический атом углерода. Все аминокислоты, образующиеся при гидролизе природных белков в условиях, исключающих рацемизацию, принадлежит к L-ряду. Таким образом, природные аминокислоты имеют пространственное расположение, аналогичное конфигурации L-глицеринового альдегида.
Пептидная связь — вид амидной связи, возникающей при образовании белков и пептидов в результате взаимодействия α-аминогруппы (—NH2) одной аминокислоты с α-карбоксильной группой (—СООН) другой аминокислоты. Из двух аминокислот(1) и (2) образуетсядипептид(цепочка из двух аминокислот) и молекула воды. По этой же схемерибосомагенерирует и более длинные цепочки из аминокислот:полипептидыибелки.
Первичная структура — последовательность аминокислот в полипептидной цепи. Важными особенностями первичной структуры являются консервативные мотивы — сочетания аминокислот, играющих ключевую роль в функциях белка. Консервативные мотивы сохраняются в процессе эволюции видов, по ним часто удаётся предсказать функцию неизвестного белка. Первичная структура предопределяет все дальнейшие виды организации белковой молекулы.
8. Зависимость биологических свойств белков от первичной структуры. Видовая специфичность первичной структуры белков (инсулины разных животных).
Анализ данных о первичной структуре белков позволяет сделать следующие общие выводы.
1. Первичная структура белков уникальна и детерминирована генетически. Каждый индивидуальный гомогенный белок характеризуется уникальной последовательностью аминокислот: частота замены аминокислот приводит не только к структурным перестройкам, но и к изменениям физико-химических свойств и биологических функций.
2. Стабильность первичной структуры обеспечивается в основном главновалентными пептидными связями; возможно участие небольшого числа дисульфидных связей.
3. В полипептидной цепи могут быть обнаружены разнообразные комбинации аминокислот; в полипептидах относительно редки повторяющиеся последовательности.
4. В некоторых ферментах, обладающих близкими каталитическими свойствами, встречаются идентичные пептидные структуры, содержащие неизменные (инвариантные) участки и вариабельные последовательности аминокислот, особенно в областях их активных центров. Этот принцип структурного подобия наиболее типичен для ряда протеолитических ферментов: трипсина, химотрипсина и др.
5. В первичной структуре полипептидной цепи детерминированы вторичная, третичная и четвертичная структуры белковой молекулы, определяющие ее общую пространственную конформацию.
Первичная структура инсулина у разных биологических видов несколько различается, как различается и его важность в регуляции обмена углеводов. Наиболее близким к человеческому является инсулин свиньи, который различается с ним всего одним аминокислотным остатком: в 30 положении B-цепи свиного инсулина расположен аланин, а в инсулине человека —треонин; бычий инсулин отличается тремя аминокислотными остатками.
9. Конформация пептидных цепей в белках (вторичная и третичная структуры). Слабые внутримолекулярные взаимодействия в пептидной цепи; дисульфидные связи.
Вторичная структура — локальное упорядочивание фрагмента полипептидной цепи, стабилизированное водородными связями. Ниже приведены самые распространённые типы вторичной структуры белков:
α-спирали— плотные витки вокруг длинной оси молекулы, один виток составляют 3,6 аминокислотных остатка, и шаг спирали составляет 0,54 нм (так что на один аминокислотный остаток приходится 0,15 нм), спираль стабилизирована водородными связями между H и O пептидных групп, отстоящих друг от друга на 4 звена. Спираль построена исключительно из одного типа стереоизомеров аминокислот (L). Хотя она может быть как левозакрученной, так и правозакрученной, в белках преобладает правозакрученная. Спираль нарушают электростатические взаимодействияглутаминовой кислоты,лизина,аргинина. Расположенные близко друг к другу остаткиаспарагина,серина,треонинаилейцинамогут стерически мешать образованию спирали, остаткипролинавызывает изгиб цепи и также нарушает α-спирали.
β-листы(складчатые слои) — несколько зигзагообразных полипептидных цепей, в которых водородные связи образуются между относительно удалёнными друг от друга (0,347 нм на аминокислотный остаток) в первичной структуре аминокислотами или разными цепями белка, а не близко расположенными, как имеет место в α-спирали. Эти цепи обычно направлены N-концами в противоположные стороны (антипараллельная ориентация). Для образования β-листов важны небольшие размеры боковых групп аминокислот, преобладают обычноглициниаланин.
Стабильность вторичной структуры обеспечивается в основном водородными связями (определенный вклад вносят и главновалентные связи – пептидные и дисульфидные). Водородная связь представляет собой слабое электростатическое притяжение (взаимодействие, связь) между одним электроотрицательным атомом (например, кислородом или азотом) и водородным атомом, ковалентно связанным со вторым электроотрицательным атомом. По современным представлениям, водородная связь включает не только электростатические силы притяжения между полярными группами. но и электронные связи такого же типа, как в ряде комплексных соединений. Водородные связи, являясь нековалентными, отличаются малой прочностью. Поскольку в белковой молекуле число водородных связей очень велико (в образование водородных связей вовлечены все пептидные группы), они в сумме обеспечивают скручивание полипептидной цепи в спиральную структуру, сообщая ей компактность и стабильность.
Третичная или трёхмерная структура— пространственное строение полипептидной цепи (набор пространственных координат составляющих белок атомов). Структурно состоит из элементов вторичной структуры, стабилизированных различными типами взаимодействий, в которыхгидрофобные взаимодействияиграют важнейшую роль. В стабилизации третичной структуры принимают участие:
диcульфи́дная связь — ковалентная связьмежду двумяатомамисеры, входящими в состав серусодержащейаминокислотыцистеина. Образующие дисульфидную связь аминокислоты могут находиться как в одной, так и в разных полипептидных цепяхбелка. Дисульфидные связи образуются в процессепосттрансляционной модификациибелков и служат для поддержания третичной и четвертичной структур белка;
ионные связимежду противоположно заряженными боковыми группами аминокислотных остатков;
водородные связи;
гидрофильно-гидрофобныевзаимодействия. При взаимодействии с окружающими молекулами воды белковая молекула «стремится» свернуться так, чтобы неполярные боковые группы аминокислот оказались изолированы от водного раствора; на поверхности молекулы оказываются полярные гидрофильные боковые группы.
10.Основы функционирования белков. Активный центр белков и его специфическое взаимодействие с лигандом как основа биологической функции всех белков. Комплементарность взаимодействия молекул белка с лигандом. Обратимость связывания.
Каждый индивидуальный белок, имеющий уникальную первичную структуру и конформацию, обладает и уникальной функцией, отличающей его от остальных белков. Набор индивидуальных белков выполняет в клетке множество разнообразных и сложных функций. Необходимое условие для функционирования белков - присоединение к нему другого вещества, которое называют "лиганд". Лигандами могут быть как низкомолекулярные вещества, так и макромолекулы. Взаимодействие белка с лигандом высокоспецифично и обратимо, что определяется строением участка белка, называемого центром связывания белка с лигандом или активным центром.
Активный центр белков - определённый участок белковой молекулы, как правило, находящийся в её углублении ("кармане"), сформированный радикалами аминокислот, собранных на определённом пространственном участке при формировании третичной структуры и способный комплементарно связываться с лигандом. В линейной последовательности полипептидной цепи радикалы, формирующие активный центр, могут находиться на значительном расстоянии друг от друга. Уникальные свойства активного центра зависят не только от химических свойств формирующих его аминокислот, но и от их точной взаимной ориентации в пространстве. Поэтому даже незначительные нарушения общей конформации белка в результате точечных изменений его первичной структуры или условий окружающей среды могут привести к изменению химических и функциональных свойств радикалов, формирующих активный центр, нарушать связывание белка с лигандом и его функцию. При денатурации активный центр белков разрушается, и происходит утрата их биологической активности.
Под комплементарностью понимают пространственное и химическое соответствие взаимодействующих молекул. Лиганд должен обладать способностью входить и пространственно совпадать с конформацией активного центра. Это совпадение может быть неполным, но благодаря конформационной лабильности белка активный центр способен к небольшим изменениям и "подгоняется" под лиганд. Кроме того, между функциональными группами лиганда и радикалами аминокислот, образующих активный центр, должны возникать связи, удерживающие лиганд в активном центре. Связи между лигандом и активным центром белка могут быть как нековалентными (ионными, водородными, гидрофобными), так и ковалентными.
11. Доменная структура и её роль в функционировании белков. Яды и лекарства как ингибиторы белков.
Доме́н белка́ — элемент третичной структуры белка, представляющий собой достаточно стабильную и независимую подструктуру белка, чей фолдинг проходит независимо от остальных частей. В состав домена обычно входит несколько элементов вторичной структуры. Сходные по структуре домены встречаются не только в родственных белках (например, в гемоглобинах разных животных), но и в совершенно разных белках. Домены могут выполнять разные функции и подвергаться складыванию (свертыванию) в независимые компактные глобулярные структурные единицы, соединенные между собой гибкими участками внутри белковой молекулы.
Достаточно часто доменам присваивают отдельные названия, так как их присутствие непосредственно влияет на выполняемые белкомбиологической функции, к примеру, Ca2+-связывающий доменкальмодулина,гомеодомен, отвечающий за связывание сДНКв различныхфакторах транскрипции. Разные домены в белке могут перемещаться друг относительно друга при взаимодействии с лигандом, что облегчает дальнейшее функционирование белка.
Аналоги естественных лигандов белков используют в медицине в качестве лекарственных средств. Широкое применение такие лекарства нашли в регуляции передачи возбуждения через синапсы. Нейромедиатор, выделяемый при прохождении импульса нервными окончаниями, должен высокоспецифично взаимодействовать с белками-рецепторами на постсинаптической мембране. Однако, модифицируя химическую структуру нейромедиатора, можно получить вещества, которые также связывались бы с рецептором, но при этом менялся физиологический эффект: уменьшался или усиливался. В фармакологии такие вещества называют "антагонисты" и "агонисты" соответственно.
Однако некоторые структурные аналоги ли-гандов рецепторных белков не являются ингибиторами, а вызывают такие же или более сильные физиологические эффекты, чем природные лиганды. Их более сильный и длительный эффект часто связан с тем, что модифицированные лиганды медленнее инактивируются и разрушаются в организме.
Некоторые яды, попадая в организм человека, прочно связываются с определёнными белками, ингибируют их и тем самым вызывают нарушения биологических функций. Например, нейротоксины кобры и крайта специфически взаимодействуют с холинергическими рецепторами постсинаптических мембран, блокируя их работу, и оказывают курареподобное действие. Сродство нейротоксинов к холинергическим рецепторам очень высоко между токсином рецептором образуется множество связей, что и приводит к их практически необратимому соединению.
Необходимо помнить, что между лекарствами и ядами часто существует прозрачная граница, и эффект их действия зависит от дозы вводимого вещества. Так, лекарства, назначаемые в дозах, больших чем терапевтические, могут действовать как яды, т.е. вызывать серьёзные нарушения обмена веществ и функций организма, а яды в микродозах часто используют как лекарственные препараты. Например, атропин, широко применяемый для снятия спазмов гладких мышц, в больших дозах вызывает возбуждение ЦНС, а в ещё больших дозах - сон, переходящий в кому. Известное гапотензивное средство клофелин при передозировке вызывает коллапс.
12.Четвертичная структура белков. Особенности строения и функционирования олигомерных белков на примере гемсодержащего белка - гемоглобина.
Четверичная структура (или субъединичная, доменная) —способ укладки в пространстве отдельных полипептидных цепей, обладающих одинаковой (или разной) первичной, вторичной или третичной структурой, и формирование единого в структурном и функциональном отношениях макромолекулярно-го образования. Многие функциональные белки состоят из нескольких полипептидных цепей, соединенных не главновалентными связями, а неко-валентными (аналогичными тем, которые обеспечивают стабильность третичной структуры). Каждая отдельно взятая полипептидная цепь, получившая название протомера, мономера или субъединицы, чаще всего не обладает биологической активностью. Эту способность белок приобретает при определенном способе пространственного объединения входящих в его состав протомеров, т.е. возникает новое качество, не свойственное мономерному белку. Образовавшуюся молекулу принято называть олигомером (или мультимером). Олигомерные белки чаще построены из четного числа протомеров (от 2 до 4, реже от 6 до 8) с одинаковыми или разными молекулярными массами – от нескольких тысяч до сотен тысяч. В частности,молекула гемоглобина состоит из двух одинаковых α- и двух β-полипептидных цепей, т.е. представляет собой тетрамер. Молекула гемоглобина содержит четыре полипептидные цепи, каждая из которых окружает группу гема – пигмента, придающего крови ее характерный красный цвет. Основной вклад во взаимодействие субъединиц вносят гидрофобные взаимодействия. И α, и β-цепи относятся к α-спиральномуструктурному классу, так как содержат исключительноα-спирали. Каждая цепь содержит восемь спиральных участков.Простетическая группанековалентно связана с гидрофобной впадиной молекулы гемоглобина
13.Лабильность пространственной структуры белков и их денатурация. Факторы, вызывающие денатурацию.
Под лабильностью пространственной структуры белка понимают способность структуры белковой молекулы претерпевать конформационные изменения под действием различных физико-химических факторов.
Под денатурацией следует понимать нарушение общего плана уникальной структуры нативной молекулы белка, преимущественно ее третичной структуры, приводящее к потере характерных для нее свойств (растворимость, электрофоретическая подвижность, биологическая активность и т.д.) Внешние проявления денатурации сводятся к потере растворимости, особенно в изоэлектрической точке, повышению вязкости белковых растворов, увеличению количества свободных функциональных SH-групп и изменению характера рассеивания рентгеновских лучей. Наиболее характерным признаком денатурации является резкое снижение или полная потеря белком его биологической активности (каталитической, антигенной или гормональной). При непродолжительном действии и быстром удалении денатурирующих агентов возможна ренатурация белка с полным восстановлением исходной трехмерной структуры и нативных свойств его молекулы, включая биологическую активность. Таким образом, при денатурации белковая молекула полностью теряет биологические свойства, демонстрируя тем самым тесную связь между структурой и функцией.
14.Шапероны - класс белков, защищающий другие белки от денатурации в условиях клетки и облегчающий формирование их нативной конформации.
Шаперо́ны (англ. chaperones) — класс белков, главная функция которых состоит в восстановлении правильной третичной структуры повреждённых белков, а также образование и диссоциация белковых комплексов. Термин «молекулярный шаперон» впервые был использован в работе Ласкей и других при описании ядерного белка нуклеоплазмина, способного предотвращатьагрегирование белков-гистонов с ДНК при образовании нуклеосом. Шапероны есть во всех живых организмах, и механизм их действия, нековалентное присоединение к белкам и их «расплетение» с использованием энергии гидролиза АТФ также консервативен.
Многие шапероны являются белками теплового шока, то есть белками, экспрессия которых начинается в ответ на рост температуры или другие клеточные стрессы. Тепло сильно влияет на фолдинг белка, а некоторые шапероны участвуют в исправлении потенциального вреда, который возникает из-за неправильного сворачивания белков.
Другие шапероны участвуют в фолдинге только что созданных белков в тот момент, когда они «вытягиваются» из рибосомы. И хотя большинство только что синтезированных белков могут сворачиваться и при отсутствии шаперонов, некоторому меньшинству обязательно требуется их присутствие.
Другие типы шаперонов участвуют в транспортировке веществ сквозь мембраны, например в митохондриях иэндоплазматическом ретикулуме у эукариот.
Продолжают обнаруживаться новые функции шаперонов, например, участие в разрушении белка, деятельности бактериального адгезина и в реакциях на заболевания, связанные с агрегацией белков.
15.Многообразие белков. Глобулярные и фибриллярные белки, простые и сложные. Классификация белков по их биологическим функциям и по семействам: (сериновые протеазы, иммуноглобулины).
До настоящего времен нет единой и стройной классификации, учитывающей различные параметры белков. В основе имеющихся классификаций обычно лежит один признак. Так, белки можно классифицировать:
по форме молекул (глобулярные или фибриллярные);
по молекулярной массе (низкомолекулярные, высокомолекулярные и др.);
по химическому строению (наличие или отсутствие небелковой части);
по выполняемым функциям (транспортные, защитные, структурные белки и др.);
по локализации в клетке (ядерные, цитоплазматические, лизосомальные и др.);
по локализации в организме (белки крови, печени, сердца и др.);
по возможности адаптивно регулировать количество данных белков: белки, синтезирующиеся с постоянной скоростью (конститутивные), и белки, синтез которых может усиливаться при воздействии факторов среды (индуцибельные);
по продолжительности жизни в клетке (от очень быстро обновляющихся белков, с Т1/2 менее 1 ч, до очень медленно обновляющихся белков, Т1/2 которых исчисляют неделями и месяцами);
по схожим участкам первичной структуры и родственным функциям (семейства белков).
Одной из самых старых и распространенных классификаций белков является классификация по форме молекулы.
Она делит белки на 2 группы: глобулярные и фибриллярные. К глобулярным относят белки, соотношение продольной и поперечной осей которых не превышает 1:10, а чаще составляет 1:3 или 1:4, т.е. белковая молекула имеет форму эллипса. Большинство индивидуальных белков человека относят к глобулярным белкам. Они имеют компактную структуру и многие из них, за счёт удаления гидрофобных радикалов внутрь молекулы, хорошо растворимы в воде.
Фибриллярные белки имеют вытянутую, нитевидную структуру, в которой соотношение продольной и поперечной осей составляет более 1:10. К фибриллярным белкам относят коллагены, эластин, кератин, выполняющие в организме человека структурную функцию, а также миозин, участвующий в мышечном сокращении, и фибрин - белок свёртывающей системы крови.
По химическому строению белки делят на простые и сложные. Белки, содержащие в своём составе только полипептидные цепи, состоящие из аминокислотных остатков, называют простые белки. Примером простых белков могут служить основные белки хроматина - гистоны; в их составе содержится много аминокислотных остатков лизина и аргинина, радикалы которых имеют положительный заряд . Однако очень многие белки, кроме полипептидных цепей, содержат в своём составе небелковую часть, присоединённую к белку слабыми или ковалентными связями. Небелковая часть может быть представлена ионами металлов, какими-либо органическими молекулами с низкой или высокой молекулярной массой. Такие белки называют сложные белки. Прочно связанная с белком небелковая часть носит название простетической группы. Простетическая группа может быть представлена веществами разной природы. Например, белки, соединённые с гемом, носят название гемопротеины.
Белки, соединённые с остатком фосфорной кислоты, называют фосфопротеинами. Фосфорные остатки присоединяются сложноэфирной связью к гидроксильным группам серина, треонина или тирозина при участии ферментов, называемых протеинкиназами.
В состав белков часто входят углеводные остатки, придающие белкам дополнительную специфичность и часто уменьшающие скорость их ферментативного протеолиза. Такие белки носят название гликопротеинов. Многие белки крови, а также рецепторные белки клеточной поверхности относят к гликопротеинам.
Белки, функционирующие в комплексе с липидами, называют липопротеинами, а в комплексе с металлами - металлопротеинами.
Сложный белок, состоящий из белковой части (апопротеин) и небелковой части (простетическая группа), называют "холопротеин".
В ходе эволюции в пределах одного биологического вида замены аминокислотных остатков могут приводить к возникновению разных белков, выполняющих родственные функции и имеющих гомологичные последовательности аминокислот. Такие белки, имеющие гомологичные участки полипептидной цепи, сходную конформацию и родственные функции, выделяют в семейства белков
К семейству родственных белков относят сериновые протеазы. Это семейство ферментов, которые используют уникально активированный остаток серина, расположенный в активном центре, для связывания и каталитического гидролиза пептидных связей в белковых субстратах. Мишени для сериновых протеаз - специфические пептидные связи в белках (часто в других сериновых протеазах). Д ля всех белков этого семейства характерно наличие в активном центре остатков Сер195, Гис57, Асп102 (эту нумерацию используют независимо от их точного расположения в первичной структуре определённых сериновых протеаз). Выявлена также высокая схожесть их пространственных структур, несмотря на то, что только в 40% положений они содержат идентичные аминокислоты. Каталитический участок сериновых протеаз расположен в расщелине между двумя доменами. Некоторые аминокислотные замены привели к изменению субстратной специфичности этих белков и к возникновению функционального многообразия внутри этого семейства. Так, пищеварительные сериновые протеазы участвуют в переваривании (гидролитическом расщеплении пептидных связей) денатурированных пищевых белков. К ним относят трипсин, химотрипсин, эластазу, но каждый из этих ферментов предпочитает разрывать пептидные связи, образованные определёнными аминокислотами. Ещё большей субстратной специфичностью обладают сериновые протеазы, участвующие в тщательно контролируемых физиологических процессах, таких как активация каскада белков свёртывания крови, фибринолиза, активация белков системы комплемента, образования белковых гормонов.
Иммуноглобулины, или антитела, - специфические белки, вырабатываемые В-лимфоцитами в ответ на попадание в организм чужеродных структур, называемых антигенами. В организме человека вырабатывается около 107 клонов В-лимфоцитов, каждый из которых специализирован на выработке одного из 107 видов иммуноглобулинов. Все иммуноглобулины характеризуются общим планом строения: состоят из четырёх полипептидных цепей: двух идентичных лёгких (L - от англ,light), содержащих около 220 аминокислотных остатков, и двух тяжёлых (Н - от англ. heavy), состоящих из 440 аминокислот каждая. Все 4 цепи соединены друг с другом множеством нековалентных и четырьмя дисульфидными связями. Лёгкие цепи состоят из 2 доменов: вариабельного (VL), находящегося в N-концевой области полипептидной цепи, и константного (CL), расположенного на С-конце. Каждый из доменов состоит из 2 слоев с β-складчатой структурой, где участки полипептидной цепи лежат антипараллельно. β-Слои связаны ковалентно дисульфидной связью примерно в середине домена. Тяжёлые цепи имеют 4 домена: один вариабельный (VH), находящийся на N-конце, и три константных (СН1, СН2, СH3). Домены тяжёлых цепей IgG имеют гомологичное строение с доменами лёгких цепей. Между двумя константными доменами тяжёлых цепей СH1, и СН2 есть участок, содержащий большое количество остатков пролина, которые препятствуют формированию вторичной структуры и взаимодействию соседних Н-цепей на этом отрезке. Этот участок называют "шарнирной областью"; он придаёт молекуле гибкость. Между вариабельными доменами тяжёлых и лёгких цепей находятся два идентичных участка, связывающих два одинаковых специфических антигена; поэтому такие антитела часто называют "биваленты". Основные функции антител - обнаружение и связывание чужеродных антигенов, находящихся в организме вне его клеток (в крови, лимфе, межклеточной жидкости, в слизистых секретах). Это происходит с помощью специфических антигенсвязывающих участков разных клонов иммуноглобулинов. Кроме, того, благодаря связыванию антигена с антителом облегчается процесс дальнейшего разрушения чужеродных веществ. Специфичность пути разрушения комплекса антиген-антитело зависит от класса антител, которых существует 5 типов: IgA, IgD, IgE, IgG, IgM.
16.Иммуноглобулины, особенности строения, избирательность взаимодействия с антигеном. Многообразие антигенсвязывающих участков Н- и L-цепей. Классы иммуноглобулинов, особенности строения и функционирования
Иммуноглобулины, или антитела, - специфические белки, вырабатываемые В-лимфоцитами в ответ на попадание в организм чужеродных структур, называемых антигенами. В организме человека вырабатывается около 107 клонов В-лимфоцитов, каждый из которых специализирован на выработке одного из 107 видов иммуноглобулинов. Все иммуноглобулины характеризуются общим планом строения: состоят из четырёх полипептидных цепей: двух идентичных лёгких (L - от англ,light), содержащих около 220 аминокислотных остатков, и двух тяжёлых (Н - от англ. heavy), состоящих из 440 аминокислот каждая. Все 4 цепи соединены друг с другом множеством нековалентных и четырьмя дисульфидными связями. Лёгкие цепи состоят из 2 доменов: вариабельного (VL), находящегося в N-концевой области полипептидной цепи, и константного (CL), расположенного на С-конце. Каждый из доменов состоит из 2 слоев с β-складчатой структурой, где участки полипептидной цепи лежат антипараллельно. β-Слои связаны ковалентно дисульфидной связью примерно в середине домена. Тяжёлые цепи имеют 4 домена: один вариабельный (VH), находящийся на N-конце, и три константных (СН1, СН2, СH3). Домены тяжёлых цепей IgG имеют гомологичное строение с доменами лёгких цепей. Между двумя константными доменами тяжёлых цепей СH1, и СН2 есть участок, содержащий большое количество остатков пролина, которые препятствуют формированию вторичной структуры и взаимодействию соседних Н-цепей на этом отрезке. Этот участок называют "шарнирной областью"; он придаёт молекуле гибкость. Между вариабельными доменами тяжёлых и лёгких цепей находятся два идентичных участка, связывающих два одинаковых специфических антигена; поэтому такие антитела часто называют "биваленты". Основные функции антител - обнаружение и связывание чужеродных антигенов, находящихся в организме вне его клеток (в крови, лимфе, межклеточной жидкости, в слизистых секретах). Это происходит с помощью специфических антигенсвязывающих участков разных клонов иммуноглобулинов. Кроме, того, благодаря связыванию антигена с антителом облегчается процесс дальнейшего разрушения чужеродных веществ. Специфичность пути разрушения комплекса антиген-антитело зависит от класса антител, которых существует 5 типов: IgA, IgD, IgE, IgG, IgM.
Иммуноглобулины М - первый класс антител, синтезирующийся в развивающихся В-лимфоцитах. Различают 2 формы иммуноглобулинов М: мономерная, мембранно-связанная форма и пентамерная, секретируемая В-лимфоцитами в кровь.
Мембранно-с вязанная форма иммуноглобулинов М . Созревающие В-лимфоциты синтезируют мономерные бивалентные молекулы IgM, по структуре похожие на рассматриваемые выше IgG, которые встраиваются в плазматическую мембрану клеток и играют роль первых антиген-распознающих рецепторов. Прикрепление IgM к мембране осуществляется с помощью гидрофобного участка, находящегося в С-концевой ("хвостовой") области тяжёлых цепей, содержащей 25 гидрофобных аминокислотных остатков. Взаимодействие антигена с рецептором на поверхности В-лимфоцита вызывает его размножение и образование целого клона лимфоцитов, происходящих из одной, стимулированной антигеном клетки. Этот клон В-лимфоцитов будет вырабатывать иммуноглобулины с одинаковыми антигенсвязывающими участками. Однако В-лимфоциты способны переключаться на выработку других классов антител.
Секреторная форма иммуноглобулинов М . Когда В-лимфоциты впервые встречаются в жидкостях организма с неизвестным ранее антигеном, они синтезируют и секретируют в кровь IgM, которые содержат пять мономерных субъединиц, связанных друг с другом дисульфидными связями и дополнительной полипептидной J-цепью (рис. 1-46).
В тяжёлых цепях их мономеров отсутствует гидрофобная "хвостовая" часть. Пентамерная молекула содержит 10 участков связывания с антигеном, что облегчает вероятность прикрепления Неизвестного ранее антигена к иммуноглобулину . Взаимодействие антигена с IgM изменяет его конформацию и индуцирует связывание его "хвостовой" области с первым компонентом системы комплемента. Если антиген расположен на поверхности микроорганизма, активирование системы комплемента вызывает нарушение целостности клеточной мембраны и гибель бактериальной клетки.
Иммуноглобулины G. В количественном отношении IgG доминируют в крови и составляют около 75% от общего количества этих белков. Строение IgG подробно описано выше. В крови IgG обнаруживают только в мономерной форме; он секретируется активированными В-лимфоцитами в больших количествах при вторичном иммунном ответе, когда антиген повторно попадает в организм. У человека обнаружено 4 подкласса IgG: IgGg1, IgGg2, IgGg3, IgGg4. Порядковый номер указывает на количественное содержание каждого подкласса в сыворотке (в наибольшем количестве содержится IgGg1 а в наименьшем - gGg4). Степень гомологии между этими подклассами очень высока (около 90-95%). IgG не только эффективно связывают и инактивируют чужеродные молекулы и клетки, попавшие в организм, но также облегчают их дальнейшее уничтожение. Конформационные изменения в "хвостовой" области IgG после его взаимодействия с антигеном приводят к связыванию и активации белков системы комплемента. Кроме того, С-концевая область IgG способна взаимодействовать со специфическими рецепторами макрофагов и нейтрофилов, что приводит к фагоцитозу комплексов антиген-антитело и разрушению их в фагосомах. IgG - единственный класс антител, способный проникать через плацентарный барьер и обеспечивать внутриутробную защиту плода от инфекций.
Иммуноглобулины А. Основной класс антител, присутствующий в секретах желёз организма (слюны, молока, пищеварительного сока, секретов дыхательных путей). В сыворотке крови его содержание не превышает 10-15% от общего количества иммуноглобулинов. Мономерная форма по строению напоминает IgG. Однако в секретах IgA находится в основном в форме димера, где мономеры соединены дополнительной пептидной цепью J . На базальной поверхности эпителиальных клеток димер IgA специфически взаимодействует с белками клеточной поверхности, называемыми секреторным компонентом. Образующийся комплекс посредством эндоцитоза поглощается внутрь клетки и перемещается к апикальной части. Здесь комплекс подвергается действию протеолитических ферментов, и свободный димер высвобождается во внеклеточное пространство. Образующийся при взаимодействии IgA с антигеном комплекс не взаимодействует с белками системы комплемента и фагоцитирующими клетками, но препятствует прикреплению антигенов к поверхности эпителиальных клеток и проникновению их в организм.
Иммуноглобулины Е. Содержание этого класса иммуноглобулинов в крови крайне мало. IgE - мономеры, но, в отличие от IgG, их тяжёлые цепи е содержат не 3, а 4 константных домена. После синтеза и секреции в кровь В-лимфоцитами IgE связываются своими С-концевыми участками с соответствующими рецепторами на поверхности тучных клеток и базофилов. В результате они становятся рецепторами антигенов на поверхности данных клеток. После присоединения антигена хотя бы к двум антигенсвязывающим участкам двух соседних IgE клетка получает сигнал к секреции биологически активных веществ (серотонина, гистамина), хранящихся в секреторных пузырьках. Выброс этих веществ в значительной мере ответственен за развитие воспалительной реакции, а также таких аллергических реакций, как бронхиальная астма, крапивница, сенная лихорадка. Увеличение количества IgE может предшествовать развитию аллергических реакций.
Иммуноглобулины D. IgD обнаружены в крови в очень малых количествах. Мономерные белки играют роль рецепторов В-лимфоцитов; других функций у IgD пока не выявлено.
17.Физико-химические свойства белков. Молекулярный вес, размеры и форма, растворимость, ионизация, гидратация
Индивидуальные белки различаются по своим физико-химическим свойствам: форме молекул, молекулярной массе, суммарному заряду молекулы, соотношению полярных и неполярных групп на поверхности нативной молекулы белка, растворимости белков, а также степени устойчивости к воздействию денатурирующих агентов.
Различия белков по молекулярной массе. Белки - высокомолекулярные соединения, но могут сильно отличаться по молекулярной массе, которая колеблется от 6000 до 1 000 000 Да и выше. Молекулярная масса белка зависит от количества аминокислотных остатков в полипептидной цепи, а для олигомерных белков - и от количества входящих в него протомеров (или субъединиц).
Различия белков по форме молекул. По форме молекул белки делят на глобулярные и фибриллярные. Глобулярные белки имеют более компактную структуру, их гидрофобные радикалы в большинстве своём спрятаны в гидрофобное ядро, и они значительно лучше растворимы в жидкостях организма, чем фибриллярные белки (исключение составляют мембранные белки).
Различия по растворимости белков. Растворимость белков в воде зависит от формы, молекулярной массы, величины заряда, соотношения полярных и неполярных функциональных групп на поверхности белка. Кроме этого, растворимость белка определяется составом растворителя, т.е. наличием в растворе других растворённых веществ. Например, некоторые белки легче растворяются в слабом солевом растворе, чем в дистиллированной воде. С другой стороны, увеличение концентрации нейтральных солей может способствовать выпадению определённых белков в осадок. Денатурирующие агенты, присутствующие в растворе, также снижают растворимость белков.
Различия по гидратации. На поверхности большинства внутриклеточных белков преобладают полярные радикалы, однако соотношение полярных и неполярных групп отлично для разных индивидуальных белков. Так, протомеры олигомерных белков в области контактов друг с другом часто содержат гидрофобные радикалы. Поверхности белков, функционирующих в составе мембран или прикрепляющиеся к ним в процессе функционирования, также обогащены гидрофобными радикалами. Такие белки лучше растворимы в липидах, чем в воде.
Различия по ионизации. Белки имеют в своём составе радикалы лизина, аргинина, гистидина, глутаминовой и аспарагиновой кислот, содержащие функциональные группы, способные к ионизации (ионогенные группы). Кроме того, на N- и С-концах полипептидных цепей имеются α-амино- и α-карбоксильная группы, также способные к ионизации. Суммарный заряд белковой молекулы зависит от соотношения ионизированных анионных радикалов Глу и Асп и катионных радикалов Лиз, Apг и Гис. Значение рН, при котором белок приобретает суммарный нулевой заряд, называют"изоэлектрическая точка" и обозначают как pI. В изоэлектрической точке количество положительно и отрицательно заряженных групп белка одинаково, т.е. белок находится в изоэлектрическом состоянии. Так как большинство белков в клетке имеет в своём составе больше анионогенных групп (-СОО-), то изоэлектрическая точка этих белков лежит в слабокислой среде. Изоэлектрическая точка белков, в составе которых преобладают катионогенные группы, находится в щелочной среде. Наиболее яркий пример таких внутриклеточных белков, содержащих много аргинина и лизина, - гистоны, входящие в состав хроматина. Белки, имеющие суммарный положительный или отрицательный заряд, лучше растворимы, чем белки, находящиеся в изоэлектрической точке. Суммарный заряд увеличивает количество диполей воды, способных связываться с белковой молекулой, и препятствует контакту одноимённо заряженных молекул, в результате растворимость белков увеличивается. Заряженные белки могут двигаться в электрическом поле: анионные белки, имеющие отрицательный заряд, будут двигаться к положительно заряженному аноду (+), а катионные белки - к отрицательно заряженному катоду (- ). Белки, находящиеся в изоэлектрическом состоянии, не перемещаются в электрическом поле.
18.Методы выделения индивидуальных белков: осаждение солями и органическими растворителями, гель-фильтрация, электрофорез, ионообменная и аффинная хроматография.
Высаливание. Метод выделения белков, основанный на различиях в их растворимости при разной концентрации соли в растворе. Соли щелочных и щёлочно-земельных металлов вызывают обратимое осаждение белков, т.е. после их удаления белки вновь приобретают способность растворяться, сохраняя при этом свои нативные свойства.
Чаще всего для разделения белков методом высаливания используют разные концентрации солей сульфата аммония - (NH4)2SO4. Чем выше растворимость белка, тем большая концентрация соли необходима для его высаливания.
Гель-фильтрация, или метод молекулярных сит. Для выделения белков часто используют хроматографические методы, основанные на распределении веществ между двумя фазами, одна из которых подвижная, а другая неподвижная. В основу хроматографических методов положены разные принципы: гель-фильтрации, ионного обмена, адсорбции, биологического сродства. Метод разделения белков с помощью гель-фильтрационной хроматографии основан на том, что вещества, отличающиеся молекулярной массой, по-разному распределяются между неподвижной и подвижной фазами. Хроматографическая колонка заполняется гранулами пористого вещества (сефадекс, агароза и др.). В структуре полисахарида образуются поперечные связи и формируются гранулы с "порами", через которые легко проходят вода и низкомолекулярные вещества. В зависимости от условий можно формировать гранулы с разной величиной "пор". Неподвижная фаза - жидкость внутри гранул, в которую способны проникать низкомолекулярные вещества и белки с небольшой молекулярной массой. Смесь белков, нанесённую на хроматографическую колонку, вымывают (элюируют), пропуская через колонку растворитель. Вместе с фронтом растворителя движутся и самые крупные молекулы. Более мелкие молекулы диффундируют внутрь гранул сефадекса и на некоторое время попадают в неподвижную фазу, в результате чего их движение задерживается. Величина пор определяет размер молекул, способных проникать внутрь гранул.
Электрофорез белков. Метод основан на том, что при определённом значении рН и ионной силы раствора белки двигаются в электрическом поле со скоростью, пропорциональной их суммарному заряду. Белки, имеющие суммарный отрицательный заряд, двигаются к аноду (+), а положительно заряженные белки - к катоду (-).
Электрофорез проводят на различных носителях: бумаге, крахмальном геле, полиакриламидном геле и др. В отличие от электрофореза на бумаге, где скорость движения белков пропорциональна только их суммарному заряду, в полиакриламидном геле скорость движения белков пропорциональна их молекулярным массам.
Ионообменная хроматография. Так же как и электрофорез, метод основан на разделении белков, различающихся суммарным зарядом при определённых значениях рН и ионной силы раствора. При пропускании раствора белков через хроматографическую колонку, заполненную твёрдым пористым заряженным материалом, часть белков задерживается на нём в результате электростатических взаимодействий. В качестве неподвижной фазы используют ионообменники - полимерные органические вещества, содержащие заряженные функциональные группы. Выбор ионообменника определяется зарядом выделяемого белка. Так, для выделения отрицательно заряженного белка используют анионообменник. При пропускании раствора белка через колонку прочность связывания белка с анионообменником зависит от количества отрицательно заряженных карбоксильных групп в молекуле. Белки, адсорбированные на анионообменнике, можно смыть (элюировать) буферными растворами с различной концентрацией соли и разным рН.
Аффинная хроматография, или хроматография по сродству. Это наиболее специфичный метод выделения индивидуальных белков, основанный на избирательном взаимодействии белков с лигандами, прикреплёнными (иммобилизированными) к твёрдому носителю. В качестве лиганда может быть использован субстрат или кофермент, если выделяют какой-либо фермент, антигены для выделения антител и т.д. Через колонку, заполненную иммобилизованным лигандом, пропускают раствор, содержащий смесь белков. К лиганду присоединяется только белок, специфично взаимодействующий с ним; все остальные белки выходят с элюатом . Белок, адсорбированный на колонке, можно снять, промыв её раствором с изменённым значением рН или изменённой ионной силой. В некоторых случаях используют раствор детергента, разрывающий гидрофобные связи между белком и лигандом. Аффинная хроматография отличается высокой избирательностью и помогает очистить выделяемый белок в тысячи раз.
19.Методы количественного измерения белков. Индивидуальные особенности белкового состава органов. Изменения белкового состава органов при онтогенезе и болезнях.
Для определения количества белка в образце используется ряд методик:
Биуретовый метод — один из колориметрическихметодов количественного определениябелковв растворе. Разработан в 1949 году Горналлом, Бардавиллом и Дэвидом, ныне мало используется в биохимической лабораторной практике (за исключением медицинских анализов на белок) из-за низкой чувствительности. Основан на образованиибиуретовогокомплекса (имеет фиолетовый цвет) пептидных связей белков с двухвалентными ионами меди. В методе используют т. н. биуретовый реактив, состоящий изKOH,CuSO4ицитрата натрия(илитартрата натрия). В образовавшемся комплексе медь связана с 4 азотами координационными связями, а с 2 кислородами — электростатическими. Полноценный комплекс образуется лишь с пептидами, состоящими более чем из 4 остатков.
Метод Лоури - основан на образовании окрашенных продуктов ароматических аминокислот с реактивом Фолина в сочетании с биуретовой реакцией на пептидные связи. Метод характеризуется высокой чувствительностью. На развитие окраски влияет большое количество веществ: компоненты буферных систем восстановители, комплексоны, детергенты и др. В связи с этим при построении калибровочного графика для определения белка по Лоури в растворитель для стандартного белка необходимо включать все компоненты, содержащиеся в анализируемых пробах. В некоторых случаях целесообразно предварительное осаждение белков из растворов, например трихлоруксусной кислотой, с последующим растворением их в щелочных растворах, или очистка белковых растворов от низкомолекулярных компонентов путем диализа или гель-фильтрации.
Определение по азоту. Определение основано на том, что содержание азота в большинстве белков практически одинаково и может быть принято равным 16%. По количеству определенного азота находят количество белка в пробе. При нагревании органического соединения с концентрированной серной (хлорной) кислотой происходит его минерализация, азот переходит в сернокислый аммоний (перхлорат аммония), и его можно определить количественно.
Спектрометрический метод - Метод основан на способности ароматических аминокислот (триптофана, тирозина и в меньшей степенифенилаланина) поглощать ультрафиолетовый свет с максимумом при 280 нм. Измеряя величину оптической плотности при этой длине волны, находят количество белка в растворе. Поскольку белки отличаются по содержанию ароматических аминокислот, их поглощение в ультрафиолетовой области спектра может сильно различаться.
Наиболее богаты белковыми веществами ткани и органы животных. Источником белка являются также микроорганизмы и растения. Большинство белков хорошо растворимо в воде. Некоторые органические вещества, выделенные из хряща, волос, ногтей, рогов, костной ткани и нерастворимые в воде, также были отнесены к белкам, поскольку по своему химическому составу оказались близки к белкам мышечной ткани, сыворотки крови, яйца. В мышцах, легких, селезенке, почках на долю белков приходится более 70–80% от сухой массы, а во всем теле человека – 45% от сухой массы. В отличие от животных тканей в растениях содержится значительно меньше белков . Для изучения химического состава, строения и свойств белков их обычно выделяют или из тканей, или из культивируемых клеток, или биологических жидкостей, например сыворотки крови, молока, мышц, печени, кожи и др. Элементный состав белков в пересчете на сухое вещество представлен 50–54% углерода, 21–23% кислорода, 6,5–7,3% водорода, 15–17% азота и до 0,5% серы. В составе некоторых белков присутствуют в небольших количествах фосфор, железо, марганец, магний, йод и др.
Таким образом, помимо углерода, кислорода и водорода, входящих в состав почти всех органических полимерных молекул, обязательным компонентом белков является азот, в связи с чем белки принято обозначать как азотсодержащие органические вещества. Содержание азота более или менее постоянно во всех белках (в среднем 16%), поэтому иногда определяют количество белка в биологических объектах по содержанию белкового азота.
Белковый состав организма здорового взрослого человека относительно постоянен, хотя возможны изменения количества отдельных белков в органах и тканях в зависимости от состава пищи и режима питания, от физиологической активности человека, биологических ритмов. В процессе развития многоклеточного организма, особенно на стадиях дифференцировки клеток, белковый состав значительно изменяется. Для каждого типа специализированных клеток характерно появление специфических белков, которые определяют особенности их биологических функций. Так, только в эритроцитах есть гемоглобин, осуществляющий транспорт кислорода, к тканям, а в клетках сетчатки глаза - белок родопсин, необходимый для улавливания фотонов света. Кроме того, специализированные клетки отличаются и количеством белков, присутствующих практически во всех или во многих клетках организма. При различных заболеваниях происходит изменение белкового состава тканей. Эти изменения называются протеинопатиями. Различают наследственные и приобретённые протеинопатии.
Наследственные протеинопатии развиваются в результате повреждений в генетическом аппарате данного индивидуума. Какой-либо белок не синтезируется вовсе или синтезируется, но его первичная структура изменена. В зависимости от роли дефектного белка в жизнедеятельности организма, от степени нарушения конформации и функции белков, от гомо- или гетерозиготности индивидуума по этому белку наследственные протеинопатии могут вызывать болезни, протекающие с различной степенью тяжести, вплоть до летального исхода ещё до рождения или в первые месяцы после рождения.
Любая болезнь сопровождается изменением белкового состава организма, т.е. развивается приобретённая протеинопатия. При этом первичная структура белков не нарушается, а обычно происходит количественное изменение белков, особенно в тех органах и тканях, в которых развивается патологический процесс. В некоторых случаях приобретённые протеинопатии развиваются в результате изменения условий, в которых функционируют белки. Иногда в результате болезни повышается уровень метаболитов в клетках и сыворотке крови, что приводит к модификации некоторых белков и нарушению их функции. Так, повышенные концентрации глюкозы в крови при сахарном диабете приводят к неферментативному присоединению её к белкам (гликозилированию белков). Кроме того, из клеток повреждённого органа в кровь могут выходить белки, которые в норме определяются там лишь в следовых количествах. При различных заболеваниях часто используют биохимические исследования белкового состава крови для уточнения клинического диагноза.
20.История открытия и изучения ферментов. Особенности ферментативного катализа. Специфичность действия ферментов. Зависимость скорости ферментативных реакций от температуры, рН, концентрации фермента и субстрата.
Термин фермент предложен в XVII веке химиком ван Гельмонтом при обсуждении механизмов пищеварения.
В кон. ХVIII — нач. XIX вв. уже было известно, что мясо переваривается желудочным соком, а крахмал превращается в сахар под действием слюны. Однако механизм этих явлений был неизвестен В XIX в. Луи Пастер, изучая превращение углеводов в этиловый спирт под действием дрожжей, пришел к выводу, что этот процесс (брожение) катализируется некой жизненной силой, находящейся в дрожжевых клетках. Более ста лет назад термины фермент и энзим отражали различные точки зрения в теоретическом споре Л. Пастера с одной стороны, и М. Бертло и Ю. Либиха — с другой, о природе спиртового брожения. Собственно ферментами (от лат. fermentum — закваска) называли «организованные ферменты» (то есть сами живые микроорганизмы), а термин энзим (от греч. ἐν- — в- и ζύμη — дрожжи, закваска) предложен в 1876 году В. Кюне для «неорганизованных ферментов», секретируемых клетками, например, в желудок (пепсин) или кишечник (трипсин, амилаза). Через два года после смерти Л. Пастера в 1897 году Э. Бухнер опубликовал работу «Спиртовое брожение без дрожжевых клеток», в которой экспериментально показал, что бесклеточный дрожжевой сок осуществляет спиртовое брожение так же, как и неразрушенные дрожжевые клетки. В 1907 году за эту работу он был удостоен Нобелевской премии. Впервые высокоочищенный кристаллический фермент (уреаза) был выделен в 1926 году Дж. Самнером. В течение последующих 10 лет было выделено еще несколько ферментов, и белковая природа ферментов была окончательно доказана.
Каталитическая активность РНК впервые была обнаружена в 1980-е годы у пре-рРНК Томасом Чеком, изучавшим сплайсинг РНК у инфузории Tetrahymena thermophila.Рибозимом оказался участок молекулы пре-рРНК Tetrahymena, кодируемый интроном внехромосомного гена рДНК; этот участок осуществлял аутосплайсинг, то есть сам вырезал себя при созревании рРНК.
Важнейшие особенности ферментативного катализа - эффективность, специфичность и чувствительность к регуляторным воздействиям. Ферменты увеличивают скорость превращения субстрата по сравнению с неферментативной реакцией в 109-1012 раз. Столь высокая эффективность обусловлена особенностями строения активного центра. Принято считать, что активный центр комплементарен переходному состоянию субстрата при превращении его в продукт. Благодаря этому стабилизируется переходное состояние и понижается активационный барьер. Большинство ферментов обладает высокой субстратной специфичностью, т. е. способностью катализировать превращение только одного или несколько близких по структуре веществ. Специфичность определяется топографией связывающего субстрат участка активного центра.
Активность ферментов регулируется в процессе их биосинтеза (в т.ч. благодаря образованию изоферментов, которы катализируют идентичные реакции, но отличаются строением и каталитическими свойствами), а также условиями среды (рН, температура, ионная сила раствора) и многочисленными ингибиторами и активаторами, присутствующими в организме. Ингибиторами и активаторами могут служить сами субстраты (в определенных концентрациях), продукты реакции, а также конечные продукты в цепи последовательных превращений вещества Ферментативные реакции чувствительны к внешним условиям, в частности к ионной силе раствора и рН среды. Влияние температуры на скорость ферментативной реакции описывается кривой с максимумом, восходящая ветвь которой отражает обычную для химической реакций зависимость, выраженную уравнением Аррениуса. Нисходящая ветвь связана с тепловой денатурацией фермента.
Биологическая функция фермента, как и любого белка, обусловлена наличием в его структуре активного центра. Лиганд, взаимодействующий с активным центром фермента, называют субстратом. В активном центре фермента есть аминокислотные остатки, функциональные группы которых обеспечивают связывание субстрата, и аминокислотные остатки, функциональные группы которых осуществляют химическое превращение субстрата. Условно эти группы обозначают как участок связывания субстрата и каталитический участок, однако следует помнить, что не всегда эти участки имеют чёткое пространственное разделение и иногда могут "перекрываться" . В участке связывания субстрат при помощи нековалентных связей взаимодействует (связывается) с ферментом, формируя фермент-субстратный комплекс. В каталитическом участке субстрат претерпевает химическое превращение в продукт, который затем высвобождается из активного центра фермента. Схематично процесс катализа можно представить следующим уравнением:
Е + S ↔ ES ↔ ЕР ↔ Е + Р,
где Е - фермент (энзим), S - субстрат, Р - продукт.
Специфичность - наиболее важное свойство ферментов, определяющее биологическую значимость этих молекул. Различают субстратную и каталитическую специфичности фермента, определяемые строением активного центра. Под субстратной специфичностью понимают способность каждого фермента взаимодействовать лишь с одним или несколькими определёнными субстратами. Различают:
абсолютную субстратную специфичность;
групповую субстратную специфичность;
стереоспецифичность.
Абсолютная субстратная специфичность. Активный центр ферментов, обладающих абсолютной субстратной специфичностью, комплементарен только одному субстрату. Следует отметить, что таких ферментов в живых организмах мало.
Групповая субстратная специфичность Большинство ферментов катализирует однотипные реакции с небольшим количеством (группой) структурно похожих субстратов.
Стереоспецифичность При наличии у субстрата нескольких стерео-изомеров фермент проявляет абсолютную специфичность к одному из них.
Каталитическая специфичность Фермент катализирует превращение присоединённого субстрата по одному из возможных путей его превращения, Это свойство обеспечивается строением каталитического участка активного центра фермента и называется каталитической специфичностью, или специфичностью пути превращения субстрата.
Скорость ферментативной реакции зависит от ряда факторов, таких как количество и активность ферментов, концентрация субстрата, температура среды, рН раствора, присутствие регуляторных молекул (активаторов и ингибиторов).
Зависимость
скорости ферментативной реакции от
количества ферментов.
При проведении ферментативной реакции
в условиях избытка субстрата скорость
реакции будет зависеть от концентрации
фермента. Графическая зависимость такой
реакции имеет вид прямой линии Однако
количество фермента часто невозможно
определить в абсолютных величинах,
поэтому на практике пользуются условными
величинами, характеризующими активность
фермента: одна
международная единица активности
(ME) соответствует такому количеству
фермента, которое катализирует превращение
1 мкмоль субстрата за 1 мин при оптимальных
условиях проведения ферментативной
реакции. Оптимальные условия индивидуальны
для каждого фермента и зависят от
температуры среды, рН раствора, при
отсутствии активаторов и ингибиторов.
![]() .
.
Количество единиц активности nME определяют по формуле:
![]()
В 1973 г. была принята новая единица активности ферментов: 1 катал (кат), соответствующий такому количеству катализатора, которое превращает 1 моль субстрата за 1 с.
Международная единица ферментативной активности ME связана с каталом следующими равенствами:
1 кат = 1 моль S/c = 60 моль S/мин = 60х106 мкмоль/мин = 6х107 ME,
1 ME = 1 мкмоль/мин = 1/60 мкмоль/с = 1/60 мккат = 16,67 нкат.
В медицинской и фармацевтической практике для оценки активности ферментов часто используют международные единицы активности - ME. Для оценки количества молекул фермента среди других белков данной ткани определяют удельную активность (уд. ак.) фермента, численно равную количеству единиц активности фермента (nМЕ) в образце ткани, делённому на массу (мг) белка в этой ткани.
По удельной активности судят об очистке фермента: чем меньше посторонних белков, тем выше удельная активность.
Зависимость скорости ферментативной реакции от температуры среды. Повышение температуры до определённых пределов оказывает влияние на скорость ферментативной реакции, подобно влиянию температуры на любую химическую реакцию. С повышением температуры ускоряется движение молекул, что приводит к повышению вероятности взаимодействия реагирующих веществ. Кроме того, температура может повышать энергию реагирующих молекул, что также приводит к ускорению реакции. Однако скорость химической реакции, катализируемая ферментами, имеет свой температурный оптимум, превышение которого сопровождается понижением ферментативной активности, возникающим из-за термической денатурации белковой молекулы .
Зависимость скорости ферментативной реакции от рН среды Активность ферментов зависит от рН раствора, в котором протекает ферментативная реакция. Для каждого фермента существует значение рН, при котором наблюдается его максимальная активность. Отклонение от оптимального значения рН приводит к понижению ферментативной активности. Влияние рН на активность ферментов связано с ионизацией функциональных групп аминокислотных остатков данного белка, обеспечивающих оптимальную конформацию активного центра фермента. При изменении рН от оптимальных значений происходит изменение ионизации функциональных групп молекулы белка. Например, при закислении среды происходит протонирование свободных аминогрупп (NH3+), а при защелачивании происходит отщепление протона от карбоксильных групп (СОО-). Это приводит к изменению конформации молекулы фермента и конформации активного центра; следовательно, нарушается присоединение субстрата, кофакторов и коферментов к активному центру. Кроме того, рН среды может влиять на степень ионизации или пространственную организацию субстрата, что также влияет на сродство субстрата к активному центру. При значительном отклонении от оптимального значения рН может происходить денатурация белковой молекулы с полной потерей ферментативной активности. Оптимум значения рН у разных ферментов различный. Ферменты, работающие в кислых условиях среды (например, пепсин в желудке или лизосомальные ферменты), эволюционно приобретают конформацию, обеспечивающую работу фермента при кислых значениях рН. Однако большая часть ферментов организма человека имеет оптимум рН, близкий к нейтральному, совпадающий с физиологическим значением рН.
Зависимость скорости ферментативной реакции от количества субстрата. Если концентрацию ферментов оставить постоянной, изменяя только количество субстрата, то график скорости ферментативной реакции описывают гиперболой. При увеличении количества субстрата начальная скорость возрастает. Когда фермент становится полностью насыщенным субстратом, т.е. происходит максимально возможное при данной концентрации фермента формирование фермент-субстратного комплекса, наблюдают наибольшую скорость образования продукта. Дальнейшее повышение концентрации субстрата не приводит к увеличению образования продукта, т.е. скорость реакции не возрастает. Данное состояние соответствует максимальной скорости реакции Vmax. Таким образом, концентрация фермента - лимитирующий фактор в образовании продукта. Ферментативный процесс можно выразить следующим уравнением:

где k1 - константа скорости образования фермент-субстратного комплекса; k-1 - константа скорости обратной реакции, распада фермент-субстратного комплекса; k2 - константа скорости образования продукта реакции.
21 .Классификация и номенклатура ферментов. Изоферменты. Единицы измерения активности и количества ферментов.
Каждый фермент имеет 2 названия. Первое - короткое, так называемое рабочее, удобное для повседневного использования. Второе (более полное) - систематическое, применяемое для однозначной идентификации фермента.
Рабочее название. В названии большинства ферментов содержится суффикс "аза", присоединённый к названию субстрата реакции, например уреаза, сахараза, липаза, нуклеаза или к названию химического превращения определённого субстрата, например лактатдегидрогеназа, аденилатциклаза, фосфо-глюкомутаза, пируваткарбоксилаза. Согласно российской классификации ферментов (КФ), названия ферментов пишутся слитно. Однако в употреблении сохранился ряд тривиальных, исторически закреплённых названий ферментов, которые не дают представления ни о субстрате, ни о типе химического превращения, например трипсин, пепсин, ренин, тромбин.
Классы ферментов. Международный союз биохимии и молекулярной биологии в 1961 г. разработал систематическую номенклатуру, согласно которой все ферменты разбиты на 6 основных классов в зависимости от типа катализируемой химической реакции. Каждый класс состоит из многочисленных подклассов и подподклассов с учётом преобразуемой химической группы субстрата, донора и акцептора преобразуемых группировок, наличия дополнительных молекул и т.д. Каждый из 6 классов имеет свой порядковый номер, строго закреплённый за ним.
Оксидоредуктазы. Катализируют различные окислительно-восстановительные реакции с участием 2 субстратов (перенос е- или атомов водорода с одного субстрата на другой).
Трансферазы. Катализируют перенос функциональных групп от одного соединения к другому. Подразделяют в зависимости от переносимой группы.
Гидролазы. Катализируют реакции гидролиза (расщепления ковалентной связи с присоединением молекулы воды по месту разрыва). Подразделяют в зависимости от расщепляемой связи.
Лиазы. К лиазам относят ферменты, отщепляющие от субстратов негидролитическим путём определённую группу (при этом могут отщепляться СО2, Н2О, NH2,SН2и др.) или присоединяющие чаще всего молекулу воды по двойной связи.
Изомеразы. Катализируют различные внутримолекулярные превращения. Подразделяют в зависимости от типа реакции изомеризации.
Лигазы (синтетазы). Катализируют реакции присоединения друг к другу двух молекул с образованием ковалент-ной связи. Этот процесс сопряжён с разрывом фосфоэфирной связи в молекуле АТФ (или других нуклеозидтрифосфатов) или с разрывом макроэргических связей других соединений. В первом случае (при использовании энергии гидролиза АТФ) такие ферменты называют лигазами, или синтетазами
Изоферменты, или изоэнзимы — это различные по аминокислотной последовательности изоформы или изотипы одного и того же фермента, существующие в одноморганизме, но, как правило, в разных его клетках, тканях или органах. Изоферменты, как правило, высоко гомологичны по аминокислотной последовательности и/или подобны по пространственной конфигурации. Особенно консервативны в сохранении строения активные центры молекул изоферментов. Все изоферменты одного и того же фермента выполняют одну и ту же каталитическую функцию, но могут значительно различаться по степени каталитической активности, по особенностям регуляции или другим свойствам.
Одна международная единица активности (ME) соответствует такому количеству фермента, которое катализирует превращение 1 мкмоль субстрата за 1 мин при оптимальных условиях проведения ферментативной реакции. Оптимальные условия индивидуальны для каждого фермента и зависят от температуры среды, рН раствора, при отсутствии активаторов и ингибиторов
.
![]() .
.
Количество единиц активности nME определяют по формуле:
![]()
В 1973 г. была принята новая единица активности ферментов: 1 катал (кат), соответствующий такому количеству катализатора, которое превращает 1 моль субстрата за 1 с.
Международная единица ферментативной активности ME связана с каталом следующими равенствами:
1 кат = 1 моль S/c = 60 моль S/мин = 60х106 мкмоль/мин = 6х107 ME,
1 ME = 1 мкмоль/мин = 1/60 мкмоль/с = 1/60 мккат = 16,67 нкат.
В медицинской и фармацевтической практике для оценки активности ферментов часто используют международные единицы активности - ME. Для оценки количества молекул фермента среди других белков данной ткани определяют удельную активность (уд. ак.) фермента, численно равную количеству единиц активности фермента (nМЕ) в образце ткани, делённому на массу (мг) белка в этой ткани.
22.Кофакторы ферментов: ионы металлов и коферменты. Коферментные функции витаминов (на примере витаминов В6, РР, В2).
Большинство ферментов для проявления ферментативной активности нуждается в низкомолекулярных органических соединениях небелковой природы (коферментах) и/или в ионах металлов (кофакторах).
Кофакторы выполняют функцию стабилизаторов молекулы субстрата, активного центра фермента и конформации белковой молекулы фермента, а именно третичной и четвертичной структур. В некоторых случаях ионы металла служат "мостиком" между ферментом и субстратом. Они выполняют функцию стабилизаторов активного центра, облегчая присоединение к нему субстрата и протекание химической реакции. В ряде случаев ион металла может способствовать присоединению кофермента. Перечисленные выше функции выполняют такие металлы, как Mg2+, Mn2+, Zn2+, Co2+, Мо2+. В отсутствие металла эти ферменты активностью не обладают. Такие ферменты получили название "металлоэнзимы". Схематично данный процесс взаимодействия фермента, субстрата и металла можно представить следующим образом:
E-Me-S
Кофермент, локализуясь в каталитическом участке активного центра, принимает непосредственное участие в химической реакции, выступая в качестве акцептора и донора химических группировок, атомов, электронов. Кофермент может быть связан с белковой частью молекулы ковалентными и нековалентными связями. В первом случае он называется простетической группой (например, FAD, FMN, биотин, липоевая кислота). Вместе с тем известны примеры, когда кофермент присоединяется к ферменту нековалентными связями настолько прочно, что не диссоциирует от белковой молекулы, например тиаминдифосфат. Во втором случае кофермент взаимодействует с ферментом только на время химической реакции и может рассматриваться в качестве второго субстрата. Примеры - NAD+, NADP+. Апофермент обеспечивает специфичность действия и отвечает за выбор типа химического превращения субстрата. Один и тот же кофермент, взаимодействуя с различными апоферментами, может участвовать в разных химических превращениях субстрата. Например, пиридоксальфосфат в зависимости от того, с каким апоферментом взаимодействует, участвует в реакциях трансаминирования или декарбоксилирования аминокислот.
Химическая природа коферментов, их функции в ферментативных реакциях чрезвычайно разнообразны. Традиционно к коферментам относят производные витаминов, хотя помимо них есть значительный класс небелковых соединений, принимающих участие в проявлении каталитической функции ферментов.
К коферментам относят следующие соединения:
производные витаминов;
гемы, входящие в состав цитохромов, каталазы, пероксидазы, гуанилатциклазы, NO-синтазы и являющиеся простетической группой ферментов;
нуклеотиды - доноры и акцепторы остатка фосфорной кислоты;
убихинон, или кофермент Q, участвующий в переносе электронов и протонов в ЦПЭ;
фосфоаденозилфосфосульфат, участвующий в переносе сульфата;
S-аденозилметионин (SAM) - донор метильной группы;
глутатион, участвующий в окислительно-восстановительных реакциях.
Витамин РР входит в состав кофермента НАД+ и НАДФ+, который принимает участие в ферментативных реакциях по последовательному механизму. Две ферментативные реакции, катализируемые ферментами Е1 и Е2, сопряжены друг с другом посредством кофермента NAD+, служащего в каждом из этих случаев субстратом. Для первого фермента субстратом служит окисленная форма NAD, в качестве второго субстрата выступает донор водорода - пример последовательных реакций, продуктом - восстановленная форма NAD, для фермента Е2 - наоборот.

Витамин В5 – принимает участие в синтезе кофермента А (Ацетил-КоА). Кофермент А (КоА) — кофермент ацетилирования; один из важнейших коферментов; принимает участие в реакциях переноса ацильных групп. Молекула КоА состоит из остатка адениловой кислоты, связанной пирофосфатной группой с остаткомпантотеновой кислоты, соединённой пептидной связью с остатком β-меркаптоэтаноламина.
С КоА связан ряд биохимических реакций, лежащих в основе окисления и синтеза жирных кислот, биосинтеза жиров, окислительных превращений продуктов распада углеводов. Во всех случаях КоА действует в качестве промежуточного звена, связывающего и переносящего кислотные остатки на другие вещества. При этом кислотные остатки в составе соединения с КоА подвергаются тем или иным превращениям, либо передаются без изменений на определённые метаболиты.
Витамин В2 – принимает участие в формировании кофактора ФАД и ФМН. Флавинадениндинуклеотид — кофактор, принимающий участие во многих окислительно-восстановительных биохимических процессах. FAD существует в двух формах — окисленной и восстановленной, его биохимическая функция, как правило, заключается в переходе между этими формами. FAD может быть восстановлен до FADH2, при этом он принимает два атома водорода. Молекула FADH2 является переносчиком энергии и восстановленныйкоферментможет быть использован каксубстратв реакцииокислительного фосфорилированиявмитохондрии. Молекула FADH2 окисляется в FAD, при этом выделяется энергия, эквивалентная (запасаемая в форме) двум молям ATФ.
23.Ингибиторы ферментов. Обратимое и необратимое ингибирование. Конкурентное ингибирование. Лекарственные препараты как ингибиторы ферментов.
К ингибиторам следует относить вещества, вызывающие снижение активности фермента. Следует отметить, что все денатурирующие агенты также вызывают уменьшение скорости любой ферментативной реакции, вследствие неспецифической денатурации белковой молекулы, поэтому денатурирующие агенты к ингибиторам не относят. В основе действия многих лекарственных препаратов и ядов лежит ингибирование активности ферментов, поэтому знание механизмов этого процесса крайне важно для молекулярной фармакологии и токсикологии. Ингибиторы способны взаимодействовать с ферментами с разной степенью прочности. На основании этого различают обратимое и необратимое ингибирование. По механизму действия ингибиторы подразделяют на конкурентные и неконкурентные.
Обратимое ингибирование Обратимые ингибиторы связываются с ферментом слабыми нековалентными связями и при определённых условиях легко отделяются от фермента. Обратимые ингибиторы бывают конкурентными и неконкурентными.
Конкурентное ингибирование К конкурентному ингибированию относят обратимое снижение скорости ферментативной реакции, вызванное ингибитором, связывающимся с активным центром фермента и препятствующим образованию фермент-субстратного комплекса. Такой тип ингибирования наблюдают, когда ингибитор - структурный аналог субстрата, в результате возникает конкуренция молекул субстрата и ингибитора за место в активном центре фермента. В этом случае с ферментом взаимодействует либо субстрат, либо ингибитор, образуя комплексы фермент-субстрат (ES) или фермент-ингибитор (EI). При формировании комплекса фермента и ингибитора (EI) продукт реакции не образуется. Для конкурентного типа ингибирования справедливы следующие уравнения:
Е + S ⇔ ES → E + P,
E + I ⇔ EI.
Лекарственные препараты как конкурентные ингибиторы Многие лекарственные препараты оказывают своё терапевтическое действие по механизму конкурентного ингибирования. Например, четвертичные аммониевые основания ингибируют ацетилхолинэстеразу, катализирующую реакцию гидролиза ацетилхолина на холин и уксусную кислоту. При добавлении ингибиторов активность ацетилхолинэстеразы уменьшается, концентрация ацетилхолина (субстрата) увеличивается, что сопровождается усилением проведения нервного импульса. Ингибиторы холинэстеразы используют при лечении мышечных дистрофий. Эффективные антихолинэстеразные препараты - прозерин, эндрофоний и др.
Неконкурентное ингибирование Неконкурентным называют такое ингибирование ферментативной реакции, при котором ингибитор взаимодействует с ферментом в участке, отличном от активного центра. Неконкурентные ингибиторы не являются структурными аналогами субстрата. Неконкурентный ингибитор может связываться либо с ферментом, либо с фермент-субстратным комплексом, образуя неактивный комплекс. Присоединение неконкурентного ингибитора вызывает изменение конформации молекулы фермента таким образом, что нарушается взаимодействие субстрата с активным центром фермента, что приводит к снижению скорости ферментативной реакции.
Необратимое ингибирование Необратимое ингибирование наблюдают в случае образования ковалентных стабильных связей между молекулой ингибитора и фермента. Чаще всего модификации подвергается активный центр фермента, В результате фермент не может выполнять каталитическую функцию. К необратимым ингибиторам относят ионы тяжёлых металлов, например ртути (Hg2+), серебра (Ag+) и мышьяка (As3+), которые в малых концентрациях блокируют сульфгидрильные группы активного центра. Субстрат при этом не может подвергаться химическому превращению. При наличии реактиваторов ферментативная функция восстанавливается. В больших концентрациях ионы тяжёлых металлов вызывают денатурацию белковой молекулы фермента, т.е. приводят к полной инактивации фермента.
Необратимые ингибиторы ферментов как лекарственные препараты. Пример лекарственного препарата, действие которого основано на необратимом ингибировании ферментов, - широко используемый препарат аспирин. Противовоспалительный нестероидный препарат аспирин обеспечивает фармакологическое действие за счёт ингибирования фермента циклооксигеназы, катализирующего реакцию образования простагландинов из арахидоновой кислоты. В результате химической реакции ацетильный остаток аспирина присоединяется к свободной концевой NH2-группе одной из субъединиц циклооксигеназы. Это вызывает снижение образования продуктов реакции простагландинов, которые обладают широким спектром биологических функций, в том числе являются медиаторами воспаления.
24.Регуляция действия ферментов: аллостерические ингибиторы и активаторы. Каталитический и регуляторный центры. Четвертичная структура аллостерических ферментов и кооперативные изменения конформации протомеров фермента.
Аллостерическая регуляция. Во многих строго биосинтетических реакциях основным типом регуляции скорости многоступенчатого ферментативного процесса является ингибирование по принципу обратной связи. Это означает, что конечный продукт биосинтетической цепи подавляет активность фермента, катализирующего первую стадию синтеза, которая является ключевой для данной цепи реакции. Поскольку конечный продукт структурно отличается от субстрата, он связывается с аллостери-ческим (некаталитическим) центром молекулы фермента, вызывая ингиби-рование всей цепи синтетической реакции.
Предположим, что в клетках осуществляется многоступенчатый биосинтетический процесс, каждая стадия которого катализируется собственным ферментом:

Скорость подобной суммарной последовательности реакций в значительной степени определяется концентрацией конечного продукта Р, накопление которого выше допустимого уровня оказывает мощное инги-бирующее действие на первую стадию процесса и соответственно на фермент E1.
Следует, однако, иметь в виду, что модуляторами аллостерических ферментов могут быть как активаторы, так и ингибиторы. Часто оказывается, что сам субстрат оказывает активирующий эффект. Ферменты, для которых и субстрат, и модулятор представлены идентичными структурами, носят название гомотропных в отличие от гетеротропных ферментов, для которых модулятор имеет отличную от субстрата структуру. Взаимопревращение активного и неактивного аллостерических ферментов в упрощенной форме, а также конфор-мационные изменения, наблюдаемые при присоединении субстрата и эффекторов. Присоединение отрицательного эффектора к аллостерическому центру вызывает значительные изменения конфигурации активного центра молекулы фермента, в результате чего фермент теряет сродство к своему субстрату (образование неактивного комплекса).
Аллостерические взаимодействия проявляются в характере кривых зависимости начальной скорости реакции от концентрации субстрата или эффектора, в частности в S-образности этих кривых (отклонение от гиперболической кривой Михаэлиса-Ментен). S-образный характер зависимости v от [ S ] в присутствии модулятора обусловлен эффектом кооперативности. Это означает, что связывание одной молекулы субстрата облегчает связывание второй молекулы в активном центре, способствуя тем самым увеличению скорости реакции. Кроме того, для аллостерических регуляторных ферментов характерна нелинейная зависимость скорости реакции от концентрации субстрата.
25.Регуляция активности ферментов путем фосфорилирования и дефосфорилирования. Участие ферментов в проведении гормонального сигнала.
Химическая модификация фермента. Некоторые белки при формировании третичной структуры подвергаются постсинтетической химической модификации. Оказалось, что активность ряда ключевых ферментов обмена углеводов, в частности фосфорилазы, гликогенсинтазы и др., также контролируется путем фосфорилирования и дефосфорили-рования, осуществляемого специфическими ферментами – протеинкиназой и протеинфосфатазой, активность которых в свою очередь регулируется гормонами. Уровень активности ключевых ферментов обмена углеводов и соответственно интенсивность и направленность самих процессов обмена определяются соотношением фосфорилированных и дефосфорилированных форм этих ферментов. Обычно различают обратимую ковалентную и нековалентную химические модификации ферментов, осуществляемые через ОН-группысерина, реже – тирозина или за счет нековалентных взаимодействий с молекулой фермента. В первом случае активным ферментомоказывается или фосфорилированная, или дефосфорилированная форма, как в случае с молекулами мышечной фосфорилазы и гликогенсинтазы соответственно). В качестве примеров можно в виде схемы представить оба типа модификации, в которой символом Р обозначается остаток фосфата, Pi– неорганический фосфат (Н3РО4), РРi – неорганический пирофосфат (Н4Р2О7),АМФ – остаток адениловой кислоты. Химическая постсинтетическая модификация ферментов включает, кроме того, процессы ограниченного протеолиза ,метилирования, гликозилирования, уридилирования, аденилирования, АДФ-рибозилирования и др., обеспечивая тем самым микроскопический тип регуляции активности ферментов и соответственно физиологическую скорость процессов обмена веществ.
Общим фундаментальным механизмом, посредством которого реализуются биологические эффекты «вторичных» мессенджеров внутри клетки, является процесс фосфорилирования – дефосфорилирования белков при участии широкого разнообразия протеинкиназ, катализирующих транспорт концевой группы от АТФ на ОН-группы серина и треонина, а в ряде случаев – тирозина белков-мишеней. Процесс фосфорилирования представляет собой важнейшую посттрансляционную химическую модификацию белковых молекул, коренным образом изменяющую как их структуру, так и функции. В частности, он вызывает изменение структурных свойств (ассоциацию или диссоциацию составляющих субъединиц), активирование или ингибирование их каталитических свойств, в конечном итоге определяя скорость химических реакций и в целом функциональную активность клеток.
26.Различия ферментного состава органов и тканей. Органоспецифические ферменты. Изменение ферментов в процессе развития.
Сравнение множества клеток самых разных типов показывает, что набор содержащихся в них ферментов во многом сходен. По-видимому, во всех живых организмах протекают в основном одни и те же метаболические процессы; некоторые различия, касающиеся конечных продуктов обмена, отражают скорее наличие или отсутствие того или иного фермента, нежели изменение общего характера метаболизма. Сложные системы углеводного обмена, состоящие из ферментов, коферментов и переносчиков, образуют главный поставляющий энергию механизм у животных, растений, плесневых грибов, дрожжей и у большинства других микроорганизмов. Однако в характере метаболизма, химическом составе и строении различных тканей и различных организмов имеются и бесспорные различия. Что касается метаболизма, то особенности его в соответствующих органах или тканях, несомненно, определяются набором ферментов. Различия в химическом составе органов и тканей тоже зависят от их ферментного состава, в первую очередь от тех ферментов, которые участвуют в процессах биосинтеза. Не исключено, что и более очевидные различия, касающиеся строения и формы тех или иных органов и тканей, также имеют энзимологическую природу: Известно, что строение и форма находятся под контролем генов; контроль осуществляется путем образования специфических белков, из которых главными для организации тканей являются ферменты я транспортные системы. Продуктами генов могут быть также белки, не обладающие каталитическими свойствами, но играющие важную роль в «встраивании» ферментных белков в соответствующие структурные ансамбли, например мембраны; однако такие молекулы можно рассматривать как компоненты катализаторов, поскольку они находятся в теснейшей взаимосвязи с ними.
27.Изменение активности ферментов при болезнях. Наследственные энзимопатии. Происхождение ферментов крови и значение их определения при болезнях.
В основе многих заболеваний лежат нарушения функционирования ферментов в клетке - энзимопатии. Различают первичные (наследственные) и вторичные (приобретённые) энзимопатии. Приобретённые энзимопатии, как и вообще протеинопатии, по-видимому, наблюдают при всех болезнях.
При первичных энзимопатиях дефектные ферменты наследуются, в основном, по аутосомнорецессивному типу. Гетерозиготы, чаще всего, не имеют фенотипических отклонений. Первичные энзимопатии обычно относят к метаболическим болезням, так как происходит нарушение определённых метаболических путей. При этом развитие заболевания может протекать
по одному из ниже перечисленных "сценариев". Рассмотрим условную схему метаболического пути:
![]()
Вещество А в результате последовательных ферментативных реакций превращается в продукт Р. При наследственной недостаточности какого-либо фермента, например фермента Е3, возможны разные нарушения метаболических путей:
Нарушение образования конечных продуктов. Недостаток конечного продукта этого метаболического пути (Р) (при отсутствии альтернативных путей синтеза) может приводить к развитию клинических симптомов, характерных для данного заболевания:
![]()
Клинические проявления. В качестве примера можно рассмотреть альбинизм. При альбинизме нарушен синтез в меланоцитах пигментов - меланинов. Меланин находится в коже, волосах, радужке, пигментном эпителии сетчатки глаза и влияет на их окраску. При альбинизме наблюдают слабую пигментацию кожи, светлые волосы, красноватый цвет радужки глаза из-за просвечивающих капилляров. Проявление альбинизма связано с недостаточностью фермента тирозингидроксилазы (тирозиназы) - одного из ферментов, катализирующего метаболический путь образования меланинов
Накопление субстратов-предшественников. При недостаточности фермента Е3 будут накапливаться вещество С, а также во многих случаях и предшествующие соединения. Увеличение субстратов-предшественников дефектного фермента - ведущее звено развития многих заболеваний:

Клинические проявления. Известно заболевание алкапгонурия, при котором нарушено окисление гомогентизиновой кислоты в тканях (гомогентизиновая кислота - промежуточный метаболит катаболизма тирозина). У таких больных наблюдают недостаточность фермента окисления гомогентизиновой кислоты - диоксигеназы гомогентизиновой кислоты, приводящей к развитию заболевания. В результате увеличиваются концентрация гомогентизиновой кислоты и выведение её с мочой. В присутствии кислорода гомогентизиновая кислота превращается в соединение чёрного цвета - алкаптон. Поэтому моча таких больных на воздухе окрашивается в чёрный цвет. Алкаптон также образуется и в биологических жидкостях, оседая в тканях, коже, сухожилиях, суставах. При значительных отложениях алкаптона в суставах нарушается их подвижность.
Нарушение образования конечных продуктов и накопление субстратов предшественников. Отмечают заболевания, когда одновременно недостаток продукта и накопление исходного субстрата вызывают клинические проявления.

Клинические проявления. Например, у людей с болезнью Гирке (гликогеноз I типа) наблюдают снижение концентрации глюкозы в крови (гипогликемия) в перерывах между приёмами пищи. Это связано с нарушением распада гликогена в печени и выходом из неё глюкозы вследствие дефекта фермента глюкозо-6-фосфатфосфатазы. Одновременно у таких людей увеличиваются размеры печени (гепатомегалия) вследствие накопления в ней не используемого гликогена.
Особый интерес для клиники представляет исследование активности индикаторных ферментов в сыворотке крови, так как по появлению в плазме или сыворотке крови ряда тканевых ферментов в повышенных количествах можно судить о функциональном состоянии и поражении различных органов (например, печени, сердечной и скелетной мускулатуры). При остром инфаркте миокарда особенно важно исследовать активность креатинкиназы, АсАТ, ЛДГ и оксибутиратдегидрогеназы. При заболеваниях печени, в частности при вирусном гепатите (болезнь Боткина), в сыворотке кровизначительно увеличиваетсяактивностьАлАТ и АсАТ, сорбитолдегидрогеназы,глутаматдегидрогеназыи некоторых другихферментов. озрастаниеактивности ферментовсыворотки кровипри многих патологических процессах объясняется прежде всего двумя причинами: 1) выходом в кровяное руслоферментовиз поврежденных участков органов илитканейна фоне продолжающегося ихбиосинтезав поврежденныхтканях; 2) одновременным повышением каталитическойактивностинекоторыхферментов, переходящих вкровь. Возможно, что повышениеактивности ферментовпри «поломке» механизмов внутриклеточной регуляцииобмена веществсвязано с прекращением действия соответствующих регуляторов иингибиторов ферментов, изменением под влиянием различных факторов строения и структурымакромолекулферментов.
28.Применение ферментов для лечения болезней. Применение ферментов как аналитических реагентов при лабораторной диагностике (определении глюкозы, этанола, мочевой кислоты и т.д.). Иммобилизованные ферменты
Второе направление медицинской энзимологии – энзимодиагностика – развивается по двум путям. Один путь – использование ферментов в качестве избирательных реагентов для открытия и количественного определения нормальных или аномальных химических веществ в сыворотке крови, моче, желудочном соке и др. (например, выявление при помощи ферментов глюкозы, белка или других веществ в моче, в норме не обнаруживаемых). Другой путь – открытие и количественное определение самих ферментов в биологических жидкостях при патологии. Оказалось, что ряд ферментов появляется в сыворотке крови при распаде клеток (отсюда их название «некротические ферменты»). Для диагностики органических и функциональных поражений органов и тканей широко применяются отдельные ферментные тесты, выгодно отличающиеся от других химических диагностических тестов, используемых в клинике, высокой чувствительностью и специфичностью. Известно около 20 тестов, основанных на количественном определении активности ферментов(и изоферментов), главным образом в крови (реже в моче), а также в биоптатах (кусочки тканей, полученные при биопсии). Следует отметить, что из огромного числа ферментов (более 3500), открытых в природе (частично и в организме человека), в диагностической энзимологии используется лишь ограниченный набор ферментов и для весьма небольшого числа болезней (гепатиты, инфаркт миокарда, органические поражения почек, поджелудочной железы, печени и др.). Так, уровень липазы, амилазы, трипсина и химотрипсина в крови резко увеличен при сахарном диабете, злокачественных поражениях поджелудочной железы, болезнях печени и др. Резко повышается в сыворотке крови уровень двух аминотрансфераз, креатинкиназы (и ее изоформ) и лактатдегидрогеназы (и ее изоформ) при инфаркте миокарда; умеренно повышено их содержание при поражениях тканей мозга и печени. Определяют, кроме того,активность кислой фосфатазы (уровень повышен при карциноме предстательной железы), щелочной фосфатазы, холинэсте-разы и некоторых других органоспецифических ферментов (например, гистидазы, уроканиназы, глицинамидинотрансферазы) в сыворотке крови при патологии костной ткани, печени, метастатических карциномах и т. д. Доказано, что органы и ткани человека характеризуются специфическим ферментным и изоферментным спектром, подверженным не только индивидуальным, но и суточным колебаниям. Существует большой градиент концентрации ферментов между внутриклеточными и внеклеточными частями тела. Поэтому любые, даже незначительные, повреждения клеток (иногда функциональные расстройства) приводят к выделению ферментов во внеклеточное пространство, откуда они поступают в кровь. Механизм гиперферментации (повышенное содержание ферментов в крови) до конца не расшифрован. Повышение уровня внутриклеточных ферментов в плазме крови прямо зависит от природы повреждающего воздействия, времени действия и степени повреждения биомембран клеток и субклеточных структур органов. В оценке ферментных тестов для диагностических целей особое значение имеет знание периода полужизни (полураспада) в плазме крови каждого из диагностических ферментов, что делает важным выбор точного времени для ферментного анализа крови. Весьма существенным является также знание особенностей распределения (топографии) ферментов в индивидуальных органах и тканях, а также их внутриклеточной локализации.
В последнее время стали применять ферменты рестрикции – специфические эндонуклеазы катализирующие разрывы межнуклео-тидных связей ДНК, для диагностики фенилкетонурии, α- и β-талассемии и других наследственных болезней человека. Метод основан на полиморфизме рестрикционных фрагментов ДНК.
Из представленных данных следует, что диагностическая энзимология может служить основой не только для постановки правильного и своевременного диагноза болезни, но и для проверки эффективности применяемого метода лечения.
Дальнейшее развитие диагностической энзимологии преимущественно идет по двум перспективным направлениям медицинской энзимологии: по пути упрощения и рациональной модификации уже испытанных методов и по пути поиска новых органоспецифических (тканеспецифических) ферментов и изоферментов.
Третье направление медицинской энзимологии – энзимотерапия, т.е. использование ферментов и модуляторов (активаторов иингибиторов) действия ферментов в качестве лекарственных средств, имеет пока небольшую историю. До сих пор работы в этом направлении почти не выходят за рамки эксперимента. Исключение составляют некоторые про-теиназы: пепсин, трипсин, химотрипсини их смеси (абомин, химопсин), которые применяют для лечения ряда болезней пищеварительного тракта. Помимо протеиназ, ряд других ферментов, в частности РНКаза, ДНКаза, гиалуронидаза, коллагеназы, эластазы, отдельно или в смеси с протеина-зами используются при ожогах, для обработки ран, воспалительных очагов, устранения отеков, гематом, келоидных рубцов, кавернозных процессов при туберкулезе легких и др. Ферменты применяются также для лечения сердечно-сосудистых заболеваний, растворениясгустков крови. В нашей стране разработан первый в мире препарат иммобилизованной стрептокина-зы, рекомендованный для лечения инфаркта миокарда. Калликреины – ферменты кининовой системы используются для снижения кровяного давления.
Важной и многообещающей областью энзимотерапии является применение ингибиторов ферментов. Так, естественные ингибиторы протеиназ (α1-трипсин, α1-химотрипсин, α-макроглобулин) нашли применение в терапии острых панкреатитов, артритов, аллергических заболеваний, при которых отмечается активация протеолиза и фибринолиза, сопровождающаяся образованием вазоактивных кининов.
В последнее время получило признание применение в онкологической клинике ферментов бактериальной природы в качествелекарственных средств. Широко используется L-аспарагиназа (выпускается в промышленных количествах и L-глутамин(аспарагин)аза для лечения острых и хронических форм лейкозов и лимфогранулематозов. Более десятка описанных в литературе бактериальных ферментов испытаны в основном на животных с перевивными опухолями или на раковых клетках опухолей человека и животных, выращенных в культуре ткани. Основными постулатами применения ферментов в онкологии являются различия в метаболизме клетокопухолей по сравнению с обменом в нормальной, здоровой, клетке. В частности, современные стратегия и тактика энзимотерапии опухолевых поражений учитывают разную чувствительность нормальных и опухолевых клеток к недостатку (дефициту) незаменимых (так называемых эссенциальных) факторов роста. К таким ростстимулирующим факторам относятся не только пищевые факторы (витамины, незаменимые аминокислоты, макро- и микроэлементы), но и ряд так называемых заменимых веществ, включая заменимые аминокислоты, к недостатку которых опухолевая клетка оказывается в силу особенностей ее обмена более чувствительной, чем нормальная. Лечебный эффект, например, L-аспарагиназы и L-глутамин (аспа-рагин)азы при лейкозах, вероятнее всего, объясняется необратимым распадом как глутамина, так и аспарагина. Оказалось, что опухолевые клетки для своего роста и размножения нуждаются в аминокислотах из организма, поскольку сами лишены способности синтезировать амиды аминокислот, в то время как нормальные клетки наделены этой способностью. Был сделан вывод о том, что амидный азот глутамина и аспарагина выполняет в клетках ряд уникальных функций, которые лучше выяснены для глута-мина. В частности, амидный азот глутамина оказался абсолютно необходимым и не заменимым другими аминокислотами источником атома азота минимум в 10 реакциях синтеза, например, пуриновых и пиримидиновых нуклеотидов, соответственно ДНК и РНК, АТФ, ге-ксозаминов, гистидина и др. Таким образом, не лишена основания гипотеза, что любой фермент или агент, катализирующий необратимое расщепление незаменимого для опухолевойклетки пищевого фактора (включая аминокислоты), может в принципе быть применен в энзимотерапии опухолей, если будут устранены ограничения, связанные с белковой природой фермента. В оценке эффективности ферментов в экспериментальной и клинической онкологии имеется немало противоречий и очень много пробелов. Положительные результаты, отмеченные в ряде случаев, вселяют надежду, что приготовление стандартных ферментных препаратов (включая создание иммобилизованных форм) в промышленных масштабах и их разумное применение в клинике, организованное на строгой научной основе, несомненно дадут в руки врачей еще одно ценное оружие в борьбе с опухолевыми заболеваниями человека.
Идея применения ферментов в качестве лекарственных средств (фармакологии ферментов) всегда казалась заманчивой. Однако их нестабильность, короткий период полураспада, нежелательные антигенные свойства, связанные с белковой природой ферментов и опасностью развития аллергических реакций, трудности доставки к пораженным органам и тканям (мишеням) существенно ограничивали возможности использования ферментных препаратов. В разработке методов иммобилизации ферментов наметились конкретные пути преодоления указанных трудностей: применение водорастворимых, биосовместимых носителей, например полимолочной кислоты (легко разлагается в организме), использование методов химической модификации имикрокапсулирования, приготовление моно- и поликлональных антител и ферментсодержащих липосом и т.д.
В последнее время интенсивно разрабатываются методы направленного транспорта ферментов, заключенных в своеобразные микроконтейнеры (тени эритроцитов, липосомы и др.), к внешней поверхности которых могут быть прикреплены адресные (векторные) белковые молекулы (например, иммуноглобулины – антитела против специфических компонентов органа или ткани-мишени, в частности опухоли). Иммобилизованные ферменты в качестве лекарственных средств начали применять в специальных колонках для экстракорпоральной перфузии крови (типа искусственной почки). Такое лечение полностью исключает нежелательные воздействия наорганизм чужеродного белка и может проводиться длительное время.
29.Обмен веществ: питание, метаболизм и выделение продуктов метаболизма. Органические и минеральные компоненты пищи. Основные и минорные компоненты.
Условно процесс обмена веществ можно разделить на три этапа:
Первый этап — ферментативное расщепление белков, жиров и углеводов до растворимых в воде аминокислот, моно- и дисахаридов, глицерина, жирных кислот и других соединений, происходящее в различных отделах желудочно-кишечного тракта, и всасывание их в кровь и лимфу.
Второй этап — транспорт питательных веществ кровью к тканям и клеточный метаболизм, результатом которого является их ферментативное расщепление до конечных продуктов. Часть этих продуктов используется для построения составных частей мембран, цитоплазмы, для синтеза биологически активных веществ и воспроизведения клеток итканей. Расщепление веществ сопровождается выделением энергии, которая используется для процесса синтеза и обеспечения работы каждого органа и организма в целом.
Третий этап — выведение конечных продуктов метаболизма в составе мочи, кала, пота, через легкие в виде CO2 и т. д
Для обеспечения всех этапов метаболизма организму необходимо питаться.
Современные исследования подтверждают жизненную важность минеральных элементов. Выявлены новые стороны их биологического действия, что позволило выделить большую группу биологически активных веществ - биомикроэлементов. Изучение минеральных веществ как необходимой составной части питания тесно связано c предупреждением распространения и ликвидацией ряда эндемических заболеваний: эндемического зоба, флюороза, кариеса, стронциевого рахита и др. Значительный вклад в развитие учения o биологическом значении минеральных элементов внесли исследования акад, B. И. Вернадского, который является основоположником учения о связи и сочетанности эволюционных процессов в химическом составе, происходящих в земной коре и организмах. B изучении роли минеральных элементов в возникновении некоторых эндемических заболеваний видное место занимают исследования акад. A. П. Виноградова, который создал учение о "биогеохимических провинциях", т. e. территориях c повышенным или недостаточным содержанием микроэлементов. Физиологическое значение минеральных элементов в основном определяется их участием в:
структуре и функции большинства ферментных систем и процессов, протекающих в организме;
пластических процессах и построении тканей организма, особенно костной ткани, где фосфор и кальций являются основными структурными компонентами;
поддержании кислотно-щелочного состояния в организме;
поддержании нормального солевого состава крови и участия в структуре форменных ее элементов;
нормализации водно-соленого обмена. Физиологическое влияние минеральных элементов значительно шире их биологического их действия.
Оно распространяется на все системы организма и процессы, протекающие в них. Особая роль принадлежит минеральным веществам в поддержании в организме кислотно-щелочного состояния. Последнее необходимо для обеспечения постоянства внутренней среды организма. Обмен веществ и все биохимические процессы в организме протекают в условиях постоянства внутренней среды. Последнее обеспечивается различными регуляторными и буферными системами, a также многими другими факторами, среди которых наиболее важным является кислотно-щелочное состояние. Оно поддерживается работой сложной системы регуляторов, объединенных в единое целое центральной нервной системой. Кислотно-щелочное состояние обеспечивает создание необходимой концентрации водородных ионов в клетках и тканях, межтканевых и межклеточных жидкостях и сообщает им осмотические свойства, необходимые для нормального течения процессов обмена
Незаменимые элементы пищи различны для разных видов живых организмов. Например, большинство видов млекопитающих синтезируют свою собственную аскорбиновую кислоту . Следовательно, она не считается незаменимой для этих животных . Но она является незаменимым элементом в пище людей , которые нуждаются во внешних источниках аскорбиновой кислоты (известной как витамин C в контексте питания). Потребности организма человека колеблются широко. Так, человек массой 70 кг содержит 1,0 кг кальция , но только 3 мг кобальта. Многие незаменимые элементы пищи при приёме в чрезмерных количествах токсичны, что приводит к возникновению патологическогосостояния (напр., гипервитаминоза). Другие же можно потреблять без видимого вреда в количествах, больших, чем в типичном суточном рационе. Дважды Нобелевскийлауреат Лайнус Полинг о витамине B3 (известном также как ниацин и ниацинамид) как-то сказал: «Меня ошеломила его очень низкая токсичность при том, что он оказывает такое значительное физиологическое влияние. Ежедневный приём крошечной малости, 5 мг, достаточен для того, чтобы сохранить жизнь умирающему от пеллагры , но у него нет токсичности в количествах в десятки тысяч раз больших, которые [иногда] можно принять без вреда» [4] К незаменимым элементам пищи человека относят следующие четыре категории:
Незаменимые жирные кислоты
α-линоленовая кислота (омега-3 жирная кислота с кратчайшей цепочкой),
линолевая кислота (омега-6 жирная кислота с кратчайшей цепочкой).
Незаменимые аминокислоты для взрослых людей
изолейцин,
лизин,
лейцин,
метионин,
фенилаланин,
треонин,
триптофан,
валин.
Витамины
биотин (витамин B7, витамин H),
холин (витамин Bp),
фолат (фолиевая кислота, витамин B9, витамин M),
ниацин (витамин B3, витамин P, витамин PP),
пантотеновая кислота (витамин B5),
рибофлавин (витамин B2, витамин G),
тиамин (витамин B1),
витамин A (ретинол),
витамин B6 (пиридоксин, пиридоксамин или пиридоксаль),
витамин B12 (кобаламин),
витамин C (аскорбиновая кислота),
витамин D (эргокальциферол или холекальциферол),
витамин E (токоферол),
витамин K (нафтохиноны).
30.Основные пищевые вещества: углеводы, жиры, белки, суточная потребность, переваривание; частичная взаимозаменяемость при питании.
Животные, в основном, получают аминокислоты из белков, содержащихся в пище. Белки разрушаются в процессе пищеварения, который обычно начинается с денатурации белка путём помещения его в кислотную среду и гидролиза с помощью ферментов, называемых протеазами. Некоторые аминокислоты, полученные в результате пищеварения, используются для синтеза белков организма, а остальные превращаются в глюкозу в процессе глюконеогенеза или используются в цикле Кребса. Использование белка в качестве источника энергии особенно важно в условиях голодания, когда собственные белки организма, в особенности мускулов, служат источником энергии. Аминокислоты также являются важным источником азота в питании организма. В среднем человеку необходимо порядка 1-2 г белка на 1кг собственного веса в сутки для нормального функционирования организма. В зависимости от интенсивности жизнедеятельности потребность может колебаться как в одну, так и в другую стороны.
Углево́ды (сахариды) — общее название обширного класса природных органических соединений. Название происходит от слов «уголь» и «вода». Причиной этого является то, что первые из известных науке углеводов описывались брутто-формулой Cx(H2O)y, формально являясь соединениями углерода и воды. Углеводы выполняют структурную функцию, то есть участвуют в построении различных клеточных структур, выполняютпластическую функцию— хранятся в виде запаса питательных веществ, а также входят в состав сложных молекул. Углеводы являются основнымэнергетическимматериалом. При окислении 1граммауглеводов выделяются 4,1 ккал энергии и 0,4 гводы. Углеводы участвуют в обеспечении осмотического давления и осморегуляции. Так, вкровисодержится 100—110 мг/% глюкозы. От концентрацииглюкозызависитосмотическое давлениекрови. Углеводы выполняют рецепторную функцию — многие олигосахариды входят в состав воспринимающей частиклеточных рецепторовили молекул-лигандов. Суточная потребность в углеводах составляет 400-450 г.
Многие жиры, в первую очередь триглицериды, используются организмом как источник энергии. При полном окислении 1 г жира выделяется около 9 ккал энергии, примерно вдвое больше, чем при окислении 1 г белков или углеводов. Поэтому жировые отложения используются в качестве запасных источников питательных веществ прежде всего животными, которые вынуждены носить свои запасы на себе. Растения чаще запасают углеводы. однако в семенах многих растений высоко содержание жиров (растительные масла добывают из семян подсолнечника. кукурузы, рапса, льна и других масличных растений). Суточная потребность взрослого человека в липидах — 70-140 грамм. Оптимальным в рационе практически здорового человека является соотношение белков, жиров и углеводов, близкое к 1:1,2:4. Это соотношение наиболее благоприятно для максимального удовлетворения как пластических, так и энергетических потребностей организма человека. Белки в большинстве случаев должны составлять 12 %, жиры — 30-35 % общей калорийности рациона. Лишь в случае значительного повышения доли физического труда и увеличения в связи с этим потребности в энергии содержание белков в рационе может быть снижено до 11 % его общей калорийности (за счет увеличения доли жиров и углеводов как поставщиков калорий).
31 .Незаменимые компоненты основных пищевых веществ. Незаменимые аминокислоты; пищевая ценность различных пищевых белков. Линолевая кислота - незаменимая жирная кислота.
Среди пищевых веществ есть такие, которые не образуются в организме человека. Эти пищевые вещества называются незаменимыми, или эссенциальными. Они обязательно должны поступать с пищей. Отсутствие в рационе любого из них приводит к заболеванию, а при длительном недостатке – и к смерти. В настоящее время науке о питании известно около 50 незаменимых пищевых веществ, которые не могут образоваться в организме и единственным источником их является пища. К незаменимым элементам пищичеловекаотносят следующие четыре категории:незаменимые жирные кислоты,незаменимые аминокислоты,витамины и минеральные соли.
В ходе эволюции человек утратил способность синтезировать почти половину из двадцати аминокислот, входящих в состав белков. К их числу относят те аминокислоты, синтез которых включает много стадий и требует большого количества ферментов, кодируемых многими генами. Следовательно, те аминокислоты, синтез которых сложен и неэкономичен для организма, очевидно, выгоднее получать с пищей. Такие аминокислоты называют незаменимыми. К ним относят:
Валин (содержится в зерновых, мясе, грибах, молочных продуктах, арахисе, сое)
Изолейцин (содержится в миндале, кешью, курином мясе, турецком горохе (нут), яйцах, рыбе, чечевице, печени, мясе, ржи, большинстве семян, сое.)
Лейцин (содержится в мясе, рыбе, буром рисе, чечевице, орехах, большинстве семян.)
Лизин (содержится в рыбе, мясе, молочных продуктах, пшенице, орехах.)
Метионин (содержится в молоке, мясе, рыбе, яйцах, бобах, фасоли, чечевице и сое.)
Треонин (содержится в молочных продуктах и яйцах, в умеренных количествах в орехах и бобах.)
Триптофан (содержится в овсе, бананах, сушёных финиках, арахисе, кунжуте, кедровых орехах, молоке, йогурте, твороге, рыбе, курице, индейке, мясе.)
Фенилаланин (содержится в говядине, курином мясе, рыбе, соевых бобах, яйцах, твороге, молоке. Также является составной частью синтетического сахарозаменителя —аспартама, активно используемого в пищевой промышленности.)
Аргинин (содержится в семенах тыквы, свинине, говядине, арахисе, кунжуте, йогурте, швейцарском сыре.)
Две аминокислоты - аргинин и гистидин - у взрослых образуются в достаточных количествах, однако детям для нормального роста организма необходимо дополнительное поступление этих аминокислот с пищей. Поэтому их называют частично заменимыми. Две другие аминокислоты - тирозин и цистеин - условно заменимые, так как для их синтеза необходимы незаменимые аминокислоты. Тирозин синтезируется из фенилаланина, а для образования цистеина необходим атом серы метионина.
Остальные аминокислоты легко синтезируются в клетках и называются заменимыми. К ним относят глицин, аспарагиновую кислоту, аспарагин, глутаминовую кислоту, глутамин, серии, пролин, аланин.
Как было показано выше, основным источником аминокислот для клеток организма являются белки пищи. В различных пищевых продуктах содержание белка колеблется в широких пределах. Распространённые продукты растительного происхождения содержат мало белка (кроме гороха и сои). Наиболее богаты белками продукты животного происхождения (мясо, рыба, сыр). Белки не являются незаменимыми пищевыми факторами, они являются источниками содержащихся в них незаменимых аминокислот, необходимых для нормального питания.
Питательная ценность белка зависит от его аминокислотного состава и способности усваиваться организмом. Белки значительно различаются по аминокислотному составу. Некоторые их них содержат полный набор незаменимых аминокислот в оптимальных соотношениях, другие не содержат одной или нескольких незаменимых аминокислот. Растительные белки, особенно пшеницы и других злаковых, полностью не перевариваются, так как защищены оболочкой, состоящей из целлюлозы и других полисахаридов, которые не гидролизуются пищеварительными ферментами. Некоторые белки по аминокислотному составу близки к белкам тела человека, но не используются в качестве пищевых, так как имеют фибриллярное строение, малорастворимы и не расщепляются протеазами ЖКТ. К ним относят белки волос, шерсти, перьев и другие. Если белок содержит все незаменимые аминокислоты в необходимых пропорциях и легко подвергается действию протеаз, то биологическая ценность такого белка условно принимается за 100, и он считается полноценным. К таким относят белки яиц и молока. Белки мяса говядины имеют биологическую ценность 98. Растительные белки по биологической ценности уступают животным, так как труднее перевариваются и бедны лизином, метионином и триптофаном. Однако при определённой комбинации растительных белков организм можно обеспечить полной и сбалансированной смесью аминокислот. Так, белки кукурузы (биологическая ценность - 36) содержат мало лизина, но достаточное количество триптофана. А белки бобов богаты лизином, но содержат мало триптофана. Каждый из этих белков в отдельности является неполноценным. Однако смесь бобов и кукурузы содержит необходимое человеку количество незаменимых аминокислот.
Линолевая кислота(ω-6 жирная кислота), а также арахидоновая кислотаилиноленовая кислотаотносятся к так называемым незаменимымжирным кислотам, необходимым для нормальной жизнедеятельности; в организм человека и животных эти кислоты поступают с пищей, главным образом в виде сложных липидов —триглицеридовифосфатидов. В виде триглицерида линолевая кислота в значительных количествах (до 40—60 %) входит в состав многихрастительных масели животных жиров, напримерсоевого,хлопкового,подсолнечного,льняного,конопляногомасел,китового жира. Линолевая кислота является незаменимым питательным веществом, без которого организм не может вырабатывать простагландин Е1(простагландин Е1 -одно из важнейших средств защиты организма от преждевременного старения, заболеваний сердца, различных форм аллергии, рака и многих-многих других).
32.История открытия и изучения витаминов. Классификация витаминов. Функции витаминов.
Важность некоторых видов еды для предотвращения определённых болезней была известна ещё в древности. Так, древние египтяне знали, что печень помогает от куриной слепоты. Ныне известно, что куриная слепота может вызываться недостатком витамина A.
В 1330 году в Пекине монгол Ху Сыхуэй опубликовал трёхтомный труд «Важные принципы пищи и напитков», систематизировавший знания о терапевтической роли питания и утверждавший необходимость для здоровья комбинировать разнообразные продукты.
В 1747 году шотландский врач Джеймс Линд (James Lind) открыл свойство цитрусовых предотвращать цингу. В 1753 году он опубликовал трактат «Лечение цинги». Однако эти взгляды получили признание не сразу. Тем не менее Джеймс Кук на практике доказал роль растительной пищи в предотвращении цинги, введя в корабельный рацион кислую капусту. В результате он не потерял от цинги ни одного матроса — неслыханное достижение для того времени.
В 1795 лимоны и другие цитрусовые стали стандартной добавкой к рациону британских моряков. Это послужило появлением крайне обидной клички для матросов — лимонник. Известны т. н. лимонные бунты: матросы выбрасывали за борт бочки с лимонным соком.
В 1880 году русский биолог Николай Лунин из Тартуского университета скармливал подопытным мышам по отдельности все известные элементы, из которых состоит коровье молоко: сахар, белки, жиры, углеводы, соли. Мыши погибли. В то же время мыши, которых кормили молоком, нормально развивались. В своей диссертационной (дипломной) работе Лунин сделал вывод о существовании какого-то неизвестного вещества, необходимого для жизни в небольших количествах. Вывод Лунина был принят в штыки научным сообществом. Другие учёные не смогли воспроизвести его результаты. Одна из причин была в том, что Лунин использовал тростниковый сахар, в то время как другие исследователи использовали молочный сахар, плохо очищенный и содержащий некоторое количество витамина B.
В последующие годы накапливались данные, свидетельствующие о существовании витаминов. Так, в 1889 году голландский врач Христиан Эйкман обнаружил, что куры при питании варёным белым рисом заболевают бери-бери, а при добавлении в пищу рисовых отрубей — излечиваются.
Роль неочищенного риса в предотвращении бери-бери у людей открыта в 1905 году Уильямом Флетчером. В 1906 году Фредерик Хопкинс предположил, что помимо белков, жиров, углеводов и т. д. пища содержит ещё какие-то вещества, необходимые для человеческого организма, которые он назвал «accessory factors». Последний шаг был сделан в 1911 году польским учёным Казимиром Функом(Casimir Funk), работавшим в Лондоне. Он выделил кристаллический препарат, небольшое количество которого излечивало бери-бери. Препарат был назван «Витамайн» (Vitamine), от латинского vita — жизнь и английского amine — амин, азотсодержащее соединение. Функ высказал предположение, что и другие болезни — цинга, пеллагра,рахит — тоже могут вызываться недостатком каких-то веществ.
В 1920 году Джек Сесиль Драммонд предложил убрать «e» из слова «vitamine», потому что недавно открытый витамин C не содержал аминового компонента. Так витамайны стали витаминами.
В 1929 году Хопкинс и Эйкман за открытие витаминов получили Нобелевскую премию, а Лунин и Функ — не получили. Лунин стал педиатром, и его роль в открытии витаминов была надолго забыта. В 1934 году в Ленинграде состоялась Первая всесоюзная конференция по витаминам, на которую Лунин (ленинградец) не был приглашён.
В 1910-е, 1920-е и 1930 годы были открыты и другие витамины. В 1940 годы была расшифрована химическая структура витаминов.
По химическому строению и физико-химическим свойствам (в частности, по растворимости) витамины делят на 2 группы.
Водорастворимые
Витамин В1 (тиамин);
Витамин В2 (рибофлавин);
Витамин РР (никотиновая кислота, никотинамид, витамин В3);
Пантотеновая кислота (витамин В5);
Витамин В6 (пиридоксин);
Биотин (витамин Н);
Фолиевая кислота (витамин Вс, В9);
Витамин В12 (кобаламин);
Витамин С (аскорбиновая кислота);
Витамин Р (биофлавоноиды).
Жирорастворимые
Витамин А (ретинол);
Витамин D (холекальциферол);
Витамин Е (токоферол);
Витамин К (филлохинон).
Водорастворимые витамины при их избыточном поступлении в организм, будучи хорошо растворимыми в воде, быстро выводятся из организма.
Жирорастворимые витамины хорошо растворимы в жирах и легко накапливаются в организме при их избыточном поступлении с пищей. Их накопление в организме может вызвать расстройство обиена веществ, называемое гипервитаминозом, и даже гибель организма.
Витамины участвуют во множестве биохимических реакций, выполняя каталитическую функцию в составе активных центров большого количества разнообразных ферментов либо выступая информационными регуляторными посредниками, выполняя сигнальные функции экзогенных прогормонов и гормонов. Они не являются для организма поставщиком энергии и не имеют существенного пластического значения. Однако витаминам отводится важнейшая роль в обмене веществ. Концентрация витаминов в тканях и суточная потребность в них невелики, но при недостаточном поступлении витаминов в организм наступают характерные и опасные патологические изменения. Большинство витаминов не синтезируются в организме человека. Поэтому они должны регулярно и в достаточном количестве поступать в организм с пищей или в виде витаминно-минеральных комплексов и пищевых добавок. С нарушением поступления витаминов в организм связаны 3 принципиальных патологических состояния: недостаток витамина —гиповитаминоз, отсутствие витамина — авитаминоз, и избыток витамина — гипервитаминоз.
ЗЗ. Алиментарные и вторичные авитаминозы и гиповитаминозы. Гипервитаминозы. Примеры.
С нарушением поступления витаминов в организм связаны 3 принципиальных патологических состояния: недостаток витамина —гиповитаминоз, отсутствие витамина — авитаминоз, и избыток витамина — гипервитаминоз.
Алиментарный авитаминоз - заболевание, являющееся следствием длительного неполноценного питания, в котором отсутствуют какие-либо витамины.
Вторичный авитаминоз (эндогенный) – заболевание, связанное с нарушением процессов пищеварения или нарушением работы органов, связанных непосредственно с пищеварением, поступлением в организм антивитаминов, например лекарственных препаратов синкумар, дикумарол, применяющихся при лечении повышенной свертываемости крови, особенностями обмена веществ в пожилом и детском возрасте.
Гиповитаминоз - болезненное состояние, возникающее при нарушении соответствия между расходованием витаминов и поступлением их в организм; то же, что витаминная недостаточность. Гиповитаминоз развивается при недостаточном поступлении витаминов. Гиповитаминоз развивается незаметно: появляется раздражительность, повышенная утомляемость, снижается внимание, ухудшается аппетит, нарушается сон. Систематический длительный недостаток витаминов в пище снижает работоспособность, сказывается на состоянии отдельных органов и тканей (кожа, слизистые, мышцы, костная ткань) и важнейших функциях организма, таких как рост, интеллектуальные и физические возможности, продолжение рода, защитные силы организма.
Гипервитаминоз — острое расстройство в результате интоксикациисверхвысокой дозой одного или несколькихвитаминов(содержащихся в пище или витаминсодержащих лекарствах). Чаще всего, гипервитаминозы вызываются приёмом резко повышенных доз жирорастворимых витаминов.
Примеры авитаминозов:
Авитаминоз С (Цинга) - недостаток витамина C приводит к нарушению синтеза коллагена,соединительная тканьтеряет свою прочность. Симптомы — вялость, быстрая утомляемость, ослабление мышечного тонуса, ревматоидные боли в крестце и конечностях (особенно нижних), расшатывание и выпадение зубов; хрупкость кровеносных сосудов приводит к кровоточивости дёсен, кровоизлияниям в виде тёмно-красных пятен на коже. При полном прекращении поступления аскорбиновой кислоты в организм цинга развивается примерно через 4–12 недель; пригиповитаминозе Склинические проявления менее выражены и появляются в более поздние сроки, обычно через 4–6 месяцев.
Авитаминоз В1(Бери-бери) - Витамин В1, называемый также тиамином, способствует нормальному протеканию процессов углеводного и жирового обмена. Его дефицит приводит к накоплению в крови человека пировиноградной кислоты и её повышенной концентрации в нервной системе. Последствием такого биохимического нарушения обмена веществ является энцефалопатия Вернике (острое поражение среднего мозга) или полиневрит (поражения нервной системы). Поражения локализуются в периферических нервах и характеризуются развитием в них дегенеративных явлений типа паренхиматозного неврита.
Авитаминоз D (Рахит) - специфическая функция витамина D заключается в регуляции процессов всасывания кальция, фосфора в кишечнике и отложения их в костную ткань, а также реабсорбциикальция и фосфатов в почечных канальцах. При дефиците витамина D происходит нарушение фосфорно-кальцивого обмена, в результате чего происходит нарушение образования костей и недостаточность их минерализации. Нарушения фосфорно-кальциевого обмена приводят к снижению окислительных процессов, развитию ацидоза в кости, углубляющего изменения клеточного метаболизма и нарушающего нормальный процесс обызвествления хрящевой и остеоидной ткани.
Примеры гипервитаминозов:
Гипервитаминоз А - протекает в виде двух форм: Острый - при однократном приеме в пищу большого количества продуктов, содержащих витамин А (печень белого медведя, кита, моржа). Протекает по типу интоксикации (острого отравления). Хронический - развивается, преимущественно у детей, при длительном приеме внутрь витамина А в максимально допустимых суточных дозах. Проявляется в виде каротинемии. В отличие от желтухи при каротинемии отмечается желтушность кожных покровов и ладонных поверхностей кисти. В крови повышается уровень холестерина и ретинола. Наблюдаются органические изменения в печени.
Гипервитаминоз D - при гипервитаминозе D активная форма витамина стимулирует остеокласты, усиливает всасывания кальция в кишечнике, стимулирует реабсорбцию, что вызывает гиперкальциемию, а также остеопороз. Избыток 1,25-дигидроксихолекальциферола приводит к повреждению мембран клеток и органелл. При разрушении лизосом высвобождаются и поступают в цитоплазму их ферменты. В первую очередь изменения возникают в почках и печени. Гиперкальциемия ведёт к кальцинозу крупных сосудов и клапанов сердца.
34.Минеральные вещества пищи. Региональные патологии, связанные с недостаточностью микроэлементов в пище и воде.
Минеральные вещества в зависимости от их содержания в организме и пищевых продуктах подразделяют на макро- и микроэлементы. К макроэлементам, которые содержатся в больших количествах (десятки и сотни миллиграммов на 100 г живой ткани или продукта), относятся кальций, фосфор, магний, калий, натрий, хлор и сера. Микроэлементы содержатся в организме и продуктах в очень малых количествах, выражаемых единицами, десятками, сотыми, тысячными долями миллиграммов. В настоящее время 14 микроэлементов признаны необходимыми для жизнедеятельности: железо, медь, марганец, цинк, кобальт, йод, фтор, хром, молибден, ванадий, никель, стронций, кремний, селен.
КАЛЬЦИЙ - (Ca) Кальций необходим для нормального роста и развития организма, работы сердца, свертываемости крови, а также для формирования мышц и нервных клеток.Длительный дефицит кальция приводит к серьезным изменениям в организме и вызывает такие заболевания, как кариес, рахит, декальцинацию костной ткани. При его недостатке часто возникают боли в суставах, которые иногда ошибочно принимают за проявления ревматизма
ЖЕЛЕЗО - (Fe)Недостаток железа в питании может вызвать анемию (малокровие). В сочетании с белком железо образует красящее вещество крови — гемоглобин, а так как процесс распада и образования кровяных телец непрерывен, то железо должно поступать в организм постоянно, в течение всей жизни.
НАТРИЙ - (Na)Дефицит ее в течение длительного времени ведет к слабости, потере аппетита, тошноте, усталости, мышечным судорогам.
КАЛИЙ - (К)Как и натрий, калий регулирует кровяное давление и содержание воды в тканях, способствует выведению воды через почки. Недостаток его проявляется в ослаблении мышечного тонуса и снижении кровяного давления.
35.Понятие о метаболизме и метаболических путях. Ферменты и метаболизм. Понятие о регуляции метаболизма. Основные конечные продукты метаболизма у человека
Метаболи́зм — полный процесс превращения химических веществворганизме, обеспечивающих его рост, развитие, еятельность ижизньв целом. В живом организме постоянно расходуетсяэнергия, причём не только во время физической и умственной работы, но и при полном покое (сне). Обмен веществ представляет собой комплексбиохимическихи энергетических процессов, обеспечивающих использование пищевых веществ для нужд организма и удовлетворения его потребностей в пластических и энергетических веществах.
Метаболический путь – это последовательный ряд превращений химического вещества из исходного состояния в необходимое, проходящий через ряд промежуточных форм, где в каждом последующем акте превращения принимает участие необходимый фермент.
Все химические реакции в клетке протекают при участии ферментов. Поэтому, чтобы воздействовать на скорость протекания метаболического пути, достаточно регулировать количество или активность ферментов. Обычно в метаболических путях есть ключевые ферменты, благодаря которым происходит регуляция скорости всего пути. Эти ферменты (один или несколько в метаболическом пути) называются регуляторными ферментами; они катализируют, как правило, начальные реакции метаболического пути, необратимые реакции, скорость-ли-митирующие реакции (самые медленные) или реакции в месте переключения метаболического пути (точки ветвления).Регуляция скорости ферментативных реакций осуществляется на 3 независимых уровнях:
изменением количества молекул фермента;
доступностью молекул субстрата и кофер-мента;
изменением каталитической активности молекулы фермента.
1. Регуляция количества молекул фермента в клетке Известно, что белки в клетке постоянно обновляются. Количество молекул фермента в клетке определяется соотношением 2 процессов - синтеза и распада белковой молекулы фермента. Синтез и фолдинг белка - многостадийный процесс. Регуляция синтеза белка может происходить на любой стадии формирования белковой молекулы. Наиболее изучен механизм регуляции синтеза белковой молекулы на уровне транскрипции, который осуществляется определёнными метаболитами, гормонами и рядом биологически активных молекул. Что касается распада ферментов, то регуляция этого процесса менее изучена. Можно только предполагать, что это не просто процесс протеолиза (разрушения белковой молекулы), а сложный механизм, возможно, определяемый на генетическом уровне.
2. Регуляция скорости ферментативной реакции доступностью молекул субстрата и коферментов Важный параметр, контролирующий протекание метаболического пути, - наличие субстратов, и главным образом - наличие первого субстрата. Чем больше концентрация исходного субстрата, тем выше скорость метаболического пути. Другой параметр, лимитирующий протекание метаболического пути, - наличие регенерированных коферментов. Например, в реакциях дегидрирования коферментом дегидрогеназ служат окисленные формы NAD+, FAD, FMN, которые восстанавливаются в ходе реакции. Чтобы коферменты вновь участвовали в реакции, необходима их регенерация, т.е. превращение в окисленную форму.
3. Регуляция каталитической активности ферментов Важнейшее значение в изменении скорости метаболических путей играет регуляция каталитической активности одного или нескольких ключевых ферментов данного метаболического пути. Это высокоэффективный и быстрый способ регуляции метаболизма.
Основные способы регуляции активности ферментов:
аллостерическая регуляция;
регуляция с помощью белок-белковых взаимодействий;
регуляция путём фосфорилирования/дефосфорилирования молекулы фермента;
регуляция частичным (ограниченным) протеолизом.
36.Исследования на целых организмах, органах, срезах тканей, гомогенатах, субклеточных структурах и на молекулярном уровне
В основе биохимической методологии лежит фракционирование, анализ, изучение структуры и свойств отдельных компонентов живого вещества. Методы биохимии преимущественно формировались в XX веке; наиболее распространенными являются хроматография, изобретённая М.С.Цветом в 1906 г., центрифугирование (Т.Сведберг, 1923 г., Нобелевская премия по химии 1926 г.) и электрофорез (А.Тизелиус, 1937 г., Нобелевская премия по химии 1948 г.). С конца ХХ в. в биохимии всё шире применяются методы молекулярной и клеточной биологии, в особенности искусственная экспрессия и нокаут генов в модельных клетках и целых организмах (см. генная инженерия, биотехнология). Определение структуры всей геномной ДНК человека выявило приблизительно столько же ранее неизвестных генов и их неизученных продуктов, сколько уже было известно к началу XXI века благодаря полувековым усилиям научного сообщества. Оказалось, что традиционный химический анализ и очистка ферментов из биомассы позволяют получить лишь те белки, которые в живом веществе присутствуют в сравнительно большом количестве. Не случайно основная масса ферментов была открыта биохимиками в середине XX века, и к концу столетия распространилось убеждение, что все ферменты уже открыты. Данные геномикиопровергли эти представления, но дальнейшее развитие биохимии требовало изменения методологии. Искусственая экспрессия ранее неизвестных генов предоставила биохимикам новый материал для исследования, часто недоступный традиционными методами. В результате возник новый подход к планированию биохимического исследования, который получил название обратная генетика или функциональная геномика. Эта методология предоставляет биохимикам шанс изучать функции продуктов уже известных генов, в то время как ранее наука шла по пути определения структуры генов, кодирующих уже известные ферменты.
37.Эндэргонические и экзэргонические реакции в живой клетке. Макроэргические соединения. Примеры.
Катаболизм - процесс расщепления органических молекул до конечных продуктов. Конечные продукты превращений органических веществ у животных и человека - СО2, Н2О и мочевина. В процессы катаболизма включаются метаболиты, образующиеся как при пищеварении, так и при распаде структурно-функциональных компонентов клеток. Реакции катаболизма сопровождаются выделением энергии (экзергонические реакции).
Анаболизм объединяет биосинтетические процессы, в которых простые строительные блоки соединяются в сложные макромолекулы, необходимые для организма. В анаболических реакциях используется энергия, освобождающаяся при катаболизме (эндергонические реакции).
Направление химической реакции определяется значением ΔG.
Если эта величина отрицательна, то реакция протекает самопроизвольно и сопровождается уменьшением свободной энергии. Такие реакции называют экзергоническими.
Если при этом абсолютное значение ΔG велико, то реакция идёт практически до конца, и её можно рассматривать как необратимую.
Если ΔG положительно, то реакция будет протекать только при поступлении свободной энергии извне; такие реакции называют эндергоническими.
Если абсолютное значение ΔG велико, то система устойчива, и реакция в таком случае практически не осуществляется. При ΔG, равном нулю, система находится в равновесии.
В биологических системах термодинамически невыгодные (эндергонические) реакции могут протекать лишь за счёт энергии экзергонических реакций. Такие реакции называют энергетически сопряжёнными. Многие из этих реакций происходят при участии аденозинтрифосфата (АТФ), играющего роль сопрягающего фактора.
Реакция фосфорилирования глюкозы свободным фосфатом с образованием глюкозо-6-фосфата является эндергонической:
(1) Глюкоза + Н3РО4 → Глюкозо-6-фосфат + Н2О (ΔG = +13,8 кДж/моль).
Для протекания такой реакции в сторону образования глюкозо-6-фосфата необходимо её сопряжение с другой реакцией, величина свободной энергии которой больше, чем требуется для фосфорилирования глюкозы.
(2) АТФ → АДФ + Н3РО4 (ΔG = -30,5 кДж/моль).
При сопряжении процессов (1) и (2) в реакции, катализируемой гексокиназой, фосфорилирование глюкозы легко протекает в физиологических условиях; равновесие реакции сильно сдвинуто вправо, и она практически необратима:
(3) Глюкоза + АТФ → Глюкозо-6-фосфат + АДФ (ΔG = -16,7 кДж/моль).
В живых организмах существует целая группа органических фосфатов, гидролиз которых приводит к освобождению большого количества свободной энергии. Такие соединения называют высокоэнергетическими фосфатами (макроэргические соединения)
|
Соединение |
Продукты реакции |
- ΔG0' , ккал/моль |
- ΔG0', кДж/моль |
|
Фосфоенолпируват |
Пируват + Н3РО4 |
14,8 |
61,86 |
|
1 ,3-Бисфосфоглицерат |
3-фосфоглицерат + Н3РО4 |
13,0 |
54,34 |
|
Карбамоилфосфат |
Карбамат + Н3РО4 |
12,0 |
51,83 |
|
Креатинфосфат |
Креатин + Н3РО4 |
10,3 |
43,05 |
|
Ацетилфосфат |
Уксусная кислота + Н3РО4 |
10,3 |
43,05 |
|
АТФ |
АДФ + Н3РО4 |
7,3 |
30,51 |
|
АДФ |
АМФ + Н3РО4 |
6,6 |
27,59 |
|
Дифосфат(Н4Р2О7) |
2 Н3Р04 |
6,6 |
27,59 |
|
Глюкозо- 1 -фосфат |
Глюкоза + Н3РО4 |
5,0 |
20,90 |
|
Фруктозо-6-фосфат |
Фруктоза + Н3РО4 |
3,8 |
15,88 |
|
Глюкозо-6-фосфат |
Глюкоза + Н3РО4 |
3,3 |
13,79 |
|
Глицеролфосфат |
Глицерин + Н3РО4 |
2,2 |
8,36 |

АТФ - молекула, богатая энергией, поскольку она содержит две фосфоаншдридные связи (β, γ). При гидролизе концевой фосфоангидридной связи АТФ превращается в АДФ и ортофосфат Рi При этом изменение свободной энергии составляет -7,3 ккал/моль. При условиях, существующих в клетке в норме (рН 7,0, температура 37 °С), фактическое значение ΔG0' для процесса гидролиза составляет около -12 ккал/моль. Величина свободной энергии гидролиза АТФ делает возможным его образование из АДФ за счёт переноса фосфатного остатка от таких высокоэнергетических фосфатов, как, например, фосфоенолпируват или 1,3-бисфосфоглицерат; в свою очередь, АТФ может участвовать в таких эндергонических реакциях, как фосфорилирование глюкозы или глицерина. АТФ выступает в роли донора энергии в эндергонических реакциях многих анаболических процессов. Некоторые биосинтетические реакции в организме могут протекать при участии других нуклеозидтрифосфатов, аналогов АТФ; к ним относят гуанозинтрифосфат (ГТФ), уридинтрифосфат (УТФ) и цитидинтрифосфат (ЦТФ). Все эти нуклеотиды, в свою очередь, образуются при использовании свободной энергии концевой фосфатной группы АТФ. Наконец, за счёт свободной энергии АТФ совершаются различные виды работы, лежащие в основе жизнедеятельности организма, например, такие как мышечное сокращение или активный транспорт веществ.
Таким образом, АТФ - главный, непосредственно используемый донор свободной энергии в биологических системах. В клетке молекула АТФ расходуется в течение одной минуты после её образования. У человека количество АТФ, равное массе тела, образуется и разрушается каждые 24 ч.
Использование АТФ как источника энергии возможно только при условии непрерывного синтеза АТФ из АДФ за счёт энергии окисления органических соединений. Цикл АТФ-АДФ - основной механизм обмена энергии в биологических системах, а АТФ - универсальная "энергетическая валюта".
З8.Дегидрирование субстрата и окисление водорода (образование Н2О) как источник энергии для синтеза АТФ. НАД- и ФАД-зависимые дегидрогеназы, убихинон-дегидрогеназа, цитохромы и цитохромоксидаза.
Энергия освобождается в процессе ферментативного окисления метаболитов специфическими дегидрогеназами. В реакциях дегидрирования электроны и протоны переходят от органических субстратов на коферменты NAD- и FAD-зависимых дегидрогеназ. Электроны, обладающие высоким энергетическим потенциалом, передаются от восстановленных коферментов NADH и FADH2 к кислороду через цепь переносчиков, локализованных во внутренней мембране митохондрий. Восстановление молекулы О2 происходит в результате переноса 4 электронов. При каждом присоединении к кислороду 2 электронов, поступающих к нему по цепи переносчиков, из матрикса поглощаются 2 протона, в результате чего образуется молекула Н2О.
Окисление органических веществ в клетках, сопровождающееся потреблением кислорода и синтезом воды, называют тканевым дыханием, а цепь переноса электронов (ЦПЭ) - дыхательной цепью.
Электроны, поступающие в ЦПЭ, по мере их продвижения от одного переносчика к другому теряют свободную энергию. Значительная часть этой энергии запасается в форме АТФ, а часть энергии рассеивается в виде тепла. Кроме того, электроны с высоким энергетическим потенциалом, возникающие при окислении различных субстратов, могут быть использованы в реакциях биосинтеза, для которых помимо АТФ требуются восстановительные эквиваленты, например NADPH.
Перенос электронов от окисляемых субстратов к кислороду происходит в несколько этапов. В нём участвует большое количество промежуточных переносчиков, каждый из которых способен присоединять электроны от предыдущего компонента и передавать следующему. Так возникает цепь окислительно-восстановительных реакций, в результате чего происходят восстановление О2 и синтез Н2О. В дыхательную цепь митохондрий входит большое число переносчиков.
За исключением убихинона (KoQ), все компоненты ЦПЭ - белки. В составе этих белков содержатся различные небелковые компоненты: FMN, Fe в составе железо-серных белков и в составе порфириновых колец, ионы Сu.
Первичные акцепторы водорода .Первичные акцепторы водорода окислительно-восстановительных реакций относят к 2 типам дегидрогеназ: никотинамвдзависимым, содержащим в качестве коферментов производные никотиновой кислоты, и флавинзависимым, содержащим производные рибофлавина .
Никотинамидзависимые дегидрогеназы содержат в качестве коферментов NAD+ или NADP+ (см. раздел 2). NAD+ и NADP+ - производные витамина PP. Эти коферменты входят в состав активных центров дегидрогеназ, но могут обратимо диссоциировать из комплекса с апоферментами и включаются в состав фермента в ходе реакции. Субстраты NAD- и NADP-зависимых дегидрогеназ находятся в матриксе митохондрий и в цитозоле. Рабочей частью никотинамидных коферментов служит никотинамид.
Большинство дегидрогеназ, поставляющих электроны в ЦПЭ, содержат NAD+. Они катализируют реакции типа:
R-CHOH-R1 + NAD+↔ R-CO-R1 + NADH + Н+.
Таким образом, NAD+, присоединяя протоны и электроны от различных субстратов, служит главным коллектором энергии окисляемых веществ и главным источником электронов, обладающих высоким энергетическим потенциалом, для ЦПЭ. NADPH не является непосредственным донором электронов в ЦПЭ, а используется почти исключительно в восстановительных биосинтезах . Однако возможно включение электронов с NADPH в ЦПЭ благодаря действию пиридиннуклеотид трансгидрогеназы, катализирующей реакцию:
NADPH + NAD+ ↔ NADP+ + NADH.

Флавиновые дегидрогеназы содержат в качестве коферментов FAD или FMN. Эти коферменты образуются в организме человека из витамина В2. Флавиновые коферменты прочно связаны с апоферментами. Рабочей частью FAD и FMN служит изоаллоксазиновая сопряжённая циклическая система.
FAD служит акцептором электронов от многих субстратов в реакциях типа:
R-CH2-CH2-R1 + Е (FAD) ↔ R-CH=CH-R1 + Е (FADH2),
где Е - белковая часть фермента.
Большинство FAD-зависимых дегидрогеназ - растворимые белки, локализованные в матриксе митохондрий. Исключение составляет сукцинат-дегидрогеназа, находящаяся во внутренней мембране митохондрий. К FMN-содержащим ферментам принадлежит NADH-дегидрогеназа, которая также локализована во внутренней мембране митохондрий; она окисляет NADH, образующийся в митохондриальном матриксе.
Цепь переноса электронов от NADH и FADH2 на кислород Перенос электронов от NADH к О2 включает ряд переносчиков, которые локализованы во внутренней мембране митохондрий. За исключением убихинона и цитохрома С, это сложные белковые комплексы.
NADH-дегидрогеназа (NADH-Q-редуктаза, комплекс I) состоит из нескольких полипептидных цепей. Роль простетической группы играет FMN. Единственный субстрат фермента - NADH, с которого 2 электрона и протон переносятся на FMN с образованием FMNH2. Второй протон поглощается из матрикса. Реакция протекает по уравнению:
NADH + Н+ + Е (FMN) → NAD+ + Е (FMNH2)
С FMNH2 электроны переносятся затем на ряд железо-серных белков (FeS), играющих роль второй простетической группы в молекуле NADH-дегидрогеназы. Атомы железа в этих белках (негемовое железо) собраны в несколько групп, так называемых железо-серных центров. FeS-центры входят в состав многих белков (флавопротеинов, цитохромов), участвующих в окислительно-восстановительных реакциях. Известны 3 типа FeS-центров (FeS, Fe2S2, Fe4S4), в которых атом железа связан с атомом серы остатков цистеина или неорганической серы. NADH-дегидрогеназа содержит несколько центров типа Fe2S2 и Fe4S4 Атомы железа в таких центрах могут принимать и отдавать электроны поочерёдно, переходя в ферро- (Fe2+) и ферри- (Fe3+) состояния. От железо-серных центров электроны переносятся на кофермент Q (убихинон).
Обозначение этого жирорастворимого хинона происходит от первой буквы английского названия хинона (quinone), а название убихинон отражает его широкую распространённость в природе (ubiquitous - вездесущий). Молекулы убихинона в зависимости от источника, из которого они выделены, различаются длиной углеводородной цепи, которая у млекопитающих содержит 10 изопреноидных звеньев и обозначается как Q10. В процессе переноса электронов с NADH-дегидрогеназы через FeS на убихинон он обратимо превращается в гидрохинон. Убихинон выполняет коллекторную функцию, присоединяя электроны от NADH-дегидрогеназы и других флавинзависимых дегидрогеназ, в частности, от сукцинат-дегидрогеназы. Убихинон участвует в реакциях типа:
Е (FMNH2) + Q → Е (FMN) + QH2.

Цитохромы или гемопротеины присутствуют во всех типах организмов. В клетках эукариотов они локализованы в митохондриальных мембранах и в ЭР. Известно около 30 различных цитохромов. Все цитохромы в качестве простетической группы содержат гем . Их многообразие обусловлено:
различием боковых цепей в структуре тема;
различием в структуре полипептидных цепей;
различием в способе связи полипептидных цепей с гемом.
В зависимости от способности поглощать свет в определённой части спектра все цитохромы делят на группы а, b, с. Внутри каждой группы отдельные виды с уникальными спектральными свойствами обозначают цифровыми индексами (b, b1, b2 и т.д.).
Структурные особенности разных видов цитохромов определяют различие в их окислительно-восстановительных потенциалах. В ЦПЭ участвуют 5 типов цитохромов (а, а3, b, с, с1). За исключением цитохрома с, все цитохромы находятся во внутренней мембране митохондрий в виде сложных белковых комплексов.
QН2-дегидрогеназа (коэнзим Q-цитохром с-ре-уктаза, комплекс III) состоит из 2 типов цитохромов (b1 и b2) и цитохрома с1. QН2-дегидрогеназа переносит электроны от убихинола на цитохром с. Внутри комплекса III электроны передаются от цитохромов b на FeS-центры, на цитохром с1, а затем на цитохром с. Группы тема, подобно FeS-центрам, переносят только по одному электрону. Таким образом, от молекулы QH2 2 электрона переносятся на 2 молекулы цитохрома b. В качестве промежуточного продукта в этих реакциях переноса электронов возможно образование свободного радикала се-михинона. В цитохромах типа b гем не связан ковалентно с белком, а в цитохромах с1 и с он присоединяется к белку при помощи тиоэфирных связей. Эти связи образуются путём присоединения 2 цистеиновых остатков к винильным группам гема.
Цитохром С - периферический водорастворимый мембранный белок с молекулярной массой 12 500 Д, имеющий одну полипептидную цепь из 100 аминокислотных остатков, и молекулу гема, ковалентно связанную с полипептидом.
Цитохромоксидаза (комплекс IV) состоит из 2 цитохромов типа аа3 каждый из которых имеет центр связывания с кислородом. Цитохромы а и а3 имеют характерную железопорфириновую простетическую группу, называемую гемом А и отличающуюся от гема цитохромов с и c1. Он содержит формильную группу вместо одной из метальных групп и углеводородную цепь вместо одной из винильных групп. Другая особенность комплекса а-а3 - наличие в нём ионов меди, связанных с белковой астью в так называемых CuA-центрах. Перенос электронов комплексом а-а3 включает реакции:
Cu+ ↔ Cu2+ + e, Fe2+ ↔ Fe3+ + e.
Комплекс цитохромов а-а3 непосредственно реагирует с молекулярным кислородом.
 39.Окислительное
фосфорилирование, коэффициент Р/О.
Строение митохондрий и структурная
организация дыхательной цепи.
Трансмембранный электрохимический
потенциал.
39.Окислительное
фосфорилирование, коэффициент Р/О.
Строение митохондрий и структурная
организация дыхательной цепи.
Трансмембранный электрохимический
потенциал.
Синтез АТФ из АДФ и Н3РО4 за счёт энергии переноса электронов по ЦПЭ называют окислительным фосфорилированием.
Протонный градиент и электрохимический потенциал Перенос электронов по дыхательной цепи от NADH к кислороду сопровождается выкачиванием протонов из матрикса митохондрий через внутреннюю мембрану в межмембранное пространство. На эту работу затрачивается часть энергии электронов, переносимых по ЦПЭ.
Протоны, перенесённые из матрикса в межмембранное пространство, не могут вернуться обратно в матрикс, так как внутренняя мембрана непроницаема для протонов. Таким образом, создаётся протонный градиент, при котором концентрация протонов в межмембранном пространстве больше, а рН меньше, чем в матриксе. Кроме того, каждый протон несёт положительный заряд, и вследствие этого появляется разность потенциалов по обе стороны мембраны: отрицательный заряд на внутренней стороне и положительный - на внешней. В совокупности электрический и концентрационный градиенты составляют электрохимический потенциал ΔμН+ - источник энергии для синтеза АТФ. Так как наиболее активный транспорт протонов в межмембранное пространство, необходимый для образования ΔμН+, происходит на участках ЦПЭ, соответствующих расположению комплексов I, III и IV, эти участки называют пунктами сопряжения дыхания и фосфорилирования. Механизм транспорта протонов через митохондриальную мембрану в пунктах сопряжения недостаточно ясен. Однако установлено, что важную роль в этом процессе играет KoQ. Наиболее детально механизм переноса протонов при участии KoQ изучен на уровне комплекса III. KoQ переносит электроны от комплекса I к комплексу III и протоны из матрикса в межмембранное пространство, совершая своеобразные циклические превращения, называемые Q-циклами. Донором электронов для комплекса III служит восстановленный убихинон (QH2), а акцептором - цитохром с. Цитохром с находится с внешней стороны внутренней мембраны митохондрий; там же располагается активный центр цитохрома с1 с которого электроны переносятся на цитохром с. В мембране существует стационарный общий фонд Q/QH2, из которого каждая молекула QH2 в одном цикле обеспечивает перенос протонов из матрикса в межмембранное пространство и электронов, которые в конечном итоге поступают на кислород. На работу, совершаемую при выкачивании протонов, расходуется часть свободной энергии, которая освобождается при переносе электронов по градиенту редокс-потенциала. Энергия электрохимического потенциала (∆μH+) используется для синтеза АТФ, если протоны возвращаются в матрикс через ионные каналы АТФ-синтазы.
Строение АТФ-синтазы и синтез АТФ АТФ-синтаза (Н+-АТФ-аза) - интегральный белок внутренней мембраны митохондрий. Он расположен в непосредственной близости к дыхательной цепи. АТФ-синтаза состоит из 2 белковых комплексов, обозначаемых как F0 и F1.Гидрофобный комплекс F0 погружён в мембрану. Он служит основанием, которое фиксирует АТФ-синтазу в мембране. Комплекс F0 состоит из нескольких субъединиц, образующих канал, по которому протоны переносятся в матрикс. Комплекс F1 выступает в митохондриальный матрикс. Он состоит из 9 субъединиц (Зα, 3β, γ, ε, δ). Субъединицы уложены попарно, образуя "головку"; между α- и β-субъединицами располагаются 3 активных центра, в которых происходит синтез АТФ; γ-, ε-, δ- субъединицы связывают комплекс F1 с F0.
Повышение концентрации протонов в межмембранном пространстве активирует АТФ-синтазу. Электрохимический потенциал ΔμH+ заставляет протоны двигаться по каналу АТФ-синтазы в матрикс. Параллельно под действием ΔμH+ происходят конформационные изменения в парах α, β-субъединиц белка F1, в результате чего из АДФ и неорганического фосфата образуется АТФ. Электрохимический потенциал, генерируемый в каждом из 3 пунктов сопряжения в ЦПЭ, используют для синтеза одной молекулы АТФ.
Коэффициент окислительного фосфорилирования Окисление молекулы NADH в ЦПЭ сопровождается образованием 3 молекул АТФ; электроны от FAD-зависимых дегидрогеназ поступают в ЦПЭ на KoQ, минуя первый пункт сопряжения. Поэтому образуются только 2 молекулы АТФ. Отношение количества фосфорной кислоты (Р), использованной на фосфорилирование АДФ, к атому кислорода (О), поглощённого в процессе дыхания, называют коэффициентом окислительного фосфорилирования и обозначают Р/О. Следовательно, для NADH Р/О = 3, для сукцината Р/О - 2. Эти величины отражают теоретический максимум синтеза АТФ, фактически эта величина меньше.
Каждая митохондрия окружена оболочкой, состоящей из двух мембран; между ними — межмембранное пространство. Отграниченное внутренней мембраной пространство называется матриксом. В матриксе содержатся большая частьферментов, участвующих вцикле Кребса, протекаетокислениежирных кислот, располагаются митохондриальныеДНК,РНКирибосомы. Внутренняя мембрана образует многочисленные гребневидные складки — кристы, существенно увеличивающие площадь ее поверхности. Наружная мембрана митохондрий имеет маленькие отверстия, образованные специальными белками, через которые могут проникать небольшиемолекулыиионы. Внутренняя мембрана таких отверстий не имеет; на ней, на стороне, обращенной к матриксу, располагаются особые молекулыАТФ-синтазы, состоящие из головки, ножки и основания. При прохождении через нихпротоновпроисходит синтез АТФ. В основании частиц, заполняя собой всю толщу мембраны, располагаются компоненты дыхательной цепи. Наружная и внутренняя мембраны в некоторых местах соприкасаются, там находится специальный белок-рецептор, способствующий транспорту митохондриальных белков, закодированных в ядре, в матрикс митохондрии.
40.Регуляция цепи переноса электронов (дыхательный контроль). Разобщение тканевого дыхания и окислительного фосфорилирования. Терморегуляторная функция тканевого дыхания
Дыхательный контроль Окисление субстратов и фосфорилирование АДФ в митохондриях прочно сопряжены. Скорость использования АТФ регулирует скорость потока электронов в ЦПЭ. Если АТФ не используется и его концентрация в клетках возрастает, то прекращается и поток электронов к кислороду. С другой стороны, расход АТФ и превращение его в АДФ увеличивает окисление субстратов и поглощение кислорода. Зависимость интенсивности дыхания митохондрий от концентрации АДФ называют дыхательным контролем. Механизм дыхательного контроля характеризуется высокой точностью и имеет важное значение, так как в результате его действия скорость синтеза АТФ соответствует потребностям клетки в энергии. Запасов АТФ в клетке не существует. Относительные концентрации АТФ/АДФ в тканях изменяются в узких пределах, в то время как потребление энергии клеткой, т.е. частота оборотов цикла АТФ и АДФ, может меняться в десятки раз. Общее содержание АТФ в организме 30-50 г, но каждая молекула АТФ в клетке "живёт" меньше минуты. В сутки у человека синтезируется 40-60 кг АТФ и столько же распадается. Увеличение концентрации АДФ немедленно приводит к ускорению дыхания и фосфорилирования.
Разобщение дыхания и фосфорилирования Некоторые химические вещества (протонофоры) могут переносить протоны или другие ионы (ионофоры) из межмембранного пространства через мембрану в матрикс, минуя протонные каналы АТФ-синтазы. В результате этого исчезает электрохимический потенциал и прекращается синтез АТФ. Это явление называют разобщением дыхания и фосфорилирования. В результате разобщения количество АТФ снижается, а АДФ увеличивается. В этом случае скорость окисления NADH и FADH2возрастает, возрастает и количество поглощённого кислорода, но энергия выделяется в виде теплоты, и коэффициент Р/О резко снижается. Как правило, разобщители - липофильные вещества, легко проходящие через липидный слой мембраны. Одно из таких веществ - 2,4-динитрофенол, легко переходящий из ионизированной формы в неионизированную, присоединяя протон в межмембранном пространстве и перенося его в матрикс. Примерами разобщителей могут быть также некоторые лекарства, например дикумарол - антикоагулянт или метаболиты, которые образуются в организме, билирубин - продукт катаболизма тема, тироксин - гормон щитовидной железы. Все эти вещества проявляют разобщающее действие только при их высокой концентрации.
Терморегуляторная функция ЦПЭ На синтез молекул АТФ расходуется примерно 40-45% всей энергии электронов, переносимых по ЦПЭ, приблизительно 25% тратится на работу по переносу веществ через мембрану. Остальная часть энергии рассеивается в виде теплоты и используется теплокровными животными на поддержание температуры тела. Кроме того, дополнительное образование теплоты может происходить при разобщении дыхания и фосфорилирования. Разобщение окислительного фосфорилирования может быть биологически полезным. Оно позволяет генерировать тепло для поддержания температуры тела у новорождённых, у зимнес-пящих животных и у всех млекопитающих в процессе адаптации к холоду. У новорождённых, а также зимнеспящих животных существует особая ткань, специализирующаяся на теплопродукции посредством разобщения дыхания и фосфорилирования - бурый жир. Бурый жир содержит много митохондрий. В мембране митохондрий имеется большой избыток дыхательных ферментов по сравнению с АТФ-синтазой. Около 10% всех белков приходится на так называемый разобщающий белок (РБ-1) - термогенин. Бурый жир имеется у новорождённых, но его практически нет у взрослого человека. В последние годы появились факты, свидетельствующие о существовании в митохондриях разных органов и тканей млекопитающих разобщающих белков, похожих по своей структуре на РБ-1 бурой жировой ткани. По своей структуре термогенин близок к АТФ/АДФ-антипортеру, но не способен к транспорту нуклеотидов, хотя сохранил способность переносить анионы жирных кислот, служащих разобщителями.На внешней стороне мембраны анион жирной кислоты присоединяет протон и в таком виде пересекает мембрану; на внутренней стороне мембраны диссоциирует, отдавая протон в матрикс и тем самым снижает протонный градиент. Образующийся анион возвращается на наружную сторону мембраны с помощью АТФ/ АДФ-антипортера. При охлаждении стимулируется освобождение норадреналина из окончаний симпатических нервов. В результате происходят активация липазы в жировой ткани и мобилизация жира из жировых депо. Образующиеся свободные жирные кислоты служат не только "топливом", но и важнейшим регулятором разобщения дыхания и фосфорилирования.
41.Нарушения энергетического обмена: гипоэнергетические состояния как результат гипоксии, гипо-, авитаминозов и других причин. Возрастная характеристика энергетического обеспечения организма питательными веществами.
Все живые клетки постоянно нуждаются в АТФ для осуществления различных видов жизнедеятельности. Клетки мозга потребляют большое количество АТФ для синтеза нейромедиаторов, регенерации нервных клеток, поддержания необходимого градиента Na+ и К+, для проведения нервного импульса; почки используют АТФ в процессе реабсорбции различных веществ при образовании мочи; в печени происходит синтез гликогена, жиров, белков и многих других соединений; в миокарде постоянно совершается механическая работа, необходимая для циркуляции крови; скелетные мышцы в покое потребляют незначительные количества АТФ, но при физической нагрузке эти потребности возрастают в десятки раз. Вместе с тем запасов АТФ в клетках практически не существует. Так, в условиях прекращения синтеза АТФ в миокарде его запасы истощаются за несколько секунд. Как мы уже знаем, для постоянного синтеза АТФ клеткам необходим приток метаболитов как субстратов дыхания и кислорода как конечного акцептора электронов в реакциях окисления, сопряжённых с синтезом АТФ. Нарушения какого-либо этапа метаболизма, приводящие к прекращению синтеза АТФ, гибельны для клетки. Состояния, при которых синтез АТФ снижен, объединяют термином "гипоэнергетические". Причинами гипоэнергетических состояний могут быть голодание, гиповитаминозы В1, РР, В2; гипоксия. Гипоксия может возникнуть: при недостатке кислорода во вдыхаемом воздухе; при заболеваниях лёгких и нарушении лёгочной вентиляции; при нарушениях кровообращения, вызванных заболеваниями сердца, спазмом и тромбозом сосудов, кровопотерей. Причинами гипоксии могут быть также наследственные или приобретенные нарушения структуры гемоглобина . Частой причиной гипоэнергетических состояний могут быть нарушения процессов использования кислорода в клетках. Причинами этих нарушений могут быть:
действие ингибиторов и разобщителей в ЦПЭ;
железодефицитные анемии;
снижение уровня гемоглобина и других железосодержащих белков (цитохромов, FeS-белков), в результате чего нарушаются перенос электронов и синтез АТФ;
наследственные дефекты ферментов ЦПЭ и цитратного цикла
42.Образование токсических форм кислорода, механизм их повреждающего действия на клетки. Механизмы устранения токсичных форм кислорода.
В большинстве реакций с участием молекулярного кислорода его восстановление происходит поэтапно с переносом одного электрона на каждом этапе. При одноэлектронном переносе происходит образование промежуточных высокореактивных форм кислорода. В невозбуждённом состоянии кислород нетоксичен. Образование токсических форм кислорода связано с особенностями его молекулярной структуры. О2 содержит 2 неспаренных электрона с параллельными спинами, которые не могут образовывать термодинамически стабильную пару и располагаются на разных орбиталях. Каждая из этих орбиталей может принять ещё один электрон. Полное восстановление О2 происходит в результате 4 одноэлектронных переходов:
![]()
Супероксид, пероксид и гидроксильный радикал - активные окислители, что представляет серьёзную опасность для многих структурных компонентов клетки. Активные формы кислорода могут отщеплять электроны от многих соединений, превращая их в новые свободные радикалы, инициируя цепные окислительные реакции. Большая часть активных форм кислорода образуется при переносе электронов в ЦПЭ, прежде всего, при функционировании QH2-дегидрогеназного комплекса. Это происходит в результате неферментативного переноса ("утечки") электронов с QH2 на кислород.
В отличие от рассмотренного механизма на этапе переноса электронов при участии цитохромоксидазы (комплекс IV) "утечка" электронов не происходит благодаря наличию в ферменте специальных активных центров, содержащих Fe и Сu и восстанавливающих О2 без освобождения промежуточных свободных радикалов. В фагоцитирующих лейкоцитах (гранулоцитах, макрофагах и эозинофилах) в процессе фагоцитоза усиливаются поглощение кислорода и образование активных радикалов. Активные формы кислорода образуются в результате активации NADPH-оксидазы, преимущественно локализованной на наружной стороне плазматической мембраны, инициируя так называемый "респираторный взрыв" с образованием активных форм кислорода. Защита организма от токсического действия активных форм кислорода связана с наличием во всех клетках высокоспецифичных ферментов: супероксиддисмутазы, каталазы, глутатион-пероксидазы, а также с действием антиоксидантов и витаминов.
К ферментам, защищающим клетки от действия активных форм кислорода, относят супероксиддисмутазу, каталазу и глутатионпероксидазу; Наиболее активны эти ферменты в печени, надпочечниках и почках, где содержание митохондрий, цитохрома Р450 и пероксисом особенно велико. Супероксиддисмутаза (СОД) превращает супероксидные анионы в пероксид водорода. Изоферменты СОД находятся и в цитозоле и в митохондриях и являются как бы первой линией защиты, потому что супероксидный анион образуется обычно первым из активных форм кислорода при утечке электронов из дыхательной цепи. СОД - индуцируемый фермент, т.е. синтез его увеличивается, если в клетках активируется перекисное окисление. Пероксид водорода, который может инициировать образование самой активной формы ОН•, разрушается ферментом каталазой:
2Н2О2 → 2 Н2О + О2.
Каталазанаходится в основном в пероксисомах, где образуется наибольшее количество пероксида водорода, а также в лейкоцитах, где она защищает клетки от последствий "респираторного взрыва"
Глутатионпероксидаза- важнейший фермент, обеспечивающий инактивацию активных форм кислорода, так как он разрушает и пероксид водорода и гидропероксиды липидов. Он катализирует восстановление пероксидов с помощью трипептида глутатиона (γ-глутамилцистеинилглицин). Сульфгидрильная группа глутатиона (GSH) служит донором электронов и, окисляясь, образует дисульфидную форму глутатиона, в которой 2 молекулы глутатиона связаны через дисульфидную группу.
Н2О2 + 2 GSH → 2 Н2О + G-S-S-G.
Окисленный глутатион восстанавливается глутатионредуктазой:
GS-SG + NADPH + Н+ → 2 GSH + NADP+.
Глутатионпероксидаза, которая восстанавливает гидропероксиды липидов в составе мембран, в качестве кофермента использует селен (необходимый микроэлемент пищи). При его недостатке активность антиоксидантной защиты снижается.
Витамин Е (α-токоферол) - наиболее распространённый антиоксидант в природе - является липофильной молекулой, способной инактивировать свободные радикалы непосредственно в гидрофобном слое мембран и таким образом предотвращать развитие цепи перекисного окисления. Различают 8 типов токоферолов, но α-токоферол наиболее активен. Витамин Е отдаёт атом водорода свободному радикалу пероксида липида (ROO•), восстанавливая его до гидропероксида (ROOH) и таким образом останавливает развитие ПОЛ. Свободный радикал витамина Е, образовавшийся в результате реакции, стабилен и не способен участвовать в развитии цепи. Наоборот, радикал витамина Е непосредственно взаимодействует с радикалами липидных перекисей, восстанавливая их, а сам превращается в стабильную окисленную форму - токоферолхинон.
Витамин
С (аскорбиновая
кислота) также является антиоксидантом
и участвует с помощью двух различных
механизмов в ингибировании ПОЛ. Во-первых,
витамин С восстанавливает окисленную
форму витамина Е и таким образом
поддерживает необходимую концентрацию
этого антиоксиданта непосредственно
в мембранах клеток. Во-вторых, витамин
С, будучи водорастворимым витамином и
сильным восстановителем, взаимодействует
с водорастворимыми активными формами
кислорода - ![]() ,
Н2О2,
ОН• и инактивирует их.
,
Н2О2,
ОН• и инактивирует их.
β-Каротин, предшественник витамина А, также обладает антиоксидантаным действием и ингибирует ПОЛ. Показано, что растительная диета, обогащённая витаминами Е, С, кароти-ноидами, существенно уменьшает риск развития атеросклероза и заболеваний ССС, подавляет развитие катаракты - помутнения хрусталика глаза, обладает антиканцерогенным действием. Имеется много доказательств в пользу того, что положительное действие этих компонентов пищи связано с ингибированием ПОЛ и других молекул и, следовательно, с поддержанием нормальной структуры компонентов клеток.
43.Катаболизм основных пищевых веществ - углеводов, жиров, белков. Понятие о специфических путях катаболизма и общих путях катаболизма.

Если процесс катаболизма рассматривать с общей точки зрения, то можно выделить три основные его части:
Расщепление в пищеварительном тракте. Это гидролитические реакции, превращающие сложные пищевые вещества в относительно небольшое число простых метаболитов: глюкоза, аминокислоты, глицерин, жирные кислоты.
Специфические пути катаболизма. Простые метаболиты подвергаются специфическим реакциям расщепления, в результате которых образуется либо пировиноградная кислота, либо ацетил — КоА. Причем ацетил — КоА может образоваться из пирувата в результате окислительного декарбоксилирования. Могут также образоваться другие соединения, непосредственно включающиеся в цитратный цикл.
Цитратный цикл и дыхательная цепь завершают расщепление пищевых веществ до конечных продуктов — СО2 и Н2О.
Следовательно, начиная со стадии образования пирувата происходит унификация путей катаболизма. Из большого числа исходных соединений образуется всего два — пируват и ацетил — СоА. Процесс, начинающийся от пирувата, называется общим путем катаболизма и в свою очередь включает:
окислительное декарбоксилирование пирувата
цитратный цикл.
Именно в общем пути катаболизма образуется основная масса субстратов для реакций дегидрирования. Совместно с дыхательной цепью и окислительным фосфорилированием общий путь катаболизма является основным источником энергии в форме АТР.
44.Окислительное декарбоксилирование пировиноградной кислоты. Последовательность реакций. Строение пируватдекарбоксилазного комплекса.
Окислительное декарбоксилирование пирувата происходит в матриксе митохондрий. Транспорт пирувата в митохондриальный матрикс через внутреннюю мембрану митохондрий осуществляется при участии специального белка-переносчика по механизму симпорта с Н+. Превращение пирувата в ацетил-КоА описывают следующим суммарным уравнением:
СН3-СО-СООН + NAD+ + HSKoA → CH3-CO ∼SKoA + NADH + H+ + CO2
В ходе этой реакции происходит окислительное декарбоксилирование пирувата, в результате которого карбоксильная группа удаляется в виде СО2, а ацетильная группа включается в состав ацетил- КоА. Один атом водорода оказывается в составе NADH, а другой в виде Н+ поступает в среду. Реакция необратима, поскольку ΔG0' = -33,5 кДж/моль.
Строение пируватдегидрогеназного комплекса Процесс окислительного декарбоксилирования пирувата катализирует сложнооргани-зованный пируватдегидрогеназный комплекс. В пируватдегидрогеназный комплекс (ПДК) входят 3 фермента: пируватдекарбоксилаза (Е1), дигидролипоилтрансацетилаза (Е2) и дигидролипоилдегидрогеназа (Е3), а также 5 коферментов: тиаминдифосфат (ТДФ), липоевая кислота,. FAD, NAD+ и КоА. Кроме того, в состав комплекса входят регуляторные субъединицы: протеинкиназа и фосфопротеинфосфатаза. Все эти ферменты и коферменты объединены в мультиферментную систему, содержащую разные количества каждого из ферментов и имеющую молекулярную массу более 6×106. В центре комплекса располагается дигидролипоилтрансацетилаза (Е2), образуя его ядро. К дигидролипоилтрансацетилазе присоединены молекулы: пируватдекарбоксилазы (Е1) и дигидролипоилдегидрогеназы (Е3). Пируватдекарбоксилаза содержит прочно связанный с белковой частью ТДФ, а дигидроли-поилдегидрогеназа - FAD.Липоиллизиновые группы центрального фермента (Е2) функционируют как поворотные "кронштейны", переносящие атомы водорода и ацетильные группы от одной ферментной молекулы комплекса к другой.
Окислительное декарбоксилирование пирувата Превращение пирувата в ацетил-КоА включает 5 стадий

Стадия I. На этой стадии пируват соединяется с ТДФ в составе Е1 и подвергается декарбоксилированию.
Пируват + Е1-ТДФ → Гидроксиэтил-ТДФ + CO2.
Стадия П. Дигидролипоилтрансацетилаза (Е2) катализирует перенос атома водорода и ацетильной группы от ТДФ на окисленную форму липоиллизиновых групп с образованием ацетилтиоэфира липоевой кислоты.
Стадия III. На стадии III КоА взаимодействует с ацетильным производным Е2, в результате чего образуются ацетил-КоА и полностью восстановленный липоильный остаток, простетическая группа Е2.
Стадия IV. На стадии IV дигидролипоилде-гидрогеназа (Е3) катализирует перенос атомов водорода от восстановленных липоильных групп на FAD - простетическую группу фермента Е3.
Стадия V . На стадии V восстановленный FADH2 передаёт водород на NAD+ с образованием NADH.
Пируватдегидрогеназный комплекс характеризуется большим отрицательным окислительно-восстановительным потенциалом, который обеспечивает наряду с восстановлением кофермента (NADH) образование высокоэнергетической тиоэфирной связи в ацетил-КоА
45.Цикл лимонной кислоты: последовательность реакций и характеристика ферментов. Связь между общими путями катаболизма и цепью переноса электронов и протонов.
Цикл лимонной кислоты (цитратный цикл, цикл Кребса, цикл трикарбоновых кислот, ЦТК) - заключительный этап катаболизма, в котором углерод ацетильного остатка ацетил-КоА окисляется до 2 молекул СО2. Атомы водорода, освобождающиеся в окислительно-восстановительных реакциях, доставляются в ЦПЭ при участии NAD- и FAD-зависимых дегидрогеназ, в результате чего происходят синтез воды и окислительное фосфорилирование АДФ. Связь между атомами углерода в ацетил-КоА устойчива к окислению. В условиях организма окисление ацетильного остатка происходит в несколько этапов, образующих циклический процесс из 8 реакций:

Последовательность реакций цитратного цикла
Образование цитрата

В реакции образования цитрата углеродный атом метильной труппы ацетил-КоА связывается с карбонильной группой оксалоацетата; одновременно расщепляется тиоэфирная связь и освобождается коэнзим A (ΔG0' = -37,6 кДж/моль). Равновесие реакции в клетке сильно сдвинуто вправо, о чём свидетельствует отрицательная величина стандартной свободной энергии. Реакция сопровождается потерей большого количества энергии в виде теплоты. Катализирует реакцию цитрат синтаза, фермент, локализованный в матриксе митохондрий.
Превращение цитрата в изоцитрат

Вторая реакция цитратного цикла - обратимое превращение цитрата в изоцитрат (рис. 6-24). Фермент, катализирующий эту реакцию, назван аконитазой по промежуточному продукту, цис-аконитовой кислоте, которая предположительно образуется в реакции. Однако это соединение не обнаруживается в свободном виде, так как не отделяется от активного центра фермента до завершения реакции.
Окислительное декарбоксилирование изоцитрата

Эту реакцию катализирует изоцитратдегидрогеназа. Существуют 2 формы изоцитратдегидрогеназы: одна содержит в качестве коферментa NAD+, вторая - NADP+. NAD-зависимый фермент локализован в митохондриях и участвует в ЦТК; NADP-зависимый фермент, присутствующий и в митохондриях, и в цитоплазме, играет иную метаболическую роль, В результате действия этого фермента на изоцитрат образуется α-кетоглутарат Реакция, катализируемая NAD-зависимой изоцитратдегидрогеназой, - самая медленная реакция цитратного цикла. АДФ - аллостерический активатор фермента.
Окислительное декарбоксилирование α-кетоглутарата

В этой реакции α-кетоглутарат подвергается окислительному декарбоксилированию с образованием в качестве конечных продуктов сук-цинил-КоА, СО2 и NADH + Н+. В результате этой реакции образуется сукцинил-КоА Реакцию катализирует α-кетоглутаратдегидрогеназный комплекс, который по структуре и функциям сходен с пируватдегидрогеназным комплексом (ПДК). Подобно ПДК, он состоит из 3 ферментов: α-кетоглутаратдекарбоксилазы, дигидролипоилтранссукцинилазы и дигидролипоилдегидрогеназы. Кроме того, в этот ферментный комплекс входят 5 коферментов: тиаминдифосфат, кофермент А, липоевая кислота, NAD+ и FAD. Существенное отличие этой ферментной системы от ПДК - то, что она не имеет сложного механизма регуляции, какой характерен для ПДК. В частности, в этом комплексе отсутствуют регуляторные субъединицы. Равновесие реакции окислительного декарбоксилирования α-кетоглутарата сильно сдвинуто в сторону образования сукцинил-КоА, и её можно считать однонаправленной.
Превращение сукцинил-КоА в сукцинат

Сукцинил-КоА - высокоэнергетическое соединение. Изменение свободной энергии гидролиза этого тиоэфира составляет ΔG0'= -35,7 кДж/моль. В митохондриях разрыв тиоэфирной связи сук-цинил-КоА сопряжён с реакцией фосфорилирования гуанозиндифосфата (ГДФ) до гуанозинтрифосфата (ГТФ).
Сукцинил-КоА → Сукцинат (ΔG0 = -10,36 кДж/моль).
Эту сопряжённую реакцию катализирует сукцинаттиокиназа. Промежуточный этап реакции - фосфорилирование молекулы фермента по одному из гистидиновых остатков активного центра. Затем остаток фосфорной кислоты присоединяется к ГДФ с образованием ГТФ. С ГТФ концевая фосфатная группа может переноситься на АДФ с образованием АТФ; эту обратимую реакцию катализирует нуклеозид-дифосфаткиназа.
ГТФ + АДФ ↔ ГДФ + АТФ.
Образование высокоэнергетической фосфо-ангидридной связи за счёт энергии субстрата (сукцинил-КоА) - пример субстратного фосфорилирования.
Дегидрирование сукцината

Образовавшийся на предьщущем этапе сукцинат превращается в фумарат под действием сукцинатдегидрогеназы. Этот фермент - флавопротеин, молекула которого содержит прочно связанный кофермент FAD. Сукцинат дегидрогеназа прочно связана с внутренней митохондриальной мембраной. Она состоит из 2 субъединиц, одна из которых связана с FAD. Кроме того, обе субъединицы содержат железо-серные центры; одна - Fe2S2, a другая - Fe4S4. В железо-серных центрах атомы железа меняют свою валентность, участвуя в транспорте электронов.
Образование малата из фумарата

Образование малата происходит при участии фермента фумаратгидратазы. Этот фермент более известен как фумараза. Фумараза - олигомерный белок, состоящий из 4 идентичных полипептидных цепей. Он расположен в матриксе митохондрий. Фумаразу относят к ферментам с абсолютной субстратной специфичностью: она катализирует гидратацию только транс-формы фумарата.
Дегидрирование малата

В заключительной стадии цитратного цикла малат дегидрируется с образованием оксалоа-цетата. Реакцию катализирует NAD-зависимая малатдегидрогеназа, содержащаяся в матриксе митохондрий. Равновесие малатдегидрогеназной реакции сильно сдвинуто влево. Тем не менее, в интактных клетках эта реакция идёт слева направо, потому что продукт реакции, оксалоацетат, активно используется в цитратсинтазной реакции. В цитозоле содержится изоформа малат-дегидрогеназы, также NAD-зависимая, но не принимающая участие в цитратном цикле. Обе изоформы малатдегидрогеназы - димеры.

46.Механизмы регуляции цитратного цикла. Анаболические функции цикла лимонной кислоты. Реакции, пополняющие цитратный цикл
Регуляция цитратного цикла. В большинстве случаев скорость реакций в метаболических циклах определяется их начальными реакциями. В ЦТК важнейшая регуляторная реакция - образование цитрата из оксалоацетата и ацетил-КоА, катализируемая цитратсинтазой. Эта реакция ускоряется при повышении концентрации оксалоацетата - субстрата реакции и тормозится продуктом реакции - цитратом. Когда отношение NADH/NAD+ снижается, скорость окисления маната в оксалоацетат возрастает. Повышение концентрации оксалоацетата ускоряет цитратсинтазную реакцию. Скорость реакции снижается при повышении концентрации АТФ, сукцинил-КоА и длинноцепочечных жирных кислот. Однако точный механизм влияния этих метаболитов на цитратсинтазу недостаточно ясен. Изоцитратдегидрогеназа, олигомерный фермент, состоит из 8 субъединиц. Присоединение изоцитрата к первой субъединице вызывает кооперативное изменение конформации других, увеличивая скорость присоединения субстрата. Фермент аллостерически активируется АДФ и Са2+, которые присоединяются к ферменту в разных аллостерических центрах. В присутствии АДФ конформация всех субъединиц меняется таким образом, что связывание изоцитрата происходит значительно быстрее. Таким образом, при концентрации изоцитрата, которая существует в митохондриальном матриксе, небольшие изменения концентрации АДФ могут вызвать значительное изменение скорости реакции. Увеличение активности изоцитратдегидрогеназы снижает концентрацию цитрата, что, в свою очередь, уменьшает ингибирование цитратсинтазы продуктом реакции. При повышении концентрации NADH активность фермента снижается. α-Кетоглутаратдегидрогеназный комплекс, имеющий сходное строение с пируватдегидрогеназным, в отличие от последнего, не имеет в своём составе регуляторных субъединиц. Главный механизм регуляции α-кетоглутаратдегидрогеназного комплекса - ингибирование реакции NADH и сукцинил-КоА. α-Кетоглутаратдегидрогеназный комплекс, как и Изоцитратдегидрогеназа, активируется Са2+, а при повышении концентрации АТФ скорости обеих реакций снижаются. В регуляции цитратного цикла существует множество дополнительных механизмов, обеспечивающих необходимый уровень метаболитов и их участие в других метаболических путях. Компартментализация ферментов, участвующих в реакциях окислительного декарбоксилирования пирувата и цикла лимонной кислоты, играет важную роль в регуляции этих процессов. Внутренняя мембрана митохондрий непроницаема для анионов и катионов, в том числе и для промежуточных продуктов цитратного цикла, которые могут быть перенесены через мембрану только при участии специальных белков. Поэтому ферменты цитратного цикла имеют больше возможностей для взаимодействия с продуктами предыдущих реакций, чем в случае свободного удаления этих продуктов из митохондрий. Доступность субстратов возрастает также в результате образования ферментных комплексов. Малатдегидрогеназа и цитратсинтаза образуют непрочные комплексы, в которых цитратсинтаза может использовать оксалоацетат, непосредственно образующийся малатдегидрогеназой. В ПДК и α-кетоглутаратдегидрогеназном комплексе субстраты непосредственно передаются от одного фермента к другому: только транса-цилаза может взаимодействовать с промежуточным продуктом, связанным с ТДФ, а дигидролипоилдегидрогеназа - с дигидролипоевой кислотой.

NAD+, NADH, КоА, ацетил-КоА и сукцинил-КоА не имеют транспортных белков в мембране митохондрий. Поэтому эти соединения не могут пройти через митохондриальную мембрану. Накопление ацил-КоА производных, таких как ацетил-КоА или сукцинил-КоА, в митохондриальном матриксе ингибирует другие реакции, для которых необходим КоА. Тесная связь цитратного цикла и ЦГКЭ поддерживается благодаря использованию в этих реакциях общего фонда NAD+ и NADH.
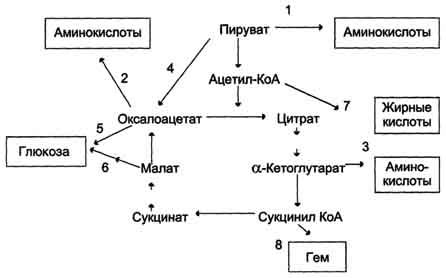
47.Основные углеводы животных, их содержание в тканях, биологическая роль. Основные углеводы пищи. Переваривание углеводов
Гликоген – главный резервный полисахарид высших животных и человека, построенный из остатков D-глюкозы. Эмпирическая формулагликогена, как и крахмала, (С6Н10О5)n. Гликоген содержится практически во всех органах и тканях животных и человека; наибольшее количество обнаружено в печени и мышцах. Молекулярная масса гликогена 105–108 Да и более. Его молекула построена из ветвящихся полиглюкозидных цепей, в которых остатки глюкозы соединены α-1–>4-гликозидными связями. В точках ветвления имеются α-1–>6-гликозидные связи. По строению гликоген близок к амилопектину. В молекуле гликогена различают внутренние ветви – участки от периферической точки ветвления до нередуцирующего конца цепи. Гликоген характеризуется более разветвленной структурой, чем амилопектин; линейные отрезки в молекуле гликогена включают 11–18 остатков α-D-глюкопиранозы.
При гидролизе гликоген, подобно крахмалу, расщепляется с образованием сначала декстринов, затем мальтозы и, наконец, глюкозы.
Различают шесть основных классов гликозаминогликанов . Каждый из гликозаминогликанов содержит характерную для него повторяющуюся дисахаридную единицу; во всех случаях (кроме кератансульфатов) эта единица содержит либо глюкуроновую, либо идуроновую кислоту. Все гликозаминогликаны, за исключением гиалуроновой кислоты, содержат остатки моносахаридов с О- или N-сульфатной группой. Гликозаминогликаны значительно различаются по размерам, их молекулярные массы в пределах от 104 Да для гепарина до 107 Да для гиалуроновой кислоты.
Выделенные индивидуальные гликозаминогликаны могут содержать смесь цепей различной длины. Гликозаминогликаны как основное скрепляющее вещество связаны со структурными компонентами костей и соединительной ткани. Их функция состоит также в удержании большой массы воды и в заполнении межклеточного пространства. Иными словами, гликозаминогликаны – основной компонент внеклеточного вещества – жела-тинообразного вещества, заполняющего межклеточное пространство тканей. Они также содержатся в больших количествах в синовиальной жидкости – это вязкий материал, окружающий суставы, который служит смазкой и амортизатором. Поскольку водные растворы гликозаминогликанов гелеобразны, их называют мукополисахаридами.
Наконец, если цепи гликозаминогликана присоединены к белковой молекуле, соответствующее соединение называют протеогликаном.
Протеогликаны образуют основное вещество внеклеточного матрикса. В отличие от простых гликопротеинов, которые содержат только несколько процентов углеводов (по массе), протеогликаны могут содержать до 95% (и более) углеводов.
Крахмал - наиболее важный углеводный компонент пищевого рациона. Это резервный полисахарид растений, содержащийся в наибольшем количестве (до 45% от массы сухого вещества) в зёрнах злаков (пшеница, кукуруза, рис и др.), а также луковицах, стеблях и клубнях растений (в картофеле примерно 65%). Крахмал - разветвлённый полисахарид, состоящий из остатков глюкозы (гомогликан). Он находится в клетках растений в виде гранул, практически нерастворим в воде. Крахмал состоит из амилозы и амилопектина. Амилоза - неразветвлённый полисахарид, включающий 200-300 остатков глюкозы, связанных α-1,4-гликозидной связью. Благодаря α-конфигурации глюкозного остатка, полисахаридная цепь имеет конформацию спирали. Синяя окраска при добавлении йода к раствору крахмала обусловлена наличием такой спирали. Амилопектин имеет разветвлённую структуру. В местах ветвления остатки глюкозы соединены α-1,6-гликозидными связями. Линейные участки содержат примерно 20-25 остатков глюкозы. При этом формируется древовидная структура, в которой имеется лишь одна аномерная ОН-группа. Крахмал - высокомолекулярное соединение, включающее сотни тысяч остатков глюкозы. Его молекулярная масса составляет порядка 105-108 Д.
Биологическое значение углеводов:
Углеводы выполняют структурную функцию, то есть участвуют в построении различных клеточных структур (например, клеточных стенок растений).
Углеводы выполняют защитную роль у растений (клеточные стенки, состоящие из клеточных стенок мертвых клеток защитные образования — шипы, колючки и др.).
Углеводы выполняют пластическую функцию — хранятся в виде запаса питательных веществ, а также входят в состав сложных молекул (например, пентозы (рибоза идезоксирибоза) участвуют в построении АТФ, ДНК и РНК.
Углеводы являются основным энергетическим материалом. При окислении 1 грамма углеводов выделяются 4,1 ккал энергии и 0,4 г воды.
Углеводы участвуют в обеспечении осмотического давления и осморегуляции. Так, в крови содержится 100—110 мг/% глюкозы. От концентрации глюкозы зависитосмотическое давление крови.
Углеводы выполняют рецепторную функцию — многие олигосахариды входят в состав воспринимающей части клеточных рецепторов или молекул-лигандов.

48.Глюкоза как важнейший метаболит углеводного обмена. Общая схема источников и путей расходования глюкозы в организме
Глюкоза является альдогексозой. Она может существовать в линейной и циклической формах. Циклическая форма глюкозы, предпочтительная в термодинамическом отношении, обусловливает химические свойства глюкозы. Как и все гексозы, глюкоза имеет 4 асимметричных углеродных атома, обусловливающих наличие сте-реоизомеров. Возможно образование 16 стереоизомеров, наиболее важные из которых D- и L-глюкоза. Эти типы изомеров зеркально отображают друг друга. Расположение Н- и ОН-групп относительно пятого углеродного атома определяет принадлежность глюкозы к D- или L-ряду. В организме млекопитающих моносахариды находятся в D-конфигурации, так как к этой форме глюкозы специфичны ферменты, катализирующие её превращения. В растворе при образовании циклической формы моносахарида образуются ещё 2 изомера (α- и β-изомеры), называемые аномерами, обозначающие определённую конформацию Н- и ОН-групп относительно С, У α-D-глюкозы ОН-группа располагается ниже плоскости кольца, а у β-D-глюкозы, наоборот, над плоскостью кольца. Поскольку в составе основных углеводов пищи преобладает глюкоза, её можно считать основным продуктом переваривания углеводов. Другие моносахариды, поступающие из кишечника в процессе метаболизма, могут превращаться в глюкозу или продукты её метаболизма. Часть глюкозы в печени депонируется в виде гликогена, а другая часть через общий кровоток доставляется и используется разными тканями и органами. При нормальном рационе питания концентрация глюкозы в крови поддерживается на уровне -3,3-5,5 ммоль/л (60-100 мг/дл). А в период пищеварения её концентрация может повышаться примерно до 150 мг/дл (8 ммоль/л).
Фософорилирование глюкозы В дальнейших превращениях в клетках глюкоза и другие моносахариды участвуют только в виде фосфорных эфиров. Фосфорилирование свободных моносахаридов - обязательная реакция на пути их использования, она приводит к образованию более реакционно-способных соединений и поэтому может рассматриваться как реакция активации. Глюкоза, поступающая в клетки органов и тканей, сразу же подвергается фосфорилированию с использованием АТФ. Эту реакцию во многих тканях катализирует фермент гексокиназа, а в печени и поджелудочной железе - фермент глюкокиназа. Фосфорилирование глюкозы - практически необратимая реакция, так как она протекает с использованием значительного количества энергии. Образование глюкозо-6-фосфата в клетке - своеобразная "ловушка" для глюкозы, так как мембрана клетки непроницаема для фосфорилированной глюкозы (нет соответствующих транспортных белков). Кроме того, Фосфорилирование уменьшает концентрацию свободной глюкозы в цитоплазме. В результате создаются благоприятные условия для облегчённой диффузии глюкозы в клетки из крови.
Глюкокиназа. Фосфорилирование глюкозы в гепатоцитах в период пищеварения обеспечивается свойствами глюкокиназы, которая имеет высокое значение Кm - 10 ммоль/л. В этот период концентрация глюкозы в воротной вене больше, чем в других отделах кровяного русла и может превышать 10 ммоль/л, а следовательно, активность глюкокиназы в гепатоцитах повышается. Следует отметить, что активность глюкокиназы, в отличие от гексокиназы, не ингибируется продуктом катализируемой реакции - глюкозо-6-фосфатом. Это обстоятельство обеспечивает повышение концентрации глюкозы в клетке в фосфорилированной форме, соответственно её уровню в крови. Как уже упоминалось, глюкоза проникает в гепатоциты путём облегчённой диффузии при участии транспортёра ГЛЮТ-2 (независимого от инсулина). ГЛЮТ-2, так же, как глюкокиназа, имеет высокую Кm, что способствует повышению скорости поступления глюкозы в гепатоциты в период пищеварения, следовательно, ускоряет её фосфорилирование и дальнейшее использование для депонирования. Хотя инсулин и не влияет на транспорт глюкозы, он усиливает приток глюкозы в гепатоциты в период пищеварения косвенным путём, индуцируя синтез глюкокиназы и ускоряя тем самым Фосфорилирование глюкозы. Преимущественное потребление глюкозы гепатоцитами, обусловленное свойствами глюкокиназы, предотвращает чрезмерное повышение её концентрации в крови в абсорбтивном периоде. Это, в свою очередь, снижает последствия протекания нежелательных реакций с участием глюкозы, например гликозилирования белков.
Гексокиназа отличается от глюкокиназы высоким сродством к глюкозе (Кm <0,1 ммоль/л). Следовательно, этот фермент, в отличие от глюкокиназы, активен при низкой концентрации глюкозы в крови, что характерно для постабсорбтивного состояния. Печень в этот период поглощает гораздо меньше глюкозы, так как скорость её внутриклеточного фосфорилирования глюкокиназой резко снижается. Тогда как потребление глюкозы мозгом, эритроцитами и другими тканями обеспечивается активной в этих условиях гексокиназой. Фермент гексокиназа может катализировать фосфорилирование не только D-глюкозы, но и других гексоз, хотя и с меньшей скоростью. Активность гексокиназы изменяется в зависимости от потребностей клетки в энергии. В качестве регуляторов выступают соотношение АТФ/АДФ и внутриклеточный уровень глюкозо-6-фосфата (продукта катализируемой реакции). При снижении расхода энергии в клетке повышается уровень АТФ (относительно АДФ) и глюкозо-6-фосфата. В этом случае активность гексокиназы снижается, и, следовательно, уменьшается скорость поступления глюкозы в клетку. Следует отметить, что в разных тканях гексокиназа присутствует в различных изоформах, отличающихся величиной Кm. Глюкокиназа печени (и почек) является изоформой IV (гексокиназа IV). В клетках мышц содержится гексокиназа II, а в клетках опухолевых тканей преобладает гексокиназа III, с более высоким, чем у гексокиназы II, сродством к глюкозе.
Дефосфорилирование глюкозо-6-фосфата Превращение глюкозо-6-фосфата в глюкозу возможно в печени, почках и клетках эпителия кишечника. В клетках этих органов имеется фермент глюкозо-6-фосфатаза, катализирующая отщепление фосфатной группы гидролитическим путём:
Глюкозо-6-фосфат +Н2О → Глюкоза + Н3РО4
Образовавшаяся свободная глюкоза способна диффундировать из этих органов в кровь. В других органах и тканях глюкозо-6-фосфатазы нет, и поэтому дефосфорилирование глюкозо-6-фосфата невозможно. Пример подобного необратимого проникновения глюкозы в клетку - мышцы, где глюкозо-6-фосфат может использоваться только в метаболизме этой клетки.
Метаболизм глюкозо-6-фосфата Глюкозо-6-фосфат может использоваться в клетке в различных превращениях, основными из которых являются: синтез гликогена, катаболизм с образованием СО2 и Н2О или лактата, синтез пентоз. Распад глюкозы до конечных продуктов служит источником энергии для организма. Вместе с тем в процессе метаболизма глюкозо-6-фосфата образуются промежуточные продукты, используемые в дальнейшем для синтеза аминокислот, нуклеотидов, глицерина и жирных кислот. Таким образом, глюкозо-6-фосфат - не только субстрат для окисления, но и строительный материал для синтеза новых соединений
 .
.
49. Аэробный распад — основной путь катаболизма глюкозы у человека и других аэробных организмов. Последовательность реакций до образования пирувата (аэробный гликолиз).

Аэробный распад глюкозы можно выразить суммарным уравнением:
С6Н12О6 + 6 О2 → 6 СО2 + Н2О + 2820 кДж/моль.
Этот процесс включает несколько стадий:
Аэробный гликолиз - процесс окисления глюкозы с образованием двух молекул пирувата;
Общий путь катаболизма, включающий превращение пирувата в ацетил-КоА и его дальнейшее окисление в цитратом цикле;
ЦПЭ на кислород, сопряжённая с реакциями дегидрирования, происходящими в процессе распада глюкозы.
Аэробным гликолизом называют процесс окисления глюкозы до пировиноградной кислоты, протекающий в присутствии кислорода. Все ферменты, катализирующие реакции этого процесса, локализованы в цитозоле клетки.
Этапы аэробного гликолиза
В аэробном гликолизе можно выделить 2 этапа.
Подготовительный этап, в ходе которого глюкоза фосфорилируется и расщепляется на две молекулы фосфотриоз. Эта серия реакций протекает с использованием 2 молекул АТФ.
Этап, сопряжённый с синтезом АТФ. В результате этой серии реакций фосфотриозы превращаются в пируват. Энергия, высвобождающаяся на этом этапе, используется для синтеза 10 моль АТФ.
Реакции аэробного гликолиза
Превращение глюкозо-6-фосфата в 2 молекулы глицеральдегид-3-фосфата Глюкозо-6-фосфат, образованный в результате фосфорилирования глюкозы с участием АТФ, в ходе следующей реакции превращается в фруктозо-6-фосфат. Эта обратимая реакция изомеризации протекает под действием фермента глюкозофосфатизомеразы.
Затем следует ещё одна реакция фосфорилирования с использованием фосфатного остатка и энергии АТФ. В ходе этой реакции, катализируемой фосфофруктокиназой, фруктозо-6-фосфат превращается в фруктозо-1,6-бисфосфат. Данная реакция, так же, как гексокиназная, практически необратима, и, кроме того, она наиболее медленная из всех реакций гликолиза. Реакция, катализируемая фосфофруктокиназой, определяет скорость всего гликолиза, поэтому, регулируя активность фосфофруктокиназы, можно изменять скорость катаболизма глюкозы.
Фруктозо-1,6-бисфосфат далее расщепляется на 2 триозофосфата: глицеральдегид-3-фосфат и дигидроксиацетонфосфат. Реакцию катализирует фермент фруктозобисфосфатальдолаза, или просто альдолаза. Этот фермент катализирует как реакцию альдольного расщепления, так и альдольной конденсации, т.е. обратимую реакцию. Продукты реакции альдольного расщепления - изомеры. В последующих реакциях гликолиза используется только глицеральдегид-3-фосфат, поэтому дигидроксиацетонфосфат превращается с участием фермента триозофосфатизомеразы в глицероальдегид-3-фосфат. В описанной серии реакций дважды происходит фосфорилирование с использованием АТФ. Однако расходование двух молекул АТФ (на одну молекулу глюкозы) далее будет компенсировано синтезом большего количества АТФ
Превращение глицеральдегид-3-фосфата в пируват Эта часть аэробного гликолиза включает реакции, связанные с синтезом АТФ. Наиболее сложной в данной серии реакций является реакция превращения глицеральдегид-3-фосфата в 1,3-бисфосфоглицерат. Это превращение - первая реакция окисления в ходе гликолиза. Реакцию катализирует глицеральдегид-3-фосфатдегидрогеназа, которая является NAD-зависимым ферментом. Значение данной реакции заключается не только в том, что образуется восстановленный кофермент, окисление которого в дыхательной цепи сопряжено с синтезом АТФ, но также и в том, что свободная энергия окисления концентрируется в макроэргической связи продукта реакции. Глицеральдегид- 3 -фосфатдегидрогеназа содержит в активном центре остаток цистеина, сульфгидрильная группа которого принимает непосредственное участие в катализе. Окисление глицеральдегид-3-фосфата приводит к восстановлению NAD и образованию с участием Н3РО4 высокоэнергетической ангидридной связи в 1,3-бисфосфоглицерате в положении 1. В следующей реакции высокоэнергетический фосфат передаётся на АДФ с образованием АТФ. Фермент, катализирующий это превращение, назван по обратной реакции фосфоглицераткиназой (киназы называются по субстрату, находящемуся в уравнении реакции по одну сторону с АТФ).
Образование АТФ описанным способом не связано с дыхательной цепью, и его называют субстратным фосфорилированием АДФ. Образованный 3-фосфоглицерат уже не содержит макроэргической связи. В следующих реакциях происходят внутримолекулярные перестройки, смысл которых сводится к тому, что низкоэнергетический фосфоэфир переходит в соединение, содержащее высокоэнергетический фосфат. Внутримолекулярные преобразования заключаются в переносе фосфатного остатка из положения 3 в фосфоглицерате в положение 2. Затем от образовавшегося 2-фосфоглицерата отщепляется молекула воды при участии фермента енолазы. Название дегидратирующего фермента дано по обратной реакции. В результате реакции образуется замещённый енол - фосфоенолпируват. Образованный фосфоенолпируват - макроэргическое соединение, фосфатная группа которого переносится в следующей реакции на АДФ при участии пируваткиназы (фермент также назван по обратной реакции, в которой происходит фосфорилирование пирувата, хотя подобная реакция в таком виде не имеет места).
Превращение фосфоенолпирувата в пируват - необратимая реакция. Это вторая в ходе гликолиза реакция субстратного фосфорилирования. Образующаяся енольная форма пирувата затем неферментативно переходит в более термодинамически стабильную кетофор-му.
50.Распространение и физиологическое значение аэробного распада глюкозы. Использование глюкозы для синтеза жиров в печени и в жировой ткани.
Основное физиологическое назначение катаболизма глюкозы заключается в использовании энергии, освобождающейся в этом процессе для синтеза АТФ. Энергия, выделяющаяся в процессе полного распада глюкозы до СО2 и Н2О, составляет 2880 кДж/моль. Если эту величину сравнить с энергией гидролиза высокоэнергетических связей
- 38 моль АТФ (50 кДж на моль АТФ), то получим: 50×38 = 1900 кДж, что составляет 65% от всей энергии, выделяющейся при полном распаде глюкозы. Такова эффективность использования энергии распада глюкозы для синтеза АТФ. Необходимо учитывать, что реальная эффективность процесса может быть ниже. Точно оценить выход АТФ можно только при субстратном фосфорилировании, а соотношение между поступлением водорода в дыхательную цепь и синтезом АТФ является приблизительным. Аэробный распад глюкозы происходит во многих органах и тканях и служит основным, хотя и не единственным, источником энергии для жизнедеятельности. Некоторые ткани находятся в наибольшей зависимости от катаболизма глюкозы как источника энергии. Например, клетки мозга расходуют до 100 г глюкозы в сутки, окисляя её аэробным путём. Поэтому недостаточное снабжение мозга глюкозой или гипоксия проявляются симптомами, свидетельствующими о нарушении функций мозга (головокружения, судороги, потеря сознания). Анаэробный распад глюкозы происходит в мышцах, в первые минуты мышечной работы, в эритроцитах (в которых отсутствуют митохондрии), а также в разных органах в условиях ограниченного снабжении их кислородом, в том числе в клетках опухолей. Для метаболизма клеток опухолей характерно ускорение как аэробного, так и анаэробного гликолиза. Но преимущественный анаэробный гликолиз и увеличение синтеза лактата служит показателем повышенной скорости деления клеток при недостаточной обеспеченности их системой кровеносных сосудов. Кроме энергетической функции, процесс катаболизма глюкозы может выполнять и анаболические функции. Метаболиты гликолиза используются для синтеза новых соединений. Фруктозо-6-фосфат и глицеральдегид-3-фосфат участвуют в образовании рибозо-5-фосфата - структурного компонента нуклеотидов; 3-фосфоглицерат может включаться в синтез аминокислот, таких как серии, глицин, цистеин. В печени и жировой ткани ацетил-КоА, образующийся из пирувата, используется как субстрат при биосинтезе жирных кислот, холестерина, а дигидроксиацетонфосфат как субстрат для синтеза глицерол-3-фосфата .
Окислительный этап образования пентоз и неокислительный этап (путь возвращения пентоз в гексозы) составляют вместе циклический процесс. Такой процесс можно описать общим уравнением:
6 Глюкозо-6-фосфат + 12 NADP+ + 2 Н2О → 5 Глюкозо-6-фосфат + 12 NADPH +12 Н+ + 6 СO2.
Это означает, что из 6 молекул глюкозы образуются 6 молекул рибулозо-5-фосфат (пентозы) и 6 молекул СО2. Ферменты неокислительной фазы превращают 6 молекул рибулозо-5-фосфат в 5 молекул глюкозы (гексозы). При последовательном проведении этих реакций единственным полезным продуктом является NADPH, образующийся в окислительной фазе пентозофосфатного пути. Такой процесс называют пентозофосфатным циклом Протекание пентозофосфатного цикла позволяет клеткам продуцировать NADPH, необходимый для синтеза жиров, не накапливая пентозы. Энергия, выделяющаяся при распаде глюкозы, трансформируется в энергию высокоэнергетического донора водорода - NADPH. Гидрированный NADPH служит источником водорода для восстановительных синтезов, а энергия NADPH преобразуется и сохраняется во вновь синтезированных веществах, например жирных кислотах, высвобождается при их катаболизме и используется клетками.
51 .Анаэробный распад глюкозы (анаэробный гликолиз). Гликолитическая оксиредукция, пируват как акцептор водорода. Субстратное фосфорилирование. Распространение и физиологическое значение этого пути распада глюкозы.
Анаэробным гликолизом называют процесс расщепления глюкозы с образованием в качестве конечного продукта лактата. Этот процесс протекает без использования кислорода и поэтому не зависит от работы митохондриальной дыхательной цепи. АТФ образуется за счёт реакций субстратного фосфорилирования. Суммарное уравнение процесса:
С6Н1206 + 2 Н3Р04 + 2 АДФ = 2 С3Н6О3 + 2 АТФ + 2 Н2O.
Реакции анаэробного гликолиза При анаэробном гликолизе в цитозоле протекают все 10 реакций, идентичных аэробному гликолизу. Лишь 11-я реакция, где происходит восстановление пирувата цитозольным NADH, является специфической для анаэробного гликолиза (рис. 7-41). Восстановление пирувата в лактат катализирует лактатдегидро-геназа (реакция обратимая, и фермент назван по обратной реакции). С помощью этой реакции обеспечивается регенерация NAD+ из NADH без участия митохондриальной дыхательной цепи в ситуациях, связанных с недостаточным снабжением клеток кислородом. Роль акцептора водорода от NADH (подобно кислороду в дыхательной цепи) выполняет пируват. Таким образом, значение реакции восстановления пирувата заключается не в образовании лактата, а в том, что данная цитозольная реакция обеспечивает регенерацию NAD+. К тому же лактат не является конечным продуктом метаболизма, удаляемым из организма. Это вещество выводится в кровь и утилизируется, превращаясь в печени в глюкозу, или при доступности кислорода превращается в пируват, который вступает в общий путь катаболизма, окисляясь до СО2 и Н2О.

52. Биосинтез глюкозы (глюконеогенез) из аминокислот, глицерина и молочной кислоты. Взаимосвязь гликолиза в мышцах и глюконеогенеза в печени (цикл Кори).
Глюконеогенез - процесс синтеза глюкозы из веществ неуглеводной природы. Его основной функцией является поддержание уровня глюкозы в крови в период длительного голодания и интенсивных физических нагрузок. Процесс протекает в основном в печени и менее интенсивно в корковом веществе почек, а также в слизистой оболочке кишечника. Эти ткани могут обеспечивать синтез 80-100 г глюкозы в сутки. На долю мозга при голодании приходится большая часть потребности организма в глюкозе. Это объясняется тем, что клетки мозга не способны, в отличие от других тканей, обеспечивать потребности в энергии за счёт окисления жирных кислот .Кроме мозга, в глюкозе нуждаются ткани и клетки, в которых аэробный путь распада невозможен или ограничен, например эритроциты (они лишены митохондрий), клетки сетчатки, мозгового слоя надпочечников и др. Первичные субстраты глюконеогенеза - лактат, аминокислоты и глицерол. Включение этих субстратов в глюконеогенез зависит от физиологического состояния организма.
Лактат - продукт анаэробного гликолиза. Он образуется при любых состояниях организма в эритроцитах и работающих мышцах. Таким образом, лактат используется в глюконеогенезе постоянно.
Глицерол высвобождается при гидролизе жиров в жировой ткани в период голодания или при длительной физической нагрузке.
Аминокислоты образуются в результате распада мышечных белков и включаются в глюконеогенез при длительном голодании или продолжительной мышечной работе.
Большинство реакций глюконеогенеза протекает за счёт обратимых реакций гликолиза и катализируется теми же ферментами. Однако 3 реакции гликолиза термодинамически необратимы. На этих стадиях реакции глюконеогенеза протекают другими путями. Необходимо отметить, что гликолиз протекает в цитозоле, а часть реакций глюконеогенеза происходит в митохондриях.

Образование фосфоенолпирувата из пирувата . Образование фосфоенолпирувата из пирувата происходит в ходе двух реакций первая из которых протекает в митохондриях. Пируват, образующийся из лактата или из некоторых аминокислот, транспортируется в матрикс митохондрий и там карбоксилируется с образованием оксалоацетата.
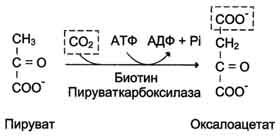
Пируват-карбоксилаза, катализирующая данную реакцию, - митохондриальный фермент, коферментом которого является биотин. Реакция протекает с использованием АТФ.
Дальнейшие превращения оксалоацетата протекают в цитозоле. Следовательно, на этом этапе должна существовать система транспорта оксалоацетата через митохондриальную мембрану, которая для него непроницаема. Оксалоацетат в митохондриальном матриксе восстанавливается с образованием малата при участии NADH (обратная реакция цитратного цикла).

Образовавшийся малат затем проходит через митохондриальную мембрану с помощью специальных переносчиков. Кроме того, оксалоацетат способен транспортироваться из митохондрий в цитозоль в виде аспартата в ходе малат-аспартатного челночного механизма. В цитозоле малат вновь превращается в оксалоацетат в ходе реакции окисления с участием кофермента NAD+. Обе реакции: восстановление оксалоацетата и окисление малага катализируют малатдегидрогеназа, но в первом случае это митохондриальный фермент, а во втором - цитозольный. Образованный в цитозоле из ма-лата оксалоацетат затем превращается в фосфоенолпируват в ходе реакции, катализируемой фосфоенолпируваткарбоксикиназой - ГТФ-зависимым ферментом.
Образование глюкозы из лактата. Лактат, образовавшийся в интенсивно работающих мышцах или в клетках с преобладающим анаэробным способом катаболизма глюкозы, поступает в кровь, а затем в печень. В печени отношение NADH/NAD+ ниже, чем в сокращающейся мышце, поэтому лактатдегидрогеназная реакция протекает в обратном направлении, т.е. в сторону образования пирувата из лактата. Далее пируват включается в глюконеогенез, а образовавшаяся глюкоза поступает в кровь и поглощается скелетными мышцами. Эту последовательность событий называют "глюкозо-лактатным циклом", или "циклом Кори".

Цикл Кори выполняет 2 важнейшие функции: 1 - обеспечивает утилизацию лактата; 2 - предотвращает накопление лактата и, как следствие этого, опасное снижение рН (лактоацидоз). Часть пирувата, образованного из лактата, окисляется печенью до СО2 и Н2О. Энергия окисления может использоваться для синтеза АТФ, необходимого для реакций глюконеогенеза.
Образование глюкозы из аминокислот. Аминокислоты, которые при катаболизме превращаются в пируват или метаболиты цитратного цикла, могут рассматриваться как потенциальные предшественники глюкозы и гликогена и носят название гликогенных. Например, окса-лоацетат, образующийся из аспарагиновой кислоты, является промежуточным продуктом как цитратногр цикла, так и глюконеогенеза. Из всех аминокислот, поступающих в печень, примерно 30% приходится на долю аланина. Это объясняется тем, что при расщеплении мышечных белков образуются аминокислоты, многие из которых превращаются сразу в пируват или сначала в оксалоацетат, а затем в пируват. Последний превращается в аланин, приобретая аминогруппу от других аминокислот. Аланин из мышц переносится кровью в печень, где снова преобразуется в пируват, который частично окисляется и частично включается в глюкозонеогенез. Следовательно, существует следующая последовательность событий (глюкозо-аланиновый цикл): глюкоза в мышцах → пируват в мышцах → аланин в мышцах → аланин в печени → глюкоза в печени → глюкоза в мышцах. Весь цикл не приводит к увеличению количества глюкозы в мышцах, но он решает проблемы транспорта аминного азота из мышц в печень и предотвращает лактоацидоз.

Образование глюкозы из глицерола. Глицерол образуется при гидролизе триацил-глицеролов, главным образом в жировой ткани. Использовать его могут только те ткани, в которых имеется фермент глицерол киназа, например печень, почки. Этот АТФ-зависимый фермент катализирует превращение глицерола в α-глицерофосфат (глицерол-3-фосфат). При включении глицерол-3-фосфата в глюконеогенез происходит его дегидрирование NAD-зависимой дегидрогеназой с образованием дигидроксиацетонфосфата, который далее превращается в глюкозу.

53. Представление о пентозофосфатном пути превращений глюкозы. Окислительные реакции (до стадии рибулозо-5-фосфата). Распространение и суммарные результаты этого пути (образование пентоз, НАДФН и энергетика)
Пентозофосфатный путь, называемый также гексомонофосфатным шунтом, служит альтернативным путём окисления глюкозо-6-фосфата. Пентозофосфатный путь состоит из 2 фаз (частей) - окислительной и неокислительной.
В окислительной фазе глюкозо-6-фосфат необратимо окисляется в пентозу - рибулозо-5-фосфат, и образуется восстановленный NADPH. В неокислительной фазе рибулозо-5-фосфат обратимо превращается в рибозо-5-фосфат и метаболиты гликолиза. Пентозофосфатный путь обеспечивает клетки рибозой для синтеза пуриновых и пиримидиновых нуклеотидов и гидрированным коферментом NADPH, который используется в восстановительных процессах. Суммарное уравнение пентозофосфатного пути выражается следующим образом:
3 Глюкозо-6-фосфат + 6 NADP+ → 3 СО2 + 6 (NADPH + Н+) + 2 Фруктозо-6-фосфат + Глицеральдегид- 3 -фосфат.
Ферменты пентозофосфатного пути, так же, как и ферменты гликолиза, локализованы в цитозоле. Наиболее активно пентозофосфатный путь протекает в жировой ткани, печени, коре надпочечников, эритроцитах, молочной железе в период лактации, семенниках.
В окислительной части пентозофосфатного пути глюкозо-6-фосфат подвергается окислительному декарбоксилированию, в результате которого образуются пентозы. Этот этап включает 2 реакции дегидрирования.
Первая реакция дегидрирования - превращение глюкозо-6-фосфата в глюконолактон-6-фосфат - катализируется NАDР+-зависимой глюкозо-6-фосфатдегидрогеназой и сопровождается окислением альдегидной группы у первого атома углерода и образованием одной молекулы восстановленного кофермента NADPH. Далее глюконолактон-6-фосфат быстро превращается в 6-фосфоглюконат при участии фермента глюконолактонгидратазы. Фермент 6-фосфоглюконатдегидрогеназа катализирует вторую реакцию дегидрирования окислительной части, в ходе которой происходит также и декарбоксилирование. При этом углеродная цепь укорачивается на один атом углерода, образуется рибулозо-5-фосфат и вторая молекула гидрированного NADPH. Восстановленный NADPH ингибирует первый фермент окислительного этапа пентозофосфатного пути - глюкозо-6-фосфатдегидрогеназу. Превращение NADPH в окисленное состояние NADP+ приводит к ослаблению ингибирования фермента. При этом скорость соответствующей реакции возрастает, и образуется большее количество NADPH.
Суммарное уравнение окислительного этапа пентозофосфатного пути можно представить в виде:
Глюкозо-6-фосфат + 2 NADP+ + Н2О → Рибулозо-5-фосфат + 2 NADPH + Н+ + СО2.
Реакции окислительного этапа служат основным источником NADPH в клетках. Гидрированные коферменты снабжают водородом биосинтетические процессы, окислительно-восстановительные реакции, включающие защиту клеток от активных форм кислорода.

Окислительный этап образования пентоз и неокислительный этап (путь возвращения пентоз в гексозы) составляют вместе циклический процесс. Такой процесс можно описать общим уравнением:
6 Глюкозо-6-фосфат + 12 NADP+ + 2 Н2О → 5 Глюкозо-6-фосфат + 12 NADPH +12 Н+ + 6 СO2.
Это означает, что из 6 молекул глюкозы образуются 6 молекул рибулозо-5-фосфат (пентозы) и 6 молекул СО2. Ферменты неокислительной фазы превращают 6 молекул рибулозо-5-фосфат в 5 молекул глюкозы (гексозы). При последовательном проведении этих реакций единственным полезным продуктом является NADPH, образующийся в окислительной фазе пентозофосфатного пути. Такой процесс называют пентозофосфатным циклом. Протекание пентозофосфатного цикла позволяет клеткам продуцировать NADPH, необходимый для синтеза жиров, не накапливая пентозы.
Энергия, выделяющаяся при распаде глюкозы, трансформируется в энергию высокоэнергетического донора водорода - NADPH. Гидрированный NADPH служит источником водорода для восстановительных синтезов, а энергия NADPH преобразуется и сохраняется во вновь синтезированных веществах, например жирных кислотах, высвобождается при их катаболизме и используется клетками.
54. Свойства и распространение гликогена как резервного полисахарида. Биосинтез гликогена. Мобилизация гликогена.
Гликоген - разветвлённый гомополимер глюкозы, в котором остатки глюкозы соединены в линейных участках α-1,4-гликозидной связью. В точках ветвления мономеры соединены α-1,6-гликозидными связями. Эти связи образуются примерно с каждым десятым остатком глюкозы. Следовательно, точки ветвления в гликогене встречаются примерно через каждые десять остатков глюкозы. Так возникает древообразная структура с молекулярной массой >107Д, что соответствует приблизительно 50 000 остатков глюкозы. Таким образом, в молекуле гликогена имеется только одна свободная аномерная ОН-группа и, следовательно, только один восстанавливающий (редуцирующий) конец. В клетках животных гликоген - основной резервный полисахарид. При полимеризации глюкозы снижается растворимость образующейся молекулы гликогена и, следовательно, её влияние на осмотическое давление в клетке. Это обстоятельство объясняет, почему в клетке депонируется гликоген, а не свободная глюкоза. Гликоген хранится в цитозоле клетки в форме гранул диаметром 10-40 нм. С гранулами связаны и некоторые ферменты, участвующие в метаболизме гликогена, что облегчает их взаимодействие с субстратом. Разветвлённая структура гликогена обусловливает большое количество концевых мономеров, что способствует работе ферментов, отщепляющих или присоединяющих мономеры при распаде или синтезе гликогена, так как эти ферменты могут одновременно работать на нескольких ветвях молекулы. Гликоген депонируется главным образом в печени и скелетных мышцах. Распад гликогена печени служит в основном для поддержания уровня глюкозы в крови в постабсорбтивном периоде. Поэтому содержание гликогена в печени изменяется в зависимости от ритма питания. При длительном голодании оно снижается почти до нуля. Гликоген мышц служит резервом глюкозы - источника энергии при мышечном сокращении. Мышечный гликоген не используется для поддержания уровня глюкозы в крови. Как уже упоминалось ранее, в клетках мышц нет фермента глюкозо-6-фосфатазы, и образование свободной глюкозы невозможно. Расход гликогена в мышцах зависит в основном от физической нагрузки.
Гликоген синтезируется в период пищеварения (через 1-2 ч после приёма углеводной пищи). Следует отметить, что синтез гликогена из глюкозы как и любой анаболический процесс, является эндергоническим, т.е. требующим затрат энергии. Глюкоза, поступающая в клетку, фосфорилируется при участии АТФ (реакция 1). Затем глюкозо-6-фосфат в ходе обратимой реакции превращается в глюкозо-1 -фосфат (реакция 2) под действием фермента фосфоглюкомутазы. Глюкозо-1-фосфат по термодинамическому состоянию мог бы служить субстратом для синтеза гликогена. Но в силу обратимости реакции глюкозо-6-фосфат ↔ глюкозо-1-фосфат синтез гликогена из глюкозо-1-фосфата и его распад оказались бы также обратимыми и поэтому неконтролируемыми. Чтобы синтез гликогена был термодинамически необратимым, необходима дополнительная стадия образования уридинди-фосфатглюкозы из УТФ и глюкозо-1-фосфата (реакция 3). Фермент, катализирующий эту реакцию, назван по обратной реакции: УДФ-глюкопирофосфорилаза. Однако в клетке обратная реакция не протекает, потому что образовавшийся в ходе прямой реакции пирофосфат очень быстро расщепляется пирофосфатазой на 2 молекулы фосфата.

Образованная УДФ-глюкоза далее используется как донор остатка глюкозы при синтезе гликогена (реакция 4). Эту реакцию катализирует фермент гликогенсинтаза (глюкозилтрансфераза). Поскольку в данной реакции не используется АТФ, фермент называют синтазой, а не синтетазой.

Распад гликогена или его мобилизация происходят в ответ на повышение потребности организма в глюкозе. Гликоген печени распадается в основном в интервалах между приёмами пищи, кроме того, этот процесс в печени и мышцах ускоряется во время физической работы. Распад гликогена происходит путём последовательного отщепления остатков глюкозы в виде глюкозо-1-фосфата. Гликозидная связь расщепляется с использованием неорганического фосфата, поэтому процесс называется фосфоролизом, а фермент гликогенфосфорилазой. Так же как и синтез, расщепление гликогена начинается с нередуцирующего конца полисахаридной цепи. При этом наличие разветвлённой структуры гликогена облегчает быстрое высвобождение глюкозных остатков, так как чем больше концов имеет молекула гликогена, тем больше молекул гликогенфосфорилазы могут действовать одновременно. Гликогенфосфорилаза расщепляет только α-1,4-гликозидные связи (реакция 1). Последовательное отщепление глюкозных остатков прекращается, когда до точки ветвления остаётся 4 мономера. Подобная особенность в действии гликогенфосфорилазы обусловлена размером и строением её активного центра. Дальнейший распад гликогена требует участия двух других ферментов. Сначала три оставшихся до точки ветвлении глюкозных остатка переносятся при участии олигосахаридтрансферазы (реакция 2) на нередуцирующий конец соседней цепи, удлиняя её и таким образом создавая условия для действия фосфорилазы. Оставшийся в точке ветвления глюкозный остаток гидролитически отщепляется с помощью α-1,6-глюкозидазы в виде свободной глюкозы (реакция 3), после чего неразветвлённый участок гликогена может вновь атаковаться фосфорилазой. Считают, что перенос трёх остатков глюкозы и удаление мономера из точки ветвления (реакции 2 и 3) катализирует один и тот же фермент, который обладает двумя разными ферментативными активностями - трансферазной и гликозидазной. Его называют "деветвящим" ферментом Продукт действия гликогенфосфорилазы - глюкозо-1-фосфат - затем изомеризуется в глюкозо-6-фосфат фосфоглюкомутазой. Далее глюкозо-6-фосфат включается в процесс катаболизма или другие метаболические пути. В печени (но не в мышцах) глюкозо-6-фосфат может гидролизоваться с образованием глюкозы, которая выделяется в кровь. Эту реакцию катализирует фермент глюкозо-6-фосфатаза. Реакция протекает в просвете ЭР, куда с помощью специального белка транспортируется глюкозо-6-фосфат. Фермент локализован на мембране ЭР таким образом, что его активный центр обращён в просвет ЭР. Продукты гидролиза (глюкоза и неорганический фосфат) возвращаются в цитоплазму также с помощью транспортных систем.

55. Особенности обмена глюкозы в разных органах и клетках: эритроциты, мозг, мышцы, жировая ткань, печень.
Метаболизм глюкозы в эритроцитах. Эритроциты лишены митохондрий, поэтому в качестве энергетического материала они могут использовать только глюкозу. В эритроцитах катаболизм глюкозы обеспечивает сохранение структуры и функции гемоглобина, целостность мембран и образование энергии для работы ионных насосов. Глюкоза поступает в эритроциты путём облегчённой диффузии с помощью ГЛЮТ-2. Около 90% поступающей глюкозы используется в анаэробном гликолизе, а остальные 10% - в пентозофосфатном пути. Конечный продукт анаэробного гликолиза лактат выходит в плазму крови и используется в других клетках, прежде всего гепатоцитах. АТФ, образующийся в анаэробном гликолизе, обеспечивает работу Nа+, К+-АТФ-азы и поддержание самого гликолиза, требующего затраты АТФ в гексокиназной и фосфофруктокиназной реакциях. Важная особенность анаэробного гликолиза в эритроцитах по сравнению с другими клетками - присутствие в них фермента бисфосфоглицератмутазы. Бисфосфоглицератмутаза катализирует образование 2,3-бисфосфоглицерата из 1,3-бисфосфоглицерата. Образующийся только в эритроцитах 2,3-бисфосфоглицерат служит важным аллостерическим регулятором связывания кислорода гемоглобином. Глюкоза в эритроцитах используется и в пентозофосфатном пути, окислительный этап которого обеспечивает образование кофермента NADPH, необходимого для восстановления глу-татиона.
Метаболизм глюкозы в печени. Основная роль печени в углеводном обмене заключается в обеспечении постоянства концентрации глюкозы в крови. Это достигается регуляцией между синтезом и распадом гликогена, депонируемого в печени. В печени синтез гликогена и его регуляция в основном аналогичны тем процессам, которые протекают в других органах и тканях, в частности в мышечной ткани. Синтез гликогена из глюкозы обеспечивает в норме временный резерв углеводов, необходимый для поддержания концентрации глюкозы в крови в тех случаях, если ее содержание значительно уменьшается (например, у человека это происходит при недостаточном поступлении углеводов с пищей или в период ночного «голодания»). Необходимо подчеркнуть важную роль фермента глюкокиназы в процессе утилизации глюкозы печенью. Глюкокиназа, подобногексокиназе, катализирует фосфорилирование глюкозы с образованием глюкозо-6-фосфата, при этом активность глюкокиназы в печенипочти в 10 раз превышает активность гексокиназы. Важное различие между этими двумя ферментами заключается в том, что глюкокиназа в противоположность гексокиназе имеет высокое значение КМ для глюкозы и не ингибируется глюкозо-6-фосфатом. Считают, что основная роль печени – расщепление глюкозы – сводится прежде всего к запасанию метаболитов-предшественников, необходимых для биосинтеза жирных кислот и глицерина, и в меньшей степени к окислению ее до СО2 и Н2О. Синтезированные впечени триглицериды в норме выделяются в кровь в составе липопротеинов и транспортируются в жировую ткань для более «постоянного» хранения. В реакциях пентозофосфатного пути в печени образуется НАДФН, используемый для восстановительных реакций в процессах синтезажирных кислот, холестерина и других стероидов. Кроме того, при этом образуются пентозофосфаты, необходимые для синтезануклеиновых кислот. Наряду с утилизацией глюкозы в печени происходит и ее образование. Непосредственным источником глюкозы в печени служитгликоген. Распад гликогена в печени происходит в основном фосфоролитическим путем. В регуляции скорости гликогенолиза в печенибольшое значение имеет система циклических нуклеотидов. Кроме того, глюкоза в печени образуется также в процессе глюконеогенеза.
Метаболизм глюкозы в мозгу. Основным субстратом дыхания мозговой ткани является глюкоза. В 1 мин 100 г ткани мозга потребляют в среднем 5 мг глюкозы. Подсчитано, что более 90% утилизируемой глюкозы в ткани мозга окисляется до СО2 и Н2О при участии цикла трикарбоновых кислот. В физиологических условиях роль пентозофосфатного пути окисления глюкозы в мозговой ткани невелика, однако этот путь окисленияглюкозы присущ всем клеткам головного мозга. Образующаяся в процессе пентозофосфатного цикла восстановленная форма НАДФ (НАДФН) используется для синтеза жирных кислот и стероидов. Между глюкозой и гликогеном мозговой ткани имеется тесная связь, выражающаяся в том, что при недостаточном поступлении глюкозыиз крови гликоген головного мозга является источником глюкозы, а глюкоза при ее избытке – исходным материалом для синтеза гликогена. Распад гликогена в мозговой ткани происходит путем фосфоролиза с участием системы цАМФ. Однако в целом использование гликогена в мозге по сравнению с глюкозой не играет существенной роли в энергетическом отношении, так как содержание гликогена в головном мозге невелико. Наряду с аэробным метаболизмом углеводов мозговая ткань способна к довольно интенсивному анаэробному гликолизу. Значение этого явления пока недостаточно ясно, ибо гликолиз как источник энергии ни в коей мере не может сравниться по эффективности с тканевым дыханием в головном мозге.
Метаболизм глюкозы в мышцах. При работе умеренной интенсивности мышца может покрывать свои энергетические затраты за счет аэробного метаболизма. Однако при больших нагрузках, когда возможность снабжения кислородом отстает от потребности в нем, мышца вынуждена использовать гликолитический путь снабжения энергией. При интенсивной мышечной работе скорость расщепления гликогена или глюкозы с образованием молочной кислоты увеличивается в сотни раз. Соответственно содержание молочной кислоты в мышечной ткани может повышаться до 1,0–1,2 г/кг и более. С током крови значительное количество молочной кислоты поступает в печень, где ресинтезируется в глюкозу и гликоген (глюконеогенез) за счет энергии окислительных процессов.
Метаболизм глюкозы в жировой ткани. В адипоцитах для обеспечения реакций синтеза жира распад глюкозы идёт по двум путям: гликолиз, обеспечивающий образование глицерол-3-фосфата и ацетил-КоА, и пентозофосфатный путь, окислительные реакции которого обеспечивают образование NADPH, служащего донором водорода в реакциях синтеза жирных кислот.
56. Представление о строении и функциях углеводной части гликолипидов и гликопротеинов. Сиаловые кислоты
Гликопротеины – сложные белки, содержащие, помимо простогобелкаилипептида, группу гетероолигосахаридов. В настоящее время их принято называть гликоконъюгатами. В состав гликоконъюгата входит углеводный компонент (гликановая фракция), ковалентно связанный с неуглеводной частью (агликановая фракция), представленнойбелком,пептидом,аминокислотойилилипидом. Химический составгликопротеиновболее или менее установлен, структура определена только у ряда из них. Кполипептидуприсоединяются гетероолигосахаридные цепи, содержащие от 2 до 10, реже 15 мономерных остатковгексоз(галактозаиманноза, режеглюкоза),пентоз(ксилоза,арабиноза) и конечныйуглевод, чаще всего представленный N-ацетилга-лактозамином, L-фукозой или сиаловойкислотой; в отличие от про-теогликановгликопротеиныне содержатуроновых кислотисерной кислоты. Типы связей между углеводными компонентами ибелкамиопределены только у рядагликопротеинов, аминокислотный состав и структура которых известны (иммуноглобулины,гормоны); они включают О-гликозидные связи (с ОН-группамисерина,треонинаи оксилизина), N-гликозидные связи (с амидными группамиаспарагина, режеглутаминаили ω-NH2-группами лизинаиаргинина) и эфирные гликозидные связи со свободными СООН-группами глутаминовой и аспарагиновойкислот. Углеводные компоненты соединены ковалентно сазотомаспарагинамолекулыбелка.
Гликолипиды —сложные липиды, образующиеся в результате соединения липидов с углеводами. У гликолипидов имеются полярные «головы» (углевод) и неполярные «хвосты» (остатки жирных кислот). Благодаря данному свойству, вместе с фосфолипидами, гликолипиды входят в состав клеточных мембран. Гликолипиды широко представлены в тканях, особенно в нервной ткани, в частности в ткани мозга. Они локализованы преимущественно на наружной поверхности плазматической мембраны, где их углеводые компоненты входят в число других углеводов клеточной поверхности.
Сиа́ловые кисло́ты - ациальные производные нейраминовой кислоты, присутствуют во всех тканях и жидкостях организма животных и человека и у некоторых микроорганизмов. У человека в норме наибольшее количество Сиаловые кислоты обнаруживается в слюнных железах, в секретах различных слизистых оболочек, а также в сыворотке крови, где их содержание резко повышается при ряде заболеваний. Сиаловые кислоты являются полифункциональными соединениями с сильными кислотными свойствами. Как правило, в свободном виде в норме они не встречаются, а входят в состав различных углеводсодержащих веществ, таких как гликопротеины, гликолипиды (ганглиозиды), олигосахариды. Занимая в молекулах этих веществ концевое положение, сиаловые кислоты оказывают значительное влияние на их физико-химические свойства и биологическую активность. Определяя отрицательный заряд молекул гликопротеинов, сиаловые кислоты обусловливают вытянутую форму их молекул и как следствие высокую вязкость содержащих эти гликопротеины секретов слизистых оболочек дыхательного, кишечного и полового трактов. Это обеспечивает защиту слизистых оболочек от механических и химических повреждений. Наличие сиаловых кислот в составе белков крови (церулоплазмина, кислого α1-гликопротеина и др.) и некоторых гормонов (хорионического гонадотропина, фолликулостимулирующего и лютеинизирующего гормонов) определяет длительность циркуляции этих соединений в кровотоке. После отщепления сиаловой кислоты, когда концевым сахаром в молекулах гликопротеинов становится галактоза, эти белки поглощаются клетками печени. Именно этим объясняется потеря гормонами биологической активности. Длительность циркуляции в кровотоке некоторых клеток крови (эритроцитов, лимфоцитов) также зависит от наличия или отсутствия сиаловых кислот на их поверхности. Процесс старения эритроцитов связан с уменьшением количества сиаловых кислот в их оболочке. Находясь в составе углеводной части гликопротеинов, сиаловые кислоты маскируют остатки сахаров, являющихся антигенными детерминантами и таким образом, играют важную роль в иммунных реакциях, снижая иммуногенные свойства нормальных и опухолевых клеток. Установлено, что сиаловые кислоты являются компонентом клеточных рецепторов, специфичных для вирусов гриппа.
57. Наследственные нарушения обмена моносахаридов и дисахаридов: галактоземия, непереносимость фруктозы и дисахаридов. Гликогенозы и агликогенозы
Нарушения метаболизма фруктозы
|
Неактивный фермент |
Блокируемая реакция |
Локализация фермента |
Клинические проявления и лабораторные данные |
|
Фруктокиназа |
Фруктоза + АТФ → Фруктозе-1-фосфат + АДФ |
Печень Почки Энтероциты |
Фруктоземия, фруктозурия |
|
Фруктозе-1-фосфатальдолаза |
Фруктозе-1-фосфат → Дигидроксиацетон-3 -фосфат + Глицеральдегид |
Печень |
Рвота, боли в животе, диарея, гипогликемия, Гипофосфатемия, фруктоземия, гиперурикемия, хроническая недостаточность функций печени, почек. |
Недостаточность фруктокиназы клинически не проявляется. Фруктоза накапливается в крови и выделяется с мочой, где её можно обнаружить лабораторными методами. Очень важно не перепутать эту безвредную аномалию с сахарным диабетом. Данное заболевание известно как доброкачественная эссенциальная фруктозурия и встречается с частотой 1:130 000.
Наследственная непереносимость фруктозы, возникающая при генетически обусловленном дефекте фруктозо-1-фосфатальдолазы, не проявляется, пока ребёнок питается грудным молоком, т.е. пока пища не содержит фруктозы. Симптомы возникают, когда в рацион добавляют фрукты, соки, сахарозу. Рвота, боли в животе, диарея, гипогликемия и даже кома и судороги возникают через 30 мин после приёма пищи, содержащей фруктозу. У маленьких детей и подростков, продолжающих принимать фруктозу, развиваются хронические нарушения функций печени и почек. Непереносимость фруктозы - достаточно частая аутосомно-рецессивная форма патологии.
Дефект альдолазы фруктозе-1-фосфата сопровождается накоплением фруктозе-1-фосфата, который ингибирует активность фосфоглюко-мутазы, превращающей глюкозо-1-фосфат в глюкозо-6-фосфат и обеспечивающей включение продукта гликогенфосфорилазной реакции в метаболизм. Поэтому происходит торможение распада гликогена на стадии образования глюкозо-1 -фосфата, в результате чего развивается гипогликемия. Как следствие, ускоряется мобилизация липидов и окисление жирных кислот. Следствием ускорения окисления жирных кислот и синтеза кетоновых тел, замещающих энергетическую функцию глюкозы, может быть метаболический ацидоз, так как кетоновые тела являются кислотами и при высоких концентрациях снижают рН крови. Результатом торможения гликогенолиза и гликолиза является снижение синтеза АТФ. Кроме того, накопление фосфорилированной фруктозы ведёт к нарушению обмена неорганического фосфата и гипофосфатемии. Для пополнения внутриклеточного фосфата ускоряется распад адениловых нуклеотидов. Продукты распада этих нуклеотидов включаются в катаболизм, проходя стадии образования гипоксантина, ксантина и, наконец, мочевой кислоты. Повышение количества мочевой кислоты и снижение экскреции уратов в условиях метаболического ацидоза проявляются в виде гиперурикемии. Следствием гиперурикемии может быть подагра даже в молодом возрасте
