
- •1. Гомолитические (радикальные) реакции
- •2. Гетеролитические (ионные)
- •Вопрос 10. Хим св-ва алкенов и алкинов.
- •Вопрос11. Циклоалканы- это циклические предельные углевоороды. СnH2n-общ формула. (строение их см в тет)
- •Вопрос12 Арены-это углеводородные производные бензола,включая сам бензол(с6h6).Впервые бензол был открыт Фарадеем.
- •Вопрос13. Алкадиены. Диены-орг.Соед-ия,молекулы кот сост.Из ат. С и н и помимо простых б-связей содержат еще и две двойные п-св. Их общ.Формула СnH2n-2.
- •Вопрос14.Реакции полимеризации диеновых у/в.
- •Вопрос16.Сравнительная хар-ка хим св-в алиф-их и аромат-их галогенуглеводородов
- •27Оксикислоты
- •Вопрос 33. Монасахариды-сахароподобные,сладкие на вкус и не подверженные гидролизу до более простых соединений индивидуальные в-ва.
- •Вопрос 34. Дисахариды- углеводы, кот сод-ат 2 остатка моносахаридов,связанных между собой простой эфирной гликозидной связью.
- •Вопрос 53
- •Вопрос 54.
- •Нахождение в природе
- •Вопрос 55
1.основные положения теории Бутлерова:
а)атомы в молекуле расположены не беспорядочно ,а в строго определенной последовательности,в соответствии с их валентностью.б)св-ва молекул зависит не только от качественного и количественного состава ,но и от взаимного положения и влияния атома друг на друга.в)изучение свойств химических соединений позволяет прогнезировать и определять их химическое строение .Из этой теории следует,что для написания структурной формулы любого органического соединения нужно исходить из четырех основных свойств атома углерода:а)четырехвалетности,а также способности его:б)соединяться в молекулярные цепи,в)образовывать двойные и тройные связи,г)образовывать циклы.Замечательным успехом этой теории явл. Возможность объяснения ею явления изомерии.Изомеры-молекулы,имеющие качеств. и колич. состав.,но различные св-ва.Так,в цепи из 4-х атомов углерода (в молекуле бутана) один из атомов углерода может быть присоединен двояко:к одному из крайних:С-С-С-СНз или к среднему ат.углерода,например,так:С-С(СН3)-С
Следовательно,для в-ва с молек.(бутто) формулой С4Н10 должно существ. Два изомера-бутан и изобутан,что,как видно из вышеприведенных формул,и наблюдается в действительности.Др.примерами изомеров могут быть этанол С2Н5ОН и диметиловый эфир СН3-О-СН3.У молекул всех рассмотренных и других изомеров одинаковая мол.масса,но разное просторанственное строение.
2.Ионная связь: электростатический вид связи(за исключением солей карбоновых кислот) в чистом виде для органических соедин. Не характерен.Формир-е этого вида связи возможно только между атомами значительно отличающимися по электроотрицательности и из стремления атомов к «обладанию» октетом(или,например,дублетом у ат.водорода)электронов.С учетом этого,одни элементы (щелочные МЕ)стермяться отдать один электрон,а другие (гелогены)его принять,например:Na .+.Cl:--Na+Cl-,что и приводит к формированию ионной связи(электровалентной,гетерополярной)связи.При этом атом,отдавший электрон,превращается в положительно заряженный(катион),а принявший его-в отрицательно заряж.(анион).Изображение связи:R-COO-(сверху)Na+
Ковалентная: Характерна неорганическим соединениям.Образ-ся за счет перекрывание электронов ,близких по электроотрицателтности атомов,когда обр-ся либо неполярная связь,например:Cl.+.Cl—Cl2;N.+.N—N2,либо полярная (один из атомов более электроотрицателен и «оттягивает» обобществленную электронную пару ):H.+.Cl—H:Cl.Но такое «оттягивание»не заходит так далеко,как и в иной связи.В органических соединениях в чистом виде ков. св. не встречается.
Водородная:обр-ся внутри-или межмолекулярно между атомами,имеющими свободную (неподеленную) электронную пару,например:
Это наиболее слабый вид вязи(энергия этой связи равна 3-4 Дж./моль).Наибольшее значение этот вид связи приобретает в полимерных и,в частности,белковых макромолекулах,где суммарная энергия всех водородных связей может даже превышать энергию простой сигма-связи.
Орбиталь-область пространства вокруг ядра атома в наиболее вероятном нахождении электронов.
3. Разрыв ковалентной связи может происходить двумя способами. 1. Разрыв связи, при котором каждый атом получает по одному электрону из общей пары, называется гомолитическим:
![]()
Например,
CH4 свет→ CH3∙ + ∙H
Cl2 свет→ Cl∙ + ∙Cl
В результате гомолитического разрыва образуются сходные по электронному строению частицы, каждая из которых имеет неспаренный электрон. Такие частицы называются свободными радикалами.
Радикал – свободный атом или частица с неспаренными электронами, неустойчив и способный быстро вступать в химическую реакцию.
Гомолитический разрыв сопровождает процессы, осуществляемые при высоких температурах; на свету; при радиоактивном облучении в отсутствие растворителя (в газовой фазе) или неполярных растворителях. Гомолитическому разрыву подвергаются малополярные или неполярные связи C-C, C-H, Cl-Cl и др.
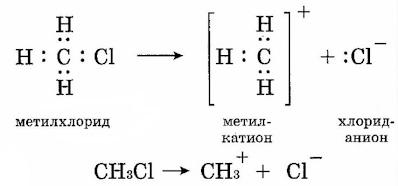
2. Если при разрыве связи общая электронная пара остается у одного атома, то такой разрыв называется гетеролитическим:
![]()
А+ - электрофильная частица, :В- - нуклеофильная частица
Например,
CH3Сl → CH3+ + :Cl-
В результате образуются разноименно заряженные ионы - катион ианион. Если заряд иона сосредоточен на атоме углерода, то катион называют карбокатионом, а анион - карбанионом.
В зависимости от способа разрыва ковалентной связи в реагирующей молекуле органические реакции подразделяются на радикальные и ионные реакции.
1. Гомолитические (радикальные) реакции
Например, галогенирование алканов (реакция цепная)
CH4 + Cl2 hν → CH3Cl + HCl (1 стадия) ;
CH3Cl + Cl2 hν → CH2Cl2 + HCl (2 стадия);
СH2Cl2 + Cl2 hν → CHCl3 + HCl (3 стадия);
CHCl3 + Cl2 hν → CCl4 + HCl (4 стадия).
Внимание! В реакциях замещения алканов легче всего замещаются атомы водорода у третичных атомов углерода, затем у вторичных и, в последнюю очередь, у первичных.
4 3 2 1
CH3 - CH2 - CH - CH3 + Cl2 hν → смесь галогеналканов.
│
CH3
1; 4 – первичные; 3 – вторичный; 2 – третичный.
2. Гетеролитические (ионные)
Гетеролитический распад ковалентной полярной связи приводит к образованию нуклеофилов (анионов) и электрофилов (катионов):
а)
б) H2O → H+ + OH-
Образовавшиеся ионы вступают в дальнейшие превращения, например:
CH3+ + OH- → CH3OH
электрофил нуклеофил
Ионные реакции делятся по характеру реагента, действующего на молекулу, на электрофильные и нуклеофильные.
Электрофил E (любящий электроны) – это частица, которая атакует атом углерода органического соединения, отнимая у него электронную пару (является акцептором электронов). Примеры частиц – электрофилов:H3O+, H+, HCl, HNO3, NO2+, AlCl3 и др
Нуклеофил N (любящий ядро) – это частица, которая атакует атом углерода, предоставляя ему электронную пару (является донором электронов). Такие частицы, как правило, обладают основными свойствами. К ним относятся: OH-, Cl-, S2-, NH3, H2O, R-OH, CH3O- и др
Нуклеофильные реакции – это реакции органических веществ с нуклеофилами, т.е. анионами или молекулами, которые предоставляют электронную пару на образование новой связи:
СH3Br(субстрат) + NaOH(реагент-нуклеофил) → CH3OH + NaBr
Электрофильные реакции – реакции органических соединений с электрофильными реагентами, т.е. катионами или молекулами, которые имеют свободную орбиталь, готовые принять электронную пару для образования новой связи
C6H6 (субстрат) + HO:- NO2+(реагент –электрофил) → C6H5 – NO2 + H –OH
Примеры нуклеофильных реакций
Нуклеофильное замещение:

Не для всех реакций можно чётко определить механизм, по которому они протекают, так как чистый SN1 или SN2 являются всего лишь идеальными (предельными) модельными случаями. Следует помнить, что один и тот же субстратможет реагировать с одним и тем же нуклеофилом, в зависимости от условий реакции и растворителя, как по механизмуSN1, так и SN2.
Например, скорость гидролиза2-бромпропана описывается с учётом смешанного механизма его протекания[7]:
CH3−CHBr−CH3 + HO− → CH3−CHOH−CH3 + Br−
4.Алканы-органич. соединения,молекулы которых состоят из углерода и водорада,относят к углеводородам.Если молекула углеводородов содержат только простые сигма-связи,а их состав отвечает общей формуле Cn H2n+2,то их относят к предельным,или парафинам.Атомы углерода в алканах наход. в состоянии sp3-гибридизации и четырехвалентны.Алканы образуют ряд гомологов,в котором каждый последующий член отличается от предыдущего на гомологич. Разность –CH2-группу.
Изомерия:1)изомерия углеродного скелета;
2)изомерия положения заместителя в углеродной цепи
Номенклатура:по номенкл. ИЮПАК названия предельных углеводородов характ-ся суффиксом –ан-.Парвые четыре углеводорода носят тривиальные названия ,а начиная с пятого –в их основе лежит название латинского числительного в соответствии с числом ат.углерода в молекуле.Названия углеводороднх радикалов строят путем замены суффикса –ан на –ил.
Общие способы получения:
1.Реакция Вюрца(взимод-е галогенуглеводородов с щелочными Ме-Li,Na,K)
CH3Br+2Na +Br-CH32NaBr+CH3-CH3
CH3-Cl+2Na+Cl-CH3CH3-CH3+2NaCl
2.Гидрирование непред.углеводородов
CH2=CH2-этилен
CH2=CH2+H2Pt,tCH3-CH3-этан
Физические св-ва:
1.от С1-С4-газы(б.з)
2.от С5-С22-жидкости(спец.з)
3.>С22-твердые в-ва(б.з)
Хорошо изучены до С100.Темп.кипеня или плавления их в гомологическом ряду монотонно возрастают с каждой новой –CH2-группой(яркий пример перехода кол-ва в качество).
Химические св-ва:
1.Р-ции замеш-я ат .Н:
А)прямое галогенирование(F2.Cl2.Br2)
Cl2+CH4hvHCL+CH3Cl+CH2Cl2+CHCl3+CCl4
-Фторирование(со взрывом)
-хлорирование(на свету)
Механизм хлорирования(цепной,радикальный)
Cl2hv2Cl.
Cl.+CH4HCl+CH3
CH3+Cl. CH3Cl-обрыв цепи
CH3.+Cl2Cl.+CH3ClHCl+CH2Cl. и тд-рост цепи
-бромирование(нагревание ,получ-е света)
Б)нитрование(-No2 гр.)-р-ция Коновалава
CH3-CH3+NO3140CH2O+CH3-CH2NO2нитроэтан
В)Сульфохлорирование(SO3,Cl2)
CH3-CH3+SO3+CL2hvHCl+CH3-CH2-SO3Clсульфахлорэтан
Г)Кретинг
CH3-CH2-CH2-CH3Pt,tCH2=CH2+CH3-CH3
Использование в сельском хоз-ве:распр.применение отработанных масел в качестве гербицидов для уничтожения двудольных сорняков в посевах злаков и кукурузы.Большое практическое значение приобрели нефтеотходы в связи с открытием возможности примен-я их в кач-ве органич. Субстратов при выращивании некоторых штаммов дрожжевых культур для получ-я сухих белково-витаминных концентратов(БВК).
5. sp3-гибридизация
Происходит при смешивании одной s- и трех p-орбиталей, образуя четыре равноценные по форме и энергии sp3-гибридные орбитали. Могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов.
Оси sp3-гибридных орбиталей направлены к вершинам правильного тетраэдра. Тетраэдрический угол между ними равен 109°28', что соответствует наименьшей энергии отталкивания электронов. Так же sp3-орбитали могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов.Такое состояние характерно для атомов углерода в насыщенных углеводородах и соответственно в алкильных радикалах и их производных.
Примеры соединений, для которых характерна sp3-гибридизация: NH3, POCl3, SO2F2, SOBr2, NH4+, H3O+. Также, sp3-гибридизация наблюдается во всех предельных углеводородах (алканы, циклоалканы) и других органческих соединениях: CH4, C5H12, C6H14, C8H18 и др. Общая формула алканов: CnH2n+2. Общая формула циклоалканов: CnH2n. В предельных углеводородах все химические связи одинарные, поэтому между гибридными орбиталями этих соединений возможно только σ-перекрывание.
sp3- Гибридизация характерна для атомов углерода в насыщенных углеводородах (алканах) – в частности, в метане
 Рис.2 Схема
электронного строения молекулы метана
Рис.2 Схема
электронного строения молекулы метана
6.Алкены-органич.соединения,молекулы которых состоят из ат.углерода и водорода и помимо простых сигма-св. содерж. Еще и двойную пи-св.Их состав отвечает общей формуле CnH2n.что означает налич. В их сост. Молек. Дефицита 2 ат. Водорода в сравнении с алканами.
Этилен CH2=CH2
Электронная природа двойной связи: С точки зрения электронных представлений двойная связь осуществляется двумя парами электронов, принадлежавших двум связываемым углеродным атомам. Одна пара электроновобразует при этом обычную ковалентную σ-связь, вторая же пара электронов образует связь иного характера, так называемую π-связь. Особая конфигурация электронных облаков π-связи обусловливает фиксирование направлений остальных четырех ковалентных σ-связей при таких двух углеродных атомах. Эти связи оказываются лежащими в одной плоскости и располагаются под углами 120° друг относительно друга и относительно направления σ-связи между атомами углерода, связанными двойной связью.Двойная связь энергетически не является вдвое более прочной по сравнению с простой связью. Соответствующие энергии связей для С—С и С=С составляют 79,3 и 140,5 ккал/моль.
Изомерия :
1.углеродный скелет
CH2=CH-CH2-CH2-CH3 пентен-1
CH2=C(CH3)-CH2-CH3 2-метилбутен-1
2.полож-е заместителя
CH2=CH-CH(CH3)-CH3 3-метилбутен-1
3.полож-е дв.связи в углеводородной цепи
CH3-CH=CH-CH2-CH3 пентен-2
4.геометрическая(цис-,транс-)
Номенклатура:
Пользуются ИЮПАК-номенкл.Отличительной особенностью является необходимость выбирать в случае алкенов в качестве главной углерод-углеродную цепь,включающую в себя дв.св.,а характер. Алканам суффиксы –вн а алкенах заменять на –ен.Например:
Способы получения:
1.Крекинг алканов.Заключается в термическом разложении алканов с более длинной цепью углер.атомов до смеси алканов и ненасыщ.углеводородов с короткой цепью и водорода при 500-700 С и высоком давл.:
2.Дегидратация спиртов.Протекает в присутствии катализатора –оксида алюминия и водоотнимающих средств при обязат.дополнит.нагревании и в согласии со схемой(по правилу А.Зайцева:отщепление воды от спиртов происходит с участием гидроксильной группы за счет ат.водорода соседнего и наименее гидрогенизированного ат.углерода) :
3.Дегалогенирование дигалогенпроизводных углеводородов протекает в присутствии активных двухвалентный металлов(Mg,Zn) при нагревании,по схеме:
4.Восстановление алкинов(насыщение трйной связи активным водородом)в зависимости от типа использованного катализатора приводит к образованию цис- или транс-алкенов по схеме):
5.Дегидрогалогенирование моногалогенуглеводородов спиртовой щелочью протекает при темп. Кипения спирта
7. sp2-гибридизаця
Происходит при смешивании одной s- и двух p-орбиталей. Образуется три гибридные орбитали с осями, расположенными в одной плоскости и направленными к вершинам треугольника под углом 120 градусов. Негибридная p-атомная орбиталь перпендикулярна плоскости и, как правило, участвует в образовании π-связей
Атомы углерода в sp2-гибридном состоянии образуют такие аллотропные формы как графит, графен, фуллерены и другие наноструктуры. sp2-Гибридизация характерна для атомов С, N, O и др. с двойной связью (sp2-атомы выделены красным цветом):H2C=CH2 (анимация, 21,3 Кб), H2C=CHR, R2C=NR, R-N=N-R, R2C=O, R-N=O, а также для катионов типа R3C+ и свободных радикалов R3C•.
Электронная модель молекулы этилена.

Цис-,транс-изомерия на примере бутена -2.
 цис-бутен2,
цис-бутен2,  транс-бутен2
транс-бутен2
Геометрическая, или цис-транс-изомерия - эт вид пространственной изомерии, зависящей от различного расположения атомов по отношению к плоскости двойной связи. Дис-изомером называется такой изомер, у которого одинаковые атомы ( или атомные группы) расположены по одну сторону плоскости двойной связи.
8.Алкины-органич.соединения,молекулы которых сост. Их атомов углерода и водорода и помимо простых сигма-связей содержат еще и не менее двух двойных пи-всязей;присутствует одна тройна связь.Их состав отвечает общей фотрмуле CnH2n-2,что означает означает наличие в сравнении с алканами дефицита сразу 4-ёх ат.водорода в молекуле.
Ацетилен C2H2( );пропин( )
Природа тройной связи:
У алкинов связь −С≡С− линейна (угол 180°) и находится в одной плоскости. Атомы углерода связаны одной σ- и двумя π-связями, максимальная электронная плотность которых расположена в двух взаимно перпендикулярных плоскостях[5]. Длина тройной связи примерно 0,121 нм, энергия связи 836 кДж/моль.


На представленной выше диаграмме приведены молекулярные орбитали этилена и ацетилена.
Изомерия:
1.углеродного скелета
2.положение заместителя
3.Положение тройной связи(этот вид изомерии для этого вида цепи невозможен,тк. Не зватает длины угл.цепи)
Номенклатура:ИЮПАК.При этом окончание-ин,характеризующие наличие тройной связи:
Способы получения:
1.Дегидрирование алкенов
CH2=CH2этиленKt,tH2+HC=CHаустилен
2.Двойной дегидрогемогенорование дигалогенуглеводородов(-2НХ)
3.Карбидный метод(только для ацитилена)
А)>60% в химич.пром-ти
Б)>30%в технике >3000С
Химические св-ва:
1.Реакции замещения атомов Н при ат. С с тройной св.
А)замещ=е на металл(Na,k,Cu)
Б)замещ-е на галоген(Cl,Br)
2.Реакции с участием пи-св.
А)присоед-я
Присоед-я с водой (р.Кучерова)
3.Р-ии полимеризации
А)димеризация
Вопрос 9.Sp-гибридизация.электронная модель мол ацетилена.качественная реакция на ацетилен. sp-гибридизация (характерна для алкинов).Происходит при смешивании одной s- и одной p-орбиталей. Образуется две равноценные sp-атомные орбитали, расположенные линейно под углом 180 градусов и направленные в разные стороны от ядра атома углерода. Две оставшиеся негибридные p-орбитали располагаются во взаимно перпендикулярных плоскостях и участвуют в образовании π-связей, либо занимаются неподелёнными парами электронов Простейший член и родоначальник гомологич ряда у/в-ацетилен С2Н2. Атомы С в ацетилене объединены тремя общими парами электронов, т.е.связаны тройной С===С связью. Строение мол ацетилена: н-с===с-н. исходя из SP-гибридного состояния атС у тройной связи,строение молекулы ацетилена можно представить как результат перекрывания 2-х гибридных (s и рх) орбиталей от каждого соседнего атС. При этом гибридные sp-орбитали расположены на одной прямой,образуя угол в 180. (см в уч и тет сроение мол ацетилена) наличие двух П-связей и sp-гибридных орбиталей приводит к резкому увеличению электронной плотности между ат Н. (см рис в тет) как следствие оч слабая связь С-Н.
Методы получения: дегидрирование алкенов
Карбидный метод(для ацетилена)
1.Реакция замещения атН при ат С трйной св.: а) замщение на Ме(Сu, Нg)
(р-ия алкиннов Сu-качественная р-ия на эти алкины)
Замещение на галоген(хлор,бром)
