
- •Анализ удобрений
- •Распознавание минеральных удобрений по качественным реакциям
- •Форма записи результатов
- •Определение азота в нитратных удобрениях методом деварда
- •Форма записи результатов
- •Определение содержания азота в аммиачных и аммиачно-нитратных удобрениях формалиновым методом
- •Форма записи результатов
- •Определение азота в мочевине формалиновым методом
- •Форма записи результатов
- •Определение содержания водорастворимых фосфатов в удобрениях объемным методом Шефера
- •Форма записи результатов
- •Определение калия в калийных удобрениях
- •Шкала для приготовления эталонных растворов
- •Форма записи результатов
- •Определение общей нейтрализующей способности известковых удобрений
- •Форма записи результатов
- •Анализ гипса
- •Форма записи результатов
- •Анализ органических удобрений
- •Определение общего содержания азота в навозе
- •Форма записи результатов
- •Определение аммиачного азота в навозе по и.Ромашкевичу колориметрическим методом
- •Форма записи 1
- •Форма записи 2
- •Определение общего содержания фосфора в навозе
- •Форма записи результатов
- •Список использованных источников
Определение содержания азота в аммиачных и аммиачно-нитратных удобрениях формалиновым методом
Данный метод принят в качестве стандартного при определении содержания азота в аммиачных удобрениях – сернокислом аммонии, хлористом аммонии и др. В случае анализа аммиачной селитры результат удваивается, так как в этом удобрении азот входит в состав катиона и аниона.
Принцип метода. Основан на количественном связывании аммиака формалином с образованием нейтрального соединения гексаметилентетрамина (уротропина)- С6Н12N4. Реакция образования гексаметилентетрамина идет в нейтральной среде. При этом выделяется соответствующая минеральная кислота в количестве, эквивалентном содержанию аммиачного азота:
2(NH4)2SO4 + 6HCOH = C6H12N4 + 2H2SO4 + 6H2O
По количеству образовавшейся кислоты, которую учитывают титрованием щелочью, определяют процент азота в удобрении.
Ход анализа. На технических весах берут навеску удобрения 2 г, помещают в химический стакан и растворяют примерно в 100 мл дистиллированной воды. Затем переносят в мерную колбу на 250 мл, доводят водой до метки и перемешивают. Если раствор получается мутный, его фильтруют. Берут пипеткой 25 мл раствора, переносят в коническую колбу, прибавляют 2-3 капли индикатора метилрота . Если раствор кислый (розовый цвет от индикатора), его нейтрализуют 0.1 н щелочью (не допуская ее избытка) до момента перехода розовой окраски в золотисто-желтую.
В другую коническую колбу помещают 10 мл 40 %-ного раствора формалина и также прибавляют к нему 2-3 капли метилрота. При наличии кислой реакции раствор формалина также нейтрализуют 0.1 н щелочью. Приготовленный раствор формалина вливают в нейтрализованный раствор анализируемого удобрения. Сразу же после сливания исследуемый раствор изменяет окраску в розовую вследствие выделения кислоты при реакции формалина с аммиаком.
К раствору с выделившейся минеральной кислотой прибавляют 2-3 капли фенолфталеина и титруют его 0.1 н щелочью. При титровании следует внимательно наблюдать за изменением цвета раствора. Вначале розовая окраска переходит в бледно-желтую, а затем она сменяется слабо-розовой, определяющей конец титрования.
Расчет содержания азота (в %) производится по формуле:
V*н*0.014*100*р
%N = -------------------------------------
m
где V–объем NaOH, пошедший на титрование, мл; н – молярная концентрация NaOH, ммоль/мл; 0.014 – молярная масса азота, г/ммоль; m – навеска удобрения, г; р – разведение (250/25); 100 – для выражения результата в %.
Реактивы: 1) 0.1 н раствор NaOH (4 г NaOH на 1 л раствора), 2) метилрот; 3) 40 %-ный раствор формалина; 4) фенолфталеин.
Форма записи результатов
|
Название удобрения |
Навеска, г |
Разведение |
NaOH |
N,% | ||
|
мл |
Н | |||||
|
|
|
|
|
|
| |
Определение азота в мочевине формалиновым методом
Принцип метода. При нагревании с серной кислотой мочевина подвергается гидролизу с образованием аммиака и угольной кислоты.
CO(NH2)2+2H2O → 2NH3+H2CO3
Угольная кислота разлагается на СО2 и Н2О. Аммиак связывается с серной кислотой в сульфат аммония:
2NH3+H2SO4 = (NH4)2SO4
Избыток серной кислоты осторожно нейтрализуют щелочью. Далее ход анализа аналогичен определению азота в сульфате аммония.
Ход анализа. 1 г мочевины – CO(NH2)2 переносят в плоскодонную колбу из тугоплавкого стекла. Смывают приставшие к горлу колбы частицы небольшим количеством дистиллированной воды и добавляют 5 мл концентрированной H2SO4. Содержимое колбы кипятят в вытяжном шкафу до прекращения бурного выделения СО2, а затем до появления белых паров сернистого ангидрида. Охладив колбу, приливают в нее 50 мл дистиллированной воды и 2-3 капли метилрота. Нейтрализуют кислоту в колбе 5.0 н NaOH до перехода окраски в золотисто-желтую. Последующим добавлением по каплям 0.5 н H2SO4 добавляются появления розовой окраски. К нейтрализованному раствору прибавляют 20 мл 40 %-ного формалина и 2-4 капли фенолфталеина. Выделившуюся кислоту титруют до появления через желтую розовой окраски.
Расчет содержания азота (в %) производится по формуле:
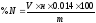
где V – объем NaOH, пошедший на титрование, мл; н – молярная концентрация NaOH, ммоль/мл; 0.014 – молярная масса азота, г/ммоль; m – навеска удобрения, г; 100 – для выражения результата в %.
Реактивы: 1) концентрированная H2SO4; 2) 5.0 н NaOH (200 г NaOH на 1 л раствора); 3) 0.5 н H2SO4 (14 мл конц. H2SO4 на 1 л раствора); 4) 40 %-ный раствор формалина; 5) 1.0 н NaOH (40 г. NaOH на 1 л раствора).
