
умк_Галушков_Теорет. основы химии_ч
.1.pdf
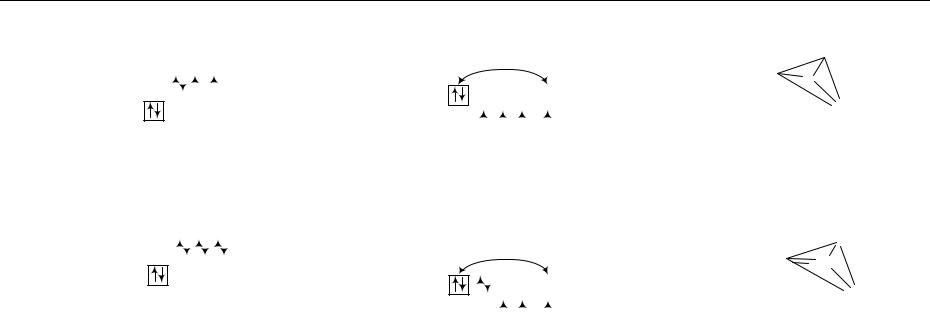
На рисунке 4.13 показана конфигурация электронных пар атома А и геометрическая форма молекул (ионов) типа ABn Em , где Е – несвязываю-
щие электронные пары. На этом рисунке положение связывающих элек- тронных пар определяется линиями, соединяющими атомы А и В, а несвя- зывающие обозначены двумя точками.
∙∙
AB3 |
AB2E |
|
∙∙ |
∙∙ |
AB4 |
AB3E |
AB2E2 |
 ∙∙
∙∙

AB5 
AB6
AB4E |
AB3E2 |
|
∙∙ |
AB5E
∙∙
∙ |
AB2E3 |
∙ |
|
|
∙∙ |
∙∙ |
|
∙∙
AB4E2
∙∙
∙∙ ∙∙
Рис. 4.13. Конфигурация электронных пар атома А и геометрическая форма молекул (ионов) типа ABn Em (Е – несвязывающие электронные пары):
а) треугольная конфигурация; форма молекулы (иона) – правильный треугольник; б) треуголь- ная конфигурация; форма молекулы (иона) – угловая; в) тетраэдрическая конфигурация; форма молекулы (иона) – тетраэдр; г) тетраэдрическая конфигурация; форма молекулы (иона) – три- гональная пирамида; д) тетраэдрическая конфигурация; форма молекулы (иона) – угловая; е) тригонально-бипирамидальная конфигурация; форма молекулы (иона) – тригональная бипи- рамида; ж) тригонально-бипирамидальная конфигурация; форма молекулы (иона) – искажен- ный тетраэдр; з) тригонально-бипирамидальная конфигурация; форма молекулы (иона) – Т-форма; и) тригонально-бипирамидальная конфигурация; форма молекулы (иона) – линейная; к) октаэдрическая конфигурация; форма молекулы (иона) – октаэдр; л) октаэдрическая конфи- гурация; форма молекулы (иона) – тетрагональная пирамида; м) октаэдрическая конфигурация; форма молекулы (иона) – квадрат
91

Как видно из рис. 4.13, при тригонально-бипирамидальной конфигу- рации электронных пар в молекуле (ионе) типа ABn Em несвязывающие электронные пары занимают экваториальное положение, а при октаэдри- ческой конфигурации – аксиальное. При описании строения молекул (ио- нов) теории гибридизации и ОЭПВО дополняют друг друга.
На практике для определения структур одиночных молекул (ионов) удобно использовать условный прием, основанный на применении идеи гиб- ридизации, донорно-акцепторного механизма образования связи и понятии о степени окисления. Этот прием предусматривает следующие операции:
1)переход электронов от атома А к атомам (лигандам) В или наобо- рот в молекуле ABn в соответствии со степенью окисления этих элементов;
2)гибридизация валентных орбиталей атома А с участием неподе- ленных электронных пар (если имеются);
3)образование связей по донорно-акцепторному механизму между находящимися в соответствующих степенях окисления центральной час- тицей А и лигандами В в молекуле ABn .
С помощью указанного выше условного приема определим структу- ру молекул SF4 , XeOF2 и NH3 , используя табл. 4.3 и рис. 4.13. Результаты удобно представить в виде табл. 4.4.
Вметоде ВС рассматриваются химические связи, осуществляемые парой электронов (двухэлектронные двухцентровые связи). В то же время встречаются соединения, в которых число электронов, приходящихся на одну связь, больше или меньше двух. Для примера рассмотрим объяснение природы ковалентной связи в рамках метода ВС в молекулах O2 и B2 H6 .
Ватоме кислорода имеются два неспаренных электрона, способных образовать одну σ- и одну π- связь. Поэтому считалось, что атомы кисло- рода в молекуле O2 связаны двойной связью O == O . Однако эксперимен-
тально установлено, что молекула O2 парамагнитна, а значит, содержит неспаренные электроны. Для обоснования парамагнетизма кислорода была предложена так называемая трехэлектронная связь, которую образуют два неподеленных электрона от одного атома и один неспаренный электрон от его партнера
|
|
|
x |
x |
|
|
|
||
|
|
|
||
∙∙ O |
∙ x x Ox |
|||
↓
В приведенной схеме строения молекулы O2 для удобства крестиками обозначены электроны от одного атома кислорода, а точками – от другого. Валентная черточка означает простую σ- связь за счет одного из двух не- спаренных электронов от каждого атома кислорода. Другой неспаренный электрон, входящий в состав трехэлектронной связи, обозначен стрелкой.
92
93
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 4.4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Строение молекул SF4 |
, |
XeOF2 и NH3 |
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Молекула |
|
|
Валентные орбитали |
|
|
|
|
Гибридные орбитали атома А в степени окис- |
Электронная конфигурация |
||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
изолированного |
|
|
|
|
ления z при образовании связей по донорно- |
и геометрическая форма молекулы |
||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
атома А |
|
|
|
|
акцепторному механизму с лигандами В |
(в скобках) |
|||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|||||||||||||
+4 −1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S F4 |
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S |
|
|
|
sp3d |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3d0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
∙∙ |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
2p4 |
|
|
|
|
−1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
− |
|
|
− |
|
|
− |
|
|
− |
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
2s2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||
|
|
0 |
|
|
|
|
F |
F |
F |
F |
тригонально-бипирамидальная |
||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 F |
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
4 F |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(искаженный тетраэдр) |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+4 −2 −1 |
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Xe O F 2 |
|
Xe |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Xe |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
∙∙ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5d0 |
|
|
|
|
|
|
|
sp3d |
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
0 |
5s |
2 |
|
|
|
|
|
|
5p6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
∙∙ |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
− |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
O,2 F |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
−2 −1 |
|
|
|
|
|
2 |
F− |
F− |
тригонально-бипирамидальная |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O,2 F |
|
|
|
|
O |
(Т-форма) |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
93

Молекула
−3 +1
N H3
94
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Продолжение табл. 4.4 |
|
|
|
|
|
|
|
|
|
Гибридные орбитали |
|
|
|||||||||||
Валентные орбитали |
атома А в степени окисления z |
Электронная конфигурация |
|||||||||||||||||||
изолированного |
при образовании связей |
и геометрическая форма |
|||||||||||||||||||
|
атома А |
по донорно-акцепторному |
молекулы (в скобках) |
||||||||||||||||||
|
|
|
|
|
|
|
|
механизму с лигандами В |
|
|
|||||||||||
0 |
|
|
|
|
|
|
|
−3 |
|
|
|
|
|
|
|
|
|
|
|
∙ |
∙ |
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
sp3 |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2p3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
2s2 |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
0 |
+1 |
+ + + |
|
тетраэдрическая |
|||||||||||||||||
3H |
|
|
|
|
|
|
|
H H H |
|||||||||||||
|
|
|
|
|
|
|
3H |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(тригональная пирамида) |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
94
Принимается, что прочность трехэлектронной связи небольшая: энергия ее меньше π- связи.
Примером вещества с дефицитом валентных электронов может слу- жить молекула диборана B2 H6 . В молекуле B2 H6 восемь межатомных связей обслуживают всего лишь 12 электронов (вместо 16)
Это возможно потому, что каждый мостиковый атом водорода может образовать с двумя атомами бора двухэлектронную связь
 ∙
∙
∙ |
∙ |
за счет перекрывания двух гибридных sp2 - орбиталей от двух атомов бора и s-орбитали атома водорода. Ввиду изогнутости мостиковой связи В --- Н --- В ее иногда называют «банановой»
Приведенные примеры свидетельствуют о том, что метод ВС мало- пригоден для объяснения природы ковалентной связи в молекулах с из- бытком или дефицитом электронов. Для этих целей обычно используют метод МО. Так, электронная конфигурация молекулы O2 может быть представлена с помощью метода МО в следующем виде:
2O 2s2p4 = O2 σs2 (σ*s )2σ2z π2x π2y (π*x )1(π*y )1 ,
где * – соответствует разрыхляющим молекулярным орбиталям. Присутствие двух неспаренных электронов на разрыхляющих орби-
талях π*x и π*y объясняет парамагнитные свойства кислорода.
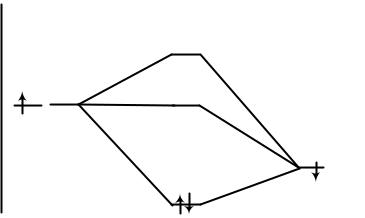
Существование молекулы B2 H6 легко объясняется с помощью энер-
гетической диаграммы (рис. 4.14).
95
 sp3 −
sp3 −
B2H6
σ * σ0
σ
Рис. 4.14. Энергетическая схема уровней трехцентровых орбиталей молекулы B2 H 6
Пара электронов, находящаяся на связывающей σ- орбитали, обеспе- чивает устойчивость молекулы B2 H6 .
Таким образом, методы МО и ВС не противоречат, а дополняют друг друга.
Их объединяют следующие положения:
1)это квантово-химические методы;
2)они являются приближенными;
3)в обоих методах исходят из обобществления электронной плот- ности связывающих электронов;
4)σ- и π- связи отличаются друг от друга как по характеру пере- крывания электронных облаков, так и по свойствам симметрии.
В то же время каждый метод имеет свои преимущества и недостатки.
Метод молекулярных орбиталей:
1)более общий и универсальный;
2)описывает молекулу в целом;
3)объясняет возможность образования многоцентровых связей;
4)предусматривает переход молекул в возбужденное состояние;
5)объясняет природу окраски веществ и их магнитные свойства;
6)количественные расчеты параметров молекул значительно проще
идоступнее.
Метод валентных связей:
1)более нагляден и привычен обычному химическому мышлению;
2)позволяет представить пространственную структурную формулу молекулы.
96
При образовании связи между атомами разных элементов электроны всегда смещаются к более электроотрицательному элементу. Вследствие этого симметрия распределения зарядов нарушается и связь становится полярной. Мерой полярности связи является ее электрический момент ди- поля или дипольный момент (μ ), равный произведению эффективного за- ряда q, возникшего в связи со смещением электронов, на длину связи (d)
µ = q × d . |
(4.5) |
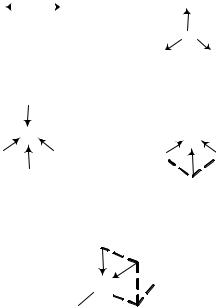
Дипольный момент измеряется в Кл×м (кулон на метр) или в дебаях (Д). 1 Д = 3,33 ×10−30 Кл× м. В двухатомных гетероядерных молекулах диполь- ный момент связи определяет дипольный момент всей молекулы. Если же в состав гетероядерной молекулы входят три и более атомов, то диполь- ный момент таких молекул находят сложением векторов дипольных мо- ментов всех связей. Результирующий дипольный момент симметричных молекул равен нулю, а у несимметричных молекул он отличен от нуля
O |
|
|
C |
|
O |
|
F |
|
|
|
|
|
|||
ÐOCO =180° |
|
B |
|||||
μCO2 |
= 0 |
|
|
||||
|
F |
F |
|||||
|
|
|
|
|
|
ÐFBF = 120° |
|
|
|
H |
μBF = 0 |
||||
|
|
|
|
|
|
|
3 |
|
|
|
C |
|
O |
||
H |
|
H |
H |
H |
|||
|
|
|
H |
|
|
||
ÐHCH =109° |
ÐHOH = 104° |
||||||
μ |
CH 4 |
= 0 |
|
μH |
O μOH 0 |
||
|
|
|
|
2 |
|
||
H
 N
N H
H
H ÐHNH =108°
ÐHNH =108°
μNH3 μNH 0
Химические свойства молекул определяются не только исходным распределением электронной плотности в них, но и способностью стано- виться полярной (или более полярной) в результате действия на молеку- лу внешнего электрического поля. Степень смещения электронной плот- ности под действием внешнего электрического поля характеризует
97
поляризуемость связи. Поляризация связи может происходить и под дей- ствием электрического поля, создаваемого соседними молекулами, атома- ми, ионами и другими источниками.
В результате поляризации может произойти полный разрыв связи с переходом связывающей электронной пары к одному из атомов и образо- ванием ионов.
Химическая связь, образующаяся в результате электростатического взаимодействия между положительно заряженным ионом – катионом и от- рицательно заряженным ионом – анионом, называется ионной. Она не об- ладает насыщаемостью и направленностью. Вследствие ненаправленности и ненасыщаемости ионной связи энергетически наиболее выгодно, чтобы каждый ион был окружен максимальным числом ионов противоположного знака. Однако из-за отталкивания одноименных ионов друг от друга ус- тойчивость системы достигается только при определенном числе соседей. Количество ближайших соседей определяет координационное число для иона. Координационное число зависит от соотношения ионных радиусов. Например, при соотношении ионных радиусов в пределах 0,41 – 0,73 со- седние ионы располагаются в вершинах октаэдра (октаэдрическая коорди- нация), а при соотношении 0,73 – 1,33 – в вершинах куба (кубическая ко- ординация) и т.д.
Таким образом, в результате взаимодействия большого количества ионов образуются ионные кристаллы – « гигантские полимерные молеку- лы». Наименьшему фрагменту ионного кристалла («полимерной молеку- лы») приписывают химическую формулу. Эти формулы отражают состав реально не существующих, виртуальных молекул. Например, NaCl,
KBr, CaF2 и др. Понятие валентности к ионной связи неприменимо. В
этом случае можно говорить только о некоторой формальной (стехиомет- рической) валентности, которая отражает соотношение между катионами и анионами в кристаллической решетке.
Между полярной ковалентной и ионной связями не существует резкой границы. По мере увеличения разности электроотрицательностей ( ЭО) об- разующих связь атомов элементов полярность связи возрастает и в пределе она должна превратиться в чисто ионную, но на практике это не достигается.
Эффективный заряд q на атомах отличается от теоретического (от степени окисления). Если абсолютное значение q в долях заряда электрона (q/e) больше 0,5 (50 %), считается, что атомы превратились в ионы, а связь стала ионной (рис. 4.15).
98
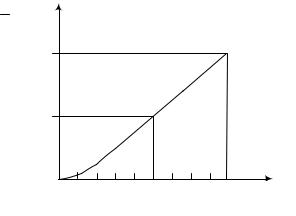
Как следует из рис. 4.15, связь считается ионной при |
ЭО > 1,9, пол- |
|
ностью ионной она бы стала при |
ЭО = 3,5. К 100 %-ной ионности связь |
|
приближается только в CsF и FrF ( ЭО = 4,0 – 0,7 = 3,3). |
|
|
q ×100 |
|
|
e |
|
|
|
∙ |
|
|
∙ |
|
|
∙ |
|
∙ |
|
|
|
ЭО |
|
Рис. 4.15. Зависимость степени ионности связи (q/e) от разности |
||
электроотрицательностей элементов ( ЭО), образующих связь
Ионные молекулы можно обнаружить только в парáх ионных соеди- нений. Причем в парáх ионных соединений содержатся не только отдель- ные молекулы, но и более сложные частицы – ассоциаты, а также ионы. Например, в паре хлорида натрия кроме молекул NaCl присутствуют также
( NaCl )2 , ( NaCl )3 , Na2Cl+ , NaCl2− .
Так как ионная связь осуществляется за счет электростатического притяжения ионов, то ее энергию можно рассчитать, используя закон Кулона. Если ионы считать недеформируемыми заряженными шарами с зарядами, равными е, то сила притяжения между ними выразится уравне- нием закона Кулона
F |
|
= e2 / d 2 , |
(4.6) |
|||
пр |
|
|
|
|
||
где d – расстояние между центрами ионов. |
|
|||||
Энергия притяжения двух ионов по закону Кулона равна |
|
|||||
E |
|
= − |
e2 |
|
(4.7) |
|
пр |
d |
|||||
|
|
|
||||
|
|
|
|
|||
При сближении ионов на очень малых расстояниях проявляются также силы отталкивания, обусловленные взаимодействием электронных оболочек. Энергию отталкивания можно принять обратно пропорциональ- ной расстоянию между ионами в степени n
E = − |
B |
, |
(4.8) |
отт |
d n |
|
где n – коэффициент борновского отталкивания (n >> 1).
99

Учитывая, что сила равна первой производной от энергии по рас- стоянию, получаем из формулы (4.8)
Fотт = - nBn +1 . d
В ионной молекуле на равновесном расстоянии равна силе отталкивания
|
|
e2 |
= n |
|
B |
|
|
|
||||||
|
|
|
|
|
|
|
|
. |
|
|
|
|||
|
|
2 |
|
|
n +1 |
|
|
|
||||||
|
|
d0 |
|
|
|
d0 |
|
|
|
|||||
Отсюда |
|
B = e2 |
d0n −1 |
|
|
|
|
|||||||
|
|
|
|
|
||||||||||
Тогда при d = d0 |
|
|
|
|
|
|
|
|
n |
|
|
|
||
|
|
|
|
|
|
|
|
× d0n −1 |
|
|
|
|||
Eотт |
= |
|
B |
= |
e2 |
= |
e2 |
|||||||
|
d0n |
|
|
n × d0n |
d0 |
× n |
||||||||
|
|
|
|
|
|
|
||||||||
(4.9)
d0 сила притяжения
(4.10)
(4.11)
(4.12)
Энергия ионной связи при d = d0 |
равна сумме Eпр и Eотт |
|
|||||||||
E = Eпр + Еотт |
= - |
e2 |
+ |
e2 |
= - |
e2 |
|
- |
1 |
|
|
|
|
|
1 |
|
|
(4.13) |
|||||
d0 |
d0 × n |
d0 |
|
||||||||
|
|
|
|
|
|
n |
|
||||
Для молекул с зарядами ионов z1 и z2 |
уравнение (4.13) примет вид |
|||||||||
|
z × z |
|
×( |
|
)2 |
|
|
1 |
|
|
|
2 |
e |
|
|
||||||
E = - |
1 |
|
|
|
1 |
- |
|
|
(4.14) |
|
|
d0 |
|
||||||||
|
|
|
|
n |
|
|||||
Это уравнение, известное как уравнение Борна, позволяет оценить энергию ионной связи. Однако вследствие слишком упрощенного подхода к описанию ионной связи рассчитанные по формуле (4.14) энергии не сов- падают с экспериментальными значениями. Кривая зависимости E = f (d )
для ионных молекул имеет такой же вид, как и представленная на рис. 4.4
зависимость для иона H2+ (кривая 1).
Отклонение от чисто ионной связи в любом соединении можно рас- сматривать как результат взаимного влияния ионов друг на друга. Этот эффект не был учтен при выводе уравнения (4.14), что является одной из причин его расхождения с опытом.
Влияние друг на друга близко расположенных противоположно за- ряженных ионов вызывает их взаимную поляризацию.
Процесс поляризации является двусторонним – в нем сочетаются
поляризуемость ионов с их поляризующим действием.
100
