
ShPOR_PO_HIMII_21-40
.doc23.
Межмолекулярное взаимодействие:
-
Ориентационное – проявляется между полярными молекулами. В результате беспорядочного теплового движения молекул при их сближении друг с другом одноименно заряженные концы диполей взаимно отталкиваются, а противоположно заряженные притягиваются. Чем более полярны молекулы, тем сильнее они притягиваются и тем самым больше ориентационное взаимодействие.
-
Индукционное – взаимодействие между полярной и неполярной молекулами. Полярная молекула индуцирует временный дипольный момент и обе молекулы взаимодействуют как диполи.
-
Дисперсионное – мгновенно наведенный диполь. Наиболее универсальное и проявляется между любыми молекулами.
24.
Водородная связь – тип молекулярного взаимодействия, возникает между атомом водорода одной молекулы и атомом сильно электроотрицательного элемента другой молекулы.
Но в отличии от дипольного взаимодействия, механизм возникновения водородной связи обусловлен донорно-акцепторным взаимодействием, где донор – атом электроотрицательного элемента одной молекулы, а акцептор – атом водорода.
Обладает насыщаемостью и направленностью. Определяет свойства веществ в жидком состоянии. Бывает:
-
внутримолекулярная
Н
-
межмолекулярная
Характер химической связи между атомами оказывает влияние на физические и химические свойства веществ.
Наличие водородных связей – более высокая температура кипения воды.
Свойства веществ с ионной связью отличаются от свойств веществ с неполярной ковалентной связью: имеют высокую температуру кипения и плавления, в расплавленном состоянии обладают электропроводностью, в воде диссоциируют на ионы.
А вещества с полярной ковалентной связями занимают между ними промежуточное положение.
25.
Химическая термодинамика изучает:
-
переход энергии из одной формы в другую, от одной части системы к другой.
-
Энергетические эффекты
-
Возможность и направление самопроизвольного протекания процессов.
Система – тело или группа тел, находящихся во взаимодействии с окружающей средой и мысленно обособляемых от нее.
Гетерогенная система – состоит из нескольких фаз.
Гомогенная – однофазная.
Изолированные системы – не могут обмениваться с внешней средой ни веществом, ни энергией.
Закрытые системы – могут обмениваться с внешней средой только энергией.
Открытые системы – и веществом, и энергией (жидкость и ее пар).
Закон сохранения энергии (первое начало термодинамики):
Сообщенная системе теплота расходуется на изменение внутренней энергии и на совершение работы против внешних сил.
Q= U+A
U+A
U=Uпост+Uвращ+Uколеб+Uмежмолек. взаим.
Под величиной А имеют в виду работу против всех сил, действующих на систему.
Изохорный процесс: V=const
-
если поршень закреплен неподвижно, то сообщенная системе теплота идет полностью на увеличение запаса внутренней энергии.
A =p*
V=0
=p*
V=0
Q V=
U
V=
U
Энергия системы определяется тепловым эффектом реакции.
Изобарный процесс: P=const
- если дать возможность поршню свободно перемещаться, то газ, расширяясь, совершит работу:
A=p* V=p(V2-V1)
V=p(V2-V1)
Qp= U+p(V2-V1)
U+p(V2-V1)
U1 и U2 - запас внутренней энергии системы в исходном и конечном состояниях, то
 U=U2-
U1
U=U2-
U1
Qp=(U2+pV2)-(U1+pV1)
Функция H=UpV – энтальпия, является функцией состояния системы.
Энтальпия – рассматривается как энергия расширения системы.
Тепловой эффект процесса – количество выделенной или поглощенной теплоты.
QV= U
Qp=
U
Qp= H
H
Параметры состояния
-
экстенсивные – зависят от количества вещества (V, m)
-
интенсивные – не зависят от количества вещества (T, p)
26.
Термохимия – раздел химии, изучающий тепловые эффекты химических процессов.
Термохимические уравнения – уравнения реакции, в которых указываются тепловые эффекты (и агрегатное состояние веществ).
Для изобарного процесса:
Qp= H=∑
H=∑ Hкон
- ∑
Hкон
- ∑ Hисх.
Hисх.
Для изохорного процесса:
QV= U=∑Uкон
- ∑Uисх.
U=∑Uкон
- ∑Uисх.
Qp ≠ QV
Закон Гесса:
Тепловой эффект реакции зависит только от начального и конечного состояния реагирующих веществ, и не зависит от Пети процесса, т.е. от числа промежуточных стадий.
1-е следствие:
Тепловой эффект реакции равен разности между суммой теплот образования продуктов реакции и суммой теплот образования исходных веществ.
ΔH0p=∑VjΔH0fпрод - ∑VjΔH0fисх
Энтальпия (теплота образования) – тепловой эффект образования 1 моль вещества из простых веществ, устойчивых при стандартных условиях.
Энтальпии образования простых веществ в стандартном состоянии условно принимаются равными 0.
2-е следствие:
Тепловой эффект реакции равен разности между суммой теплот сгорания исходных веществ и суммой теплот сгорания продуктов реакции.
ΔH0p=∑VjΔH0сгор.исх. - ∑VjΔH0сгор.прод.
3-е следствие (закон Лавуазье-Лапласа):
Тепловой эффект разложения какого-либо химического соединения точно равен, но противоположен по знаку тепловому эффекту его образования.
4-е следствие:
Если совершаются две реакции, приводящих из различных начальных состояний к одинаковым конечным состояниям, то разница между их тепловыми эффектами представляет собой тепловой эффект перехода из одного начального состояния в другое.
Стандартная молярная энтальпия плавления (ΔНпл) – изменение энтальпии, которым сопровождается плавление 1 моль вещества при температуре плавления и р=1атм.
Стандартная молярная энтальпия испарения (ΔНисп) – изменение энтальпии, которым сопровождается испарение 1 моль вещества при его температуре кипения и р=1атм.
27.
Состояние любой совокупности частиц можно характеризовать:
-
указав значение непосредственно измеряемых свойств вещества, таких как t и p, которые являются характеристиками макросостояния вещества
-
указав мгновенные характеристики каждой частицы вещества – ее положение в пространстве, скорость и направление перемещения – характеристики микросостояния вещества.
Данному макросостоянию отвечает колоссальное число различных микросостояний.
Критерием направленности процесса может служить степень неупорядоченности системы, мерой которой является функция состояния системы, называемая энтропией (S):
S=k*lnW – уравнение Больцмана
2-е начало термодинамики:
1) невозможен самопроизвольный переход энергии (в форме теплоты) от менее нагретого тела к более нагретому
2) все самопроизвольные процессы в изолированных системах протекают в сторону увеличения энтропии ΔS>0
Энтропия растет:
- с увеличением температуры
- при плавлении (и возгонке) твердого вещества
- при кипении жидкости
- при расширении газа
- при растворении кристаллов
- при диссоциации веществ, когда вследствие роста числа частиц неупорядоченность увеличивается
Энтропия падает:
- при охлаждении
- при отвердевании
- при сжатии
- при кристаллизации из растворов
- в реакциях с уменьшением объема
Стандартная энтропия образования соединения равна изменению энтропии, которое сопровождает реакцию образования 1 моль соединения в стандартных условиях из простых веществ.
В изменении энтропии веществ:
1) усложнение молекулы приводит к увеличению энтропии
2) увеличение твердости веществ, упорядочение структуры приводит к уменьшению энтропии
3) энтропия веществ в аморфном и стеклообразном состояниях больше, чем в кристаллах.
4) энтропия простых веществ и соединений элементов является периодическим свойством
5) среди одинаковых по форме молекул энтропия возрастает с увеличением массы этих соединений
6) с уменьшением плотности Ме энтропия возрастает.
Вывод: для живых организмов, как и для тел неживой природы, полностью выполняются законы термодинамики в целом, энтропия системы организм-среда увеличивается.
28.
Самопроизвольно, т.е. без затраты работы извне, система может переходить только из менее устойчивого состояния в более устойчивое.
В химических процессах одновременно действуют 2 тенденции:
1) стремление частиц объединяться за счет простых связей в более сложные, что уменьшает энтальпию системы
2) стремление частиц разъединяться, что увеличивает энтропию системы
Суммарный эффект этих двух тенденций в процессах, протекающих при постоянных Т и р, отражается изменением изобарно-изотермического потенциала. В честь американского ученого Гиббса, ее называют также свободной энергией Гиббса ΔG, проявляется действие двух прямо противоположных факторов – энтальпийного ΔН и энтропийного.
ΔG= ΔН – ТΔS
ΔGp,t<0 – процесс термодинамически возможен
ΔG>0 – невозможен
ΔG=0 – состояние химического равновесия
Все процессы могут самопроизвольно протекать в сторону уменьшения свободной энергии Гиббса.
ΔGреак.=ΣΔGfкон - ΣΔGfисх.
ΔG образования наиболее устойчивой модификации простого вещества принимается равной нулю.
|
ΔН |
ΔS |
ΔG |
ΔН – ТΔS= ΔG |
возможность/невозможность |
|
- |
+ |
- |
-ΔH-TΔS<0 |
возможно при любых Т |
|
+ |
- |
+ |
ΔH+ TΔS>0 |
невозможно при любых Т |
|
- |
- |
+ - |
-ΔH +TΔS<0 |
при низких Т |
|
+ |
+ |
+ - |
ΔH- TΔS<0 |
при высоких Т |
29.
Под стандартной энергией Гиббса образования ΔG0f понимают изменение энергии Гиббса при реакции образования 1 моль вещества, находящегося в стандартном состоянии. Это определение подразумевает, что стандартная энергия Гиббса образования простого вещества, устойчивого в стандартных условиях, равна нулю.
Изменение энергии Гиббса, как и изменение энтальпии и энтропии системы, не зависит от пути процесса. Поэтому для реакции вида
aA+bB+…=dD+eE+…
изменение стандартной энергии Гиббса ΔG0 равно разности между суммой стандартных энергий Гиббса образования исходных веществ:
ΔG0=(dΔG0f,D+eΔG0f,E+…) – (aΔG0f,A+bΔG0f,B+…)
ΔG0=ΣΔG0f,прод. - ΣΔG0f,исх.
При пользовании значениями стандартной энергии Гиббса критерием принципиальной возможности процесса в нестандартных условиях следует принять условие ΔG0<<0, а критерием принципиальной невозможности осуществления процесса - неравенство ΔG>>0. Разумеется, если ΔG0=0, то это вовсе не означает, что в реальных условиях система будет находится в равновесии. Таким образом, во многих случаях значениями ΔG0 можно пользоваться лишь для приближенной оценки направления реакций.
30.
Химическая кинетика изучает скорость и механизм химических реакций.
Скорость хим. реакции – изменение концентрации реагирующих веществ в единицу времени при неизменном объеме системы:
Vcp= − (c2-c1)/(t2-t1)= - ∆c/∆t – для исходных веществ
Истинная скорость – скорость в данный момент времени, которая определяется как первая производная от концентрации по времени:
Vист= ±dc/dt
Скорость химических реакций зависит от:
-
природы и концентрации реагирующих веществ
-
температуры
-
давления (для реакций с участием газов)
-
присутствия катализаторов
-
среды
-
интенсивности света (в фотохимических реакциях)
31.
Закон действующих масс (1867г.):
скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, возведенных в степени их стехиометрических коэффициентов.
m A
+ nB
= pC
+ gD
A
+ nB
= pC
+ gD
V (скорость)
= k1*cAm*cBn
(скорость)
= k1*cAm*cBn
V = k2*cCp*cDg
k – коэффициент пропорциональности (константа скорости)
k – зависит от природы реагирующих веществ и температуры, но не зависит от концентрации!
Кинетическое уравнение связывает скорость реакции с концентрацией.
32.
Правило Вант-Гоффа:
при повышении температуры на каждые 100С, скорость гомогенной химической реакции увеличивается в 2-4 раза.
По этому правилу определяется приближенная зависимость:
V2/V1 = γ∆t/10 V – скорость, γ – температурный коэффициент
γ = (kt + 10)/kt ≈ 2-4
γ – это отношение константы
Уравнение Аррениуса:
k = A*e*(-Ea)/RT
В логарифмической форме:
lnk = lnA – Ea/RT
A – предэкспоненциальный множитель
33.
Активированный комплекс – соединение, в котором ослаблены и удлинены связи, разрываемые в ходе данной реакции.
Р
 азность
энергий активации прямой и обратной
реакции равна тепловому эффекту:
азность
энергий активации прямой и обратной
реакции равна тепловому эффекту:
∆
 H
= Ea
– Ea,
∆H<0
– экзотермический
процесс
H
= Ea
– Ea,
∆H<0
– экзотермический
процесс
Ea>Ea, ∆H>0 – эндотермический процесс
Уравнение Аррениуса:
k = A*e*(-Ea)/RT
В логарифмической форме:
lnk = lnA – Ea/RT
A – Предэкспоненциальный множитель
lnkT1 = lnA – Ea/RT1 (1)
lnkT2 = lnA – Ea/RT2 (2)
(2) – (1):
lnkT2 – lnkT1 = - Ea/RT2 + Ea/RT1
lnkT2/kT1 = Ea/R(1/T1 – 1/T2)
34.
Катализатор – вещество, изменяющее скорость химической реакции, но само в реакции не образуется и в конечные продукты не входит.
B + A kat
AB
+ A kat
AB
S O2
+ 1/2O2
NO
SO3
O2
+ 1/2O2
NO
SO3
A
 + K [A…K] [A…K] + B AB +
K
+ K [A…K] [A…K] + B AB +
K
1
 /2O2
+ NO NO2
NO2
+ SO2
SO3
+ NO
/2O2
+ NO NO2
NO2
+ SO2
SO3
+ NO
Если Ea этих стадий ниже Ea процесса в отсутствии катализатора, то общая скорость процесса увеличивается, и такой катализ называют положительным.
Если скорость процесса уменьшается, то катализ будет отрицательным (ингибитором).
Ингибиторы отличаются от катализаторов тем, что входят в состав продуктов реакции.
В присутствии катализатора Ea реакции снижается на величину ∆Eak.
Катализаторы обладают избирательностью (селективностью):
C 2H5OH
AL2O3
C2H4
+ H2O
– дегидратация этанола (350-3600C)
2H5OH
AL2O3
C2H4
+ H2O
– дегидратация этанола (350-3600C)
C 2H5OH
Cu
CH3
– COH
+ H2
–
дегидрирование этанола (200-2500C)
2H5OH
Cu
CH3
– COH
+ H2
–
дегидрирование этанола (200-2500C)
Гетерогенный катализ – катализатор и реагенты находятся в разных фазах, и процесс протекает на поверхности их раздела.
Каталитические яды – вещества, которые снижают активность или полностью деактивируют твердый катализатор.
Промоторы – вещества, усиливающие действие катализатора данной реакции, хотя сами катализаторами не являются.
Ферменты (энзимы) – биологические катализаторы.
Ферменты – особый класс белков, присутствие которых в небольших количествах жизненно необходимо для всех биологических организмов.
Особенности ферментов как катализаторов:
-
исключительно большая каталитическая активность
-
высокая химическая специфичность
-
инактивация
35.
Необратимые реакции – реакции, которые протекают только в одном направлении и идут до конца.
В практически необратимых преобладает реакция, идущая в одном направлении. Среди них выделяют несколько типов:
-
реакции двойного обмена с образованием малорастворимого вещества.
N aCI
+ AgNO3
= NaNO3
+ AgCI
aCI
+ AgNO3
= NaNO3
+ AgCI
C I-
+ Ag+
= AgCI
I-
+ Ag+
= AgCI
-
р
 еакции
с образованием газообразных веществ
еакции
с образованием газообразных веществ
Na2CO3 + 2HCI = 2NaCI + H2O + CO2
C O32-
+ 2H+
= H2O
+ CO2
O32-
+ 2H+
= H2O
+ CO2
-
реакции с образованием малодиссоциирующих веществ
HNO3 + KOH = KNO3 + H2O
H+ + OH- = H2O
-
и
 онные
ОВР
онные
ОВР
Zn + H2SO4 = ZnSO4 + H2
-
реакции, приводящие к образованию комплексных соединений
CuSO4 + 4NH4OH = [Cu(NH3)4]SO4 + 4H2O
Cu2+ + 4NH4OH = [Cu(NH3)4]2+ + 4H2O
-
реакции, сопровождающиеся большим количеством энергии
C6H12O6 + 6O2 = 6CO2 + 6H2O; ∆H0 = - 2867 кДж/моль
 2KCIO3
= 2KCI + 3O2
2KCIO3
= 2KCI + 3O2
Pb(N3)2 = Pb + 3H2
Обратимые – протекают в противоположных направлениях и не идут до конца.
C + CO2
2CO
+ CO2
2CO
N 2
+ 3H2
2NH3
2
+ 3H2
2NH3
Химическое равновесие – состояние системы реагирующих веществ, при котором скорости прямой и обратной реакций равны между собой.
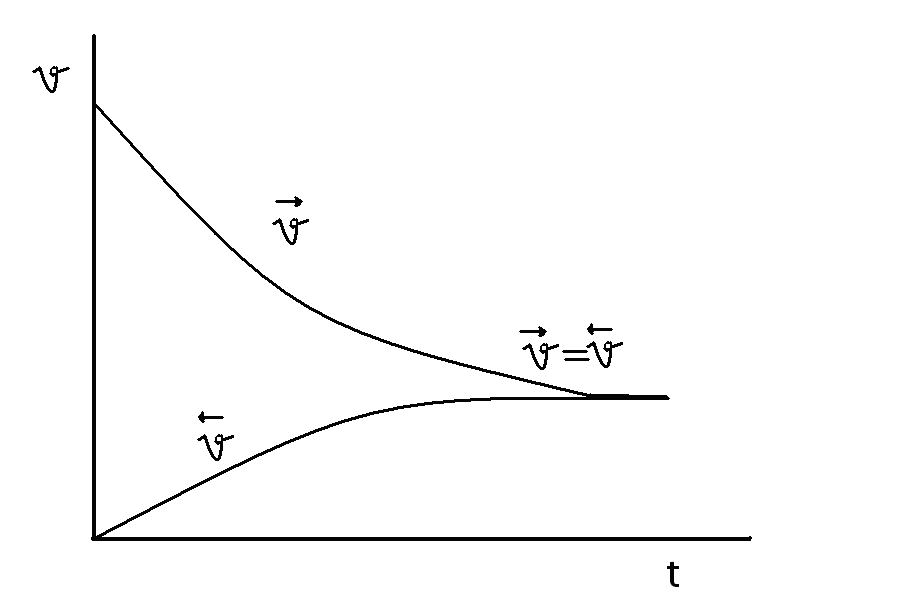
в общем виде:
mA
+ nB
![]() pС
+ gD
pС
+ gD
→ v1 = к1 · [A] m · [B] n
← v2 = k2 · [C] p · [D] g
Концентрации реагирующих веществ, которые устанавливаются при химическом равновесии, называются равновесными, обозначаются при помощи квадратных скобок, в отличии от неравновесных.
В состоянии динамического равновесия v1 = v2 - кинетическая концепция равновесия. С течением времени v1 уменьшается, а v2- увеличивается. В некоторый момент они становятся равными.
k1 · [A]m · [B]n = k2· [C]p · [D]g
Кс = k1/k2 = [ C]p · [D]g/ [A]m · [B]n
Константа Кс, отражающая соотношение концентраций компонентов обратимой реакции в состоянии динамического равновесия называется константой равновесия.
Кс = [C]p · [D]g / [A]m · [B]n –
уравнение закона действующих масс в общем виде.
Формулировка закона действующих масс (з.д.м.) для обратимых реакций:
В данной обратимой реакции при данной температуре отношение произведений равновесных концентраций продуктов реакции и исходных веществ, возведенных в степени их стехиометрических коэффициентов есть величина постоянная.
Кс показывает во сколько раз скорость прямой реакции больше скорости обратной, если концентрации каждого из реагирующих веществ равны 1 моль/л. В этом физический смысл константы равновесия.
Константа равновесия определяет глубину протекания процесса в момент достижения состояния равновесия. Чем больше К, тем полнее происходит взаимодействие веществ. Зная К, можно вычислить теоретически возможный выход продуктов реакции.
З.д.м. применим ко всем обратимым реакциям.
Для гомогенных газов, реакций при небольших давлениях, когда газ подчиняется законам идеальных газов, вместо концентраций используют равновесные парциальные давления реагентов.
Р
=
![]() · R
·T
· R
·T
P = Cm · R · T
См = n/V, P = Cм · R · T, См = P/R · T
mA
+ nB
![]() pС
+ gD
pС
+ gD
Кp
=
P![]() ·
P ·
·
P ·![]() /Р
/Р![]() ·
Р
·
Р![]() ,
,
