
УЧЕБНИК ПО ФХ
.pdf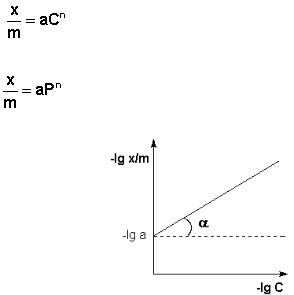
4. Притяжение молекулы адсорбата поверхностью адсорбента не зави-
сит от наличия в адсорбционном объеме других молекул, вследствие чего возможна полимолекулярная адсорбция.
5. Адсорбционные силы не зависят от температуры и, следовательно, с
изменением температуры адсорбционный объем не меняется.
10. Уравнение Фрейндлиха. Изотерма адсорбции.
Теоретические представления, развитые Лэнгмюром и Поляни, в значи-
тельной степени идеализируют и упрощают истинную картину адсорбции.
На самом деле поверхность адсорбента неоднородна, между адсорбирован-
ными частицами имеет место взаимодействие, активные центры не являются полностью независимыми друг от друга и т.д. Все это усложняет вид урав-
нения изотермы. Г.Фрейндлих предположил, что число молей адсорбиро-
ванного газа или растворенного вещества, приходящееся на единицу массы адсорбента (т.н. удельная адсорбция x/m) должна быть пропорциональна равновесному давлению (для газа) или равновесной концентрации (для ве-
ществ, адсорбируемых из раствора) адсорбента, возведенной в некоторую степень, которая всегда меньше единицы:
(VΙΙΙ.24)
(V111.25)
Рис. 47. Изотерма адсорбции Фрейндлиха в логарифмических координатах.
171

Показатель степени n и коэффициент пропорциональности а в уравне-
нии Фрейндлиха определяются экспериментально. Логарифмируя уравнения
(VΙΙΙ.24, V111.25) получаем:
(V111.26)
(V111.27)
Т.о., зависимость логарифма удельной адсорбции от логарифма концен-
трации (давления) графически выражается прямой линией, отсекающей на оси ординат отрезок, равный lga, тангенс угла наклона которой к оси абсцисс равен по величине показателю степени при давлении или концентрации (рис.
47):
(V111.28)
11. Адсорбция на границе твердое тело – раствор
Молекулярная адсорбция из растворов
Изотермы адсорбции растворенных веществ из раствора по своему виду аналогичны изотермам адсорбции для газов; для разбавленных растворов эти изотермы хорошо описываются уравнениями Фрейндлиха или Лэнгмюра,
если в них подставить равновесную концентрацию растворенного вещества в растворе. Однако адсорбция из растворов является значительно более слож-
ным явлением по сравнению с газовой, поскольку одновременно с адсорбци-
ей растворенного вещества часто происходит и адсорбция растворителя.
Рис. 48 Ориентация молекул ПАВ на поверхности адсорбента.
172
Зависимость адсорбции от строения молекул адсорбата очень сложна, и
вывести какие-либо закономерности довольно трудно. Молекулы многих ор-
ганических веществ состоят из полярной (гидрофильной) и неполярной
(гидрофобной) группировок, т.е. являются поверхностно-активными вещест-
вами. Молекулы ПАВ при адсорбции на твердом адсорбенте ориентируются на его поверхности таким образом, чтобы полярная часть молекулы была об-
ращена к полярной фазе, а неполярная – к неполярной. Так, при адсорбции алифатических карбоновых кислот из водных растворов на неполярном ад-
сорбенте – активированном угле – молекулы ориентируются углеводород-
ными радикалами к адсорбенту; при адсорбции из бензола (неполярный рас-
творитель) на полярном адсорбенте – силикагеле – ориентация молекул ки-
слоты будет обратной (рис. 48).
Адсорбция из растворов электролитов
Адсорбция из водных растворов электролитов происходит, как правило,
таким образом, что на твердом адсорбента из раствора адсорбируются пре-
имущественно ионы одного вида. Преимущественная адсорбция из раствора или аниона, или катиона определяется природой адсорбента и ионов. Меха-
низм адсорбции ионов из растворов электролитов может быть различным;
выделяют обменную и специфическую адсорбцию ионов.
Обменная адсорбция представляет собой процесс обмена ионов между раствором и твердой фазой, при котором твердая фаза поглощает из раствора ионы какого-либо знака (катионы либо анионы) и вместо них выделяет в раствор эквивалентное число других ионов того же знака. Обменная адсорб-
ция всегда специфична, т.е. для данного адсорбента к обмену способны только определенные ионы; обменная адсорбция обычно необратима.
При специфической адсорбции адсорбция на поверхности твердой фазы ионов какого-либо вида не сопровождается выделением в раствор эквива-
лентного числа других ионов того же знака; твердая фаза при этом приобре-
тает электрический заряд. Это приводит к тому, что вблизи поверхности под
173
действием сил электростатического притяжения группируется эквивалент-
ное число ионов с противоположным зарядом, т.е. образуется двойной элек-
трический слой. Взаимодействие концентрирующихся на поверхности заря-
дов приводит к понижению поверхностной энергии системы. Для случая специфической адсорбции электролита Песковым и Фаянсом было сформу-
лировано следующее эмпирическое правило:
На поверхности кристаллического твердого тела из раствора элек-
тролита специфически адсорбируется ион, который способен дост-
раивать его кристаллическую решетку или может образовывать с одним из ионов, входящим в состав кристалла, малорастворимое со-
единение.
12.Вопросы и задачи
1.Что такое поверхностная энергия?
2.Какие способы уменьшения поверхностной энергии существу-
ют?
3.Что такое адгезия и когезия ? Каким уравнением они связаны со свободной энергией?
4.Что называется капиллярным давлением? Каким уравнением оно определяется?
5.Напишите уравнение Томсона. Какие явления объясняет это уравнение?
6.Что называется краевым углом смачивания?
7.Как определяют радиусы кривизны выпуклой и вогнутой по-
верхностей?
8.Что такое теплота смачивания? Что характеризует его величи-
на?
174
9.В чем сущность гидрофилизации и гидрофобизации поверхно-
стей?
10.Вертикально установленная капиллярная трубка с внутренним диаметром d = 3· 10-2 мкм одним концом погружена в жидкость на глубину h = 3 см, а вторым соединена с сосудом. в котором поддерживается избыточное давление. Определить, при каком давлении в сосуде будет происходить отрыв пузырьков воздуха от нижнего, погруженного в жидкость конца капилляра. По-
верхностное натяжение и плотность жидкости соответственно равны Q = 72· 10-3 н/м и ρ = 1· 103 кг/м3.
соприкосновении с жидкостью пластинка втягивается в нее на
глубину Решение
Пузырек воздуха отрывается, когда давление в сосуде станет равным сумме гидростатического давления столба жидкости, вы-
сота которого равна глубине погружения капилляра, и капилляр-
ного давлении, действующего на поверхность пузырька:
Р = h(р2 – р1)q + 2Q/r,
где r – радиус капилляра, равный в момент отрыва пузырька ра-
диусу кривизны его поверхности. Так как
р2 > > р1, то
Р= hРq + 2Q/r = 3· 10-2· 103·9,8 + 2·72· 10-3/1,5 · 10-4 = 125 кПа.
11.Стеклянная пластинка размером 20х20х0,1 мм подвешена к кварцевой пружине с коэффициентом жесткости К = 1,43.
Грань пластины 29х0,1 мм горизонтально. При соприкоснове-
нии с жидкостью пластина втягивается в не на глубину h = 2мм. Определить поверхностное натяжение жидкости, если плотность ρ = 1· 103кг/м3, а краевой угол смачивания = 0º.
175
Решение
Пластина при соприкосновении с жидкостью будет в нее втя-
гиваться под действием силы, равной произведению Q на дли-
ну границы контакта пластины, жидкости и воздуха. На час-
тично погруженную пластину, кроме того будет действовать выталкивающая сила. При механическом равновесии эти две силы уравновешены силой жесткости пружины. Поэтому
Q (а + b) – аbРqh = kh, где
а и b – размеры горизонтальной грани пластины. Откуда
Q = (аbРq + k)h/2(а + b) = (20 · 10-3 · 0,1 · 10-3 · 103 · 0,91 + 1.43)2 · 10-3/2(20 ·10-3 + 0,1 · 10-3 ) = 72 · 10-3 н/м.
12.Дать определение адсорбции и назвать ее виды.
13.Какие вещества называют поверхностно-активными? Привес-
ти примеры.
14. Вычислить количество теплоты, которое выделится при сма-
чивании 3 кг угля, если теплота смачивания угля водой равна
11, 6 кал/г.
15. Сформулировать правило Траубе и иллюстрировать его при-
мерами.
16. Укажите различие между физической адсорбцией и хемосорб-
цией.
17. Написать уравнения изотермы адсорбции Фрейндлиха и Лен-
гмюра
18. В чем сущность теории адсорбции Поляни?
176
19. Пользуясь правилом Траубе, найти, во сколько раз поверхно-
стная активность амилового спирта СН3(СН2)3СН2ОН больше поверхностной активности этилового спирта С2Н5ОН.
20. Вычислить константу адсорбции пропилового спирта С3Н8О
при 15ºС из водного раствора с концентрацией 0,12 моль/л.
Поверхностное натяжение воды при 15ºС равно 73,49 · 10-3 н/м,
а 0,12 М раствора спирта – 63,3 · 10-3 н/м.
Решение
Используем уравнение Гиббса
Г = - С ·
Для приближенных расчетов можно заменить
на ∆ = − о∆С С−Со
0,12
Г = - 8,31·103·298· · , где ζ – поверхностное натяжение раствора, ζо – по-
верхностное натяжение воды; с – концентрация спирта в растворе; со – его кон-
центрация в воде, равная 0.
Концентрация раствора с = 0,12 моль/л = 0,23 кмоль/м3, R = 8,31· 103
Дж/(град · кмоль.
Находим:
63,3 ·10−4−73,·10−3) = 4,2 · 10-9 кмоль/м2. 0,12
21. Вычислить величину адсорбции пропионовой кислоты СН3СН2СООН из раствора с концентрацией 0,5 моль/л при 15ºС. Поверхностное натяжение раствора и воды при 15ºС равны соответственно 54,1 · 10-3 и 73,49 ·10-3
н/м.
22. Найти равновесную концентрацию уксусной кислоты, для которой х/ m в
уравнении Фрейндлиха равна 0,012 кмоль/м2, а константы k и n равны со-
ответственно 0,25 и 3,1.
177
Глава ΙΧ. КОЛЛОИДНЫЕ СИСТЕМЫ
1. Введение
Коллоидные системы относятся к дисперсным системам – системам, где одно вещество в виде частиц различной величины распределено в другом.
Дисперсные системы чрезвычайно многообразны; практически всякая ре-
альная система является дисперсной. Дисперсные системы классифицируют прежде всего по размеру частиц дисперсной фазы (или степени дисперсно-
сти); кроме того, их разделяют на группы, различающиеся по природе и аг-
регатному состоянию дисперсной фазы и дисперсионной среды.
Если дисперсионной средой является жидкость, а дисперсной фазой – твердые частицы, система называется взвесью или суспензией; если дис-
персная фаза представляет собой капельки жидкости, то систему называют эмульсией. Эмульсии, в свою очередь, подразделяют на два типа: "масло в воде" (когда дисперсная фаза – неполярная жидкость, а дисперсионная среда
– полярная жидкость) и "вода в масле" (когда полярная жидкость дисперги-
рована в неполярной). Среди дисперсных систем выделяют также пены (газ диспергирован в жидкости) и пористые тела (твердая фаза, в которой дис-
пергированы газ либо жидкость).
По степени дисперсности выделяют обычно следующие классы дис-
персных систем:
Грубодисперсные системы – системы, размер частиц дисперсной фазы в которых превышает 10-7 м.
Коллоидные системы – системы, размер частиц дисперсной фазы в ко-
торых составляет 10-7 – 10-9 м. Коллоидные системы характеризуются гете-
рогенностью, т.е. наличием поверхностей раздела фаз и очень большим зна-
чением удельной поверхности дисперсной фазы. Это обусловливает значи-
178
тельный вклад поверхностной фазы в состояние системы и приводит к появ-
лению у коллоидных систем особых, присущих только им, свойств.
Иногда выделяют молекулярно(ионно)-дисперсные системы, которые,
строго говоря, являются истинными растворами, т.е. гомогенными система-
ми, поскольку в них нет поверхностей раздела фаз.
Коллоидные системы, в свою очередь, подразделяются на две группы,
резко отличные по характеру взаимодействий между частицами дисперсной фазы и дисперсионной среды – лиофобные коллоидные растворы (золи) и
растворы высокомолекулярных соединений (ВМС), которые ранее называли лиофильными коллоидами. К лиофобным коллоидам относятся системы, в
которых частицы дисперсной фазы слабо взаимодействуют с дисперсионной средой; эти системы могут быть получены только с затратой энергии и ус-
тойчивы лишь в присутствии стабилизаторов.
Растворы ВМС образуются самопроизвольно благодаря сильному взаи-
модействию частиц дисперсной фазы с дисперсионной средой и способны сохранять устойчивость без стабилизаторов. Лиофобные коллоиды и раство-
ры ВМС различаются также и структурой частиц, составляющих дисперс-
ную фазу. Для лиофобных коллоидов единицей структуры является сложный многокомпонентный агрегат переменного состава – мицелла, для растворов ВМС – макромолекула.
2. Методы получения коллоидных систем
Коллоидные системы по степени дисперсности занимают промежуточ-
ное положение между истинными растворами (молекулярноили ионно-
дисперсными системами) и грубодисперсными системами. Поэтому колло-
идные растворы могут быть получены либо путем ассоциации (конденсации)
молекул и ионов истинных растворов, либо дальнейшим раздроблением час-
тиц дисперсной фазы грубодисперсных систем.
179
Методы получения коллоидных растворов также можно разделить на две группы: методы конденсации и диспергирования (в отдельную группу выделяется метод пептизации, который будет рассмотрен позднее). Еще од-
ним необходимым для получения золей условием, помимо доведения разме-
ров частиц до коллоидных, является наличие в системе стабилизаторов – веществ, препятствующих процессу самопроизвольного укрупнения колло-
идных частиц.
Дисперсионные методы
Дисперсионные методы основаны на раздроблении твердых тел до час-
тиц коллоидного размера и образовании таким образом коллоидных раство-
ров. Процесс диспергирования осуществляется различными методами: меха-
ническим размалыванием вещества в т.н. коллоидных мельницах, электроду-
говым распылением металлов, дроблением вещества при помощи ультразву-
ка.
Механические методы. При этом методе применяются специальные ма-
шины, работающие по принципу ударного размельчения и растирания измель-
чаемых веществ. Наибольшее значение из механических устройств для дис-
пергирования веществ имеют шаровые и коллоидные мельницы. Шаровая мельница представляет собой полый цилиндр, в котором находятся стальные или фарфоровые шарики разных размеров. В цшаровую мельницу загружают вещество, подлежащее раздроблению, и он с помощью электромотора приво-
дится в быстрое вращение. Измельчение вещества происходит за счет движе-
ния шариков, находящихся в цилиндре.
Для получения высокой степени дисперсности, используют коллоидные мельницы. Она представляет собой полый цилиндр, внутри которого находит-
ся ротор с лопастями. Диспергирование веществ происходит в зазорах между лопастями ротора и выступами внутри корпуса в результате быстрого враще-
ния вала.
180
