
- •Лабораторный практикум
- •1.2 Газожидкостная хроматография
- •1.2.1 Качественный анализ. Идентификация компонентов анализируемой смеси
- •1.2.2 Количественный анализ
- •Метод нормализации площадей
- •Определение калибровочных коэффициентов
- •Метод стандартных добавок
- •1.2.3 Блок-схема газового хроматографа
- •1.3 Бумажная и тонкослойная хроматография
- •Тонкослойной хроматографии
- •1.4 Ионообменная хроматография
- •Лабораторная работа № 1
- •Качественный и количественный анализ
- •Многокомпонентных смесей углеводородов
- •Методом газо-жидкостной хроматографии
- •Вопросы к отчету по лабораторной работе: «Качественный и количественный анализ многокомпонентных смесей углеводородов методом газо-жидкостной хроматографии»
- •Лабораторная работа № 2
- •Методом бумажной хроматографии
- •Вопросы к отчету по теме «Бумажная и тонкослойная хроматография»
- •Лабораторная работа № 3
- •Методом ионообменной хроматографии
- •Вопросы к отчету по теме
- •Кондуктометрическое титрование
- •Аппаратура кондуктометрических измерений
- •Платиновыми электродами (кондуктометрическая ячейка)
- •2.1.3 Методика кондуктометрических измерений
- •2.2 Высокочастотное титрование
- •2.2.1 Теоретические основы
- •2.2.2 Аппаратура для проведения высокочастотного титрования
- •Для высокочастотного титрования
- •2.3 Потенциометрический метод анализа
- •2.3.1 Теоретические основы
- •С использованием ионоселективных электродов:
- •На кривой титрования методом трёх касательных
- •2.4 Амперометрическое титрование
- •2.4.1 Теоретические основы
- •2.4.2 Схема установки для амперометрического титрования
- •Лабораторная работа № 5 определение содержания сульфат-ионов в растворе методом прямой кондуктометрии
- •Выполнение работы
- •Лабораторная работа № 6
- •Анализ смеси хлористоводородной
- •И борной кислот методом
- •Высокочастотного титрования
- •Выполнение работы
- •Вопросы к отчету по теме «Кондуктометрический метод анализа. Высокочастотное титрование»
- •Лабораторная работа № 7 определение содержания бромид-ионов в растворе с помощью метода ионометрии
- •Выполнение работы
- •От логарифма концентрации
- •Лабораторная работа № 8 определение коэффициента селективности ионоселективного электрода
- •От логарифма концентрации иона в присутствии мешающего иона
- •Вопросы к отчету по теме «Потенциометрический метод анализа»
- •Лабораторная работа № 10 амперометрическое определение железа
- •Лабораторная работа № 11 амперометрическое определение цинка
- •Лабораторная работа № 12 амперометрическое определение меди
- •Вопросы к отчету по теме «Амперометрическое титрование»
- •Библиографический список
- •Оглавление
- •Учебное издание
2.4.2 Схема установки для амперометрического титрования
с платиновым вращающимся электродом
На рисунке 2.14 представлена схема установки для амперометрического титрования с платиновым вращающимся электродом.
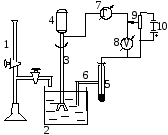
Рисунок 2.14 – Схема установки для амперометрического титрования
с платиновым вращающимся электродом:
1 – микробюретка; электролизёр; 2 - платиновый электрод с мешалкой;
3 - электродвигатель; 4 - каломельный электрод; 5 - солевой мостик;
6 – гальванометр; 7- вольтметр; 8 - потенциометр; 9 - источник питания
(батарея на 4,3 В)
Лабораторная работа № 4
АНАЛИЗ СМЕСИ ХЛОРИСТОВОДОРОДНОЙ
И БОРНОЙ КИСЛОТ МЕТОДОМ
КОНДУКТОМЕТРИЧЕСКОГО ТИТРОВАНИЯ
|
Цель работы: |
определить массовое содержание сильной и слабой кислот в анализируемой смеси. |
|
Реактивы: |
раствор хлористоводородной кислоты с точно известной концентрацией, стандартный раствор NaOH, смесь хлористоводородной и борной кислот. |
|
Посуда: |
кондуктометр марки ОК-102/1, электролитическая ячейка, микробюретка емкостью 10 см3. |
Метод
основан на титровании смеси этих кислот
стандартным раствором щелочи и измерении
электропроводности после добавления
каждой порции титранта. Вначале титруется
хлористоводородная кислота, затем
слабая – борная (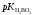 =9,12).
=9,12).
Выполнение работы
Стандартизация титранта NaOH проводится титрованием раствора хлористоводородной кислоты с точно известной концентрацией. Для этого 10,00 см3 раствора хлористоводородной кислоты помещается в электролитическую ячейку, добавляется дистиллированная вода на 0,5 см выше уровня электродов и проводится кондуктометрическое титрование.
Для определения содержания хлористоводородной и борной кислот получают у лаборанта смесь кислот в электролитическую ячейку, добавляют дистиллированную воду на 0,5 см выше уровня электродов и проводят кондуктометрическое титрование, как описано выше.
Расчет результатов анализа
По результатам кондуктометрического титрования раствора хлористоводородной кислоты рассчитывается молярная концентрация эквивалента щелочи по формуле
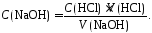 .
.
Расчет содержания кислот в смеси производят по формуле
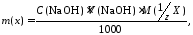
где C (NaOH) и V (NaOH) – молярная концентрация эквивалента титранта и объем титранта, затраченного на титрование кислоты;
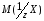 -
масса эквивалента определяемой кислоты.
-
масса эквивалента определяемой кислоты.
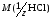 =36,5
(z=1);
=36,5
(z=1); =61,83
(z=1).
=61,83
(z=1).
Лабораторная работа № 5 определение содержания сульфат-ионов в растворе методом прямой кондуктометрии
|
Цель работы: |
определить концентрацию сульфата натрия в анализируемом растворе. |
|
Реактивы: |
сульфат натрия (х.ч.). |
|
Посуда: |
мерные колбы вместимостью 50 см3 (6 шт.), капельницы, резиновые пробки, электролитическая ячейка, кондуктометр марки ОК–102/1. |
Определение основано на измерении электропроводности анализируемого раствора, содержащего сульфат-ионы.
Выполнение работы
Приготавливают 500 см3 раствора Na2SO4 молярной концентрации 0,2 моль/дм3. Затем из данного раствора готовят растворы с молярной концентрацией 0,15; 0,1; 0,07; 0,04; 0,02; 0,01 моль/дм3. Для этого в 6 мерных колб вместимостью 50 см3 помещают 30, 25, 17,5; 10, 5, 2,5 см3 раствора Na2SO4, молярной концентрации 0,2 моль/дм3, разбавляют дистиллированной водой до метки и тщательно перемешивают содержимое колб. Измеряют электропроводность полученных растворов, помещая в кондуктометрическую ячейку последовательно растворы из всей мерных колб, начиная с меньшей концентрации раствора. Электропроводность каждого раствора одной и той же концентрации должна измеряться 5 раз и определяется среднее арифметическое значение электропроводности.
Затем у лаборанта в мерную колбу получают анализируемый раствор, разбавляют водой до метки и определяют его электропроводность описанным выше методом (5 раз).
Расчет результатов анализа
1) Результаты измерения электропроводности стандартных и анализируемого растворов Na2SO4 приведены в таблице 1.
Таблица 1 – Результаты экспериментов
|
Концентрация раствора Na2SO4, моль/дм3 |
Электропроводность G, См | |||||
|
1 |
2 |
3 |
4 |
5 |
Среднее | |
|
|
|
|
|
|
|
|
|
Анализируемый р-р |
|
|
|
|
|
|
2) Построение калибровочного графика и определение концентрации анализируемого раствора.
Калибровочный график строится по результатам, приведенным в таблице 1.
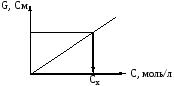
моль/дм3
Результат проверяют у преподавателя или лаборанта, оформляют отчет по выполненной работе.
