
Контрольные задания
-
Составьте электронные и графические формулы с порядковыми номерами 23 и 35. К какому семейству элементов относится каждый из них? Сколько электронов находится на каждом энергетическом уровне и подуровне у атомов этих элементов? Чему равна валентность элементов в нормальном состоянии?
-
Составьте электронные и графические формулы для атомов элементов с порядковыми номерами 17 и 29. На основании электронных формул определите период и группу периодической системы, в которых находятся эти элементы? К какому семейству элементов относится каждый из них?
-
Составьте электронные и графические формулы с порядковыми номерами 21 и 40. Сколько электронов находится на каждом энергетическом уровне и подуровне у атомов этих элементов. Чему равна валентность элементов в нормальном состоянии? К какому семейству элементов относится каждый из них?
-
Составьте электронные и графические формулы с порядковыми номерами 15 и 24. На основании электронных формул определите период и группу периодической системы, в которых находятся эти элементы? К какому семейству элементов относится каждый из них?
-
Составьте электронные и графические формулы с порядковыми номерами 22 и 54. Какие орбитали каждого энергетического уровня занимают электроны в атомах этих элементов? Чему равна валентность элементов в нормальном состоянии? К какому семейству элементов относится каждый из них?
-
Составьте электронные и графические формулы с порядковыми номерами 17 и 24 .На основании электронных формул определите период и группу периодической системы, в которых находятся эти элементы? К какому семейству элементов относится каждый из них?
-
Составьте электронные и графические формулы с порядковыми номерами 16 и 46, учитывая, что последний, находясь в пятом периоде, на пятом энергетическом ровне не содержит ни одного электрона.
-
Составьте электронные и графические формулы с порядковыми номерами 25 и 34. Какие орбитали каждого энергетического уровня занимают электроны в атомах этих элементов? Чему равна валентность элементов в нормальном состоянии? К какому семейству элементов относится каждый из них?
-
Составьте электронные и графические формулы с порядковыми номерами 12 и 41, учитывая, что у последнего происходит провал одного 5s-электрона на 3d–подуровень. На основании электронных формул определите период и группу периодической системы, в которых находятся эти элементы? К какому семейству элементов относится каждый из них?
-
В чем заключается принцип наименьшей энергии? Чем отличается последовательность заполнения атомных орбиталей у атомов d-элементов в отличие от последовательности заполнения их у атомов s- и р-элементов? Составьте электронные формулы атомов элементов технеция и цезия.
-
Что называется электрическим моментом диполя? В каких единицах он выражается? Какие из молекул HF, НСl, ICl, HI имеют наибольший момент диполя? Ответ мотивируйте исходя из значений электроотрицательности соответствующих элементов.
-
Какая химическая связь называется ионной? Как она образуется и какими свойствами обладает? Что следует понимать под эффективным зарядом атома в соединении?
-
Как метод валентных связей объясняет линейную структуру молекулы СО2? Сколько σ– и π–связей и за счет каких электронов образует углерод в этой молекуле? Имеет ли молекула CO2 электрический момент диполя? Почему?
-
Распределите электроны ионов N-, N+ и О- по квантовым ячейкам. Какую валентность проявляют эти ионы в соединениях? Как метод валентных связей рассматривает строение молекулы N2О?
-
Как метод валентных связей объясняет строение молекулы Н2О? Почему угол между связями Н–О близок к тетраэдрнческому?
-
Как метод валентных связей объясняет направленность коваленной связи. Как метод валентных связей объясняет строение молекулы NH3? Почему угол между связями Н–N близок к тетраэдрическому?
-
Как метод валентных связей объясняет линейную фору молекулы ВеCl2 и угловую Н2О?
-
Как метод валентных связей объясняет строение молекул BF3 и СН4?
-
Какая ковалентная связь называется σ– и π–связью? Как метод ВС объясняет строение молекулы азота?
-
Как метод валентных связей объясняет тетраэдрическое строение молекулы и CCl4 и октаэдрнческое SF6?
-
Исходя из степени окисления марганца , серы и азота в соединениях KMnO4, H2S HNO2 определите, какое из них может проявлять окислительные своства. какое восстановительные и какое может проявлять как окислительные так и восстановительные свойства? Почему. На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
Na2Cr2O7 + NaNO2 + H2SO4→Cr2(SO4)3 + NaNO3 + Na2SO4 + H2O
-
Исходя из степени окисления хрома , серы и иода в соединениях K2Cr2O7, H2SO3 KI определите, какое из них может проявлять окислительные своства. какое восстановительные и какое может проявлять как окислительные так и восстановительные свойства?
-
Почему. На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
H3AsO3 + KMnO4 + H2SO4 → H3AsO4 + MnSO4 + K2SO4 + H2O
Почему азотистая кислота может отоявлять ка окислительные, так и восстановительные свойства? На основании электронных уравнений расставьте коэффициенты в уравнении реакцииидущей по схеме
КMnО4 + K2SO3 + Н2О→ MnO2 + K2SO4 + КОН
-
Почему сернистая кислота может проявлять как окислительные, так и восстановительные свойства? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
СrС13 +NaClO + NaOH→ Na2CrO4 + NaCl + H2O
-
Какие реакции называются реакциями самоокисления— самовосстановления или диспропорционирования? Почему гидразин (N2H4), пероксид водорода (Н2O2) и сульфит калия (K2SO3),cnocoбны к диспропорционированию? На основании электронных уравнений составьте уравнения реакций, происходящих при нагревании этих веществ.
-
Какие реакции называются реакциями внутримолекулярного окисления— восстановления? На основании, электронных уравнений закончите уравнения следующих реакций:
KCIO4→ KC1+…; KMnO4 → K2MnO4 + MnO2 +…;
NH4NO3 → N2 + …
Укажите окислитель и восстановитель в каждой из них.
-
Атом какого элемента самый сильный восстановитель и атом какого элемента — самый сильный окислитель? Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
AsH3 + HNO3→ H3AsO4 + NO2+ H2O
-
Почему атомы большинства р-элементов способны к реаrциям диспропорционирования (самоокисления — самовосстановления)? На основании электронных уравнений, закончите уравнения следующих реакций:
P +KOH + H2O→ KH2PO2 + …; I2+ Ba(OH)2 → Ba(IO3)2+ …
-
Является ли реакция, разложения муравьиной кислоты HCOOH=CO+H2O окислительно-восстановительной? На основаннн электронных уравнений расставьте коэффициенты в уравнении ре акции, идущей по схеме
СН3ОН + КМnO4 + H2SO4 → НСООН + MnSO4 + K2SO4 + Н2О
-
Какие из ионов металлов, могут проявлять восстановительные свойства Sn4+; V2+; Т13+; Сr3+? Почему? На основании элект- ронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме
Cu2S +HMO3→Cu (NO3)2 + H2SO4 + NO + H2O
-
На основании стандартных теплот образования и абсолютных
стандартных
энтропии соответствующих веществ
вычислите ∆![]()
реакции, протекающей по уравнению
CO (г) + Н2O (ж) = СО2(г) + Н2(г)
Возможна ли эта реакция при стандартных условиях? (Ответ:-19,91 кДж)
-
При какой температуре наступит равновесие системы
4 НСl(г) + O2(г) ↔ H2O(г) + С12 (г); ∆Н= – 114,42 кДж.
Что в этой системе является более сильным окислителем – хлор или
кислород и при каких температурах? (Ответ: 891 К)
-
Чем можно объяснить, что при стандартных условиях невозможна экзотермическая реакция, протекающая по уравнению
Н2(г) + СО2 (г) = СО (г) +Н2О (ж); ∆Н= – 2,85 кДж.
Вывод сделайте
на основании качественного изменения
энтропии?
Зная тепловой эффект реакции и абсолютные
стандартные энтропии соответствующих
веществ, определите ∆![]() этой
реакции.
( +19,91 кДж.)
этой
реакции.
( +19,91 кДж.)
-
На оснований стандартных теплот образования и абсолютных
стандартных
энтропии соответствующих веществ
вычислите ∆![]() реакции, протекающей по уравнению
реакции, протекающей по уравнению
СО2 (г) + 4Н2(г) = СН4 (г) + 2Н2О (ж)
Возможна ли эта реакция при стандартных условиях? (Ответ: - 130,89 кДж)
-
Определите ∆
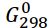 реакции, протекающей по уравнению
реакции, протекающей по уравнению
4 NH3(г) + 5 O2(г) = 4 NO(г) + 6H2O(г)
Вычисления сделайте на основании стандартных теплот образования и абсолютных стандартных энтропий. Возможна ли эта реакцию при стандартных условиях ( -957,77 кДж)
-
Образование сероводорода из простых веществ протекает по уравнению
Н2 (г) + S (ромб) = H2S (г); ∆Н= – 20,15 кДж.
Исходя
из значений ![]() соответствующх веществ вычислите
соответствующх веществ вычислите ![]() и ∆
и ∆![]() для
этой реакции. Возможно ли образование
H2S
вз
простых веществ при стандартных
условиях?
для
этой реакции. Возможно ли образование
H2S
вз
простых веществ при стандартных
условиях?
(43,15 Дж/(молв·К); - 33,01 кДж)
-
Зная тепловой эффект реакции и абсолютные стандартные энтропии соответствующих веществ вычислите G0298реакции, протекающей по уравнению
Н2
(г)
+ СО2
(г)
=СО (г)
+ Н2О
(ж)
;
![]() Н
= – 2,85 кДж?
Н
= – 2,85 кДж?
Возможна ли эта реакция при стандартных условиях?
-
На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислите G0298реакции, протекающей по уравнению
Fе2О3 (к) + ЗН2 (г) =2Fe (к) + ЗН2О (г) Fe3O4 (к) + СО (г) = 3FeO (к) + СО2 (г)
Возможна ли реакция восстановления Fe2O3 водородом при температурах 500 и 2000 К?
-
На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислите G0298реакции, протекающей по уравнению
ТiО2(к) + 2С(к)=Тi(к)+ 2СО(г)
Возможна ли реакция восстановления ТiО2 углеродом при температурах 1000 и 3000 К?
-
Определите, при какой температуре начнется реакция восстановления Fe3O4, протекающая по уравнению.
Fe3O4
(к)
+ СО (г)
= 3FeO
(к)
+ СО2
(г);
![]() Н
=
+ 34,55 кДж.
Н
=
+ 34,55 кДж.
-
Что такое эбуллископическая и криоскопическая константа растворителя? Вычислите криоскопическую константу бензола, зная, что при растворении 0,0125 моля вещества в 125 г бензола температура кристаллизации его понижается на 0,512 град.
-
Температура кипения сероуглерода 46,200С, а эбуллиоскопичекая константа его 2,36 град. раствор, содержащий 0,512 г сероуглерода, кипит при 46,670С. Из скольких атомов состоят молекулы серы, растворенной в сероуглероде?
-
При растворении 15 г хлороформа в 400г эфира, эбуллиоскопическая константа которого равна 2,12,температура кипения повысилась на 0,6650С. Определите молекулярную массу хлороформа.
-
Водный растовр, содержащий 5,18 г растворенного вещества в 155,18 г раствора, кристаллизуется при –1,390С. Криоскопическая константа воды 1,86 град.
-
Температура кристаллизации уксусной кислоты 16,650С, а криоскопическая константа ее 3,9 град. Вычислите температуру кристаллизации раствора, содержащего 0,1 моль растворенного вещества в 125 г уксусной кислоты.
-
Раствор, содержащий 0,6 г растворенного вещества в 40 г эфира, кипит при 36,130С. Температура кипения эфира 35,60С, а эбуллиоскопическая константа его равна 2,12 град. Вычислите молекулярную массу растворенного вещества.
-
Давление пара воды при 1000С равна 1,01325∙105 Па. Вычислите давление пара над 4%-ным раствором мочевины СО(NH2)2 при этой температуре.
-
Равные объемы растворов формалина НСНО и глюкозы С6Н12О6 при данной температуре обладают одинаковым осмотическим давлением. В каком весовом отношении взяты эти вещества.
-
Как вычисляется осмотическое давление? Какой из растворов, взятых в одинаковом объеме и содержащих равное число граммов растворенного вещества, имеет при одинаковой температуре большое осмотическое давление: нафталина С10Н18 или антрацена С14Н10.
-
Давление пара эфира при 300С равно 0,86392∙105 Па. Сколько молей вещества надо растворить в 40 молях эфира, чтобы понизить давление пара при данной температуре.
-
В одном литре 0,01 н раствор уксусной кислоты содержится 6,26∙1021 ее молекул и ионов. Определите изотонический коэффициент и степень ионизации СН3СООН в этом растворе ( Ответ 1,04; 0,04)
-
Константа ионизации хлорноватистой кислоты равна 3,0∙ 10-8. чему равна степень ионизации НСlO в 0,1 н растворе? вычислите концентрацию ионов водорода в этом растворе. ( Ответ 5,5∙10-4; 5,5∙10-5)
-
При какой концентрации раствора степень ионизации азотистой кислоты будет равна 20%, если константа ионизации равна 5,1∙10-4? Вычислите концентрацию ионов водорода в этом растворе. ( Ответ 1,25∙10-2; 2,25∙10-3)
-
Вычислите степень ионизации гидроксида аммония в 0,01н растворе, константа ионизации NH4OH равна 2,0 ∙10-5 ( Ответ 5,0∙10-2)
-
Вторая константа ионизации угольной кислоты К2=5,0∙10-11. Вычислите концентрацию иона
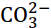 в растворе, в котором концентрация
ионов
в растворе, в котором концентрация
ионов 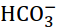 равна 0,0001 г/моль ( Ответ
7,0∙10-8)
равна 0,0001 г/моль ( Ответ
7,0∙10-8) -
Чему равны изотонический коэффициент и степень ионизации 0,2 н раствора хлороводородной (соляной) кислоты, если в литре этого растора содержится 2,19 ∙1023 ее молекул и ионов? ( Ответ 1,82; 0,81)
-
Давление пара раствора, содержащего 0,05 моля Na2SO4 в 450 г воды, равно 1,000818∙ 105 Па при1000С. Определите кажущуюся степень ионизации сульфата натрия в этом растворе. ( Ответ 0,75)
-
Температура кипения раствора, содуржащего 9,09 г KNO3 в 100 г воды, равна 100,80С. вычислите ажущуюся стеень ионизации нитрата калия в этом растворе. ( Ответ 0,71)
-
Раствор, содержащий 0,53 г Na2CO3 в 200г воды, кристаллизуется при –0,130С. Вычислите кажущуюся степень ионизации карбоната натрия в этом растворе. ( Ответ 0,895).
-
Каково будет при 1000С давление пара раствора, содержащего2,5 г гидроксида натрия в 90 г воды, если кажущуюся степень ионизации NaOH в этом растворе равна 80%. ( Ответ 0,99098∙105 Па)
-
Произведение растворимости сульфата кальция равно 6,26·10-5. Образуется ли осадок, если смешать равные обемы 0,04 н растворов СaCl2 и Na2SO4?
-
Вычислите произведение растворимости карбоната стронция, если в 5 л насыщенного раствора содержится 0,05 г этой (Ответ: 4,58·10-9.)
-
Произведение растворимости SrSO4 равно 3,6·10-7. Вычислите растворимость этой соли в молях на литр и в граммах на литр. (Ответ: 6·10-4; 0,11.)
-
Вычислите произведение растворимости Ее(ОН)2, если в 100 мл его насыщенного раствора содержится 9,6·10-5 г этого гидроксида. (Ответ: 4,76·10-15 .)
-
Произведение растворимости MgF2 равно 7,0·10-9. Вычислите растворимость этой соли в молях на литр и в граммах на литр. (Ответ: 1,20·10-3; 0,075.)
-
Произведение растворимости Ag2SO4 равно 7,0·10-9. Образуется ли осадок, если к 0,02 н раствора AgNO3 прибавить равный объем 1 н раствора H2SO4?
-
Сколько воды потребуется для растворения одного грамма ВаСО3, произведение растворимости которого равно 1,9·10-9 (Ответ:
 117
л.)
117
л.) -
В 100 мл насыщенного раствора РbI2 содержится ионов свинца 0,0268 г. Вычислите произведение растворимости этой соли. (Ответ: 8,79·10-9)
-
Концентрация ионов магния в насыщенном, раство Mg(OH)2 составляет 2,6·10-3 г/л. Вычислите произведение растворимости этого гидроксида, (Ответ: 4,77·10-12.)
-
Произведение растворимости AgI равно 8,5·10-17. Образуется ли осадок, если смешать равные объемы 0,002 н раствор NaI и AgC1O4?
-
Определите заряд комплексного иона, координационное число и степень окисления комплексообразователя в соединениях: K3[Cr(CN)6], Na[Ag(NO2 )2], K2[MoF8], [Co(H2O)2 (NH3)3Cl]Cl2.
-
Определите чему равен заряд комплексного иона, координационное число и степень окисления комплексообразователя в соединениях Na2[Cd(CN)4], K4[TiCl8], [Cr(H2O)4 Cl2 ]Cl, H[ZnCl 2OH].
-
Составьте координационные формулы и напишите уравнения их диссоциации комплексных соединений платины PtCl2·4NHЗ, PtCl2·3NHЗ, , PtCl2·2NHЗ, PtCl2· КС1·NHЗ, PtCl2· 2КС1в водных растворах? Какое из этих соединений является комплексным не электролитом? Координационное число Pt2+ равно четырем.
-
Составьте координационные формулы и напишите уравнения диссоциации комплексных соединений CoBr·4NH3·2H2O ;CoCl3·4NH; CoCl3·4NH3·H2O в водных растворах. Какое из этих соединений является комплексным не электролитом? Координационное число Со3+ равно шести.
-
Определите заряд (х) следующих комплексных ионов; а) [Pd(NH3)2 (H2O)Cl]x; б) [Co(NO2)4 (NH3)2]x; в) [РtCl(ОН)5]x; г) [Au(CN)2Br2]x . Степени окисления комплексообразователей: а) +2; б) +3; в) +4; г) +3. Напишите формулы соединений, содержащих эти комплексные ионы.
-
Составьте координационные формулы семи комплексных соединений, которые можно получить из сочетания частиц Сг3+, Н2О, Cl-, К+. Напишите уравнения их диссоциации в водных растворах. Какое из соединений является комплексным неэлектролитом? Кординационное число Сr 3+равно шести.
-
Что называется константой нестойкости комплексного иона? Напишите выражение константы нестойкости для комплексных ионов: [CuCl2]-, [Cu(NH3)4]2+; [Fe(CN)6]3-.
-
Напишите, выражения констант нестойкости для комплексных ионов [Сd(СN)4]2-; [Ni(CN)4]2-; [Hg(CN)4]2-? Они соответственно равны 1,4·10-17; З,0 ·10-16 ; 4,0 ·10-41. В растворе какогокомплексного иона содержится, больше ионов CN- при одинаковой молярной концентрации?
-
При прибавлении KCN к раствору сульфата тетраамминцинка [Zn(NH3)4]S04 образуется растворимый тетрацианоцинкат калия K2[Zn(CN)4]. Напишите молекулярное и ионно-молекулярное уравнения реакции. Константа нестойкости какого иона: [Zn(NH3)4]2+ или [Zn(CN)4]2- больше? Почему?
-
Какая ковалентная связь называется донорно-акцепторной? Каков механизм ее образования? Какой атом или ион – донор и какой – акцептор в следующих комплексных ионах: [BF4]-; [H3O]+; [Zn(NH3)4]2+?
-
Какое соединение образуется при сгорании калия в избытке кислорода? Кислород этого соединения при взаимодействии его: а) с водой, б) с разбавленной H2SO4 диспропорционирует, приобретая степеньокисления – 1 и 0. Составьте электронные и молекулярные уравнения указанх выше реакций.
-
Что такое поташ? Как он получается и в каких производствах применяется ? Как получить поташ, имея в распоряжении вещества: K2SO4, Ba(OH)2, CaCO3, HCl и H2O? Составьте уравнения соответствующих реакций.
-
Гидрид лития можно получить при нагревании нитрида лития в атмосфере водорода. Составьте уравнения реакций получения и его взаимодействия: а) с водой; б) с водородом.
-
При высокой температуре щелочные металлы восетанавливают соли кислородсодержащих кислот. Напишите электронные и молекудярное уравнения реакции, происходящей при сплавлении калия с K2SO4.Окислитель в этой реакции восстанавливается максимально.
-
Составьте уравнения реакций, которые нужно провести для осуществления следующих превращений:
Ве→ BeCl2→ Ве(OH)2→Na2[Be(OH)4]→BeSO4
-
Составьте электронные и молекулярные уравнения реакций: а) бериллия с концентрированным раствором гидроксида натрия; б) магния с концентрированной серной кислотой при максимальном восстановлении последней.
-
Составьте уравнении реакций, которые нужно провести для осуществления следующих превращений:
Са→СаН3→Са (ОН)2→ СаСО3→ Са(НСО3)2
-
Составьте уравнения реакций, которые нужно провести для осуществления следующих превращений:
Ва→Ва (ОН)2→ ВаО2→О2
Для последней реакции используйте раствор дихлорида ртути (сулемы).
-
Фосфид бария можно получить в дуговой печи, восстана ливая его фосфат углеродом. Составьте электронные и молекулярное уравнения этой реакции, имея в виду, что фосфор приобретат низшую степень окисления, а углерод образует СО. Что образуется при взаимодействии фосфида бария с водой?
-
Являясь сильными восстановителями, магний, кальций и барий применяются в металлотермии для получения, металлов из оксидов.. Составьте электронные и молекулярные уравнения реакций кальция: а) с CaSО4; б) с V2О5. В каждой из этих реакций окислитель восстанавливается максимально.
-
Составьте уравнения реакций, которые надо провести для осуществления следующих превращений:
В2О3→В→Н3ВО3→ Na2В4О7→ Н3ВО3
-
Если через раскаленный карбид кальция пропустить пары воды, то продуктами реакция являются карбонат кальция, диоксид углерода и водород. Отразите в электронных уравнениях изменение степени окисления атомов окислителя и восстановителя и составьте уравнение этой реакции. Как она протекает в обычных условиях?
-
Карбид кремния (карборунд) – химически очень стойкое ве щество. Однако в присутствии кислорода он взаимодействует с расплавленными щелочами. Составьте электронные и молекулярное уравнения этого процесса, учитывая, что углерод приобретает максимальную степень окисления.
-
Чем можно объяснить окислительные свойства оксида свинца (IV)? На основании электронных уравнений закончите уравнения реакция:
РbО2 + Мn (NO3)2+ HNO3→ HMnO4 + ...
РbО2 + HClконц→
-
Чем можно объяснить, восстановительные свойства соедини ний германия (II) и олова (II)? На основании электронных уравнении закончите уравнения реакции:
SnCl2 + HgCl2 =
SnCl2+Na2AsO4 + HCI=
-
Составьте электронные и молекулярные ;уравнения разложения: а) азотной кислоты; б) азотистой кислота; в) гидразина; г) нитрата серебра. К какому типу окислительно–восстановительных реакций относится каждая из них?
-
Какие кислоты могут образовываться при гидратации оксида фосфора (V)? Составьте уравнения реакций при помощи которых можно получить ортофрсфорную кислоту, исходя: a) из свободного фосфора; б):из фосфата кальция.
-
Какие свойства в окислительно-восстановительных реакциях может проявлять As2О3? Почему? Составьте электронные и молекул реакций As2О3: а) с азотной кислотой; б) с цинком в соляной кислоте. Мышьяк (III) окисляется (а) и восстанавливается (б) максимально.
-
Составьте электронные и молекулярные уравнения реакций пероксида водорода: а) с Ag2O; б) с PbS.
-
Кристаллический иод растворяется в концентрированных растворах: а) азотной кислоты; б) гидроксида калия; в) иодида калия. Составьте уравнения соответствующих реакций.
-
Составьте уравнения реакций, протекающих при при осуществлении следующих превращений:
W→WO3 → Na2WO4 → H2WO4 → W2O5
-
Восстанволение иона
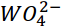 в W2O5
лучше всего
проводить цинком в солянокислой среде.
в W2O5
лучше всего
проводить цинком в солянокислой среде. -
Составьте уравнения реакций, протекающих при осуществлении следующих превращений:
MоO3 → Mo →Na2МoO4 → H2MоО4 → (МоО2)SО4
-
Перевод молибдена в растворимый молибдат натрия легче всего осуществляется путем сплавления молибдена с нитратом и карбонатом натрия (селитрой и содой). О каких свойствах гидроксида молибдата (VI) говорит последнее превращение?
-
Составьте уравнения реакций протекающих при осуществлении следующих превращений:
Mn → MnCl2 → Mn(OH)2 → Mn(OH)4→ MnCl2
-
Составьте уравнения реакций протекающих при осуществлении следующих превращении:
Fe → FeCl2 → Fe(CN)2 →K4[Fe(CN)6] → K3[Fe(CN)6]
Для окислительно-восстановительных реакций приведите электронные уравнения.
-
Составьте уравнения реакций, протекающих при осуществлении следующих превращений:
Co →Cо (NО3)2 → Cо(OH)2 → Сo(OH)3 → CoCl2
Уравнения окислительно-восстановительных реакций напишите на основании электронных уравнений.
-
Составьте уравнения реакций, протекающих при осуществлении следующих превращений:
Ni → Ni(NO3)2 → Ni(OH)2 → Ni(OH)3 → NiCl2
Уравнения окислительно-восстановительных реакций напишите на основании электронных уравнений.
-
Для рутения наиболее характерна степень окисления +4, а для осмия +8. Исходя из этого составьте электронные молекулярные уравнения реакций взаимодействия следующих веществ:
K2RuO4 + НCl → …
K2OsO4 + О2 + H2O → …
-
Иридий в отличие от кобальта и родия образует устойчивые соединения, где он проявляет степень окисления +4. Исходя из этого составьте электронные и молекулярные уравнения реакций взаимодействия следующих веществ:
Ir + Cl2 + KCl → …
Ir(OH)3 + O2 + H2O → …
