
- •Тема 1: химия как наука и её значение в жизни человека
- •Тема 2: периодический закон и периодическая система химических элементов д.И. Менделеева
- •Большие и малые периоды
- •Тема 3: строение атома. Ядерные превращения
- •Тема 4: строение электронной оболочки атомов
- •Тема 5: периодическое изменение свойств химических элементов
- •Оэо по Полингу
- •Тема 6: химическая связь и строение молекул (I часть)
- •Энергии (Есв) и длины (св) галогеноводородных соединений
- •Заключение по материалу «Химическая связь и строение молекул»
- •Тема 8: межмолекулярное взаимодействие
- •Тема 9: основные закономерности протекания химических процессов
- •Тема 10: направленность химических реакций
- •Тема 12: электрохимические процессы
- •Тема 13: электролиз
- •Основные понятие и особенности электролиза.
- •Отдельные примеры электролиза растворов и расплавов солей.
- •Применение электролиза
- •Закон Фарадея. Решение задач.
- •Тема 14: химия металлов и электротехнические материалы Металлическое состояние вещества
- •Тема 14: химия металлов и электротехнические материалы Физические свойства металлов
- •Тема 14: химия металлов и электротехнические материалы химические свойства металлов
- •Взаимодействие металлов с кислотами
- •Действие хлороводородной кислоты на металлы
- •Действие серной кислоты на металлы
- •Действие азотной кислоты на металлы
- •Действие щелочей на металлы
- •Действие серной кислоты на металлы
- •Действие азотной кислоты на металлы
- •Действие щелочей на металлы
- •Тема 14: химия металлов и электротехнические материалы способы получения металлов
- •Получение металлов
- •Тема 14: химия металлов и электротехнические материалы зонная теория внутреннего строения металлов
- •I. Теория электронного газа.
- •II. Зонная теория кристаллов.
- •Выводы:
- •Тема 14: химия металлов и электротехнические материалы электротехнические материалы.
- •Сверхпроводники
Тема 3: строение атома. Ядерные превращения
1. Экспериментальные доказательства сложности структуры атома.
2. Планетарная модель атома по Резерфорду.
3. Закон Мозли, его практическое применение.
4. Состав атомных ядер. Протонно-нейтронная теория состава ядра. Изотопы, изобары, изотоны.
5. Радиоактивные элементы и типы радиоактивного распада.
Экспериментальные доказательства сложности структуры атома.
Долгое время в науке господствовало мнение, что атомы неделимы, т. е. не содержат более простых составных частей.
Однако в конце XІX и начале XX века появились экспериментальные доказательства сложности структуры атома.
а) Выделение из атомов отрицательно заряженных частиц – катодных лучей. Открытие принадлежит Круксу (1879 г.) В 1897 г. Дж. Томсон (Англия) вычислил массу и скорость этих частиц: масса равна 9,11∙10-28г., а скорость ~ ½ (света). Ф. Малликен определил заряд этих частиц, который равен 1,6∙10-19 . Кл. Стонней впоследствии дал название отрицательно заряженным частицам – электрон.
б) Фотоэффект (открытый Столетовым) – явление, когда при освещении металлов с их поверхности испускаются электроны (используются в фотоэлементах)
в) Термоэлектронная эмиссия – испускание металлом электронов при нагревании.
г) Рентгеновские лучи – электромагнитное излучение, испускаемое веществами при сильном воздействии на них катодных лучей. Открытый в1895 г. Рентгеном.
Таким образом было ясно, что электрон входит в состав атома.
д) Открытие радиоактивности.
В 1896 г. Анри Беккерель открыл невидимое излучение урана, которое засвечивает фотопленку, без освещения руды, т.е. он открыл радиоактивность урана.
Продолжая работу Беккереля, супруги Пьер и Мария Кюри в 1898 г. открыли самопроизвольное излучение у Ra, Po и Th.
Явление самопроизвольного лучеиспускания было названо радиоактивностью, а вещества способные к лучеиспусканию – радиоактивными. Пьер и Мария Кюри открыли явление естественной радиоактивности.
Естественной радиоактивностью называется процесс самопроизвольного распада ядер природных тяжелых элементов, сопровождающийся выделением лучей высокой проникающей способности и излучением энергии. Оказалось, впоследствии, что все элементы после висмута (83Bi) – радиоактивные.
В 1934 г. второе поколение Кюри – Ирен и Фредерик Жолио Кюри открыли искусственную радиоактивность для тех изотопов, которые не встречаются в природе, но могут быть получены в результате ядерных процессов:
![]()
Радиоактивное излучение изучалось Пьером и Марией Кюри, а также Резерфордом. Ими было установлено, что радиоактивное излучение неоднородно. В электрическом и магнитном поле оно распадается на 3 пучка: α, β, γ пучки. Э. Резерфорд открыл α и β лучи, а γ лучи открыл П. Виллар.
Характеристика лучей:
α лучи отклоняются в электрическом поле к (-) полюсу, значит частицы имеют положительный заряд+2 и массу 4 у.е. (+24α). Это ядра атома 24Не. Они обладают большой ионизирующей способностью, но малой проникающей, т.к. имеют большую массу. Скорость ~20км/сек., длина пробега 3-11см.
β лучи отклоняются в электрическом поле к (+) полюсу, значит это поток отрицательно заряженных частиц – электронов. У них малая ионизирующая способность, но большая проникающая, из-за малой массы. Скорость близка к скорости света (~300000 км/сек.)
γ лучи не отклоняются ни в электрическом ни в магнитном поле, т.е. не имеют знака заряда. По природе это электромагнитное излучение с очень маленькой длинной волны (λ = 0,0005 – 0,04 нм.) Эти лучи обладают большой проникающей способностью, из-за малой массы. Это жесткие лучи. Обладая большой проникающей способностью, проникают через материалы живой и неживой природы. В живых клетках они вызывают (вторгаясь в оболочки атомов) как деструктирующие (разрушающие) так и структурирующие (сшивающие), процессы. Так из 39 природных радиоактивных элементов 4 элемента имеют α,β, γ лучи; 21 элемент α,γ лучи; 14 элементов β, γ лучи.
Все вышеперечисленные открытия подтверждают, что атомы химических элементов имеют сложное строение и сложный состав.
Радиоактивное излучение – ядерный процесс, чтоб его понять надо изучить строение атомов и состав ядра атома.
в начало
Планетарная модель атома по Резерфорду.
Опыты показали, что наиболее легко удаляемой частью атома являются электроны.
В 1903 г. Дж. Томсон предложил статическую модель атома: атом представляет собой положительный заряд, в котором вкраплены колеблющиеся электроны. Эта модель не имела экспериментального подтверждения.
Для проверки гипотезы Д. Томсона и более точного определения строения атома Э. Резерфорд правёл серию опытов по рассеиванию α - частиц тонкими металлическими пластинками – фольгой. Основываясь на данные опыта, он предложил ядерную или планетарную модель атома, уподобляющую его солнечной системе. Согласно модели: 1) в центре атома находится положительно заряженное ядро, в котором сосредоточена почти вся масса атома. Ядро занимает небольшой объём внутриатомного пространства (rатома~10-10м; rядра~10-15 – 10-14м; т.е. rатома> rядра в 105 – 104 раз). Положительно заряженные частицы ядра он назвал – протоны(+11p);
2) вокруг ядра движутся электроны, число которых определяется зарядом ядра. Атом электронейтрален;
3) сила электростатического притяжения между ядром и электронами уравновешивается центробежной силой вращения электронов, так что электроны удерживаются на своих орбитах. Атом – система устойчивая. Но у этой модели были недостатки:
1. Модель
не объясняла устойчивость атома.
Электрон, вращаясь вокруг положительно
заряженного ядра, должен излучать
электромагнитную энергию в виде световых
волн. Но излучая
свет, электрон теряет свою энергию и
приближается к ядру. Исчерпав всю свою
энергию, он должен «упасть» на ядро и
атом прекратит существование. Излучая
энергию электрон «упадёт» на ядро
через ![]() сек.
Это противоречит реальным свойствам
атома, т.к. атом – система устойчивая.
сек.
Это противоречит реальным свойствам
атома, т.к. атом – система устойчивая.
2. Модель не объясняет линейчатость спектра атомов. При непрерывном излучении энергии спектр излучения атома должен быть сплошным, а в действительности он линейчатый.
Таким образом, теория Резерфорда не объясняла ни устойчивости атома, ни линейчатость спектра. Дальнейшие исследования Нильса Бора объяснили эти факты.
Опыты по рассеиванию α частиц дали возможность Резерфорду не только обнаружить ядро в атоме, но и определить его заряд. Он определял заряд ядер атомов металлов, из которых была сделана фольга (Cu, Ag, Pb) Им были получены заряды ядер: Pb – 77,4; Cu – 29,3; Ag – 46,3. Заряд ядра совпадал с порядковым номером элемента в периодической системе. Необходимо было установить физический смысл порядкового номера (Z).
в начало
Закон Мозли, его практическое применение.
В 1913 г. Г. Мозли, работая в лаборатории Резерфорда изучал рентгеновские спектры некоторых элементов(изучил спектры 37 элементов). Он установил простую связь между длинами волн определённых линий рентгеновского спектра элемента и его порядковым номером. Оказалось, что длина волны равномерно уменьшается с увеличением порядкового номера элемента. Он сформулировал закон Мозли, корень квадратный из величины обратной длине волны или из частоты колебаний определенной линии характеристического рентгеновского спектра элемента, есть линейная функция заряда ядра, или что тоже самое порядкового номера элемента.
![]() =
= ![]() =а(Z-b),
=а(Z-b),
где Z – порядковый номер, а, b – const.
После открытия закона Мозли был выяснен физический смысл порядкового номера элемента: порядковый номер является важнейшей константой элемента, выражающий положительный заряд ядра атома элемента, а поскольку атом электронейтрален, то указывает и на число электронов в атоме.
Это открытие дало новое обоснование расположению элементов в периодической системе: место элемента определяется зарядом атомного ядра (это объясняет положение элементов с большей атомной массой, впереди элементов с меньшей атомной массой: теллур и йод, аргон и калий, кобальт и никель). Итак, заряд атомного ядра является более важной характеристикой, чем атомная масса. Например: заряд ядра атома теллура – 52, а атома йода – 53; поэтому теллур, несмотря на большую атомную массу, должен стоять впереди йода. От заряда ядра атома зависят свойства элемента и его положение в периодической системе. Современная формулировка этого закона звучит так: Свойства элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от заряда ядра атомов элементов, который совпадает с порядковым номером элемента.
в начало
Состав атомных ядер
В 1911 г. Резерфорд открыл в ядре – протоны (+11р). В 1932г. Д. Чедвик открыл в ядре нейтральную частицу – нейтрон (01n) при реакции:
![]()
В том же 1932 г. появилась протонно-нейтронная теория состава ядра атомов: «Ядра атомов всех элементов, кроме водорода, состоят из протонов и нейтронов». Она была одновременно предложена русскими учёными Д.Д. Иваненко и Е.Н. Гапон и немецким ученым В. Гейзенбергом. Число протонов в ядре определяет его положительный заряд(Z), а суммарное число протонов и нейтронов равно атомной массе (А). Если число нейтронов обозначить N, то атомная масса равна A=Z+N, отсюда N=A- Z.
Вместе протоны и нейтроны называются – нуклоны (ядерные частицы)
Вычислим нуклонный состав ядра атома Al.
1327Al A=27y.e. Z=13(+11p); N=27-13=14(01n).
Протоны и нейтроны при определённых условиях могут переходить друг в друга, давая при этом ℮- или ℮+, т.е. это два состояния одной и той же частицы: при одинаковой массе одно состояние имеет заряд (+11р), а другое состояние – не имеет заряда (01n).
Протонно-нейтронная теория состава ядер атомов объяснила существование изотопов, изобаров, и изотонов.
Изотопы –
разновидность атомов одного и того же
элемента, имеющие одинаковое зарядовое
число, но различную атомную массу
(![]() -const).
-const).
|
Например: |
протий |
дейтерий |
тритий* |
|
|
|
|
|
11Н |
1 2Д |
1 3Т |
|
1735Cl |
1737Cl |
|
|
+11р 1 |
1 |
1 |
+11p |
17 |
17 |
|
|
01n 0 |
1 |
2 |
01n |
18 |
20 |
*примечание: тритий – искусственный изотоп.
Как видно, изотопы отличаются по числу нейтронов. Дробные значения атомных масс в таблице Менделеева объясняются наличием изотопов у элементов, т.е. атомные массы элементов занесены в периодическую систему – это среднее арифметическое значение из атомных масс всех изотопов данного элемента с учетом распространения изотопов в природе. Так для изотопов хлора (распространение 35Cl – 75,53%, 37Cl – 24,47%) среднее арифметическое значение атомной массы рассчитывается:
35∙0,7553+37∙0,2447=35,453 а.е.м. Это значение и заносится в таблицу.
Изобары – разновидность атомов различных элементов, имеющих различное зарядовое число, но одинаковую атомную массу. (Z+N=const)
|
|
1940K |
1840Ar |
|
+11p |
19 |
18 |
|
01n |
21 |
22 |
Изобары отличаются как по числу протонов, так и по числу нейтронов, одинаковая только их сумма.
Изотоны – атомы различных элементов, имеющие одинаковое число нейтронов (N=const).
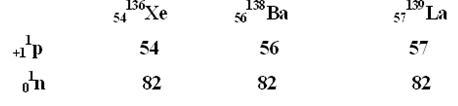
Возможно превращение атомных ядер, это явление возникает при ядерных реакциях. Ядерные реакции происходят с радиоактивными элементами.
Ядерными называются реакции (самопроизвольно возникающие или искусственно вызванные), при которых исходное атомное ядро претерпевает более или менее глубокие превращения, в результате которых образуются новые ядра или изменяется состояние ядра.
Ядерные реакции проходят самопроизвольно, если исходное ядро неустойчивое.
Ядра
бывают протонно-дефицитные или
нейтронно-дефицитные. Так, протонно-дефицитные
ядра стабилизируются путем перехода ![]() ,
а нейтронно-дефицитные стабилизируются
путем перехода
,
а нейтронно-дефицитные стабилизируются
путем перехода ![]() (позитрон).
(позитрон).
в начало
Радиоактивные элементы и типы радиоактивного распада.
Радиоактивность, проявляемая природными радиоактивными изотопами называется естественной радиоактивностью. Естественную радиоактивность изучали Содди и Фаянс (1913 г.). Они сформулировали правило сдвига или закон смещения при радиоактивном распаде.
К основным видам радиоактивности относятся α-распад, β-распад, электронный захват и спонтанное деление.
1) α-распад. Ядра элементов с Z=84 (84Ро) и далее неустойчивые и стабилизируются путем выделения 4 нуклонов: 2 протонов и 2 нейтронов, т.е. выделяется 24 α частица, состоящая из 211р и 201n. Выделение 24 α частицы приводит к смещению дочернего (образовавшегося элемента) на две клетки левее (к началу периодической системы) от радиоактивного исходного элемента, т. к. заряд исходного элемента уменьшается на 2 единицы:
22688Ra (-,![]() )22286Rn.
)22286Rn.
2) β- распад (электронный распад) проходит в протонно-дефицитных ядрах, где стабилизация ядра идет путем перехода нейтрона в протон:
10n![]() 11р+ē,
поскольку в этом случае выделявшийся
электрон вылетает из
11р+ē,
поскольку в этом случае выделявшийся
электрон вылетает из![]() ядра,
то положительный заряд ядра увеличивается
на единицу. Дочерний элемент смещается
на клетку вправо (к концу периодической
системы).
ядра,
то положительный заряд ядра увеличивается
на единицу. Дочерний элемент смещается
на клетку вправо (к концу периодической
системы).
22889Ac(-, ℮-) 22890Th. Дочерний элемент является изобаром по отношению к исходному радиоактивному элементу.
![]() 3) β+ распад (позитронный
распад) проходящий в нейтронно-дефи-цитных ядрах.
Стабилизация ядра происходит путем
перехода протона в нейтрон: 11р 01n+℮+.
Возникший позитрон вылетает за пределы
ядра, и заряд ядра уменьшается на
единицу. Дочернее ядро смещается на
одну клетку влево (к началу периодической
системы)
3) β+ распад (позитронный
распад) проходящий в нейтронно-дефи-цитных ядрах.
Стабилизация ядра происходит путем
перехода протона в нейтрон: 11р 01n+℮+.
Возникший позитрон вылетает за пределы
ядра, и заряд ядра уменьшается на
единицу. Дочернее ядро смещается на
одну клетку влево (к началу периодической
системы) ![]() .Дочерний
элемент является изобаром по
отношению к исходному радиоактивному
элементу.
.Дочерний
элемент является изобаром по
отношению к исходному радиоактивному
элементу.
4) Е захват (электронный захват). К уменьшению заряда ядра на единицу при сохранении массового числа атома приводит захват ядром одного электронов с близлежащей к ядру электронной оболочки (чаще всего К-слоя).
Взаимодействие этого электрона с одним из содержащихся в ядре протонов приводит к образованию нейтрона:
11p +ē → 10n; 13156Ba (ē,-) 13155Cs; 4823V (ē,-) 4822Ti
Происходит Смещение дочернего элемента влево (на клетку левее), как и при β+ распаде.
5) Спонтанное деление – самопроизвольный распад ядер тяжелых элементов на два и более ядра элементов середины периодической системы. Варианты такого деления очень разнообразны, так что общих правил смещения по периодической системе не существует, чаще всего происходит распад исходного ядра на тяжелые и легкие осколки, несущие соответственно 60% и 40% заряда и массы исходного ядра.
23592U → 38Sr + 54Xe; 23592U → 9236Kr + 14156Ba + 210n
Образующиеся ядра, всё ещё содержат избыток нейтронов, оказываются неустойчивыми и поэтому претерпевают последовательный ряд β-распадов.
Элементы, расположенные в конце периодической системы (после висмута) не имеют стабильных изотопов. Подвергаясь радиоактивному распаду они превращаются в другие элементы. Если вновь образовавшийся элемент радиоактивен, он тоже распадается, превращаясь в третий элемент, и так до тех пор, пока не получаются атомы устойчивого изотопа. Ряд элементов, образующихся подобным образом один из другого, называется радиоактивным рядом. Существуют 4 радиоактивных ряда:
1.
Ряд урана (![]() U →
U → ![]() Pb); 2.
Ряд актиния (
Pb); 2.
Ряд актиния (![]() U →
U → ![]() Pb);
Pb);
3.
Ряд тория (![]() U →
U → ![]() Pb); 4.
Ряд нептуния (
Pb); 4.
Ряд нептуния (![]() U →
U → ![]() Pb).
Pb).
Как видно, конечным продуктом каждого радиоактивного ряда являются устойчивые изотопы свинца или висмута.
Искусственные
ядерные реакции вызываются «бомбардировкой»
ядра-мишени частицами достаточно высокой
энергии. К их числу относятся:![]() .
Например: ядерная реакция Резерфорда:
.
Например: ядерная реакция Резерфорда: ![]() в
сокращенной форме:
в
сокращенной форме: ![]() .
.
В 1932 г. был открыт процесс деления ядер урана под действием нейтронов. Это открытие заложило основу атомной энергетике. Процесс распада ядер 92235U при бомбардировке его нейтронами сопровождается выделением различных элементов, частиц и выделением огромного количества энергии:
![]() .
.
Один
грамм ![]() U выделяет
7,5 •107 кДж,
это больше, чем выделяется тепла при
сгорании 2 т угля.
U выделяет
7,5 •107 кДж,
это больше, чем выделяется тепла при
сгорании 2 т угля.
Из
уравнения радиоактивного распада видно,
что один ![]() n, попавший
в массу радиоактивного элемента, вызывает
появление 2-3 нейтронов, которые в свою
очередь приводят к новым ядерным
реакциям. В конечном счете возникает
лавина нейтронов, которые расщепляют
огромное количество ядер.
Лавинообразный процесс деления тяжелых
ядер называется цепной ядерной реакцией.
n, попавший
в массу радиоактивного элемента, вызывает
появление 2-3 нейтронов, которые в свою
очередь приводят к новым ядерным
реакциям. В конечном счете возникает
лавина нейтронов, которые расщепляют
огромное количество ядер.
Лавинообразный процесс деления тяжелых
ядер называется цепной ядерной реакцией.
Количество нейтронов, способных вызывать ядерную реакцию можно регулировать введением в реакционный объем стержней, поглощающих нейтроны. При этом ядерная реакция становится управляемой. Управляемые ядерные реакции используются на атомных электростанциях. Для выработки энергии применяют
в начало
