
TD
.pdf
|
Вариант 5. Найти, в каких реакциях |
|||
1. |
Н(г) + |
12 Cl2(г) |
= |
HCl(г), |
2. |
2 HCl(г) |
= Н2(г) + Cl2(г), |
||
3. |
12 Н2(г) |
+ Cl(г) |
= |
HCl(г), |
Нравно Нo298 образования HCl(г):
Нo298 = Н1;
Нo298 = Н2;
Нo298 = Н3;
4. 12 Н2(г) |
= |
Н(г), |
Нo298 |
= |
Н4/ |
Σ Нo298 = Н4/ |
|
12 Cl2(г) |
= Cl(г), |
Нo298 |
= |
Н4// |
+ Н4// + Н4/// . |
||
Н(г) + Cl(г) = HCl(г), |
Нo298 |
= |
Н4/// |
|
|
||
Вариант |
6. Обосновать, |
Н каких |
реакций |
равно Нo298 |
образования |
||
NaOH(тв): |
|
|
|
|
|
|
|
1. |
Nа(тв) |
+ О(г) + Н(г) = NaOH(тв), |
||
2. |
Nа(тв) |
+ |
12 О2(г) + |
12 Н2(г) = NaOH(тв), |
3. |
Nа2О(тв) |
+ Н2О(ж) |
= 2 NaOH(тв), |
|
4. Nа(тв) |
+ |
14 О2(г) = 12 Nа2О(тв), |
||
|
12 Н2(г) + 14 О2(г) = 12 Н2О(ж), |
|||
|
12 Nа2О(тв) + 12 Н2О(ж) = NaOH(тв), |
|||
Нo298 = Н1;
Нo298 = Н2;
Нo298 = Н3;
Нo298 = Н4/
Нo298 = Н4// Σ Нo298 = Н4/ + Н4// + Н4/// .
Нo298 = Н4///
Примеры выполнения задания 3
Под энтальпией образования соединения ( Нo298 обр) понимают изменение
энтальпии для реакции образования одного моля данного химического соедине- ния из простых веществ. При этом энтальпия образования простых веществ (N2, О2, Н2, Сграфит и др.) принимается равной нулю. Стандартная энтальпия образова- ния вычисляется при стандартных условиях: 25 °С (298 К) и Р = 1 атм, обознача-
ется Нo298 и измеряется в кДж/моль.
Энтальпия образования химического соединения равна по абсолютной вели-
чине и противоположна по знаку энтальпии разложения этого соединения на простые вещества при стандартных условиях, т. е. Нo298 обр = – Нo298 разл (за-
кон Лавуазье-Лапласа).
Пример 1. Выбрать из приведённых ниже уравнений то, которое соответст-
вует энтальпии образования сульфата алюминия: |
|
|||||||
1. |
2 Al(тв) |
+ 3 S(тв) |
+ 12 О(г) |
= Al2(SO4)3(тв), |
Н1; |
|||
2. |
Al2O3(тв) |
+ |
3 |
SO3(г) = Al2(SO4)3(тв), |
Н2; |
|||
3. |
2 Al(тв) |
+ 3 S(тв) |
+ 6 О2(г) |
= Al2(SO4)3(тв), |
Н3; |
|||
4. |
Al2O3(тв) |
+ |
3 |
S(тв) + 9 О(г) |
= Al2(SO4)3(тв), |
Н4. |
||
Из всех предложенных уравнений реакций только энтальпия реакции 3 соот- ветствует энтальпии образования одного моля Al2(SO4)3(тв) из простых веществ. В других уравнениях (1, 2 и 4) при образовании одного моля Al2(SO4)3(тв) участвуют
13

либо сложные вещества (уравнение 2), либо атомарный кислород (уравнение 1),
либо то и другое вместе (уравнение 4). Итак, |
Нo298 (Al2(SO4)3(тв)) = Н3. |
||||||||||||||
|
Пример 2. |
|
Определить, чему равна |
Нo298 обр для KClО3(тв), |
HF(г), NO(г), |
||||||||||
HCN(г) и CuSO4(тв), если |
|
|
|
|
|
|
|||||||||
1. |
К(тв) + 1 |
2 |
Сl2(г) + |
3 |
2 |
О2(г) |
= KClО3(тв), |
Н = –391,2 кДж; |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
||
2. |
Н2(г) + F2(г) |
|
= 2 HF(г), |
|
|
|
Н2 = –546,6 кДж; |
|
|||||||
3. |
1 |
2 |
О2(г) + |
1 |
2 |
N2(г) |
= NO(г), |
|
|
Н = +90,4 кДж; |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
||
4. |
HCN(г) = |
1 |
2 |
Н2(г) |
+ С(тв) |
+ 1 |
2 |
N2(г), |
Н = –130,5 кДж; |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
||
5. |
CuSO4(тв) |
|
= Cu(тв) |
+ S(тв) |
+2 O2(г), |
Н5 = +771,1 кДж. |
|
||||||||
|
Для KClО3 |
и NO приведённые значения Н1 и Н3 равны |
значениям |
||||||||||||
Нo298 обр для |
этих соединений, т. е. |
Нo298 (KClО3) = –391,2 |
кДж/моль, |
||||||||||||
Нo298 (NO) = +90,4 кДж/моль, потому, что |
Н приведённых реакций соответст- |
||||||||||||||
вуют образованию одного моля вещества из простых веществ. Энтальпия обра-
зования Нo298 для одного моля HF составляет 12 Н2, т. |
е. Нo298 (HF) = |
= –273,3 кДж/моль. Для HCN и CuSO4 приведённые значения |
Н реакций ( Н4 и |
Н5) соответствуют энтальпиям разложения этих соединений, поэтому Нo298 обр
для HCN и CuSO4 |
равны по абсолютной величине и противоположны по знаку |
значениям Н4 и |
Н5, т. е. Нo298 (HCN) = +130,5 кДж/моль, Нo298 (CuSO4) = |
= –771,1 кДж/моль. |
|
По энтальпии образования соединения можно найти энергию химической связи и наоборот.
Пример 3. Рассчитать энергию связи N–H в молекуле NН3, если для NН3 Нo298 = –45,9 кДж/моль, а Н диссоциации молекул N2 и Н2 на атомы соответст-
венно равны Н1 = 961,8 и |
Н2 = 431,8 кДж/моль. |
Образование NН3 из |
простых веществ ( 12 N2(г) + 32 Н2(г) = NН3(г)) можно |
представить в виде следующих стадий: диссоциация N2 и Н2 на атомы и образо- вание NН3 из атомов. Составляем термохимические уравнения:
1. |
12 |
N2(г) = N(г), |
Н1/ |
= 12 |
Н1 |
= 480,9 кДж; |
2. |
32 |
H2(г) = 3 H(г), |
Н2/ |
= 32 |
Н2 |
= 647,7 кДж; |
3. N(г) + 3 H(г) = NН3(г), |
Н3 – ? |
|
|
|||
Суммируем уравнения (1), (2), (3) и получаем: |
|
|
||||
12 N2(г) + 32 H2(г) = NН3(г); |
Н = 12 Н1 + 32 Н2 + Н3. |
|||||
В соответствии с законом Гесса, алгебраическая сумма Н промежуточных
стадий |
образования NН3 из |
простых веществ равна |
Нo298 для |
NН3, |
т. е. |
|
12 Н1 + 32 Н2 + Н3 = |
Нo298 |
или, подставляя значения, 480,9 + 647,7 + |
Н3 = |
|||
= –45,9 |
кДж. Отсюда |
находим Н3 образования |
аммиака |
из атомов: |
||
Н3 = –1164,5 кДж. |
|
|
|
|
|
|
|
|
|
14 |
|
|
|
Молекула аммиака имеет три связи N–H. Следовательно, средняя энергия ка-
ждой связи N–H составляет |
1164,5 |
|
||
Нср = − |
= − 388,2 кДж. |
|||
|
3 |
|||
|
|
|||
Рассмотрев энтальпии образования некоторых соединений, видим, что чем больше разняться между собой элементы, входящие в состав данного соединения по значению относительной электроотрицательности (ОЭО), тем меньше вели- чина энтальпии образования. В то же время разность значений относительных электроотрицательностей ( ОЭО) элементов качественно определяет вид хими- ческой связи между ними. А именно, соединения с ионной связью образованы элементами, у которых эта разность наибольшая ( ОЭО > 2). Ковалентные со- единения с полярной связью образуются между элементами, имеющими ОЭО ≤ 2, а с неполярной связью – при ОЭО = 0. Отсюда следует, что при переходе от
молекул с ковалентной неполярной связью к молекулам с ковалентной полярной связью, а затем с ионной, величина энтальпии образования должна уменьшаться. Так, например, согласно данным таблицы, наблюдаем, что от LiCl к CCl4 ОЭО уменьшается. Следовательно, уменьшается полярность связи и в той же последо- вательности возрастает величина энтальпии образования.
Вещество |
LiCl |
ВеCl2 |
ВCl3 |
CCl4 |
ОЭО |
2,0 |
1,5 |
1,0 |
0,5 |
Нoсв , рассчитанная на одну связь Э–Cl, кДж |
–408,3 |
–233,8 |
–134,3 |
–33,2 |
1.4. Следствие из закона Гесса. Термохимические расчёты
З а д а н и е 4
Вариант 1. Вычислить Нo (кДж) реакции
4 NН3(г) + 5 О2(г) = 6 Н2О(г) + 4 NО(г),
используя величины Нo298 (кДж/моль) из приложения (табл. 1).
Вариант 2. Горение сероводорода протекает по уравнению
2 Н2S(г) + 3 О2(г) = 2 Н2О(г) + 2 SО2(г).
Вычислить Нo298 (кДж/моль) для Н2S, если Нo реакции равно –1037,0 кДж.
Необходимые для расчёта энтальпии образования веществ использовать из при- ложения (табл. 1).
Вариант 3. При растворении 16 г СаС2 в воде выделяется 31,3 кДж теплоты
СаС2(тв) + 2 Н2О(ж) = Са(ОН)2(тв) + С2Н2(г).
Определить Нo298 (кДж/моль) для вещества Са(ОН)2. Энтальпии образования всех других соединений использовать из приложения (табл. 1).
Вариант 4. Вычислить тепловой эффект (Q) реакции
3 Mn3О4(тв) + 8 Al(тв) = 9 Mn(тв) + 4 Al2О3(тв).
15
Необходимые для расчёта величины |
Нo298 реагирующих веществ и продуктов |
|
реакции использовать из приложения (табл. 1). |
||
Вариант 5. Используя величины |
Нo298 (кДж/моль) из приложения (табл. 1), |
|
вычислить Нo реакции |
|
|
Ca3(РО4)2(тв) + 3 SiO2(тв) |
+ 5 C(графит) = 3 CaSiO3(тв) + 5 CO(г) + 2 Р(белый). |
|
Будет ли эта реакция экзо- или эндотермической? |
||
Вариант 6. Вычислить |
Нo и Q реакции |
|
2 PbS(тв) + 3 О2(г) |
= 2 PbO(тв) + 2 SO2(г), |
|
используя величины Нo298 |
(кДж/моль) из приложения (табл. 1). Определить, бу- |
|
дет ли эта реакция экзо- или эндотермической? |
||
Примеры выполнения задания 4
Зная стандартные энтальпии образования химических соединений, тепловой эффект реакции можно рассчитать, пользуясь следствием из закона Гесса.
Согласно следствию из закона Гесса для процессов, которые протекают при Р = const, тепловой эффект (изменение энтальпии) реакции равен разности между суммой энтальпий образования продуктов реакции и суммой энтальпий образо- вания исходных веществ, взятых с соответствующими стехиометрическими ко-
эффициентами. |
|
Для реакции, представленной в общем виде |
|
а А + b B = c C + d D |
(1.8) |
тепловой эффект в математической форме записывается следующим образом:
− Qр = Нр = [с Нo298 (С) + d Нo298 (D)] − [a Нo298 (A) + b Нo298 (B)], |
(1.9) |
где Qр и Нр – тепловой эффект и изменение энтальпии реакции соответственно;
– стандартные энтальпии образования исходных веществ А и В и продук-
тов реакции C и D; a, b, c, d – стехиометрические коэффициенты, соответствую- щие исходным веществам и продуктам реакции.
Пример 1. Вычислить Нo и Q реакции:
SiO2(тв) + 4 HF(г) = SiF4(г) + 2 Н2О(ж).
Определить, будет ли эта реакция экзо- или эндотермической?
Находим значения Нo298 (стандартных энтальпий) веществ, участвующих в реакции, в приложении (табл. 1).
Вещество |
SiO2(тв) |
HF(г) |
SiF4(г) |
Н2О(ж) |
Нo298 , кДж/моль |
–910,9 |
–273,3 |
–1614,9 |
–285,8 |
Согласно следствию из закона Гесса (уравнение (1.9)) находим
Нoр = [ Нo298 (SiF4(г)) + 2 Нo298 (Н2О(ж))] – [ Нo298 (SiO2(тв)) + 4 Нo298 (HF(г))] =
=–1614,9 + 2(–285,8) + 910,9 – 4(–273,3) = –1614,9 – 571,6 + 910,9 + 1093,2 =
=–182,4 кДж.
16

Qр = – Нoр . Отсюда Qр = +182,4 кДж. Данная реакция экзотермическая.
Пример 2. Найти Нo298 для SO2(г), если для реакции |
|
|||
4 FeS2(тв) + 11 О2(г) = 2 Fe2О3(тв) |
+ 8 SO2(г), |
Нoр = –3308,2 кДж. |
||
В приложении (табл. 1) находим |
Нo298 (Fe2О3(тв)) = –822,2, Нo298 (FeS2(тв)) = |
|||
= –177,4 кДж/моль. Согласно ур. (1.9) |
|
|
||
|
Нoр = [2 Нo298 (Fe2О3(тв)) |
+ 8 |
Нo298 (SO2(г))] – |
4 Нo298 (FeS2(тв)), |
отсюда |
Нo298 (SO2(г)) = 18 Нoр – 14 |
Нo298 (Fe2О3(тв)) + 12 Нo298 (FeS2(тв)). |
||
После подстановки |
|
|
|
|
Нo298 (SO2(г)) = 18 (–3308,2) – 14 (–822,2) + 12 (–177,4) = –413,5 + 205,5 – 88,7 =
= –296,7 кДж/моль.
Пример 3. Вычислить, сколько теплоты выделится при взаимодействии 100 г
карбида кальция с водой по реакции
СаС2(тв) + 2 Н2О(ж) = Са(ОН)2(тв) + С2Н2(г).
В приложении (табл. 1) находим Нo298 для веществ, участвующих в реакции.
|
Вещество |
СаС2(тв) |
Н2О(ж) |
|
Са(ОН)2(тв) |
С2Н2(г) |
|
|
Нo298 , кДж/моль |
–59,8 |
–285,8 |
|
–985,1 |
+226,8 |
|
По ур. (1.9) находим Нo реакции |
|
|
|
|
|
||
Нoр = [ Нo298 (Са(ОН)2(тв)) + |
Нo298 (С2Н2(г))] – [ |
Нo298 (СаС2(тв)) + 2 Нo298 (Н2О(ж))] = |
|||||
= –985,1 + 226,8 + 59,8 – 2(–285,8) = – 126,9 кДж, |
|
|
|||||
поскольку Qр = – Нoр , то Qр = +126,9 кДж.
Такое количество теплоты выделится при взаимодействии одного моля СаС2,
т. е. 64,1 г. Составляем пропорцию: |
|
|
||||
|
|
|
64,1 г |
СаС2 |
– |
126,9 кДж; |
|
100,0 ×126,9 |
100,0 г |
СаС2 |
– |
Qх, |
|
откуда Qх = |
=196,5 кДж. |
|
|
|||
|
64,1 |
|
|
|||
|
|
|
|
|
||
1.5. Зависимость теплового эффекта реакции от температуры. Уравнение Кирхгофа
З а д а н и е 5
Вариант 1. Найти Нoр образования аммиака по реакции
12 N2 (г) + 32 H2 (г) = NH3 (г)
при нормальном давлении и 1000 К, используя данные табл. 1, 2 приложения. Вариант 2. Рассчитать Нoр для процесса получения 102 кг оксида алюминия
(корунда) Al2O3(тв) при 600 К, используя данные приложения (табл. 1, 2).
17
Вариант 3. Для реакции синтеза метилового спирта
2 H2(г) + СО(г) = СН3ОН(г),
определить зависимость изменения энтальпии реакции от температуры при по- стоянном давлении, используя данные приложения (табл. 1, 2).
Вариант 4. Для реакции получения циклогексана
С6H6(г) + 3 Н2(г) = С6Н12(г)
вычислить изменение энтальпии при 500 К, если известно, что при температуре 150 °С при гидрировании 78 г бензола выделяется 212 752 Дж тепла (Р = 1 атм). При расчетах используйте данные приложения (табл. 2).
Вариант 5. Определить Нoр возгонки кристаллического йода при 380 К:
I2(тв) = I2(г),
используя данные приложения (табл. 1, 2).
Вариант 6. Теплота диссоциации (разложения) карбоната кальция по реакции СаСО3(тв) = СаО(тв) + СО2(г)
при 900 °С равна −166,1 кДж. Вывести уравнение зависимости Нoр разл (СаСО3)
от температуры при постоянном давлении. Определить количество теплоты, по- глощенное при разложении 1 кг карбоната кальция при 1000 °С. При расчетах используйте данные приложения (табл. 2).
Примеры выполнения задания 5
В справочных таблицах энтальпии образования сложных веществ обычно
приводятся для стандартных условий ( Нo298 при P = 1 атм, Т = 298 K). Однако, многие химические реакции протекают при температурах и давлениях, отли-
чающихся от стандартных ( НТР ); поэтому возможность определения теплового
эффекта процесса при заданных условиях (температуре, давлении) только лишь расчетным путем имеет большое практическое значение.
Зависимость теплового эффекта реакции при постоянном давлении от темпе- ратуры описывается дифференциальным уравнением Кирхгофа:
d Ho |
= CoР , |
(1.10) |
dT |
|
|
т.е. температурный коэффициент теплового эффекта процесса равен изменению теплоемкости системы, происходящему в результате процесса. Здесь СoР − из-
менение общей теплоемкости системы в результате полного протекания реакции при постоянной температуре.
Из уравнения (1.10) следует, что знак температурного коэффициента теплово-
го эффекта определяется знаком СoР ; при |
СoР > 0 тепловой эффект реакции |
растет с увеличением температуры, СoР |
< 0 уменьшается, и наконец, при |
СoР = 0 он не зависит от температуры. |
|
18
Для произвольной химической реакции (1.8) DСoР можно определить как раз-
ность между суммарной теплоемкостью продуктов реакции и суммарной тепло- емкостью исходных веществ с учетом их стехиометрических коэффициентов:
DСoР = [d сoР (D) + c сoР (С)] - [а сoР (А) + b сoР (B)], |
(1.11) |
где сoР − молярные изобарные теплоемкости исходных веществ и продуктов ре- акции.
Зависимость теплоемкости от температуры сoР (Т) чаще всего выражают эм- пирическим уравнением вида:
сo |
= а |
0 |
+ а Т + а |
−2 |
Т−2 + а |
2 |
Т2 |
, |
(1.12) |
Р |
|
1 |
|
|
|
|
где а0, а1, а−2, а2 − коэффициенты, характерные для данного вещества. Значения коэффициентов уравнения (1.12) для некоторых веществ приведены в приложе- нии (табл. 2).
Если для всех веществ, участвующих в реакции, известна зависимость тепло- емкостей от температуры в форме (1.12), то изменение теплоемкости системы в
ходе химической реакции может быть записано в виде
DСo |
= Dа |
0 |
+ Dа Т + Dа |
−2 |
Т−2 + Dа |
2 |
Т2 . |
(1.13) |
Р |
|
1 |
|
|
|
|||
Коэффициенты уравнения (1.13) Dа0, Dа1 и т. д. для реакции (1.8) рассчитывают- |
||||||||
ся по формуле: |
|
|
|
|
|
|
|
|
аi = [d ai (D) + c ai (C)] − [a ai (A) + b ai (B)]. |
(1.14) |
|||||||
Подставляя выражение (1.13) в ур. (1.10), и, интегрируя в температурном ин- тервале от Т1 до Т2, получаем зависимость DН = f(Т) в конечной форме:
|
|
|
|
(Т |
|
|
|
) + |
|
Dа1 |
(Т2 |
- Т2 )- Dа |
|
æ |
|
1 |
|
|
1 |
|
ö |
|
|
||||||
DНo |
= DНo |
+ Dа |
0 |
2 |
- Т |
1 |
|
−2 |
ç |
|
|
- |
|
÷ |
+ |
||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
Т2 |
Т1 |
|
|
|
|
2 |
2 |
1 |
|
|
ç |
Т2 |
|
|
|
|
÷ |
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
è |
|
Т1 ø |
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
а2 |
(Т |
3 |
|
- Т3 ) |
|
|
|
|
|
(1.15) |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
или, если за Т1 принять стандартную температуру 298 К |
|
|
|
|
|
|
|
||||||||||||||||||||||
DНoТ = DНo298 + Dа0 (Т - 298) + |
Dа |
1 |
(Т2 |
- 2982 )- Dа−2 |
æ 1 |
- |
1 |
|
ö |
+ |
|||||||||||||||||||
|
|
ç |
|
|
|
|
|
|
÷ |
||||||||||||||||||||
2 |
|
|
298 |
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
è Т |
|
ø |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
а2 |
|
(Т3 |
|
- 2983 ). |
|
|
|
(1.16) |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Если в рассматриваемом температурном интервале происходят фазовые пре- вращения (например, плавление), то в расчете должны быть учтены значения эн- тальпий соответствующих фазовых превращений и изменение температурной за- висимости теплоемкости претерпевшего фазовое изменение вещества.
Пример 1. Рассчитать тепловой эффект реакции
4 HCl (г) + О2 (г) = 2 H2O (г) + 2 Cl2 (г)
при температуре 800 К и давлении 1 атм.
Из приложения (табл. 1, 2) находим термохимические данные для веществ, участвующих в реакции.
19
|
o |
|
сo |
= а |
0 |
+ а Т + а |
−2 |
Т−2 + а |
2 |
Т2 |
, Дж/моль·К |
||||||
Вещество |
, кДж/моль |
Р |
|
1 |
|
|
|
|
|
|
|
|
|||||
Н298 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
а0 |
|
|
|
а1·10 |
3 |
|
а−2·10 |
–5 |
а2·10 |
6 |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
HCl(г) |
–92,31 |
26,53 |
|
|
4,60 |
|
|
1,09 |
|
|
− |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
O2(г) |
|
0 |
31,46 |
|
|
3,39 |
|
|
–3,77 |
|
− |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
H2O(г) |
–241,81 |
|
30,0 |
|
|
10,71 |
|
0,33 |
|
|
− |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Cl2(г) |
|
0 |
37,03 |
|
|
0,67 |
|
|
–2,85 |
|
− |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
По ур. (1.9) находим |
Нoр реакции при стандартной температуре |
|
|
|
||||||
Нoр = [2 Нo298 (H2O(г)) + 2 Нo298 (Cl2(г))] – [4 Нo298 (HCl(г)) + |
Нo298 (O2(г))] = |
|||||||||
= 2(–241,81) + 2·0 –4(–92,31) − 4·0 = –114,38 кДж = –114 380 Дж. |
||||||||||
Далее по ур. (1.14) рассчитываем коэффициенты степенного ряда (1.13): |
||||||||||
а0 = 2·а0(H2O(г)) + 2·а0(Cl2(г)) – 4·а0(HCl(г)) – а0(O2(г)) = |
|
|
|
|||||||
= 2·30,0 + 2·37,03 – 4·26,53 – 31,46 = –3,52; |
|
|
|
|
|
|
|
|||
а1 = 2·а1(H2O(г)) + 2·а1(Cl2(г)) – 4·а1(HCl(г)) – а1(O2(г)) = |
|
|
|
|||||||
= (2·10,71 + 2·0,67 – 4·4,60 – 3,39)·10–3 = 0,97·10–3; |
|
|
|
|||||||
а−2 = 2·а−2(H2O(г)) + 2·а−2(Cl2(г)) – 4·а−2(HCl(г)) – а−2(O2(г)) = |
|
|||||||||
= (2·0,33 − 2·2,85 – 4·1,09 + 3,77)·105 = −5,63·105; |
|
|
|
|
||||||
а2 = 0. |
|
|
|
|
|
|
|
|
|
|
После подстановки в ур. (1.16) |
Dа |
1 (8002 - 2982 )- Dа−2 |
æ 1 |
|
|
1 |
|
|
||
DН800o = DНo298 + Dа0 |
(800 - 298) + |
|
|
|
ö |
|||||
|
ç |
|
|
- |
|
|
÷ = |
|||
2 |
|
|
298 |
|
||||||
|
|
|
è 800 |
|
|
|
ø |
|||
= -114 380 - 3,52 (800 - 298) + |
0,97 ×10−3 |
(8002 |
- 2982 )+ 5,63×105 |
æ |
1 |
- |
1 |
ö |
= |
|
|
ç |
|
|
÷ |
||||||
2 |
800 |
298 |
||||||||
|
|
|
è |
|
ø |
|
= – 117 065 Дж = – 117,07 кДж.
Пример 2. Пользуясь данными приложения (табл. 1, 2), определите удельную теплоту испарения воды (кДж/г) при температуре 373 К и давлении 1 атм.
Для фазовых превращений справедливы те же термодинамические законо- мерности, что и для химических реакций. Для процесса испарения воды
H2O(ж) = H2O(г)
в приложении (табл. 1, 2) находим термохимические данные.
|
|
сo |
= а |
0 |
+ а Т + а |
−2 |
Т−2 + а |
2 |
Т2 |
, Дж/моль·К |
||||
Вещество |
Нo298 , кДж/моль |
Р |
|
1 |
|
|
|
|
|
|
||||
|
а0 |
|
|
|
а1·10 3 |
|
а−2·10 –5 |
а2·10 6 |
||||||
|
|
|
|
|
|
|
||||||||
H2O(ж) |
−285,8 |
39,02 |
|
|
76,64 |
|
11,96 |
|
− |
|||||
|
|
|
|
|
|
|
|
|
|
|
||||
H2O(г) |
–241,8 |
|
30,0 |
|
|
10,71 |
|
0,33 |
|
− |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20
По ур. (1.9) находим DНoр реакции при стандартной температуре
DНo298 = DНo298 (H2O(г)) – DНo298 (H2O(ж)) = −241,8 + 285,8 = 44 кДж = 44 000 Дж.
Далее по ур. (1.14) рассчитываем коэффициенты полинома (1.13):
Dа0 = а0(H2O(г)) − а0(H2O(ж)) = 30,0 − 39,02 = −9,02;
Dа1 = а1(H2O(г)) − а1(H2O(ж)) = (10,71 − 76,64)·10–3 = −65,93·10–3; Dа−2 = а−2(H2O(г)) − а−2(H2O(ж)) = (0,33 − 11,96)·105 = −11,63·105;
Dа2 = 0.
Подставляем в ур. (1.16)
DН373o |
= DНo298 |
+ Dа0 |
(373 - 298) + |
Dа |
1 (3732 |
- 2982 )- Dа−2 |
æ |
1 |
- |
1 |
ö |
= |
|
|
ç |
|
|
÷ |
|||||||||
2 |
373 |
298 |
|||||||||||
|
|
|
|
|
|
è |
|
ø |
|
= 44000 - 9,02 (373 - 298) |
- |
65,93×10 |
−3 |
(3732 - 2982 )+ 11,63×105 |
æ |
1 |
- |
1 ö |
= |
|||
|
|
ç |
|
|
÷ |
|||||||
2 |
|
373 |
|
|||||||||
= 40 880 Дж = 40,88 кДж. |
|
|
|
|
è |
|
298 ø |
|
||||
|
|
|
|
|
|
|
|
|
|
|
||
Такое количество теплоты будет затрачено на испарение 1 моль H2O, т. е. 18 г |
||||||||||||
при температуре 373 К. Составляем пропорцию: |
|
|
|
|
|
|
||||||
|
|
18,0 г |
Н2О |
– |
40,88 кДж; |
|
|
|
|
|
|
|
откуда DНх = 1,0 ×40,88 |
|
1,0 г |
Н2О |
– |
DНх, |
|
|
|
|
|
|
|
= 2,27 кДж. |
|
|
|
|
|
|
|
|
|
|||
18,0 |
|
|
|
|
|
|
|
|
|
|
|
|
Проанализируем влияние температуры на изменение энтальпии процессов в примерах 1 и 2.
В примере 1 с большим ( ≥ 100 кДж) стандартным тепловым эффектом при изменении температуры на DТ1 = (800 − 298) = 502 К тепловой эффект изменился
на
D1 = ± (114,38 - 117,07)×100% = 2,4% . 114,38
В примере 2 тепловой эффект процесса при стандартных условиях невелик (£ 50 кДж). При изменении температуры на DТ2 = (373 –298) = 75 К тепловой
эффект изменился уже на
D2 = ± (44 - 40,88)×100% = 7,1% . 44
Зависимость величины DНТР от давления Р, как правило, невелика. В том слу-
чае, когда число газообразных молекул в результате взаимодействия не меняют- ся (например, N2 + 2O2 = 2NO2 или H2 + Cl2 = 2HCl), давление вообще не влияет на величину теплового эффекта. Поэтому при выполнении термохимических расчетов, допуская определенную ошибку, можно пользоваться стандартными
DНo298 даже тогда, когда температура и давление, при которых идет взаимодей- ствие, отличаются от стандартных.
21
2.НАПРАВЛЕННОСТЬ ФИЗИКО-ХИМИЧЕСКИХ ПРОЦЕССОВ
2.1.Энтропия как мера вероятности состояния системы. Зависимость энтропии от различных факторов.
Стандартная энтропия
|
|
З а д а н и е 6 |
Вариант 1. |
Определить, в каком случае энтропия должна быть больше и по- |
|
чему? |
|
|
1. |
NН3(г) при Р = 1 атм или при Р = 1000 атм (Т = const). |
|
2. |
I2(г) или |
I2(тв) при Т = const. |
3. |
Н2О(ж) при Т = 298 К или Н2О(ж) при Т = 373 К (Р = const). |
|
4. |
Sn(аморф) |
или Sn(тв). |
Вариант 2. Для какого из веществ стандартная энтропия (So298 ) должна быть больше и почему?
1.СО(г) или СО2(г).
2.TiCl2(тв), TiCl3(тв) или TiCl4(ж).
3.HF(г), HCl(г), HBr(г) или НI(г).
4.О(г), О2(г) или О3(г).
Вариант 3. меньше и почему?
1.WCl2(тв), WCl4(тв) или WCl6(тв).
2.F2(г), Cl2(г), Br2(г) или I2(г).
3.Cl2(г) или Cl(−раствор) .
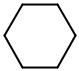
4. С6Н14 – гексан, |
С6Н12 |
(СН2=СН–СН2–СН2–СН2–СН3) – гексен-1 или |
|
Н2С |
СН2 |
С6Н12 – циклогексан |
Н2С |
СН2 |
|
Н2С |
СН2 |
Вариант 4. Для какого из веществ стандартная энтропия (So298 ) должна быть больше и почему?
1.ВеО(тв), MgO(тв), СаО(тв), SrO(тв) или ВаО(тв).
2.С(графит) или С(алмаз).
3.Ag(тв), AgBr(тв), AgCl(тв) или AgI(тв).
4.KCl(тв) или KClO3(тв).
Вариант 5. |
Ниже приведены |
значения стандартных энтропий |
So298 |
||
(Дж/моль·К) |
для |
различных |
аллотропических |
модификаций |
серы |
|
|
|
22 |
|
|
