
khimia_semistrovaya_rabota
.docxМинистерство образования и науки Российской Федерации
Федеральное государственное бюджетное образовательное учреждение
высшего профессионального образования
«Южно-Уральский государственный университет»
(Национальный исследовательский университет)
Кафедра «Конструирование и технология электронных средств»
СЕМЕСТРОВАЯ РАБОТА ПО ХИМИИ
ТЕМА: Электролиз
Вариант 5
Преподаватель: Смолко В.А.
Студент: Головнин А.А.
Факультет: ПС Группа: 139
Учебный год: 2013 Семестр: 1
Челябинск
2013
Обессоливание воды электролизом
Очистка воды электролизом представляет собой физико-химический процесс. Он заключается в выделении на электродах различных составных частей веществ, растворенных в воде. Процедура очистки воды электролизом возникает при пропускании через раствор или расплав электролита электрического разряда. Анодом в химии называется положительный электрод, катодом — отрицательный. Положительные ионы — (катионы) — начинают движение к катоду, отрицательные ионы — (анионы) — стремятся к аноду. Суть процесса в следующем: в электрическом поле, созданном соединенными с источником электрической энергии электродами, возникает упорядоченное движение ионов. Для возникновения процесса необходимо лишь поместить устройство в проводящую жидкость – воду. Электролиз воды - это сложный электролитический процесс доочистки водопроводной воды, при котором с помощью электрического тока вода распадается на составляющие - кислород и водород, иногда для этого процесса используется шестивольтная батарея. Ячейка электролиза состоит из двух электродов. Их присоединяют к противоположным полюсам источника электрической энергии. Первые примеры применения электролиза описаны в истории и датированы примерно 300 столетием до н.э.
Широкое применение процесса электролиза очистки воды обусловлено его эффективностью. Результатом такой водоподготовки является разрушение органических веществ в воде и извлечение металлов, кислот, неорганических веществ и примесей. Электролитическая очистка осуществляется с помощью специальных устройств - электролизеров. Стоит отметить, что обычный гидравлический насос – простой приборчик элементарного электролиза воды из крана.
Поскольку очистка воды электролизом основана на способности веществ распадаться под действием электрического тока, то использование этого метода имеет ряд преимуществ, главное из которых — высокая степень очистки, позволяющая передавать очищенную воду на коммунальные сооружения, также следует отметить, что вещества (СО2, Н2, О2), образующиеся при распаде воды, оказывают гораздо меньшее воздействие на окружающую среду, чем содержащиеся в исходной воде. К недостаткам этого метода можно отнести повышенный расход электроэнергии. Сегодня представляет интерес использование этого метода для локальной очистки водоемов, содержащих роданид, тиосульфат и сульфат натрия с высокой концентрацией загрязняющих примесей. В настоящее время установки для очистки воды электролизом разрабатываются повсеместно, ведутся исследования этого перспективного метода, который в дальнейшем позволит устранить ряд важных проблем, связанных со здоровьем человека и защитой окружающей среды.
Часто электрохимическое обессоливание воды комбинируется с реагентным или ионитным методом обработки воды. При этом анодные и катодные продукты используются для умягчения воды или регенерации Н - - и ОН-ионитов.
Принцип электрохимического обессоливания воды заключается в следующем. Если в среднее отделение ванны, разделенной диафрагмами на три отделения, залить воду, содержащую растворенные соли, например, хлорид натрия, в крайние отделения, залитые чистой водой, поместить электроды и вести электролиз, то анионы током будут переноситься в анодное пространство.
Способ электрохимического обессоливания воды с помощью ионитовых диафрагм, являющихся полупроницаемыми, так как каждая пропускает ионы только определенного заряда, называется электродиализом.
Способ электрохимического обессоливания воды имеет перспективы дальнейшего совершенствования в случае применения диафрагм из ионитовых смол, например, СДВ-3 в качестве катодной и АН-2 ф в качестве анодной, избирательно пропускающих только катионы или только анионы.
Принцип электрохимического обессоливания воды заключается в следующем. Если в среднее отделение ванны, разделенной диафрагмами на три отделения, залить воду, содержащую растворенные соли, например, хлорид натрия, в крайние отделения, залитые чистой водой, поместить электроды и вести электролиз, то анионы током будут переноситься в анодное пространство.
Принцип электрохимического обессоливания воды заключается в следующем. Если в среднее отделение электролизера, разделенного диафрагмами на три отделения, залить воду, содержащую растворенные соли, например, хлорид натрия, в крайние отделения, залитые чистой водой, поместить электроды и вести электролиз, то анионы током будут переноситься в анодное пространство.
Описанный способ электрохимического обессоливания воды называется электроосмосом. В настоящее время из-за весьма большого расхода электроэнергии на опреснение воды до солености не выше 1 Бр он практически не применяется.
|
|
|
Поскольку при электрохимическом обессоливании воды последняя является электролитом, применение металлов в водяном тракте собственно установки (камерах, трубах, арматуре и насосах) должно быть исключено или должны быть приняты меры, предотвращающие электрохимическую коррозию металлических частей.
Для понижения расхода электроэнергии при электрохимическом обессоливании воды необходимо в первую очередь упорядочить движение ионов из обессоливаемой воды, направив к аноду только анионы, а к катоду - только катионы. Для этой цели применяют электрохимически активные диафрагмы из ионнообменных смол, связанных нерастворимым в воде инертным материалом - матрицей.
Электролизёр – это устройство для проведения электролиза, состоящее, в принципе, из двух электродов, один из которых подсоединён к положительному полюсу источника тока и служит анодом. На нём происходит процесс окисления. Второй электрод присоединён к отрицательному полюсу и является катодом. На его поверхности идёт процесс восстановления.
Процесс на аноде зависит от материала, из которого он изготовлен, если анод активный, т.е. растворяется (железо, цинк, медь, серебро и др. металлы в процессе электролиза), то независимо от природы аниона окисляется металл анода.
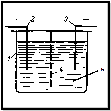 Схема
элекролизёра
Схема
элекролизёра
На рисунке показана схема электролизёра, где 1 – ёмкость, 2 – анод из железа, 3 – катод из железа, 4 – диафрагма, 5 – водный раствор FeSO4.
На положительном электроде — аноде ионы отдают электроны, т. е. протекает реакция электрохимического окисления; на отрицательном электроде — катоде происходит присоединение электронов, т. е. протекает реакция восстановления.
Составим схему процесса электролиза:
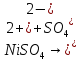 ;
;
Воздух, рН<7
А(+) Ni2+; SO42-; H2O (OH-) Cu2+; H2O (H+) К(-)
Ni Cu
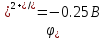
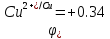
Ni
- 2ē→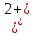 Cu2+
+ 2ē → Cu
Cu2+
+ 2ē → Cu
φ 2H2O-/O2+4H+ = +0.805 B φ 2H2O-/H2+2OH- = -0.228 В
2H2O - 4ē → O2+4H+ 2H2O+2e→H2+2OH-
φ S2O82-/2SO42- = +2,01 B
2SO42-—2e→S2O82-
η O2/Ni=0.70 В η H/Cu=0.48 В
φ (i)2H2O/O2 + 4H+ = φ 2H2O/O2 + 4H+ - η O2/Ni= φ (i)2H2O/H2 + 2OH- = φ 2H2O/O2 + 2OH- - η H2/Cu=
=+ 0,805 - 0.70 =0.105 В =-0.228 – 0.48=-0.708 В
Наименьшим электродным Наибольшим электродным
потенциалом обладает процесс потенциалом обладает процесс
окисления никеля. Следовательно, восстановления углерода,
в соответствии с правилом, будет следовательно
происходить процесс: в соответствии с правилом,
Ni – 2ē → Ni2+
будет происходить процесс:
Cu2+ + 2ē → Cu
Теоретическую массу меди, выделившегося при электролизе на катоде, можно рассчитать с помощью объединённого закона Фарадея, используя формулу:
mтеор
(Сu)=
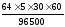 =
5,97
г
=
5,97
г
Вычисляем практическую массу меди:
m(Cu) = 5,97×90/100 = 5,37 г
Находим теоретическую массу кислотного остатка:
mтеор
(SO4)=
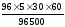 =
8,95г
=
8,95г
Находим практическую массу кислотного остатка:
m(SO4) = 8,95×90/100 = 8,05 г
