
Порядок выполнения работы
В стакан наливают исследуемый раствор объемом 30 мл, устанавливают электроды для измерения электропроводности и термодатчик. Серебряные электроды в стакане устанавливают так, чтобы они были ниже уровня раствора на 0,5–1 см.
Электроды для измерения электропроводности подключаются к разъемам модуля, обозначенными как I и R, термодатчик подключается к разъему 1.
Проводят измерение электропроводности раствора (Gх), как указано в приложении 2.
Определение постоянной сосуда
Если бы расстояние между электродами точно равнялось 1 см, а площадь каждого электрода – 1 см2 и в прохождении тока участвовал только один объем раствора, заключенный между электродами, то электропроводность, измеренная в таких условиях, представляла бы собой удельную электропроводность раствора. Практически очень сложно выполнить все условия. Поэтому для каждого сосуда определяют его постоянную С0.
Если
в формуле
![]() ,
обозначить
,
обозначить![]() =С0
– как
постоянную сосуда, тогда
=С0
– как
постоянную сосуда, тогда
![]() .
Отсюда можно заключить, что
.
Отсюда можно заключить, что![]() ,
гдеGx
– измеряемая электропроводность.
,
гдеGx
– измеряемая электропроводность.
Практически постоянную сосуда определяют следующим образом.
В сосуд для измерения электропроводности наливают 0,02 н раствор хлорида калия таким образом, чтобы в раствор были погружены только электроды. Электропроводность раствора хлористого калия Gx определяют, как указано в прил. 2. Из табл. 1 определяют удельную электропроводность хлорида калия χ при данной температуре.
Таблица 1
Удельная электрическая проводимость растворов KCl
в интервале 0 – 25 С
-
Температура
t, С о
Удельная электропроводность растворов KCl
(ом-1см-1)
1 н
0,1 н
0,02 н
0
0,06541
0,00715
0,001521
10
0,08319
0,00933
0,001994
15
0.09252
0,01048
0002243
16
0,09441
0,01072
0,002294
17
0,09631
0,01095
0,002345
18
0,09822
0,01119
0,002397
19
0.10014
0,01143
0,002449
20
0,10207
0,01167
0,002501
21
0,10400
0,01191
0,002553
22
0,10554
0,01215
0,002606
23
0,10789
0,01239
0,002659
24
0,10984
0,01264
0,002712
25
0,11180
0,01288
0,002765
Измерение электропроводности органической кислоты
Измеряют электропроводность растворов уксусной кислоты следующих концентраций: 0,001; 0,01, 0,1; 1 н.
Начинают измерения в растворе меньшей концентрации. Электроды и сосуд перед началом измерений необходимо промыть сначала дистиллированной водой, а затем определяемым раствором. Объем кислоты в сосуде должен быть таким же, каким был объем раствора хлорида калия. Данные измерений заносят в табл. 2:
Таблица 2
Данные измерений
-
№
с, моль/л
Gх, мСм
χ
λ
α
К
1
2
3
4
Зная электропроводность раствора и постоянную сосуда – С0, находят удельную электропроводность данного раствора по формуле
![]() ,
[Ом-1·см-1].
,
[Ом-1·см-1].
По
формуле
![]() находят молярную электропроводность.
Затем по формуле
находят молярную электропроводность.
Затем по формуле![]() определяютλ.
Предельные подвижности катионов и
анионов
определяютλ.
Предельные подвижности катионов и
анионов
![]() и
и![]() находят по табл. 3.
находят по табл. 3.
По
формуле
![]() определяют степень электролитической
диссоциации.
определяют степень электролитической
диссоциации.
По
формуле
![]() проверяют закон разведения Оствальда.
проверяют закон разведения Оствальда.
Таблица 3
Предельная подвижность ионов при бесконечном разведении
-
Катионы
Анионы
Ион
Температура, ºC
Ион
Температура, ºC
18
25
18
25
Н+ (Н2О)
315
349,7
Cl–
65,5
76,32
Na+
43,5
50,1
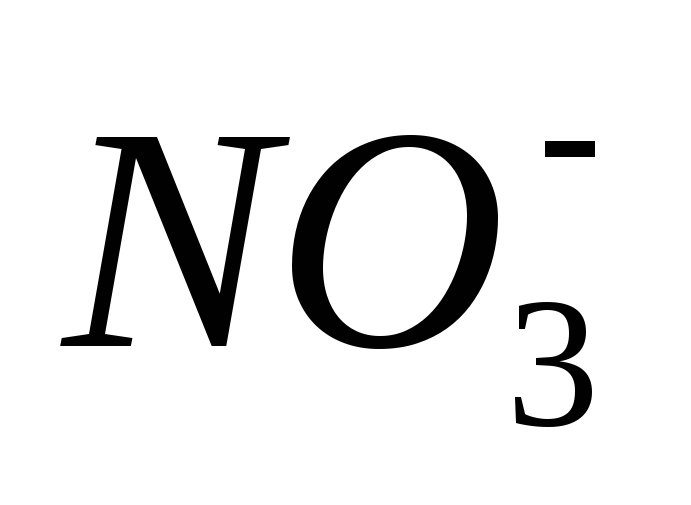
61,7
71,42
K+
64,6
73,5
HCOO-
47
54,6
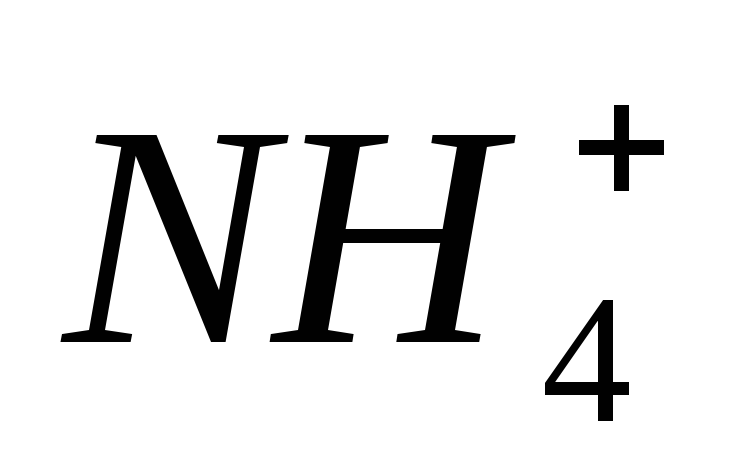
64
73,7
CH3COO-
34
41
1/2Ва2+
54,6
63,6
C2H5COO-
-
35,8
Приложение
