
- •Магістерська робота
- •Реферат
- •Огляд наукової літератури
- •Місце та методика проведення досліджень
- •2.1. Грунтові умови
- •2.2. Кліматичні умови
- •2.3. Методика проведення досліджень
- •3.2. Фенологічні спостереження та обліки
- •3.3. Тривалість міжфазного та вегетаційного періодів
- •3.4. Біометричні показники та стійкість до шкідників і хвороб
- •3.5. Показники структури урожаю
- •3.6. Урожайність
- •Економічна ефективність вирощування насіння самозапилених ліній
- •Охорона праці
- •Висновки та пропозиції
- •Список використаної літератури
2.3. Методика проведення досліджень
До кінця Х1Х ст. головним методом селекційної роботи з кукурудзою був масовий добір. Основний його зміст полягав у доборі кращих рослин за ознаками початка, об’єднання насіння від них і посів від них насіння для вирощування наступного покоління. Так створено значне число видатних сортів кукурудзи, які також стали цінним вихідним матеріалом для селекції. Однак в наступному було встановлено, що великих досягнень по врожайності при використанні цього метода досягнути неможливо. Тому в 90-х роках Х1Х сторіччя розробили початкорядний метод, або індивідуальний добір. Проводили добір кращих качанів і висівали насіння від них окремими рядками, оцінюючи нащадків. Цей метод також виявився малоефективним при селекції на врожайність.
Найбільший ефект гетерозису був встановлений при схрещуванні самозапильних ліній кукурудзи. Це відкриття поклало початок використання метода міжлінійної гібридизації – основного напрямку селекції даної культури.

Рис 3. Явище гетерозису у кукурудзи в порівнянні з батьківськими формами
Селекція гібридної кукурудзи в останні десятиліття досягла значних успіхів. Кращі сучасні гібриди перевищують старі сорти по врожаю зерна на 100% і більше.
Для створення гетерозисних гібридів кукурудзи за вихідний матеріал використовують самозапильні лінії. Тому перший етап в селекції на гетерозис – одержання самозапильних ліній.
Існує низка методів, серед них найбільш розповсюджений стандартний метод. Суть його полягає в проведенні самозапилення рослин протягом шести-семи поколінь, яке сполучається з добором ліній за комплексом цінних ознак. Лінії S6 – S7 достатньо однорідні за морфологічними ознаками.
У перший рік роботи проводиться самозапилення в об’ємі, який визначається генетичними особливостями вихідного матеріалу. При закладанні ліній на міжлінійних гібридах піддають самозапиленню 20 – 50 рослин. а при використанні сортів, міжсортових, сортолінійних гібридів, синтетиків – 100 - 200 рослин, щоб охопити можливо більше число біотипів популяції. В S0 вибраковують небажані рослини і початки. На другий рік від кожного самозапиленого качана висівають 25 – 30 зерен на один рядок і проводять самозапилення кращих п’яти-восьми рослин. Після проведення роботи для подальшої роботи залишають три-п’ять кращих початків.
На теретій рік від кожної сім’ї висівають насіння трьох-п’яти початків окремими рядками. Проводять браковку і на кращих рядках самозапилюють рослини з наступним добором трьох-п’яти початків на цих ділянках.
У наступні роки (4, 5, 6 і 7-й) продовжують самозапилення кращих рослин і добір до того часу, поки не настане вирівняність за ознакми рослини і качана.
Паралельно з створенням ліній стандартним методом проводять оцінку їх комбінаційної здатності (КС) або тестування, тобто схрещування з тестером- аналізатором. При штучному запиленні ізолюють жіночі суцвіття до появи маточкових ниток. Попередньо верхівку листків обгортки зрізують, щоб забезпечити більш рівномірний вихід маточок.
Чоловічі суцвіття волоті ізолюють під час появи пиляків на центральній вісі. Ізолятори роблять у вигляді пакетів: для волоті розміром 15x20 або 20x30 см, а для качана - 10x20 см. їх закріплюють нитками або звичайними канцелярськими скріпками.

Рис 4. Ізоляція початків самозапилених ліній кукурудзи
Як правило, через 2 дні спостерігається вихід маточкових ниток. Ізоляцію проводять не менше ніж за 24 год до запилення, щоб пилок, потрапивши на волоть з інших рослин, втратив життєздатність (рис 5).
У день запилення, яке краще виконувати в ранішні години після спадання роси, збирають пилок з волоті. Якщо погода пасмурна і вологість повітря підвищена, то запилення можна проводити протягом усього дня. Для цього волоть з ізолятором нахиляють в бік і струшують декілька разів, щоб пилок потрапив на дно ізолятора, і потім знімають його з волоті. Ізолятор з пилком опускають на початок, з якого перед цим знімають ізолятор, запобігаючи потраплянню на приймочку пилку з інших рослин. Потім ізолятор, переміщений з волоті на початок, обережно струшують, розпилюючи пилок на приймочки маточок. Після запилення ізолятор закріплюють на стеблі[39].

Рис 5. Техніка проведення самозапилення (гібридизації)
Насіння кожного самозапиленого качана зберігають і наступного року насіння з нього висівають окремими ділянками. Серед потомства її самозапиленого качана повторно відбирають рослини для самозапилення згідно з описаною методикою.
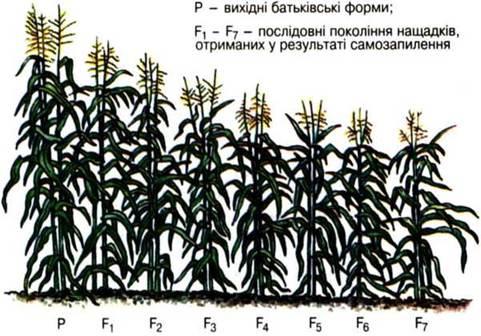
Рис 6. Послідовні покоління нащадків, отриманих в результаті самозапилення
Самозапилення цінних зразків проводять протягом 5-6 поколінь. Після чого, спостерігається явище інбредної депресії. Якщо рослини вирівняні та однорідні, то матеріал можна використовувати для подальшої селекційної роботи (рис 4)
Суб'єктивне визначення повної стиглості селекційного матеріалу при досягненні повної стиглості качанів і зерна ненадійне. Більш точно можна встановити повну стиглість за вологістю зерна або за масою врожаю на один день вегетації.
Групи стиглості кукурудзи визначають також за кількістю листків на рослинах, за сумою середньодобових температур за період від, сівби до певної фази розвитку рослин.( табл. 2.3)
Таблиця 2.3.
Класифікація гібридів кукурудзи за ФАО
|
Бал |
Група стиглості |
Група ФАО |
Кількість |
Сума ефективних температур, °С | ||
|
Діб від сходів до повної стиглості зерна |
Листків на рослині | |||||
|
1 |
Дуже ранньостигла |
110-149 |
70-80 |
9-10 |
801-900 | |
|
3 |
Ранньостигла |
150-199 |
81-90 |
11-12 |
901-1000 | |
|
4 |
Середньорання |
200-299 |
91-100 |
13-14 |
1001-1100 | |
|
5 |
Середньостигла |
300-399 |
101-110 |
15-17 |
1101-1170 | |
|
6 |
Середньопізня |
400-499 |
111-120 |
18-20 |
1171-1210 | |
|
7 |
Пізньостигла |
500-599 |
121-130 |
21-22 |
1211-1280 | |
|
9 |
Дуже пізня |
600-699 |
131-140 |
˃22 |
1281-1300 | |
Різні форми кукурудзи за тривалістю вегетації групують також залежно від кількості жилок на 10—12-му листку.
Фенологічні спостереження проводять і відмічають дати: сівби, сходів, цвітіння волотей, появи приймочкових ниток на качанах, стиглість — молочну, молочно-воскову, воскову, повну.
Холодостійкість різних зразків визначають при холодному пророщуванні насіння. Для цього певну кількість насіння висівають в ящики, заповнені ґрунтом з поля, де вирощували кукурудзу.
Шар ґрунту повинен бути 6—8 см. Насіння висівають на глибину 3—4 см. Ґрунт зволожують до 70—80% вологоємкості. Після цього ящики залишають на 24 год. при температурі 20—22 °С, щоб прискорити набубнявіння насіння, а потім їх поміщають у кліматичні камери, де підтримують температуру 10 °С протягом 10— 14 днів, а потім переносять у теплицю, в якій підтримується температура 20—22 °С. Крім цього, ще застосовують метод холодного пророщування в рулонах з фільтрувального паперу.
Найбільш простим і доступним методом визначення холодостійкості насіння кукурудзи є сівба в ранні строки в польових умовах.
Таблиця 2.4
Площа посіву дослідних ділянок і їх повторність
|
№ |
Назва лінії |
Кількість повторень |
Площа |
|
1 |
6233 |
3 |
4,9 |
|
2 |
HLG 1203 |
3 |
4,9 |
|
3 |
OM 235 |
3 |
4,9 |
|
4 |
OM 255 |
3 |
4,9 |
|
5 |
FV 243 |
3 |
4,9 |
|
6 |
Q 170 |
3 |
4,9 |
|
7 |
Cо 255 |
3 |
4,9 |
|
8 |
CG3 |
3 |
4,9 |
|
9 |
EA 2973 |
3 |
4,9 |
|
10 |
UCH 37 |
3 |
4,9 |
|
11 |
P 165 |
3 |
4,9 |
|
12 |
F2 (St) |
3 |
4,9 |
|
Всього |
- |
36 |
58,8 |
У 2014 році нами було висіяно 11 холодостійких самозапилених ліній кукурудзи у трьох повторностях, площа ділянки становила 4,9 м2, загальна площа досліду була 58,8 м2. (таблиця 2.4.)

Рис7. Рослина самозапильної лінії ОМ 235 у фазу цвітіння початків
Більш холодостійкими є і ті зразки, в яких сходи рослин мають інтенсивне зелене забарвлення. ( рис7)
Для того, щоб визначити тільки відношення насіння до холоду, треба виключити такий фактор як дію мікроорганізмів, що знаходяться в ґрунті або на самих зернівках. Така можливість появляється тоді, коли вирощують оброблене насіння фунгіцидами на стерильному ґрунті або його заміннику.3
Для кукурудзи основними елементами структури врожаю є: довжина качана, діаметр качана, кількість рядів зерен, кількість зерен в ряду, маса качана, маса зерна, маса 1000 зерен. Кожна із цих ознак вузько специфічна для ліній, успадковується та змінюються під впливом зовнішніх умов середовища.
Щодо стійкості до хвороб та шкідників, то було проведено оцінку зараженості пухирчастою сажкою та ступінь пошкодження кукурудзяним метеликом.
Ступінь пошкодження рослин шкідниками та інтенсивність ураження хворобами на всіх кукурудзі визначалось за уніфікованими шкалами у відсотках:
|
шкідники
|
хвороби
|
|
І бал – 0,1 – 25 ІІ бал - 26 – 50 ІІІ бал – 51 і більше |
І бал – 0,1 – 10 ІІ бал – 11 – 25 ІІІ бал – 26 – 50 ІV бал – 51 і більше |
Визначення ступеню ураження (інтенсивності) хворобами рослин полягає в прийнятті окомірно за 100% площі листкової поверхні або всієї рослини. При цьому окомірно листок або всі рослини приймаємо за 100%
РОЗДІЛ 3
ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА
3.1. Підбір холодостійких ліній в лабораторних умовах
Рівень ефективності селекції кукурудзи визначається наявністю генофонду цінних самозапилених ліній.
З колекції Національного центру генетичних ресурсів рослин України для досліджень холодостійкості було відібрано 36 ліній різної генетичної плазми.
Дослідження холодостійкості відібраних ліній проводились двома методами: лабораторним та польовим.
Методика проведення лабораторних досліджень полягала в пророщуванні 50-ти насінин кукурудзи в чотирьохкратній повторності в термостаті, в рулонах фільтрувального паперу на дистильованій воді. Контрольні зразки пророщувались при температурі 25 ºС на протязі 5 діб, дослідні зразки - при температурі 8-10 ºС- 20 діб, а потім 3 доби при 25 ºС.

Рис 1. Визначення холодостійкості лабораторним методом
В контрольних зразків на 5 добу, а у дослідних на 20 добу визначають схожість насіння, і через 3 доби перебування в оптимальних умовах росту проводять остаточну оцінку проростків і схожість насіння (табл. 3.1, 3.2)
Польові дослідження передбачали сівбу при різних температурах ґрунту на глибині зарубки насіння. Перший при температурі ґрунту +6°С, другий – оптимальний, при +10°С.
За результатами лабораторних та польових досліджень з усього отриманого вихідного матеріалу було відібрано 11 кращих холодостійких ліній для подальшого дослідження:6233, HLG 1203, OM 235, OM 255, FV 243, Q 170, Cо 255, CG3, EA 2973, UCH 37, P 165
Згідно даних таблиці 3.1. можна відмітити, що лабораторна схожість насіння під час холодного пророщування коливалась в межах від 56,1 (Со 255) до 96,2 (ОМ 235). Найкращі результати було відмічено в лініях: ОМ 235, UCH 37, EA 2973, ОМ 255 з показниками: 96,2%, 95,8%, 93,2%, 91,5%, відповідно.
Також згідно отриманих даних (табл.3.1) можна зробити висновок, що сівба при 10°С є найбільш оптимальною, хоча можна відмітити 4 холодостійкі лінії, які відзначені високими показниками польової схожості при температурі грунту під час сівби 6°С, а саме: ОМ 255, UCH 37, EA 2973 та 6233 з показниками 89,4%, 88,3%, 85,6% та 82,4% відповідно. Найнижчі результати були відмічені в лініях FV 243 та Q 170 з показниками 42,5% та 38,8%.
Одночасно зі схожістю насіння проводилась оцінка по таким показникам як довжина ростка та довжина корінця при оптимальному (25°С) та холодному (8-10°С) пророщуванні (таблиця 3.2.).
Можна відмітити, що лінії ОМ 235 та ОМ 255, які показали високі показники схожості насіння, також показали хороші результати при пророщуванні ростка та корінця, як при оптимальному так і при холодному. Згідно таюлиць 3.1. та 3.2. можна зробити припущення про зв'язок між схожістю та довжиною ростка і корінця. Найнижчі результати показала лінія UCH37
Таблиця 3.1
Довжина ростка та корінця при холодному та оптимальному пророщуваннях, 2013 рік
|
№ |
Назва лінії |
Тип генетичної плазми |
Довжина ростка, см |
Довжина корінця, см | ||
|
Оптимальне, 25°С |
Холодне, 8-10°С |
Оптимальне, 25°С |
Холодне, 8-10°С | |||
|
1. |
F2 (St) |
Змішана |
4,1 |
1,3 |
9,8 |
4,5 |
|
2. |
6233 |
Айодент |
4,0 |
1,1 |
9,9 |
4,8 |
|
3. |
HLG 1203 |
Айодент |
3,8 |
1,3 |
9,2 |
4,6 |
|
4. |
OM 235 |
Ланкастер |
4,1 |
1,6 |
10,2 |
4,7 |
|
5. |
OM 255 |
Ланкастер |
5,8 |
2,4 |
9,8 |
5,3 |
|
6. |
FV 243 |
Ланкастер |
2,7 |
1,3 |
7,9 |
4,2 |
|
7. |
Q 170 |
Лакауне |
3,6 |
0,9 |
5,6 |
3,4 |
|
8. |
Cо 255 |
Змішана |
4,6 |
1,2 |
8,3 |
3,8 |
|
9. |
CG3 |
Айодент |
4,1 |
1,0 |
7,9 |
3,1 |
|
10. |
EA 2973 |
Змішана |
3,4 |
1,0 |
8,6 |
4,1 |
|
11. |
UCH 37 |
Змішана |
2,5 |
0,7 |
5,6 |
3,1 |
|
12. |
P 165 |
Змішана |
4,1 |
0,9 |
9,1 |
3,0 |
Таблиця 3.2.
Лабораторна схожість відібраних ліній, 2013 рік
|
№ |
Назва лінії |
Тип генетичної плазми |
Лабораторна схожість, % | |
|
оптимальне пророщування, 25°С |
холодне пророщування, 8-10°С | |||
|
1. |
F2 (St) |
Змішана |
99,1 |
83,0 |
|
2. |
6233 |
Айодент |
96,5 |
90,1 |
|
3. |
HLG 1203 |
Айодент |
97,9 |
87,6 |
|
4. |
OM 235 |
Ланкастер |
98,4 |
96,2 |
|
5. |
OM 255 |
Ланкастер |
94,3 |
91,5 |
|
6. |
FV 243 |
Ланкастер |
92,0 |
76,7 |
|
7. |
Q 170 |
Лакауне |
100,0 |
58,3 |
|
8. |
Cо 255 |
Змішана |
98,5 |
56,1 |
|
9. |
CG3 |
Айодент |
98,1 |
88,3 |
|
10. |
EA 2973 |
Змішана |
99,2 |
93,2 |
|
11. |
UCH 37 |
Змішана |
96,4 |
95,8 |
|
12. |
P 165 |
Змішана |
98,3 |
72,1 |
Таблиця 3.3
Польова схожість самозапилених ліній кукурудзи, 2014 рік
|
№ |
Назва лінії |
Тип генетичної плазми |
Польова схожість, % | |
|
Сівба при температурі грунту: 6°С |
Сівба при температурі грунту: 10°С | |||
|
1. |
F2 (St) |
Змішана |
78,2 |
78,2 |
|
2. |
6233 |
Айодент |
82,4 |
82,4 |
|
3. |
HLG 1203 |
Айодент |
80,4 |
80,4 |
|
4. |
OM 235 |
Ланкастер |
85,0 |
85,0 |
|
5. |
OM 255 |
Ланкастер |
89,4 |
89,4 |
|
6. |
FV 243 |
Ланкастер |
42,5 |
42,5 |
|
7. |
Q 170 |
Лакауне |
38,8 |
38,8 |
|
8. |
Cо 255 |
Змішана |
46,3 |
46,3 |
|
9. |
CG3 |
Айодент |
72,3 |
72,3 |
|
10. |
EA 2973 |
Змішана |
85,6 |
85,6 |
|
11. |
UCH 37 |
Змішана |
88,3 |
88,3 |
|
12. |
P 165 |
Змішана |
76,2 |
76,2 |
