
- •Химическое отделение вятский государственный гуманитарный университет
- •М.А. Зайцев
- •Углеводороды
- •Виды изомерии органических соединений
- •Функциональные группы и классы органических веществ
- •Примеры названий органических веществ
- •Электронная структура атома углерода в органических соединениях
- •Химическая связь в органических соединениях
- •Длины и энергии углерод-углеродных связей
- •Классификация органических реакций
- •Углеводороды Алканы
- •Алкадиены
- •3Нссн бензол
- •Ароматические углеводороды (арены)
- •Задачи по теме
- •Цепочки превращений
- •Литература
3Нссн бензол
(Синтез Н.Д. Зелинского, Б.А. Казанского, 1922 г.).
4. Реакции замещения (кислотные свойства).
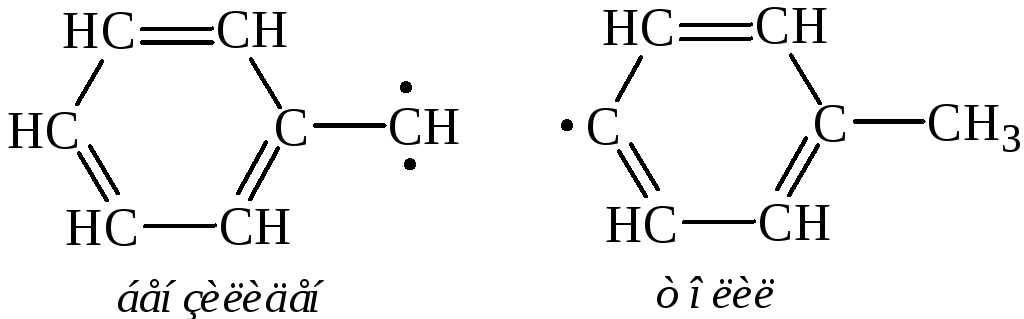
Связь С–Н в ацетилене более полярна, чем в этилене и этане, т.к. увеличивается электроотрицательность атома углерода в состоянии sр-гибридизации. Этим объясняются кислотные свойства ацетилена (и его гомологов, имеющих в молекуле концевую тройную связь), проявляющиеся в способности давать металлические производные – ацетилениды:
НССН + 2[Аg(NН3)2]ОН(р-р) АgССАg + 4NН3 + 2Н2О.
гидроксид диаммин- ацетиленид
серебра (аммиачный серебра
раствор оксида серебра) (серого цвета)
Ароматические углеводороды (арены)
Простейшим представителем аренов является бензол С6Н6. Он был открыт М. Фарадеем в 1825 г., а в 1845 г. А. Гофман выделил его из каменноугольной смолы.
Из многочисленных формул строения, предлагавшихся для бензола в 60-х годах XIX в., наиболее удачной оказалась формула А. Кекуле (1865 г.), согласно которой бензол представляет собой циклогексатриен-1,3,5 – шестичленный циклический углеводород с тремя сопряженными двойными связями:
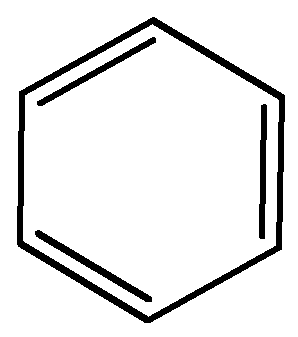
Такая структура правильно отразила равноценность всех шести атомов водорода бензола и некоторые другие особенности этого вещества. Однако формула Кекуле не могла объяснить, почему бензол не обладает свойствами ненасыщенного углеводорода: не обесцвечивает бромную воду и раствор перманганата калия. Вместо этого при действии брома протекает реакция замещения водорода, характерная для насыщенных углеводородов, и образуется бромбензол С6Н5Br; при действии азотной кислоты водород замещается на нитрогруппу и образуется нитробензол С6Н5NО2
Все же в определенных условиях возможны и реакции присоединения. При каталитическом гидрировании молекула бензола присоединяет шесть атомов водорода, образуя циклогексан:
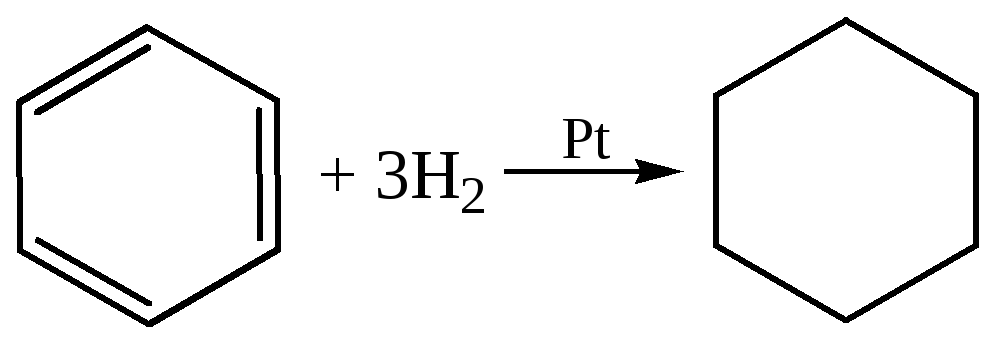
При сильном освещении бензол присоединяет шесть атомов хлора, образуя гексахлорциклогексан С6Н6Сl6.
Из приведенных примеров видно, что бензол может проявлять ненасыщенность, но в обычных условиях это свойство ослаблено.
Кроме того, реальная молекула бензола обладает меньшей энергией, чем если бы она представляла собой циклогексатриен, где электроны жестко закреплены в двойных и простых связях, т.е. бензол устойчивее.
Природа ароматического состояния
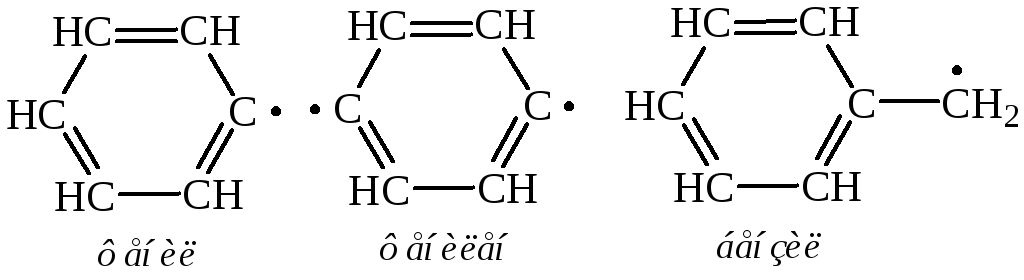
В молекуле бензола все связи С–С выровнены (длины всех связей 0,139 нм). Это плоская молекула, где 6 атомов углерода объединены в правильный шестиугольный цикл. Все атомы углерода в бензольном кольце находятся в состоянии sр2-гибридизации. Каждый из них образует три -связи (две С–С и одну С–Н) с углом между ними 120. Орбитали всех шести р-электронов перпендикулярны плоскости кольца и взаимно параллельны. Каждый из них взаимодействует с р-электронами соседних атомов углерода. Шесть р-электронов не локализованы в пары, как при образовании обычных двойных связей, а образуют общую -систему – осуществляется круговое сопряжение. Электронная плотность в бензольном кольце распределена равномерно, т.е. ни простых, ни двойных связей в бензольном ядре нет, все связи одинаковы:
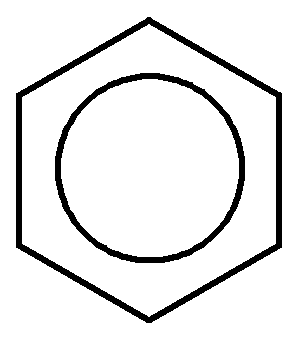
Ароматичность молекулы означает ее повышенную устойчивость, обусловленную делокализацией -электронов в циклической системе.
Критерии ароматичности аренов:
1. Атомы углерода в sp2-гибридизованном состоянии образуют циклическую систему.
2. Атомы углерода располагаются в одной плоскости (цикл имеет плоское строение).
3. Замкнутая система сопряженных связей содержит 4n+2 -электронов (n – целое число).
Этим критериям полностью соответствует молекула бензола С6Н6.
Изомерия производных бензола
Однозамещенные бензолы изомеров не имеют, т.к. все атомы углерода в бензоле равноценны.
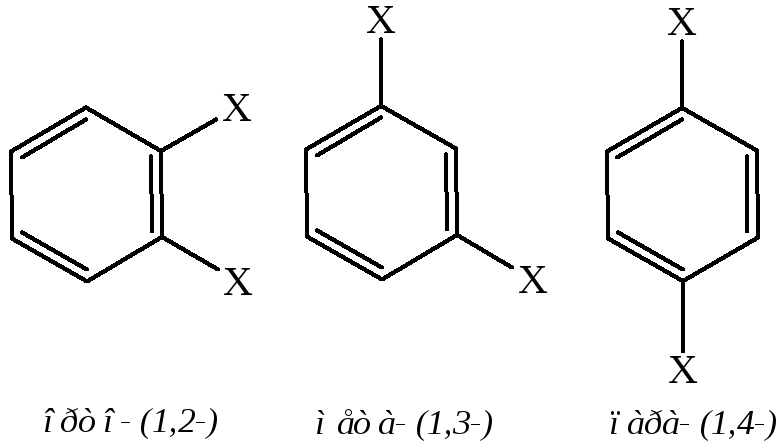
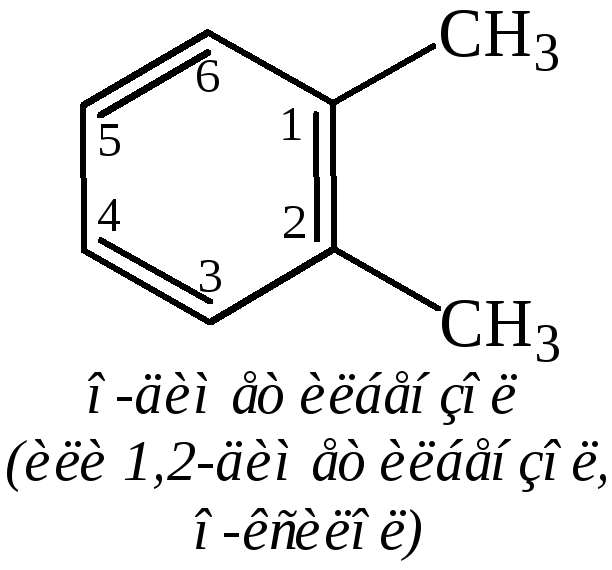
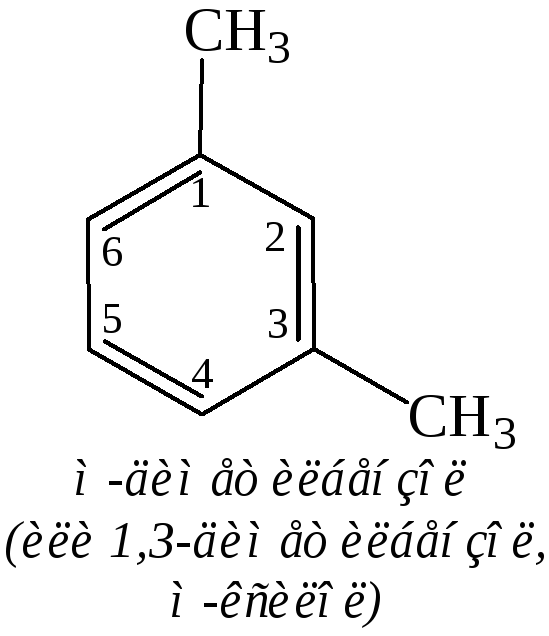
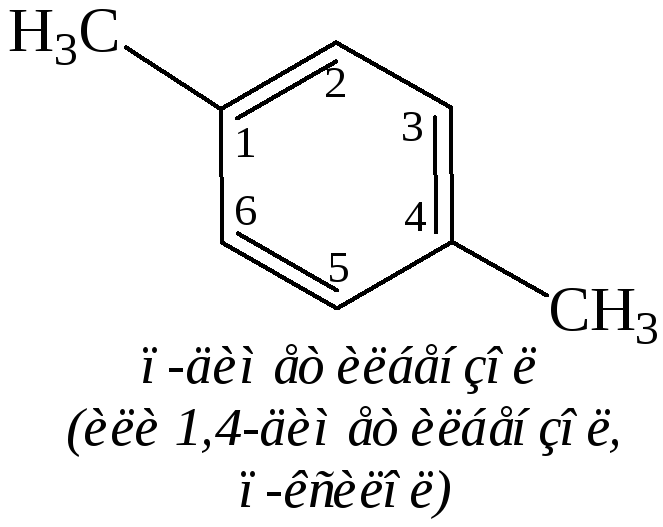
Двузамещенные бензолы существуют в виде трех изомеров, отличающихся расположением заместителей относительно друг друга. Положение заместителей указывают при помощи приставок орто- (о-, рядом), мета- (м-, через один) и пара- (п-, напротив) или обозначают цифрами:
По три изомера имеют трех- и четырехзамещенные бензолы с одинаковыми заместителями:

Производные бензола, которые можно рассматривать как продукты замещения атомов водорода бензола насыщенными (алкильными) углеводородными радикалами, называют гомологами бензола. Общая формула таких углеводородов СnН2n–6. Углеводородными заместителями могут быть также ненасыщенные радикалы (алкенильные, алкинильные). В молекулах «бензоидных» углеводородов различают две части: бензольное ядро и боковую цепь. Изомерия этих соединений обусловлена строением радикалов, их составом и расположением.
Номенклатура производных бензола
Названия углеводородов ряда бензола составляют из названий радикалов с добавлением окончания «бензол». Для многих из них употребительны тривиальные названия. Примеры:
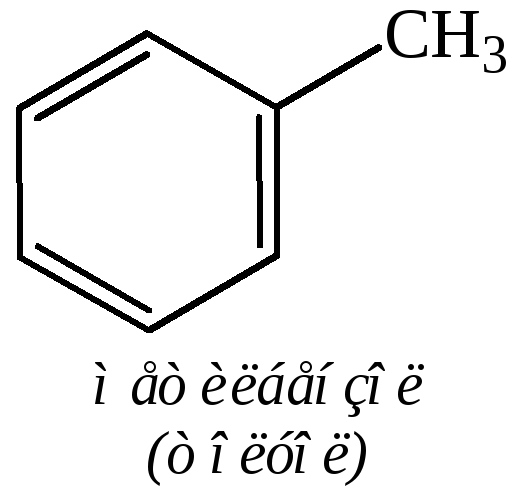
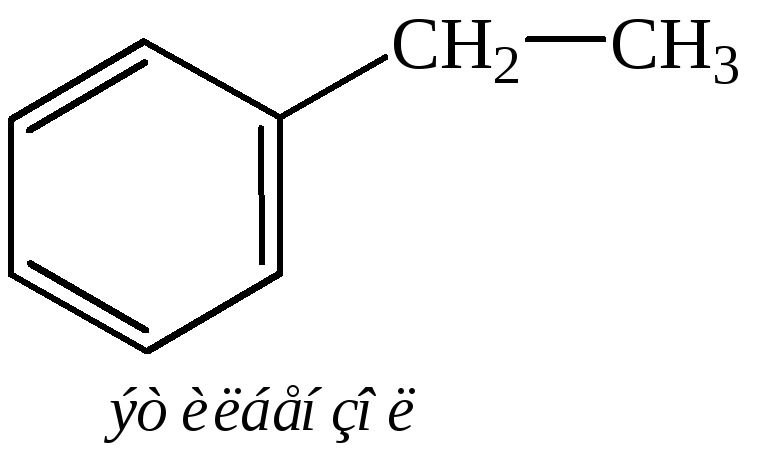

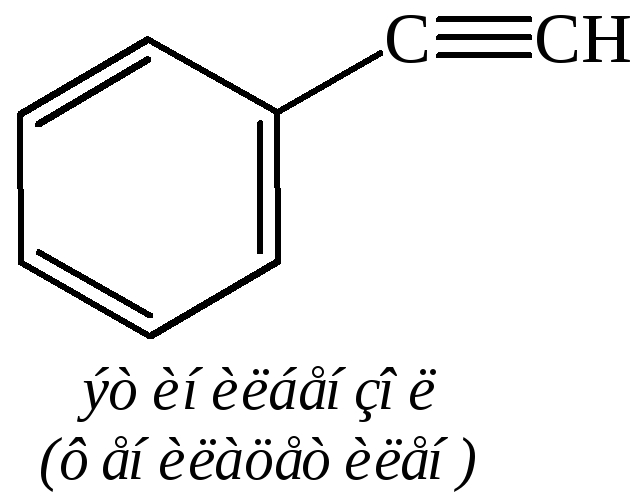
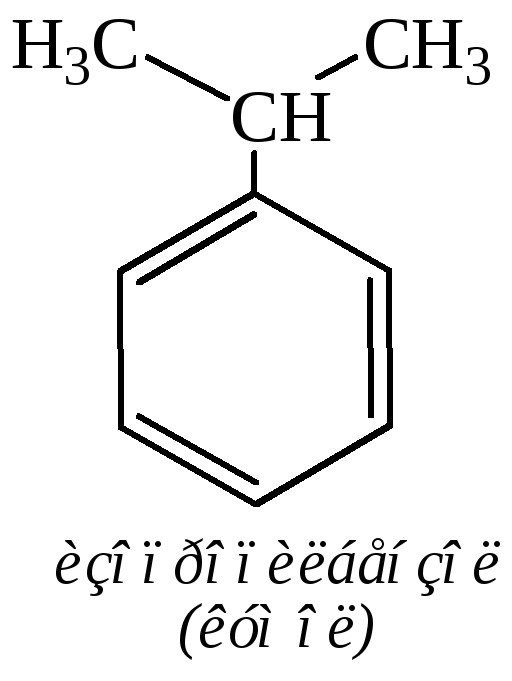
Общее название ароматических углеводородов – арены. Общее название ароматических радикалов – арилы. Примеры названий радикалов:
Способы получения
Для получения бензола и его гомологов используются нециклические и циклические углеводороды нефти.
1. Получение из нециклических углеводородов.
– Каталитическая дегидроциклизация – получение из алканов с неразветвленной цепью, имеющих не менее 6-ти атомов углерода в молекуле (Б. А. Казанский, А. Ф. Платэ, Б. Л. Молдавский):

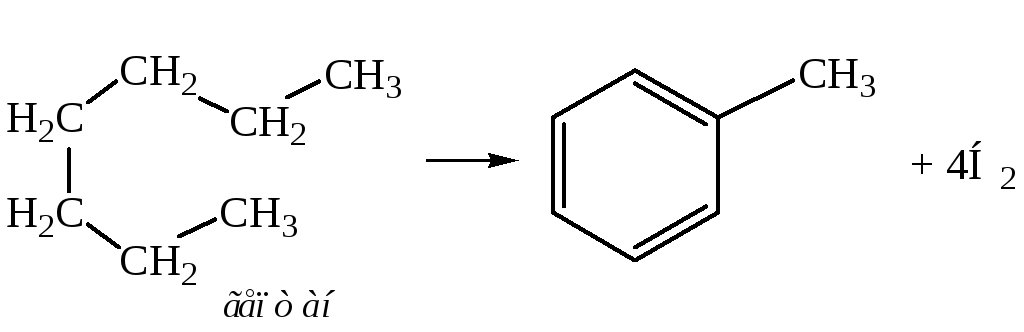
Катализатором может служить платинированный уголь при 300С, а также оксиды хрома, молибдена, ванадия. Наиболее часто используют оксид хрома на оксиде алюминия при 500С и 3МПа.
– Полимеризация ацетилена и его гомологов (см. раздел «Химические свойства алкинов»).
2. Получение из циклических углеводородов.
– Каталитическое дегидрирование (Н. Д. Зелинский, 1911 г.; катализатор – палладиевая чернь, 300С):
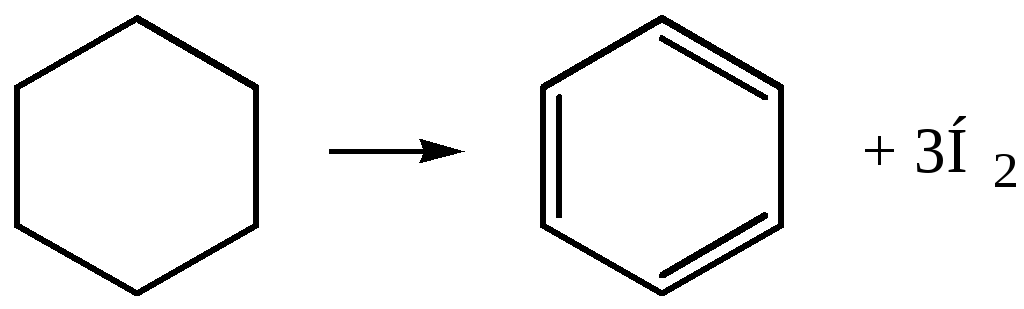
В промышленности в качестве катализатора используют платину на оксиде алюминия; температура около 450С.
Химические свойства
Арены склонны к реакциям, в результате которых сохраняется ароматичность (-система), т.е. к реакциям замещения. В реакции, сопровождающиеся нарушением ароматичности, арены вступают только в жестких условиях. Это реакции окисления и присоединения.
Реакции замещения.
– Галогенирование. В обычных условиях с хлором и бромом бензол не взаимодействует. Реакция протекает в присутствии катализатора:
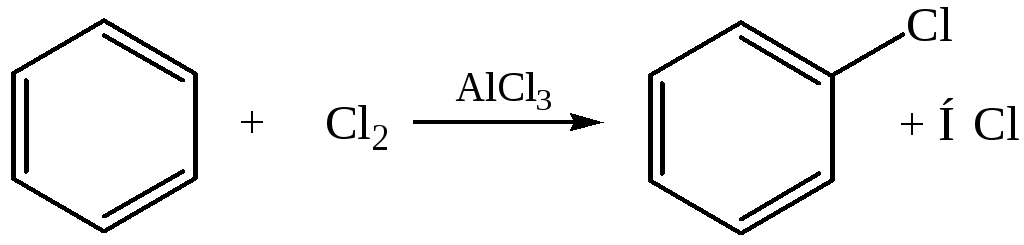
Чаще всего используют галогениды алюминия и железа: AlCl3, AlBr3, FeCl3, FeBr3.
– Нитрование. Действуют смесью концентрированных азотной и серной кислот:
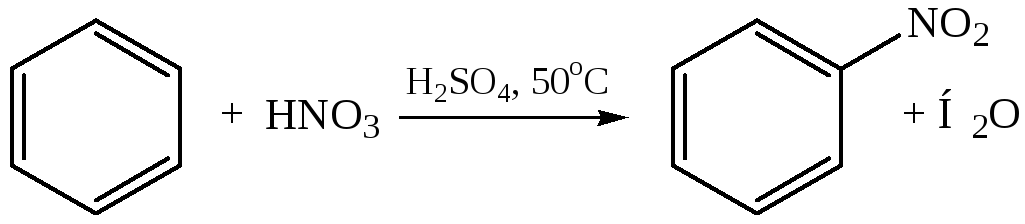
Реакции присоединения к бензолу описаны выше.
Производные бензола имеют ряд особенностей в химическом поведении, связанных с наличием в их молекулах алкильных радикалов (или функциональных групп).
Взаимное влияние атомов в молекулах производных бензола
1. Реакции в боковой цепи (влияние ядра).
По химическим свойствам алкильные радикалы подобны алканам. Атомы водорода в них замещаются на галоген. Влияние бензольного ядра приводит к тому, что замещение облегчается и замещается всегда атом водорода у атома углерода, непосредственно связанного с ароматическим кольцом:

толуол фенилхлорметан фенилдихлорметан фенилтрихлорметан
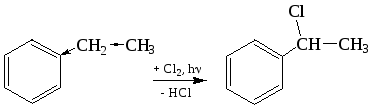
этилбензол 1-фенил-1-хлорэтан
Боковые цепи в гомологах бензола подвергаются окислению легче, чем соответствующие алканы, (например, при действии НNО3, КМnО4 и др.) и независимо от длины углеродной цепи окисляются в карбоксильную группу, что также обусловлено влиянием бензольного ядра (смещением к нему электронной плотности от углеводородных радикалов):
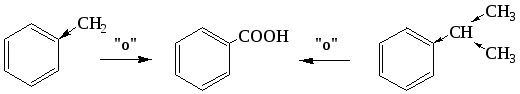
бензойная кислота
Бензольное кольцо оказывает влияние и на поведение функциональных групп (–ОН, –NН2 и др.), связанных с ним. Так, фенол проявляет более выраженные кислотные свойства по сравнению со спиртами и взаимодействует с основаниями:

фенолят натрия
Это объясняется р--сопряжением неподеленной пары электронов атома О гидроксильной группы с -системой бензольного кольца, упрочнением связи С–О и большей поляризацией связи О–Н.
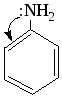
За счет р--сопряжения неподеленной электронной пары атома N аминогруппы с -системой бензольного кольца анилин является менее сильным основанием, чем амины жирного ряда:
2. Ориентация при замещении в бензольном ядре (влияние заместителей).
Вследствие равноценности всех атомов углерода в бензоле однозамещенные бензолы изомеров не имеют. При вступлении в молекулу второго заместителя могут образоваться три изомера – орто-, мета- или пара-.
Место вступления нового электрофильного заместителя (катиона или частицы, имеющей дефицит электронов) определяется природой уже имеющегося в ароматическом ядре заместителя.
Все заместители по их ориентирующему действию при реакции замещения в бензольном ядре делят на две группы:
Заместители I рода – электронодонорные группы, подающие электроны в бензольное ядро, что приводит к увеличению и перераспределению электронной плотности в ядре так, что в орто- и пара-положениях наблюдается ее избыток (-). К заместителям I рода относят алкильные радикалы, гидроксильную, аминогруппы и т.п.:
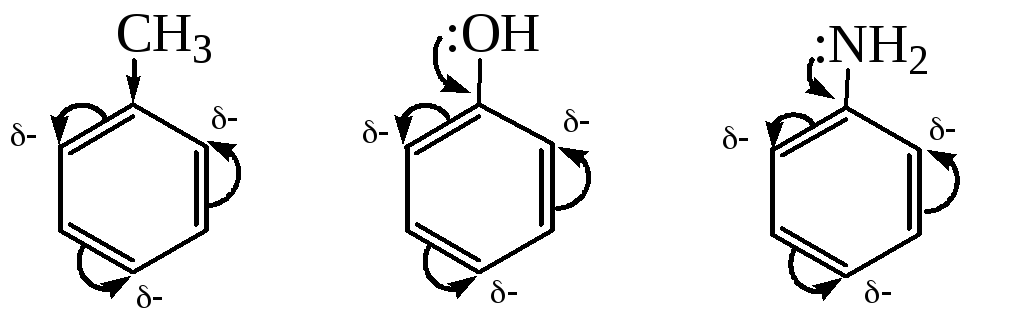
толуол фенол анилин
Таким образом, заместители I рода активируют бензольное ядро, облегчая введение нового заместителя, и ориентируют последний в орто- и пара-положения.
Например, при нитровании толуола (атакующая частица – ион нитрония NО2+) получаются орто- и (или) пара-изомеры:
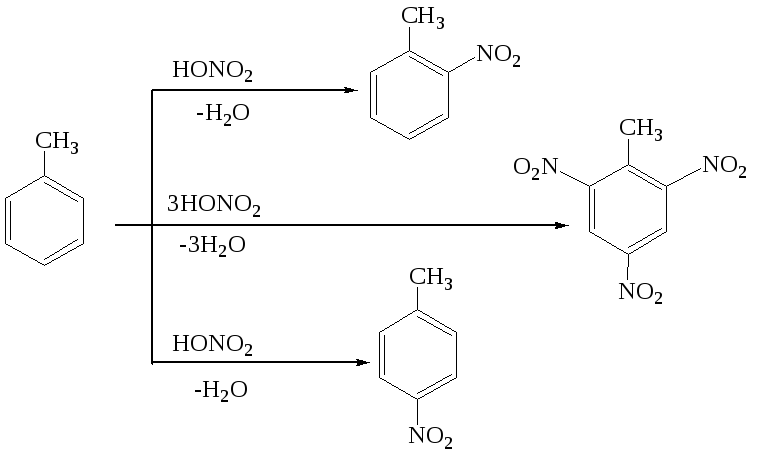
Заместители II рода – электроноакцепторные группы, оттягивающие электронную плотность от ядра, что приводит к снижению и перераспределению электронной плотности в ядре так, что в орто- и пара-положениях наблюдается ее недостаток (+), а в мета-положениях она оказывается несколько повышенной. К заместителям II рода относятся нитро-, сульфо-, циано-, карбонильная и карбоксильная группы:

нитробензол бензойная кислота
Таким образом, заместители II рода затрудняют введение нового электрофильного заместителя, а вступающий заместитель направляется ими в мета-положение:

