
- •Экзаменационные вопросы
- •По дисциплине « Атомное строение фаз»
- •Опишите фазы, образование которых определяется размерным фактором. Приведите примеры
- •Выбрать способ выражения электронной концентрации и привести её численное значение в ряду фаз …………………….
- •Опишите общие и особенные черты кристаллической структуры различных модификаций фаз Лавеса. Каковы возможные причины формирования той или иной модификации фазы Лавеса?
- •Что такое мартенсит? Назвать 3-4 примера протекания мартенситного превращения в металлах и сплавах. Опишите его основные кинетические и структурные особенности.
- •Опишите основные явления при отпуске стали.
Экзаменационные вопросы
По дисциплине « Атомное строение фаз»
-
Приведите основные положения теории Джонса-Конобеевского для оценки электронной концентрации в твердых растворах. Рассчитайте максимальную концентрацию электронов (N, эл/яч и n, эл/ат) в кристалле с ГЦК (ОЦК, примитивной кубической) решеткой.
Поверхность
Ферми имеет сферическую форму и по мере
увеличения числа электронов N
в данном объёме v, её
диаметр растет и она начинает приближаться
к границе I зоны Бриллюэна.
Максимальная электронная концентрация
соответствует моменту касания поверхности
Ферми с границей I зоны
Бриллюэна.
 =>
=>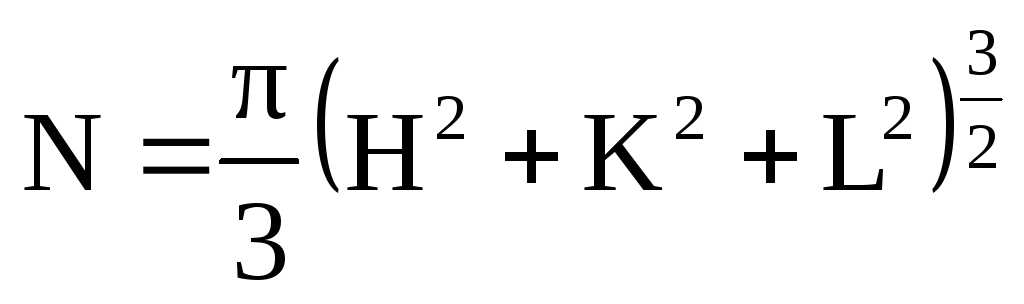 (при
рассмотренииодной элементарной
ячейки,v=a3)
(при
рассмотренииодной элементарной
ячейки,v=a3)
Примитивная (100) - N=1,05 эл/яч; n=1 ат/яч; e/a=1,05 эл/ат;
ГЦК (111) N=5,45 эл/яч; n=4 ат/яч; e/a=1,36 эл/ат;f
ОЦК (110) N=2,96 эл/яч; n=2 ат/яч; e/a=1,48 эл/ат.
-
Получите выражение для внутренней энергии бинарного твердого раствора в приближении регулярного раствора. Опишите допущения приближения регулярного раствора. Введите понятие энергии смешения, укажите возможности определения знака и величины энергии смешения.
Допущения приближения регулярного раствора: энергия парного взаимодействия одноименных атомов в тв. р-ре та же, что и в чистом компоненте, UAB не зависит от состава. Пусть Z- координационное число, тогда сZ – число атомов А в координационной сфере. Число пар А-А равно (NA.cZ)/2=с2NZ/2 где коэффициент 2 учитывает то, что взаимодействие одних и тех же атомов учитывается дважды
Аналогично,
число пар В-В равно NB(1-c)Z/2=
(1-c)2NZ/2, а
число пар А-В равно NA(1-c)Z.
Пренебрегая изменением кинетической
энергии (энергией тепловых колебаний
атомов), получим выражение для внутренней
энергии твердого раствора
U=[c2NZ/2]uAA+[(1-c)2NZ/2]uBB+c(1-c)NzuAB=
=(NZ/2)[c2uAA++(1-c)2uBB+2c(1-c)uAB].
Введем понятие энергии смешения
![]() .
Из этого видно, что U=(NZ/2)[cuAA+(1-c)uBB+2c(1-c)u].
u
0, если на диаграмме состояния имеются:
1) неограниченные твердые растворы; 2)
упорядоченные твердые растворы; 3)
промежуточные фазы. Du
>0
соответствует: 1) расслоению твердого
раствора; 2) формированию раствора с
ограниченной растворимостью (но без
промежуточных фаз).
.
Из этого видно, что U=(NZ/2)[cuAA+(1-c)uBB+2c(1-c)u].
u
0, если на диаграмме состояния имеются:
1) неограниченные твердые растворы; 2)
упорядоченные твердые растворы; 3)
промежуточные фазы. Du
>0
соответствует: 1) расслоению твердого
раствора; 2) формированию раствора с
ограниченной растворимостью (но без
промежуточных фаз).
-
Укажите приближения в анализе упорядочения по Горскому-Брэггу-Вильямсу, объясните ход вывода выражения для изменения свободной энергии при разупорядочении эквиатомного сплава АВ, упорядоченного по типу В2, и проанализируйте его (дайте графическую интерперетацию):
F()=(Nu0/8)(1-2)+ (1/2)kNT[(1+)ln(1+) + (1)ln(1) 2ln2]
Процесс протекает как фазовый переход II рода. Будем учитывать взаимодействие лишь ближайших атомов (в пределах одной координационной сферы).
Тогда
для двух атомов А и В энергия взаимодействия
Uуп= zuAB+
(z-1)uAB
=(2z-1)uAB.
Поменяем атомы А и В местами. Тогда
энергия взаимодействия этих двух атомов
с соседями равна Uразуп=
(z-1)(uaa+uBB)+uAB.
Общее изменение потенциальной энергии
решетки при сдвиге 1 атома из своей
подрешетки А в чужую подрешетку В, т.е.
при разупорядочении U=
Uразуп - Uуп=2(z-1) =
2(z-1)
u, где
u –
энергия смешения для атомов системы
А-В. Т.к. z>>1, то можно
считать, что U=
2zu.
Назовем эту величину энергией упорядочения
и обозначим через u0 (т.е.
u0= 2zu).
Рассчитаем изменение энергии решетки,
если число атомов A,
сдвинувшихся из «своих» позиций, равно
dN’A. Если
-
степень дальнего порядка в конечном
состоянии, то dU=u0dN’А.
=
2(z-1)
u, где
u –
энергия смешения для атомов системы
А-В. Т.к. z>>1, то можно
считать, что U=
2zu.
Назовем эту величину энергией упорядочения
и обозначим через u0 (т.е.
u0= 2zu).
Рассчитаем изменение энергии решетки,
если число атомов A,
сдвинувшихся из «своих» позиций, равно
dN’A. Если
-
степень дальнего порядка в конечном
состоянии, то dU=u0dN’А.
Для упорядочивающихся сплавов стехиометрического состава можно ввести s=(NA-2N’A)/NA
dU=u0sdN’A= (-NAu0σdσ)/2
DU(s)=U(s)–U(s=1)
=

Для того, чтобы разупорядочение шло произвольно необходимо, чтобы DU<0, т.е. u0= -2zDu<0 или Du>0. В противном случае для проведения разупорядочения надо затрачивать энергию DU>0
S= (- kN/2)[(1+σ)ln(1+σ)+ (1-σ)ln(1-σ)-2ln2]
△S(σ)=S(σ)-S(σ=1)= (- kN/2)[(1+σ)ln(1+σ)+ (1-σ)ln(1-σ)-2ln2]
△F(σ)=△U(σ)-T△S(σ)=(Nu0/8)(1-σ2)+ (- kTN/2)[(1+σ)ln(1+σ)+ (1-σ)ln(1-σ)-2ln2]
Если u00, т.е. u>0, то изменение свободной энергии в зависимости от величины и температуры (Т2 >T1) показано на рис.1.28. Видно, что максимальное снижение свободной энергии соответствует переходу в состояние с =0, т.е. полному разупорядочению. Таким образом при u>0 самопроизвольное упорядочение невозможно.
П ри
u0>0, т.е. u<0
видно, что при Т=0 К для всех <1
изменение свободной энергии F>0,
т.е. в этих условиях процесс разупорядочения
не идет и сохраняется полный порядок.
С повышением температуры ( Т2>T1>0
K) из-за действия энтропийного
фактора кривая F()
изменяется: на ней появляется минимум,
который соответствует состоянию с
«равновесным» значением величины .
Однако при очень высокой температуре
(Т*) максимальное снижение F
происходит при переходе из упорядоченного
состояния в полностью разупорядоченное
(=0).
ри
u0>0, т.е. u<0
видно, что при Т=0 К для всех <1
изменение свободной энергии F>0,
т.е. в этих условиях процесс разупорядочения
не идет и сохраняется полный порядок.
С повышением температуры ( Т2>T1>0
K) из-за действия энтропийного
фактора кривая F()
изменяется: на ней появляется минимум,
который соответствует состоянию с
«равновесным» значением величины .
Однако при очень высокой температуре
(Т*) максимальное снижение F
происходит при переходе из упорядоченного
состояния в полностью разупорядоченное
(=0).

-
Определите содержание компонентов в твердом растворе Al в Ni. если его период решетки составляет а= 3.601 А *
Ni и Al - ГЦК. Компоненты изоморфны. aтв.р.= aNicNi + aAlcAl или aтв.р.= aNi + acAl a=аAl-аNi
aNi = 3,520 Å, aAl = 4,050 Å -периоды решетки Ni(растворитель) и Al(растворяемый элемент) соответственно.
cNi , cAl – атомные доли компонентов.
-
Запишите аналитические выражения для зависимостей числа атомов в элементарной ячейке твердого раствора замещения В в А (n, nА, nB) и периода решетки а от концентрации растворяемого элемента В. Опишите входящие в эти выражения символы
nA=cAn, nB=cBn, cA+cB=1 и nA + nB = n; aтв.р.= aAcA+aBcB или aтв.р.= aA + acB; a=аВ-аА; где nA, nB и n - число атомов типа А и В и общее число атомов в элементарной ячейке; aA и aB - периоды решетки растворителя А и растворяемого элемента В; сA и cB - атомные доли компонентов.
-
Запишите аналитические выражения для зависимостей числа атомов в элементарной ячейке твердого раствора внедрения В в А (n, nА, nB) и периода решетки а от концентрации растворяемого элемента В. Опишите входящие в эти выражения символы.
nA=cAn=Const, nB=cBn, cA+cB=1 и nA + nB = n; атв.р.= аA + cB ( 0) где nA, nB и n - число атомов типа А и В и общее число атомов в элементарной ячейке; Коэффициент устанавливается эмпирически. где aA - период решетки растворителя; сA и cB - атомные доли компонентов.
-
Приведите графическую зависимость числа атомов в элементарной ячейке твердого раствора вычитания В в А (n, nА, nB) и периода решетки а от концентрации растворяемого элемента В. Опишите входящие в эти выражения символы
Период решетки убывает с ростом концентрации B (по закону Вегарда атв.р.=а0–qcB*(q0))
а0 - период решетки соединения стехиометрического состава
cB* - избыток элемента B, растворяющегося по типу вычитания
q – коэффициент, устанавливается эмпирически.

-
Исходя из известных характеристик компонентов бинарной системы Сu-Zn (положение в таблице Менделеева, атомный радиус, электроотрицательность, кристаллическая структура) обсудить возможность образования твердых растворов на основе компонентов, спрогнозировать протяженность концентрационных областей и тип твердого раствора.*
-
Опишите основные сверхструктуры на основе ГЦК решетки. Определите возможность фазового перехода II рода при образовании упорядоченного твердого раствора типа Cu3Au на основе ГЦК решетки (ответ должен включать аргументацию). *
В сверхструктуре типа Cu3Au атомы Au размещаются в вершинах элементарной ячейки, а атомы Cu – в центре ее граней. Символ Пирсона – сР4 или L12. Такой тип упорядочения наблюдается в сплавах Cu3Pd, Fe3Pt, Pt3Fe, Ni3Al и др. В сверхструктурах типа CuAu атомы компонентов заполняют чередующиеся атомные плоскости(001). Символ Пирсона – tP2, L10. Такой тип упорядочения наблюдается в FePt, CoPt, NiPt, FePd и др. с/а = 1,32 (в тетраганальной системе координат) или с/а = 0,94 (в кубической). Период решетки соединения CuAu ссс = а0 (а0 – период решетки “вырожденной” структуры), а период асс=а0/21/2.В сверхструктуре типа CuPt атомы компонентов размещаются в чередующихся плоскостях типа (111). Символ Пирсона L11. Образуется в системе Hg-In. Согласно теории Хачатуряна, на основе ГЦК решетки следует ожидать 7 сверхструктур замещения и 7 сверхструктур внедрения.
ФП II рода невозможен, если из векторов звезды, связанных с упорядочением, можно выбрать три таких, что их сумма равна 0 или вектору обратной решетки неупорядоченной фазы. В случае сверхструктуры Cu3Au векторами звезды могут быть 100, 010, 001. Сумма векторов звезды равна 111, а такой вектор имелся в обратной решетке неупорядоченной фазы. Поэтому в данном случае ФП II рода невозможен.
-
Выбрать звезду векторов обратной решетки и определить возможность фазового перехода II рода при упорядочении по типа CuPt*
Правило звезды: Фазовый переход II рода невозможен, если из векторов звезды, связанных с упорядочением, можно выбрать три таких (не обязательно различных), что их сумма равна 0 или вектору обратной решетки неупорядоченной фазы. Вектора звезды: 1) ГЦК (А1) CuAu [100][010][001] ФП 2 рода невозможен, CuPt [1/2 1/2 1/2][-1/2 1/2 1/2] возможен, Cu3Au [100][010][001] невозможен; 2) ОЦК (А2) CuZn или CzCl [100] возможен, Fe3Al [1/2 1/2 1/2][-1/2 -1/2 -1/2] возможен, NaTl [1/2 1/2 1/2][-1/2 -1/2 -1/2]; ОЦК (А2) Сu2MnAl
-
Определить атомные объемы (Vат) для Fe в модификации и , используя значения периодов решетки. Обсудить полученные значения.*
Vaт = 4/3πr3*η где η – коэффициент заполнения (ГЦК – 0,74; ОЦК – 0,68)
-
Указать знак энергии смешения Au-Ni по виду диаграммы состояния*
-
Указать знак энергии смешения Fe-Mo по виду диаграммы состояния*
-
На схеме диаграммы фазового равновесия показать для сверхструктуры типа АВ реакцию упорядочения, имея в виду принципиальную возможность фазового перехода второго рода и область концентраций, включающих наряду со сплавами, близкими к стехиометрическому составу, сплавы существенно нестехиометрические
-
Опишите два основных типа химического ближнего порядка в металлических системах, условия их образования и способы исследования. Приведите схематически температурную зависимости степени дальнего и ближнего порядка для случая u<0.
Параметры БП могут быть найдены с помощью дифракционных (рентгенографических, нейтронографических) исследований диффузного рассеяния. БП типа упорядочения: если α1<0, т.е. в 1-й координационной сфере преимущественно размещаются «чужие» атомы. БП типа расслоения: если α1>0, т.е. в 1-й координационной сфере преимущественно размещаются «свои» атомы. Первому способствует отрицательная энергия смешения элементов. А БП типа расслоения следует ожидать при положительной энергии смешения элементов. При этом большое различие атомных радиусов компонентов может вызвать формирование БП типа упорядочения, несмотря на u>0.


-
Указать приближения в анализе упорядочения по Горскому-Брэггу-Вильямсу, объяснить ход вывода выражения для изменения внутренней энергии при разупорядочении эквиатомного сплава АВ, упорядоченного по типу В2, и проанализировать его:
U()=(Nu0/8)(1-2)
Показать графически зависимости и ср от температуры (в случае фазового превращения II рода)..
-
Приведите схематически зависимость степени дальнего порядка от температуры в случае упорядочения, протекающего как фазовый переход I и II рода. В чем отличия атомного механизма упорядочения, протекающего, соответственно, как фазовый переход I и II рода?
ФП I рода протекает путем зарождения зародышей и их роста.
ФП II рода происходит во всем объеме (без образования зародышей).
График.
-
Опишите фазы, образование которых определяется фактором электронной концентрации. Приведите примеры.
Фазы, структура которых определяется, главным образом, электронной концентрацией, так называемые электронные соединения: фазы Юм-Розери, -фазы.
Фазы Юм-Розери. Состав этих фаз определяется фактором электронной концентрации (е/а), т.е. каждая структура образуется в определённом интервале значений электронной концентрации. Это, в частности, приводит к тому, что большинство электронных соединений – фазы переменного состава.
Можно утверждать, что фазы Юм-Розери возникают при взаимодействии следующих металлов:
переходных металлов и металлов IA и IB подгрупп с металлами IIB – VB подгрупп, например, Cu c Zn, Ni c Al, Ag c Cd;
переходных металлов начала и конца периода, например, Ti c Ni или Nb c Ru.
Примеры расчёта электронной концентрации для различных фаз Юм-Розери
-фазы:
CuZn – (1+2)/2=1,5 эл/ат
Cu3Al – (13+31)/4=1,5 эл/ат
γ-фазы:
Cu5Zn8 – (51+82)/13=21/13 эл/ат
Cu9Ga4 – (91+34)/13=21/13 эл/ат
-фазы:
CuZn3 – (11+23)/4=7/4 эл/ат
Ag5Al3 – (51+33)/8=7/4 эл/ат
Т.е. -фаза может появиться при любом составе, лишь бы е/а=1,5 эл/ат.
Фазы Юм-Розери имеют широкую область гомогенности, поэтому указанные выше электронные концентрации соответствуют лишь стехиометрическим составам соединений.
При расчёте электронной концентрации за число валентных электронов принимают номер группы непереходного элемента, а в случае переходного металла ему обычно приписывается валентность равная нулю.
Следует отметить, что различие атомных размеров компонентов в фазах Юм-Розери невелико. При больших различиях в атомных размерах возможно возникновение фаз Лавеса.
Содинения типа -FeCr и родственные им фазы
Эти фазы не имеют определённой стехиометрии и появляются в системах в интервале составов от А4В до АВ4. Обычно -фазы имеют широкую область гомогенности ~10…20%.
Эти фазы образуются только в системах с участием переходных металлов и, иногда, Al или Ga (IIIB-подгруппа):
А – элемент VA – VIIA подгрупп;
B – элемент VIIA – VIIIA подгрупп, Аl или Ga, которые очень часто образуют фазы, свойственные системам с переходными металлами.
Среди -фаз известны как сильно упорядоченные структуры (например Ta2Al, Nb2Al), так и множество разупорядоченных структур. При этом упорядоченные фазы обычно имеют значительно более узкие области гомогенности и часто переходят в разупорядоченное состояние при повышенных температурах. Для разупорядоченных -фаз характерны широкие области существования. Так как -фазы хрупкие, то их формирование обычно неблагоприятно сказывается на механических свойствах сплавов.
Состав этих фаз определяется средним числом валентных электронов, а не строгим стехиометрическим соотношением компонентов. Причем, поскольку эти фазы образуются переходными металлами, то электронную концентрацию следует считать как суммарное число s- и d- электронов, приходящихся на один атом (s+d)e.
Подавляющее большинство -фаз имеют (s+d)e=6,2…7,4 эл/ат. Отклонения от этого значения приходятся, прежде всего, на системы с участием Al и Ga, которые не являются переходными.
В большинстве случаев размерный фактор для -фаз составляет ΔR/R8%. При больших значениях размерного фактора -фаза может быть устойчива при высоких температурах.
