
- •Практикум по неорганической химии
- •Введение
- •Экспериментальная часть Лабораторная работа № 1
- •Вопросы и задачи
- •Важнейшие кислоты серы и их соли
- •Экспериментальная часть Лабораторная работа № 2
- •Вопросы и задачи
- •Экспериментальная часть Лабораторная работа № 3
- •Вопросы и задачи
- •Экспериментальная часть Лабораторная работа № 4
- •Вопросы и задачи
- •Сурьма, висмут
- •Экспериментальная часть Лабораторная работа № 5
- •Вопросы и задачи
- •Углерод, кремний
- •Экспериментальная часть Лабораторная работа № 6
- •Вопросы и задачи
- •Олово, свинец
- •Экспериментальная часть Лабораторная работа № 7
- •Вопросы и задачи
- •Бор, алюминий
- •Экспериментальная часть Лабораторная работа № 8
- •Вопросы и задачи
- •Бериллий, магний, кальций, стронций, барий.
- •Экспериментальная часть. Лабораторная работа № 9
- •Вопросы и задачи
- •Переходные металлы
- •Высшие степени окисления переходных металлов
- •Низшие степени окисления переходных элементов
- •Аквакомплексы катионов 3d–металлов
- •Комплексные соединения катионов 3d-металлов
- •Хром, молибден, вольфрам
- •Экспериментальная часть Лабораторная работа № 10
- •Вопросы и задачи
- •Марганец
- •Экспериментальная часть Лабораторная работа № 11
- •Вопросы и задачи
- •Железо, кобальт, никель
- •Экспериментальная часть Лабораторная работа № 12
- •Вопросы и задачи
- •Медь, серебро
- •Экспериментальная часть Лабораторная работа № 13
- •Вопросы и задачи
- •Цинк, кадмий, ртуть
- •Экспериментальная часть Лабораторная работа № 14
- •Вопросы и задачи
- •Содержание
- •625000, Г. Тюмень, ул. Семакова, д. 10
Комплексные соединения катионов 3d-металлов
Катионы 3d-металлов образуют весьма многочисленные комплексные соединения. Эти катионы образуют координационные сферы с октаэдрической, тетраэдрической, плоской квадратной, тригонально-бипирамидальной и тетрагонально-пирамидальной конфигурациями (табл. 5). Для многих катионов характерно существование геометрически различных координационных сфер. Координационные соединения, имеющие координационные сферы разной формы, но примерно одинаковую устойчивость легко обмениваются лигандами. Это одна из причин активности координационных центров металлоферментов и других биосоединений d-элементов.
Геометрия координационной сферы комплексов d-элементов, энергия их связей и устойчивость в водных растворах, а также другие их характеристики определяются природой катионов и лигандов.
Роль природы катиона проявляется в трех факторах: величине положительного заряда катиона, его радиусе и его электронной конфигурации.
Увеличение заряда катиона приводит к резкому росту прочности комплексов в водных растворах, что проявляется, например, в увеличении значений lgKуст. комплексных соединений в водных растворах. Влияние электронной конфигурации, как у аквакомплексов, наглядно проявляется в ряду Mn2+, Fe2+, Co2+, Ni2+, Cu2+, Zn2+, в котором наибольшей устойчивостью обладают комплексы Сu2+.
Существенным свойством комплексов двухзарядных катионов 3d-металлов является кинетическая лабильность, т.е. большая скорость их образования и диссоциации. Комплексы двухзарядных катионов с монодентатными О - и N-донорными лигандами обычно обменивают лиганды на молекулы воды за доли секунды. Наличие у катиона электронных конфигураций d3 или d6 и специфика лиганда могут сильно снизить скорость диссоциации комплексов в воде. Например, многие цианокомплексы, в том числе широко применяемые гексацианоферраты (II) и (III) [Fe(CN)6]4- и [Fe(CN)6]3- - проявляют кинетическую инертность вследствие образования очень прочных связей катионов Fe2+ и Fe3+ с С - донорным лигандом CN-.
Таблица 5.
Часто встречающиеся координационные сферы катионов М2+ и М3+ 3d-металлов
|
Заряд катиона |
К.ч. |
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
|
- |
d2 |
d3 |
d4 |
d5 |
d6 |
d7 |
d8 |
d9 |
d10 | ||
|
2+ |
6 5
4 |
- |
окт. |
окт. |
окт. |
окт. т-п
кв., тетр |
окт. |
окт. т-б
кв., тетр |
окт. т-б т-п кв., тетр |
окт. т-б т-п кв., тетр |
окт. т-п
кв. |
|
3+ |
|
d0 |
d1 |
d2 |
d3 |
d4 |
d5 |
d6 |
d7 |
d8 |
d9 |
|
6 5 4 |
окт. |
окт. |
окт. т-б тетр |
окт.
тетр |
окт. т-п |
окт.
тетр |
окт.
тетр |
т-п |
окт.
кв. |
- |
Примечание: окт. – октаэдрическая координационная сфера, т-п – тетрагонально-пирамидальная, т-б – тригонально-бипирамидальная, тетр – тетраэдрическая, кв. – квадратная.
Образование донорно-акцепторных связей повышенной прочности характерно также для катионов Cr3+ и Со3+. Прочность этих связей стабилизирует неустойчивую степень окисления +3 катиона Со3+, который благодаря этому образует большое число устойчивых комплексных соединений. Это видно из резкого различия стандартных электродных потенциалов аква - и амминокомплексов Со2+ и Со3+:
[Co(OH2)6]3+
+
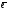
[Co(OH2)6]2+;
Eо
= + 1,808 B
[Co(OH2)6]2+;
Eо
= + 1,808 B
[Co(NH3)6]3+
+
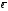
[Co(NH3)6]2+;
Eо
= + 0,10 B
[Co(NH3)6]2+;
Eо
= + 0,10 B
