

31
2.МОЛЕКУЛЯРНАЯ ФИЗИКА И ТЕРМОДИНАМИКА
2.1. Сводка основных формул
Идеальный газ. Идеальным называют газ, в котором пренебрегают размерами и взаимодействием молекул. Параметры состояния идеального газа связаны уравнением Менделеева-Клапейрона
pV = νRT ,
где р, V и T – давление, объем и абсолютная температура газа, ν = m µ - коли-
µ - коли-
чество молей, m и µ - масса и молярная масса газа, R = 8,31 Дж К/моль - универсальная газовая постоянная.
Для газов выделяют следующие изопроцессы: изотермический (Т = const), изохорный (V = const) и изобарный, (p = const), которые описываются законами:
Бойля-Мариотта (Т = const) |
pV = const , |
||
Шарля (V = const) |
p T = const , |
||
Гей-Люссака (p = const) |
V Т = const . |
||
|
|
|
|
Основное уравнение молекулярно-кинетической теории имеет вид p = nkT = 32 n ε
ε ,
,
где n – концентрация частиц, k = 1,38 10-23 Дж/К - постоянная Больцмана,  ε
ε -
-
средняя кинетическая энергия молекул.
По закону Дальтона давление р смеси газов равно сумме парциальных давлений pi каждой компоненты смеси
n
p = ∑pi
i=1
Распределения Больцмана и Максвелла. Зависимость давления газа в атмосфере Земли от высоты задается барометрической формулой
p = p0e−µgh RT ,
RT ,
где p0 - давление на нулевом уровне, h – высота от нулевого уровня.
Распределение Больцмана дает концентрацию частиц n в силовом поле
n = n0e−Ep  kT ,
kT ,
где Ep – потенциальная энергия частиц, n0 - концентрация частиц при Ep = 0.
Количество частиц dN из общего числа N , скорость которых лежит в небольшом интервале dv от v до v + dv , определяется распределением Максвелла
dN |
|
m 3 2 |
e |
−mv2 |
4πv |
2 |
dv. |
|
N |
= |
|
|
2kT |
|
|||
|
|
|||||||
|
2πkT |
|
|
|
|
|
||
Характерные скорости теплового движения молекул - вероятная vв , средняя vcp и средняя квадратичная vкв - определяются выражениями

32
vâ = 
 2RTµ , vcp =
2RTµ , vcp =  v
v =
= 
 8πµRT , vêâ =
8πµRT , vêâ = 
 3RTµ .
3RTµ .
Первое начало термодинамики. Первое начало термодинамики выражает закон сохранения энергии в тепловых процессах: количество теплоты, сообщенное термодинамической системе, идет на изменение ее внутренней энергии и совершение системой работы против внешних сил
Q = ∆U + A,
в дифференциальной форме для малых величин dQ = dU +dA.
Здесь Q – количество теплоты, ∆U – изменение внутренней энергии, А – работа. Различают три вида теплообмена: теплопроводность, конвекция и излучение.
При изменении объема от V1 до V2 термодинамическая система совершает работу, которая определяется выражением
V2
A = ∫ pdV .
V1
Работа термодинамической системы в различных процессах: изобарном
A = p∆V ,
изотермическом
A = νRT lnV2 , V1
адиабатическом
|
p1V1 |
|
|
|
γ−1 |
|
|
A = |
|
1 |
V1 |
|
. |
||
|
|||||||
γ −1 |
− |
|
|||||
|
|
V2 |
|
|
|||
|
|
|
|
|
|
|
|
Отношение количества теплоты, полученного системой, к приращению ее температуры, называется теплоемкостью
c = dQdT .
Теплоемкость С одного моля называется молярной, а одного килограмма – удельной теплоемкостью с. Теплоемкость зависит от способа нагревания системы и ее состояния. Различают теплоемкости при постоянном давлении Cp и
при постоянном объеме CV .
Молярные теплоемкости идеального газа зависят от состава молекул и определяются соотношениями
СV = 2i R , Сp = i +2 2 R ,
где i – число степеней свободы молекулы; i = 3, 5 и 6 для одно-, двух- и трехатомных молекул с жесткой связью.
Для идеального газа теплоемкости Cp и CV связаны уравнением Майера

33
Cp −CV = R .
Адиабатическим называется процесс, который происходит без теплообмена с окружающими телами. В адиабатическом процессе параметры системы связаны уравнением адиабаты (адиабата Пуассона)
pV γ = const ,
где γ =Cp  CV - показатель адиабаты; γ = 5/3, 7/5 и 4/3 – для одно-, двух- и
CV - показатель адиабаты; γ = 5/3, 7/5 и 4/3 – для одно-, двух- и
трехатомных молекул с жесткой связью.
Второе начало термодинамики. Периодически действующее устройство, преобразовывающее тепловую энергию в работу, называется тепловой машиной. Необходимыми элементами тепловой машины являются: нагреватель, от которого машина получает количество теплоты Q1 , холодильник, которому она
отдает количество теплоты Q2 , и рабочее тело, которое совершает работу А. КПД тепловой машины определятся выражением
η= A = Q1 −Q2 .
Q1 Q1
КПД идеальной тепловой машины, работающей по циклу Карно, зависит только от температуры нагревателя T1 и холодильника T2 и дается формулой
η = T1 −T2 .
T1
КПД реальной тепловой машины всегда меньше КПД идеальной, работающей в тех же условиях.
Второе начало термодинамики устанавливает направление протекания термодинамических процессов в системе. Существует несколько эквивалентных формулировок II начала термодинамики:
формулировка Томсона: невозможно организовать круговой процесс, единственным результатом которого является полное преобразование тепла одного тела в работу;
формулировка Клаузиуса: тепло не может самопроизвольно переходить от горячего тела к холодному;
закон возрастания энтропии: в замкнутой системе энтропия не убывает; вечный двигатель II рода: невозможна тепловая машина с КПД равным
единице (η < 1).
Энтропия. Энтропией называют функцию состояния, приращение которой в обратимом процессе равно приведенному теплу, полученному системой
∆S = ∫2 dQ .
1 T
По II началу термодинамики в замкнутой системе энтропия не убывает
∆S ≥ 0.
Приращение энтропии для одного моля идеального газа равно
∆S =CV ln T2 + RlnV2 .
T1 V1

34
Основное уравнение термодинамики имеет вид
TdS = dU + pdV .
Явления переноса. Молекулы газа при движении сталкиваются между собой. Средняя длина λ свободного пробега молекул (среднее расстояние между двумя последующими соударениями молекулы) определяется выражением
λ = 
 21σn ,
21σn ,
где σ = πd 2 - площадь эффективного сечения, d - эффективный диаметр молекул, n – концентрация молекул.
При нарушении термодинамического равновесия в системе возникают потоки массы, импульса и тепла. Плотность потока j переносимой величины G
пропорциональна ее градиенту
j = −13 nλ v
v G ,
G ,
где  v
v - средняя скорость теплового движения молекул.
- средняя скорость теплового движения молекул.
Сила вязкого трения определяется согласно закону Ньютона по формуле
τ = ηdudx = 13 nλ v
v m0 dudx ,
m0 dudx ,
где η- коэффициент вязкости, m0 - масса молекулы, u – скорость упорядоченно-
го движения газа, координата х направлена по нормали к скорости u. По закону Фурье для теплопроводности плотность потока тепла
j |
= −α T = −1 nλ v CV |
T , |
||
T |
3 |
N A |
|
|
|
|
|
||
где α - коэффициент теплопроводности, Т – температура. По закону Фика для диффузии плотность потока массы
jmi = −D dndxi = 13 λ v
v dndxi ,
dndxi ,
где D - коэффициент диффузии, ni - концентрация i - той компоненты в смеси.
Реальные газы. Газ Ван-дер-Ваальса. Уравнение Ван-дер-Ваальса учи-
тывает взаимодействие и размеры молекул и для одного моля газа имеет вид
(p + a V 2 )(V −b)= RT ,
V 2 )(V −b)= RT ,
где а и b – поправки, которые учитывают взаимодействие и размеры молекул. Внутренняя энергия газа Ван-дер-Ваальса для одного моля
U =CV T − Va .
Поверхностное натяжение. По разные стороны искривленной поверхности жидкости давление разное. Избыточное давления ∆p под искривленной по-
верхностью жидкости задается формулой Лапласа
|
1 |
|
1 |
|
|
|
|
+ |
|
, |
|||
R |
R |
|||||
∆p = σ |
|
|||||
|
1 |
|
2 |
|
|

35
где σ - коэффициент поверхностного натяжения, R1 и R2 - главные радиусы кривизны поверхности. Для сферической поверхности R1 = R2 = R и
∆p = 2Rσ .
Высота h подъема жидкости внутри круглого капилляра радиуса r равна h = 2σρcosgr θ,
где θ - краевой угол (θ = 0 или π при полном смачивании и несмачивании).
С наличием свободной поверхности S в жидкости связана поверхностная энергия US , которая определяется выражением
US = σS .
Фазовые переходы. Вещество может находиться в 3х агрегатных состояниях (фазах): твердое, жидкое и газообразное. Переход вещества из одного агрегатного состояния в другое называется фазовым переходом: плавление и кристаллизация (твердое ↔ жидкое), испарение и конденсация (жидкое ↔ газообразное), сублимация (твердое ↔ газообразное).
Количество теплоты при нагревании тела определяется по формуле
Q = cm(T2 −T1 )
где m – масса тела, с – удельная теплоемкость, T1 и T2 начальная и конечная
температура тела.
Количество теплоты при фазовом переходе определяется по формуле
Q = qm ,
где q – удельная теплота фазового перехода, m – масса тел.
При теплообмене выполняется уравнение теплового баланса
∑Qi + ∑Qj = 0 , Qi = mici (Ti −T ), Qj = q j m j ,
где Qi и Qj - тепло, полученное при нагревании и фазовых переходах тел.
Уравнение Клапейрона – Клаузиуса связывает параметры состояния для фазового перехода
dp |
|
|
q |
||
dT |
= |
|
|
|
, |
T (v |
2 |
− v ) |
|||
|
|
|
1 |
|
|
где q – удельная теплота фазового перехода, v1 =1 ρ1 ,v2 =1
ρ1 ,v2 =1 ρ2 и v2 - удельные объемы первой и второй фазы, Т – абсолютная температура фазового перехода.
ρ2 и v2 - удельные объемы первой и второй фазы, Т – абсолютная температура фазового перехода.
2.2.Примеры решения типовых задач
1.Давление воздуха внутри плотно закупоренной бутылки при температу-
ре t1 = 7 °С было р1 = 100 кПа. При нагревании бутылки пробка вылетела. До какой температуры t2 нагрели бутылку, если известно, что пробка вылетела при давлении воздуха в бутылке р2 = 130 кПа?
Решение. При нагревании закупоренной бутылки происходит изохорный процесс (V = const ), который описывается законом Шарля

|
|
|
|
|
|
36 |
|
|
|
|
|
|
|
|
|
|
|
p1 |
= p2 = const . |
|
|
|
|
|
|
||
|
|
|
|
T |
|
T |
|
|
|
|
|
|
|
|
|
|
|
1 |
|
2 |
|
|
|
|
|
|
|
Отсюда найдем искомую температуру |
|
|
|
|
|
|
|
||||||
|
|
|
T |
= p2T1 = 364 К = 91 °С. |
|
|
|
|
|
||||
|
|
|
2 |
p1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2. Посередине откачанного и запаянного с обоих концов капилляра, распо- |
|
||||||||||||
ложенного горизонтально, находится столбик ртути длиной l = 20 см. Если ка- |
|
||||||||||||
пилляр поставить вертикально, то столбик ртути переместится на |
l = 10 см. До |
|
|||||||||||
какого давления р0 |
был откачан капилляр? Длина капилляра L = 1 м. |
|
|
||||||||||
Решение. Объем воздуха с каждой стороны от столбика ртути при гори- |
|
||||||||||||
зонтальном положении капилляра одинаковый V0 = Sh , |
где S - площадь попе- |
|
|||||||||||
речного сечения капилляра, |
h = (L −l) 2 = 0,4м |
|
|
|
V1 |
|
|
||||||
- длина столбика воздуха. Давление в этом по- |
|
|
|
|
|
||||||||
|
h |
|
p1 |
h+Δl |
|||||||||
ложении равно p0 |
(рис. 2.1). |
|
|
|
|
|
|
||||||
|
|
|
|
S |
V0 |
p0 |
|
|
|
||||
При вертикальном |
положении капилляра |
|
|
|
|||||||||
|
|
l |
|
|
|
||||||||
объем |
воздуха в |
его |
верхней |
части |
равен |
|
|
V2 |
|
|
|||
V = S(h + ∆l), а давление равно p |
|
. Рассматри- |
|
|
|
h– |
l |
||||||
|
|
|
|
p2 |
|||||||||
1 |
|
|
|
1 |
|
|
|
|
|
|
|
|
|
ваемый процесс изотермический |
(T = const) и |
|
|
Рис. 2.1 |
|
|
|||||||
описывается законом Бойля-Мариотта
|
V0 p0 =V1 p1 или hp0 = p1(h + ∆l). |
(1) |
|
Давление p2 в нижней части капилляра складывается из давления воздуха |
|
p |
и давления столбика ртути p =ρlg , где ρ =13,6 г/см3 - плотность ртути. |
|
1 |
|
|
|
По закону Бойля-Мариотта для нижней части капилляра имеем |
|
|
p0v0 = p2v2 или hp0 = (p1 + p)(h − ∆l). |
(2) |
Решая систему уравнений (1) и (2), находим начальное давление
p0 = p(h2h− ∆l l2 ) = 50 кПа = 375 мм рт. ст.
2 ∆
3. Каков должен быть вес Р оболочки детского воздушного шарика, наполненного водородом, чтобы результирующая подъемная сила шарика F = 0, т. е. чтобы шарик находился во взвешенном состоянии? Воздух и водород находятся при нормальных условиях. Давление внутри шарика равно внешнему давлению. Радиус шарика r = 12,5 см.
Решение. На шарик действует сила тяжести mg и сила Архимеда FA , ко-
торые при равновесии скомпенсированы. Шарик находится во взвешенном состоянии, значит сумма силы тяжести m2 g шарика с водородом и веса оболочки
шарика Р равна силе тяжести воздуха m1g вытесненного шариком |
|
|
FA = m1g, mg = m2 g + P , |
F = m1g − (m2 g + P)= 0, |
(1) |
где m1 - масса воздуха в объеме шарика, |
m2 - масса водорода в объеме шарика. |
|
Массу воздуха и водорода найдем из уравнения Менделеева-Клайпейрона

37
m = µp0V , RT0
где V = 43 πr3 – объем шарика, p0 =105 Па, Т0 = 273 К - давление и температура при нормальных условиях (НУ). Молярная масса воздуха µ1 = 29 г/моль, мо-
лярная масса для водорода µ2 |
= 2 г/моль. |
|
|
|
|
|
|
|
||||||||
Вес оболочки шарика найдем из уравнения (1) по формуле |
||||||||||||||||
P = (m |
|
|
)g = |
p V |
(µ |
|
|
)g |
|
4πr3 p |
|
g |
(µ −µ |
|
)= 96 мН. |
|
− m |
2 |
0 |
|
−µ |
2 |
= |
|
0 |
|
2 |
||||||
|
|
|
|
|||||||||||||
1 |
|
|
RT0 |
1 |
|
|
|
3RT0 |
|
1 |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
4. Закрытый сосуд объемом V = 2 л наполнен воздухом при нормальных условиях. В сосуд вводится диэтиловый эфир (С2Н5ОС2Н5). После того, как весь эфир испарился, давление в сосуде стало р = 0,14 МПа. Какая масса mэ
эфира была введена в сосуд?
Решение. Согласно уравнению Менделеева-Клайперона, в начальный момент, когда сосуд был заполнен воздухом
|
|
|
p V |
= mâ RT |
, |
|
|
(1) |
||||
|
|
|
|
0 |
|
µ |
â |
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
где mв - масса воздуха, µв = 29 г/моль - молярная масса воздуха, p0 |
и Т0 - |
|||||||||||
параметры при НУ. |
|
|
|
|
|
|
|
|
|
|
|
|
Когда в сосуд ввели диэтиловый эфир, уравнение (1) примет вид |
|
|||||||||||
|
|
|
|
|
mв |
|
|
mэ |
|
mэ |
|
|
pV |
mв |
+ |
mэ |
= |
RT0 |
+ |
RT0 = p0V + |
RT0 . |
(2) |
|||
= |
RT |
µв |
µэ |
µэ |
||||||||
|
µв |
|
µэ |
|
|
|
|
|
|
|||
где µэ- молярная масса диэтилового эфира (С2Н5ОС2Н5), которую определим по его химической формуле: µэ = 12×4+1×10+16 = 74 г/моль.
Из уравнения (2) найдем массу эфира
mэ = (p − p0 )Vµэ = 2,5 г.
RT0
5. Найти плотность ρ воздуха: а) у поверхности Земли; б) на высоте h = 4 км от поверхности Земли. Температуру воздуха считать постоянной и равной t = 0 °С. Давление воздуха у поверхности Земли р0 = 100 кПа.
Решение. Для решения задачи воспользуемся распределением Больцмана
|
− |
µgh |
, |
(1) |
n = n0 exp |
|
|||
|
|
RT |
|
|
где n0 и n – начальная концентрация молекул и концентрация на высоте h, µ - молярная масса, R – универсальная газовая постоянная, Т – температура.
Учитывая, что плотность ρ пропорциональна концентрации (ρ = m0n , где m0 – масса молекулы), получаем из (1) выражение для плотности
|
− |
µgh |
(2) |
ρ =ρ0 exp |
. |
||
|
|
RT |
|

38
Плотность ρ0 найдем из уравнения Менделеева-Клапейрона
ρ0 = p0µ = 1,28 кг/м3.
RT0
Из (2) найдем плотность на высоте h:
ρ=ρ0 exp − µgh = 0,774 кг/м3.
RT
6.Какая часть молекул n кислорода при температуре t = 0 °С обладает скоростями v в интервале от v1 = 100 до v2 = 110 м/с?
Решение. Количество молекул, имеющих скорость в заданном интервале скоростей, найдем по распределению Максвелла
|
∆N |
v |
|
m |
3 2 |
|
|
mv2 |
|
|
|
|
|
2 |
|
|
− |
|
2 |
|
|
||||
n = |
N |
= ∫ |
|
|
|
|
e |
|
2kT 4πv |
|
dv. |
(1) |
|
|
|
|
|||||||||
|
v |
|
2πkT |
|
|
|
|
|
|
|
||
|
|
1 |
|
|
|
|
|
|
|
|
|
|
Учитывая, что ширина интервала ∆v = v2 − v1 = 10 м/с значительно меньше
значений скорости на концах интервала, интеграл (1) вычислим приближенно по формуле о среднем значении
|
m 3 2 |
|
− |
m v 2 |
|
2 |
|
|
|
|
|
||||||
n = F(ν )∆v = |
|
|
e |
|
2kT 4π v |
|
∆v , |
|
|
|
|||||||
|
2πkT |
|
|
|
|
|
|
|
где  v
v = (v1 + v2 )
= (v1 + v2 )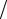 2 = 105 м/с – среднее значение скорости в заданном интерва-
2 = 105 м/с – среднее значение скорости в заданном интерва-
ле. Подставляя числовые значения, находим
n = 0,004 = 0,4 %.
7. Масса m = 10 г кислорода находится при давлении р = 0,3 МПа и температуре t = 10 °С. После нагревания при p = const газ занял объем V2 = 10 л. Найти количество теплоты Q, полученное газом, и энергию теплового движения молекул газа U до и после нагревания.
Решение. Так как кислород - двухатомный газ, то у его молекул і = 5 степеней свободы. Значит, энергия теплового движения молекул кислорода до и после нагревания будет
U |
|
= 5 m RT , |
U |
|
= 5 m RT . |
(1) |
|
|
1 |
2 µ 1 |
|
2 |
2 µ |
2 |
|
При расширении газа в изобарном процессе была совершена работа |
|
||||||
|
|
A = p∆V = p(V2 −V1 ). |
|
(3) |
|||
Количество теплоты, полученное газом найдем по I закону термодинамики |
|||||||
|
|
Q = ∆U + A, |
|
(4) |
|||
где ∆U =U2 −U1 - изменение внутренней энергии газа.
Неизвестные V1 и T2 найдем из уравнений для начального и конечного состояний газа
V = mRT1 |
, |
T = |
pV2µ |
. |
(5) |
|
|
||||||
1 |
µp |
|
2 |
mR |
|
|
Подставляя числовые данные, получим
39
U1 =1,8 кДж, U2 =7,6 кДж, Q = 7,9 кДж.
8. Для нагревания некоторой массы газа на ∆t1 = 50 °С при р = const необ-
ходимо затратить количество теплоты Q1 = 670 Дж. Если эту же массу газа охладить на ∆t2 = 100 °С при V = const, то выделяется количество теплоты
Q2 |
= 1005 Дж. Какое число степеней свободы i имеют молекулы этого газа? |
|
||||||||||||||||
|
Решение. Количество теплоты Q1 |
|
и Q2 |
определим через молярную тепло- |
||||||||||||||
емкость газа в изобарном Cp и изохорном CV |
|
|
процессах по формулам |
|
||||||||||||||
|
|
Q1 = νCp ∆t1 , |
|
Q2 = νCV ∆t2 , |
(1) |
|||||||||||||
где ν - количество молей газа. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
Молярные теплоемкости CV |
и Cp |
зависят от числа степеней свободы мо- |
|||||||||||||||
лекул газа и определяются по формулам |
|
|
|
|
|
|
|
|||||||||||
|
C = |
i |
R , |
C |
p |
=C |
+ R = |
i + 2 |
R . |
(2) |
||||||||
|
|
|
||||||||||||||||
|
V |
2 |
|
|
|
|
|
V |
|
2 |
|
|
||||||
|
Подставив (2) в (1) и разделив (1) почленно, получим |
|
||||||||||||||||
|
|
|
|
|
|
Q1 = i + 2 |
∆t1 |
, |
|
|||||||||
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
Q |
|
|
|
|
i |
∆t |
2 |
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
откуда найдем число степеней свобод |
|
|
|
|
|
|
|
||||||||||
|
|
|
i = |
|
2Q2∆t1 |
|
|
= 6. |
|
|
||||||||
|
|
|
Q ∆t |
2 |
|
−Q |
∆t |
|
|
|
||||||||
|
|
|
|
|
|
1 |
|
|
|
2 |
|
1 |
|
|
|
|
|
|
9. В сосуде под поршнем находится масса m = 1 г азота. Какое количество теплоты Q надо затратить, чтобы нагреть азот на ∆T = 10 К? На сколько при этом поднимется поршень? Масса поршня М = 1 кг, площадь его поперечного сечения S = 10 см2. Давление над поршнем р = 100 кПа.
Решение. Согласно первому закону термодинамики
Q = ∆U + A, |
(1) |
где ∆U - изменение внутренней энергии газа, А – совершенная газом работа. Для двухатомного газа азота количество степеней свободы і = 5 и
∆U = |
5 m R∆T , |
(2) |
|
2 µ |
|
где µ = 28 г/моль – молярная масса азота.
При расширении газ совершает работу против сил тяжести и атмосферного давления, которую найдем по формуле
Mg |
|
(3) |
|
A = Mg∆h + p∆V = |
S |
+ p ∆V . |
|
|
|
|
|
Из условия задачи следует, что давление газа будет постоянным, т.к. определяется весом поршня и внешним атмосферным давлением. Из уравнения Менде-
леева-Клайперона pV = mµ RT найдем приращение объема

|
|
40 |
|
|
|
|
|
Mg |
|
= |
m |
R∆T . |
(4) |
|
|
+ p ∆V |
µ |
|||
|
S |
|
|
|
|
|
Подставляя (2) - (4) в (1), найдем количество теплоты |
|
|||||
Q = |
5 m R∆T + m R∆T = |
7 m R∆T = 10,4 Дж. |
|
|||
|
2 µ |
µ |
2 µ |
|
|
|
Так как ∆V = S∆h, то высота подъема поршня |
h, будет |
|
||||
∆h = ∆SV = 2,8 см.
10. Газ расширяется адиабатически так, что его давление уменьшается от p1 = 200 кПа до р2 = 100 кПа. Затем он нагревается при постоянном объеме до первоначальной температуры, причем его давление становится равным p = 122 кПа. Найдите отношение Cp CV для этого газа. Начертите график это-
го процесса. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
Решение. |
Для адиабатического |
процесса из уравнения |
Пуассона |
|||||||||||||||||
p V γ = p V γ и уравнения состояния газа pV = νRT получим |
|
|||||||||||||||||||||
1 |
1 |
2 |
2 |
|
|
|
|
|
|
|
|
|
|
|
γ−1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
p |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
γ |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
1 |
= |
1 |
|
|
, |
|
|
|
|
(1) |
||||
|
|
|
|
|
|
|
T2 |
p2 |
|
|
|
|
|
|||||||||
где γ =Cp |
CV |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
- показатель адиабаты. |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
Для изохорного процесса (V = const) из закона Шарля p T = const с учетом |
||||||||||||||||||||
(1) найдем |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
γ−1 |
|
|
|||
|
|
|
|
|
p |
|
p |
|
|
|
|
p |
|
|
|
p |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
γ |
|
|
|
|||||||
|
|
|
|
|
|
= |
|
2 |
|
→ |
|
|
|
= |
|
1 |
|
. |
(2) |
|||
|
|
|
|
T1 |
|
T2 |
|
|
p2 |
|
|
|
p2 |
|
|
|
||||||
После логарифмирования выражения (2) и преобразований получим |
|
|
|||||||||||
|
γ −1 |
= |
ln(p p2 ) |
. |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
||||||
|
γ |
|
|
ln(p |
p |
2 |
) |
р |
1 |
|
|
||
|
|
1 |
|
|
|
|
|
|
|
||||
Решая это уравнение, найдем показатель адиабаты газа |
|
|
|
|
|||||||||
γ = |
ln(p1 p2 ) |
= 1,4. |
|
|
3 |
|
|||||||
|
|
|
|||||||||||
ln(p p) |
|
|
|
|
|
||||||||
|
|
1 |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
2 |
|
|||
График процесса в переменных ( p, V ) приведен на |
|
|
|
||||||||||
|
|
|
|
||||||||||
рис. 2.2. Здесь 1-2 – адиабата, 2-3 изохора. |
|
|
|
|
|
Рис. 2.2 |
|
V |
|||||
11. Идеальная тепловая машина работает по циклу Карно. Рабочим телом является воздух, который при давлении р1 = 708 кПа и температуре t1 = 127 °C занимает объем V1 = 2 л. После изотермического расширения воздух занял объем V2 = 5 л; после адиабатического расширения объем стал V3 = 8 л. Найти: а) координаты пересечения изотерм и адиабат; б) работу А, совершаемую на каждом участке цикла; в) полную работу А, совершаемую за весь цикл; г) КПД цикла; д) количество теплоты Q1, полученное от нагревателя за цикл; е) количество теплоты Q2, отданное холодильнику за цикл.

|
|
|
|
|
|
41 |
|
|
|
|
|
|
|
|
|
||
Решение. Описанный в задаче цикл Карно изобра- |
|
|
|
|
|||||||||||||
жен на рис. 2.3. Здесь 1-2 изотермическое расширение, р |
|
|
|
|
|||||||||||||
1 |
|
|
|
||||||||||||||
при котором рабочее тело получает количество теплоты |
|
|
|
|
|||||||||||||
Q1 от нагревателя, 2–3 – адиабатическое расширение, 3-4 |
|
|
2 |
|
|||||||||||||
– изотермическое сжатие, при котором рабочее тело от- |
|
4 |
|
|
|||||||||||||
дает количество теплоты Q2 холодильнику, 4-1 – адиаба- |
|
3 |
|
||||||||||||||
|
|
|
|||||||||||||||
тическое сжатие. Изотермы и адиабаты пересекаются в |
|
|
|
|
|||||||||||||
точках 2 и 4. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V |
||
Из закона Бойля-Мариотта p1V1 = p2V2 |
для изотермы |
|
Рис. 2.3 |
||||||||||||||
1-2 найдем давление в точке 2: |
|
|
p1V1 |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
p2 = |
|
|
= 284 кПа. |
|
|
|
|
|||||||||
|
|
V2 |
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
На адиабате 2-3 параметры состояния связаны уравнением адиабаты |
|
|
|||||||||||||||
|
|
p V γ |
|
= p V γ , |
|
|
|
|
|
|
|||||||
|
|
|
2 |
2 |
|
|
3 |
3 |
|
|
|
|
|
|
|
||
где γ = 1,4 – показатель адиабаты воздуха, как двухатомного газа. |
|
|
|
||||||||||||||
Отсюда найдем давление воздуха |
|
|
γ |
|
|
|
|
|
|
|
|
||||||
p |
|
= p |
|
V |
|
|
|
|
|
|
|
|
|
|
|||
3 |
|
|
2 |
|
|
|
=146 кПа. |
|
|
|
|
||||||
|
|
2 V |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
3 |
|
|
|
p2V2 |
|
p3V3 |
|
|
|
|
|
|
Из объединенного газового закона |
|
= |
с учетом T |
=T найдем |
|||||||||||||
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
T2 |
T3 |
2 |
1 |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
температуру воздуха
T3 =T2 p3V3 = 330 К. p2V2
Точка 4 лежит на изотерме, поэтому температура T4 =T3 = 330 К. Кроме
того, эта точка лежит на пересечении изотермы 3-4 и адиабаты 1-4. Поэтому параметры в этой точке связаны уравнениями Бойля-Мариотта и адиабаты
p V |
= p V , |
p V γ = p |
V γ . |
||||
3 |
3 |
4 |
4 |
1 |
1 |
4 |
4 |
Поделив почленно уравнения, найдем объем, а затем и давление воздуха
|
|
γ |
1 |
|
|
p3V3 |
|
|
|
γ−1 |
|
|
|||||
V4 |
|
p1V1 |
|
|
|
= 3,2 л, p4 = |
= 365 кПа. |
|
|
|
|
||||||
= |
p V |
|
|
|
V |
|||
|
|
3 3 |
|
|
|
|
4 |
|
Таким образом, параметры состояния воздуха во всех точках рассчитаны. Работу газа в изотермическом процессе 1-2 определим по формуле
2 |
|
|
|
m |
|
2 dV |
|
|
|
m |
|
V |
|
|
|
|
|
|||||
A12 = ∫pdV = |
|
RT1 ∫ V |
=RT1 |
|
|
2 |
= 1300 Дж. |
|
|
|||||||||||||
µ |
µ ln |
|
|
|
|
|||||||||||||||||
V |
|
|
||||||||||||||||||||
1 |
|
|
|
|
1 |
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|||
Работу газа в адиабатическом процессе 2-3 определим по формуле |
||||||||||||||||||||||
3 |
3 |
|
|
|
|
|
|
|
|
γ−1 |
|
|
|
|
|
|
|
|
T3 |
|
|
|
dV |
|
RT2 |
m |
|
|
V2 |
|
|
|
|
|
RT2 |
m |
|
|
|
|
|||||
γ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
A23 = ∫pdV =p2V2 |
∫V γ |
= |
|
|
|
|
|
− T |
= 620 Дж. |
|||||||||||||
γ −1 µ |
1 − V |
|
|
|
= γ −1 µ |
1 |
|
|||||||||||||||
2 |
2 |
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
2 |
|
|
||
Работу газа в изотермическом процессе 3-4 определим по формуле

42
4 |
m ln |
V4 |
|
|
A34 = ∫pdV =RT3 |
= - 1070 Дж. |
|||
V3 |
||||
3 |
µ |
|
Работу газа в адиабатическом процессе 4-1 определим по формуле
3 |
RT4 |
|
m |
|
T1 |
|
|
|
A41 = ∫pdV = |
|
|
||||||
|
|
|
= - 620 Дж. |
|||||
γ −1 |
µ |
|||||||
1 |
− T |
|
||||||
2 |
|
|
|
|
4 |
|
|
|
Как видно, при сжатии газа его работа отрицательная. А это означает, что в этих процессах над газом совершается работа. Полную работу за цикл найдем как алгебраическую сумму всех работ
A = ∑Ai = 230 Дж.
Как известно, КПД цикла Карно можно найти по формуле
η= T1 −T2 = 0,175,
T1
где Т1 и Т2 – температуры нагревателя и холодильника.
С другой стороны КПД тепловой машины определяется выражением
η= A = Q1 −Q2 ,
Q1 Q1
где Q1 и Q2 – количество теплоты, полученное от нагревателя и отданное холодильнику.
Отсюда находим Q1 и Q2:
Q1 = ηA = 1300 Дж, Q2 =Q1 − A = 1070 Дж.
Количество теплоты Q1 можно найти другим способом, используя I начало термодинамики. Для процесса 1 – 2 по I началу термодинамики с учетом
U = const имеем: Q1 = ∆U + A12 = A12 = 1300 Дж.
12. Пространство между двумя коаксиальными цилиндрами заполнено газом. Радиусы цилиндров равны r = 5 см и R = 5,2 см. Высота внутреннего цилиндра h = 25 см. Внешний цилиндр вращается с частотой n = 360 об/мин. Для того чтобы внутренний цилиндр оставался неподвижным, к нему надо приложить касательную силу F = l,38 мН. Рассматривая в первом приближении случай как плоский, найти из
данных этого опыта вязкость η газа, находящегося между цилиндрами.
Решение. Эта задача связана с вязкостью газа, которая проявляется, если соседние слои газа движутся с разными скоростями. По условию прилипания вязкий газ вблизи поверхности движется со скоростью поверхности. В данном примере газ возле внешнего цилиндра движется со скоростью вращения цилиндра v = 2πRn , а возле внутреннего цилиндра – покоится (рис. 2.4). По закону вязкого трения Ньютона, сила трения равна
F = η∆v S , |
(1) |
тр ∆x

43 |
|
где ∆v = v2 − v1 = 2πRn - разность скоростей газа возле ци- |
ω |
линдров, ∆x = R − r - расстояние между слоями газа (ци- |
|
линдрами), η - коэффициент вязкости газа, S = 2πrh – |
|
площадь поверхности, вдоль которой действует сила вязкого трения. Направлена эта сила против относительного h движения слоев газа.
По условию задачи Fтр скомпенсирована внешней силой F, для которой получаем уравнение
2πRn |
2πrh = η |
4π2 Rrnh |
, |
|
F = η R − r |
R − r |
Рис. 2.4 |
||
|
|
|
|
из которого находим коэффициент вязкости
η= F(R − r)= 18 мкПа с.
4π2 Rrnh
13. Между двумя пластинами, находящимися на расстоянии d = 1 мм друг от друга, находится воздух. Между пластинами поддерживается разность температур ∆T = 1 К. Площадь каждой пластины S = 0,01 м2. Какое количество теплоты Q передается за счет теплопроводности от одной пластины к другой за время t = 10 мин? Считать, что воздух находится при нормальных условиях. Диаметр молекул воздуха d = 0,3 нм.
Решение. Количество теплоты, передаваемое через воздух от одной пластины к другой за время t определим по закону Фурье
|
|
|
|
Q = a |
∆T |
|
S t , |
|
|
|
(1) |
||||
|
∆T |
|
∆x - разность |
∆x |
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||
где |
и |
температур |
|
и расстояние |
между пластинами, |
||||||||||
a = |
1 nλ v |
CV |
– коэффициент теплопроводности, λ = |
|
1 |
|
- средняя длина |
||||||||
|
|
|
|
||||||||||||
|
3 |
N A |
|
|
|
|
|
|
|
|
2πd 2n |
|
|||
свободного пробега молекулы, |
v = |
8RT |
|
- средняя скорость теплового движе- |
|||||||||||
|
πµ |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
ния молекул воздуха, Cv = 52 R - молярная теплоемкость при постоянном объеме, n – концентрация молекул, N A - число Авогадро.
Концентрацию молекул найдем из основного уравнения молекулярнокинетической теории
p = nkT ,
где k = R N A = 1,38 10-23 Дж/К- постоянная Больцмана.
N A = 1,38 10-23 Дж/К- постоянная Больцмана.
Подставляя все выражения в (1), и учитывая нормальные условия (Т= 273 К, р = 105 Па), находим количество переданнойтеплоты
Q = |
5 |
RT R ∆T |
S t = 77 Дж. |
|||
|
|
|
|
|||
3πσ2 |
πµ N A d |
|||||
|
|
|||||
14. Найти изменение ∆S энтропии при превращении массы m = 10 г льда
44
при температуре t = - 20 °С в пар при температуре tп = 100 °С.
Решение. Изменение энтропии при переходе вещества из состояния 1 в состояние 2 определяется выражением
∆S = ∫2 dQ .
1 T
При переходе вещества из одного агрегатного состояния в другое, общее изменение энтропии складывается из ее изменений в отдельных процессах:
∆S = ∆S1 + ∆S2 + ∆S3 + ∆S4 , где ∆S1 , ∆S2 , ∆S3 и ∆S4 - изменение энтропии при нагревании льда, плавлении льда, нагревании воды и испарении воды. При
нагревании льда от T =t + 273 = 253К до температуры плавления T0 = 273 К
|
|
T0 c mdT |
|
|
|
|
T |
|
|
|
|
|
|||||
|
|
∫ |
л |
|
T |
|
|
|
|
|
|
T |
|
|
|
|
|
∆S = |
|
|
|
|
= c |
л |
mln |
0 |
, |
|
|
|
|
||||
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
где сл = 2100 Дж/кг К - удельная теплоемкость льда. |
|
|
|
|
|
||||||||||||
При плавлении льда при температуре Т0 |
|
|
|
|
|
|
|
|
|
||||||||
|
|
2 dQ |
2 |
λdm |
λm |
|
|
|
|
|
|||||||
∆S2 = ∫ |
T |
|
= ∫ |
T |
|
|
= T |
, |
|
|
|
|
|||||
|
|
1 |
|
0 |
1 |
0 |
|
|
0 |
|
|
|
|
|
|||
где λ = 330 кДж/кг - удельная теплота плавления льда. |
|
|
|
|
|||||||||||||
При нагревании воды от T0 |
до Tn |
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
Tn ñ mdT |
|
|
|
|
T |
|
|
|
|
|
|||||
∆S3 = ∫ |
â |
|
|
|
|
|
|
|
n |
|
|
|
|
|
|||
|
|
T |
|
= câmln T |
, |
|
|
|
|
||||||||
|
|
T |
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
где св = 4190 Дж/кг К удельная теплоемкость воды. |
|
|
|
|
|
||||||||||||
При испарении воды при температуре Тn |
|
|
|
|
|
|
|
|
|||||||||
|
|
2 dQ |
2 rdm |
rm |
|
|
|
|
|
||||||||
∆S4 = ∫ T |
= ∫ T |
|
|
= T , |
|
|
|
|
|||||||||
|
|
1 |
|
|
n |
1 |
|
n |
|
|
n |
|
|
|
|
|
|
где r = 2,26 МДж/кг удельная теплота парообразования. |
|
|
|
|
|||||||||||||
Общее изменение энтропии |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T0 |
|
λ |
|
|
Tn |
|
r |
|
|||
∆S = ∆S1 + ∆S2 + ∆S3 + ∆S4 |
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
+ T |
|
|
|
+ T |
|
||||||||
= cл ln T |
|
+ cв ln T |
|
m = 87,4 Дж/К. |
|||||||||||||
|
|
|
|
|
|
|
|
|
0 |
|
|
0 |
|
|
П |
||
15. Найти изменение энтропии ∆S при переходе массы m = 6 г водорода от объема V1 = 20 л под давлением p1 = 150 кПа к объему V2 = 60 л под давлением
р2 = 100 кПа.
Решение. Изменение энтропии при переходе вещества из состояния 1 в состояние 2 определяется выражением
2 |
|
|
∆S = ∫dQ . |
(1) |
|
1 |
T |
|
По первому началу термодинамики
dQ = dU + dA = νCV dT + pdV , |
(2) |
45
где ν = m µ - количество молей вещества, µ = 2 г/мольмолярная масса водорода, CV =5R
µ - количество молей вещества, µ = 2 г/мольмолярная масса водорода, CV =5R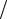 2 - молярная теплоемкость водорода как двухатомного газа при по-
2 - молярная теплоемкость водорода как двухатомного газа при по-
стоянном объеме.
Подставляя (2) в (1) и интегрируя, получаем
2 |
dT |
2 |
dV m |
|
T2 |
V2 |
|
|
mR |
|
5 |
p2V2 |
V2 |
|
|
||
|
|
|
|
|
|
|
|
||||||||||
∆S =νCV ∫ T |
+νR∫ V |
= µ |
= |
µ |
2 ln |
p V |
, |
||||||||||
CV ln |
T |
+ Rln V |
|
|
+ ln V |
|
|||||||||||
1 |
|
1 |
|
|
|
1 |
1 |
|
|
|
|
|
1 1 |
1 |
|
|
|
где температура исключена на основании уравнения состояния pV = νRT .
Подставляя числовые данные, находим приращение энтропии
∆S = 70,6 Дж/К.
2.3. Задачи для работы в аудитории
1.Каким должен быть наименьший объем V баллона, вмещающего мас-
су m = 6,4 кг кислорода, если его стенки при температуре t = 20 °C выдерживают давление р = 15,7 МПа?
Ответ: V = 31 л.
2.Посередине откачанного и запаянного с обоих концов капилляра, расположенного горизонтально, находится столбик ртути длиной l = 20 см. Если
капилляр поставить вертикально, то столбик ртути переместится на l = 10 см. До какого давления р0 был откачан капилляр? Длина капилляра L = 1 м.
Ответ: р0 = 375 мм рт. ст. = 50 кПа.
3. Масса m = 10 г кислорода находится при давлении p = 304 кПа и температуре t1 = 10 °C. После расширения вследствие нагревания при постоянном давлении кислород занял объем V2 = 10 л. Найти объем V1 до расширения, тем-
пературу t2 газа после расширения, плотности ρ1 и ρ2 газа до и после расширения.
Ответ: V1 = 2,4 л; t2 = 1170 °К; ρ1 = 4,14 кг/м3; ρ2 = 1 кг/м3.
4. В закрытом сосуде объемом V = 1 м3 находится масса m1 = 1,6 кг кислорода и масса m2 = 0,9 кг воды. Найти давление р в сосуде при температуре
t = 500 °С, зная, что при этой температуре вся вода превращается в пар. Ответ: р = 640 кПа.
5.Закрытый сосуд объемом V = 2 л наполнен воздухом при нормальных
условиях. В сосуд вводится диэтиловый эфир (С2Н5ОС2Н5). После того, как весь эфир испарился, давление в сосуде стало равным р = 0,14 МПа. Какая масса m эфира была введена в сосуд?
Ответ: m = 2,5 г.
6.Какая часть молекул n кислорода при температуре t = 0 °С обладает скоростями v в интервале от 100 до 110 м/с?
Ответ: n = 0,4 %.
7.Найти плотность ρ воздуха: а) у поверхности Земли; б) на высоте h = 4 км от поверхности Земли. Температуру воздуха считать постоянной и
равной t = 0 °С. Давление воздуха у поверхности Земли р0 = 100 кПа.
Ответ: а) ρ = 1,28 кг/м3 б) ρ = 0,78 кг/м3.
8.Масса m = 10 г кислорода находится при давлении р = 0,3 МПа и температуре t = 10 °С. После нагревания при p = const газ занял объем V2 = 10 л.
46
Найти количество теплоты Q, полученное газом, и энергию теплового движения молекул газа U1 и U2 до и после нагревания.
Ответ: Q = 7,9 кДж; U1 = 1,8 кДж; U2 = 7,6 кДж.
9. Для нагревания некоторой массы газа на ∆t1 = 50 °С при р = const необходимо затратить количество теплоты Q1 = 670 Дж. Если эту же массу газа охладить на ∆t2 = 100 °С при V = const, то выделяется количество теплоты Q2 = 1005 Дж. Какое число степеней свободы i имеют молекулы этого газа?
Ответ: i = 6.
10. В сосуде под поршнем находится масса m = 1 г азо та. Какое количество теплоты Q надо затратить, чтобы нагреть азот на ∆T = 10 К? На сколько при этом поднимется поршень? Масса поршня М = 1 кг, площадь его поперечного сечения S = 10 см2. Давление над поршнем р = 100 кПа.
Ответ: Q = 10,4 Дж, ∆h = 2,8 см.
11. В сосуде под поршнем находится газ при нормальных условиях. Расстояние между дном сосуда и поршнем h = 25 см. Когда на поршень положили груз массой m = 20 кг, поршень опустился на ∆h = 13,4 см. Считая сжатие адиабатическим, найти для данного газа отношение Cp CV . Площадь попереч-
CV . Площадь попереч-
ного сечения поршня S = 10 см2. Массой поршня пренебречь. Ответ: Cp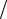 CV = 1,4.
CV = 1,4.
12. Газ расширяется адиабатически от давления p1 = 200 кПа до давления р2 = 100 кПа. Затем он нагревается при постоянном объеме до первоначальной температуры, причем его давление становится равным p = 122 кПа. Найдите отношение Cp CV для этого газа. Начертите график этого процесса.
CV для этого газа. Начертите график этого процесса.
Ответ: Cp CV = 1,4.
CV = 1,4.
13. Масса m = 10 г кислорода, находящегося при нормальных условиях, сжимается до объема V2 = 1,4 л. Найти давление р2 и температуру t2 кислорода после сжатия, если кислород сжимается: а) изотермически; б) адиабатически. Найти работу А сжатия в каждом из этих случаев.
Ответ: а) р2 = 510 кПа; Т2 = 273 К; А = - 1140 Дж; б) р2 = 960 кПа; Т2 = 520 К; А = - 1590 Дж.
14. Идеальная тепловая машина работает по циклу Карно. Воздух при
давлении р1 = 708 кПа и температуре t1 = 127 °C занимает объем V1 = 2 л. После изотермического расширения воздух занял объем V2 = 5 л; после адиабатического расширения объем стал равным V3 = 8 л. Найти: а) координаты пересечения изотерм и адиабат; б) работу А, совершаемую на каждом участке цикла; в) полную работу А, совершаемую за весь цикл; г) КПД цикла; д) количество теплоты Q1, полученное от нагревателя за цикл; е) количество теплоты Q2, отданное холодильнику за цикл.
Ответ: а) V1 = 2 л, р1 = 708 кПа, V2 = 5 л, р2 = 284 кПа, V3 = 8 л, р3 = 146 кПа, V4 = 3,22л, р4 = 365 кПа;
б) А1 = 1300 Дж, А2 = 620Дж, А3 = - 1070 Дж, А4 = - 620 Дж;
в) А = ∑Ai = 230 Дж; г) КПД = 0,175;
д) Q1 = 1300 Дж; е) Q2 = 1070 Дж.
47
15. Найти изменение ∆S энтропии при превращении массы m = 10 г льда при температуре t = - 20 °С в пар при температуре tп = 100 °С.
Ответ: ∆S = 88 Дж/ К.
16. Найти изменение ∆S энтропии при переходе массы m = 8 г кислорода от объема V1 = 10 л при температуре t1 = 80 °С к объему V2 = 40 л при темпера-
туре t2 = 300 °С.
Ответ: ∆S = 5,4 Дж/ К.
17.Объем V1 = 1 м 3 воздуха, находящегося при температуре t1 = 0 °С и давлении p1 = 98 кПа, изотермически расширяется от объема V1 до объема V2 = 2V1. Найти приращение энтропии ∆S в этом процессе.
Ответ: ∆S = 500 Дж/К.
18.Пространство между двумя коаксиальными цилиндрами заполнено газом. Радиусы цилиндров равны r = 5 см и R = 5,2 см. Высота внутреннего цилиндра h = 25 см. Внешний цилиндр вращается с частотой n = 360 об/мин. Для того чтобы внутренний цилиндр оставался неподвижным, к нему надо приложить касательную силу F = l,38 мН. Рассматривая в первом приближении слу-
чай как плоский, найти из данных этого опыта вязкость η газа, находящегося между цилиндрами.
Ответ: η = 18 мкПа с.
19.Между двумя пластинами, расположенными на расстоянии а = 1 мм
друг от друга, находится воздух. Между пластинами поддерживается разность температур ∆T = 1 К. Площадь каждой пластины S = 0,01 м2. Какое количество теплоты Q передается за счет теплопроводности от одной пластины к другой за время t = 10 мин? Считать, что воздух находится при нормальных условиях. Диаметр молекул воздуха d = 0,3 нм.
Ответ: Q = 78 Дж.
20.Найти среднюю длину свободного пробега λ атомов гелия, если известно, что плотность гелия ρ = 0,021 кг/м3, а диаметр молекул d = 0,2 нм.
Ответ: λ = 1,8 мкм.
2.4.Задачи для самостоятельной работы
|
1. В |
баллоне находилась масса m1 = 10 кг |
газа при давлении |
р1 |
= 10 МПа. Какую массу m газа взяли из баллона, |
если давление стало |
|
р2 |
= 2,5 МПа? Температуру газа считать постоянной. |
|
|
|
Ответ: |
m = 7,5 кг. |
|
2.Какая должна быть масса m оболочки воздушного шарика, наполненного гелием, чтобы шарик находился во взвешенном состоянии? Воздух и гелий находятся при нормальных условиях. Давление внутри шарика равно внешнему давлению. Диаметр шарика d = 20 см.
Ответ: m = 4,6 г.
3.В запаянном сосуде находится вода, занимающая объем, равный половине объема сосуда. Найти давление р и плотность ρ водяного пара при тем-
пературе t = 400 °С, зная, что при этой температуре вся вода обращается в пар. Ответ: р = 155 МПа; ρ = 500 кг/м3.
48
4.В первом сосуде объемом V1 = 3 л находится газ под давлением р1 = 0,2 МПа. Во втором сосуде объемом V2 = 4 л находится тот же газ под давлением р2 = 0,1 МПа. Температуры газа в обоих сосудах одинаковы. Под каким давлением р будет находиться газ, если соединить оба сосуда трубкой? Объемом трубки пренебречь.
Ответ: р = 415 кПа.
5.В сосуде находятся масса m1 = 14 г азота и масса m2 = 9 г водорода
при температуре t = 10 °С и давлении р = 1 МПа. Найти молярную массу µ смеси и объем V сосуда.
Ответ: µ = 0,0046 кг/моль; V = 11,7 л.
6.Какая часть молекул азота при температуре Т имеет скорости, лежащие
винтервале от vв до vв + ∆ v, где vв – вероятная скорость, ∆ v = 20 м/с, если: а) T =
400 К; б) T = 900 К?
Ответ: a) vв = 487 м/с, ∆N/N = 3,4 %; б) vв = 731 м/с, ∆N/N = 2,2 %;
7.На какой высоте h плотность газа вдвое меньше его плотности на уровне моря? Температуру газа считать постоянной и равной t = 0 °С. Задачу решить для: а) воздуха, б) водорода.
Ответ: a) h = 5,5 км; б) h = 80 км.
8.Масса m = 12 г азота находится в закрытом сосуде объемом V = 2 л
при температуре t = 10 °С. После нагревания давление |
в сосуде стало |
р = 1,33 МПа. Какое количество теплоты Q сообщено газу при |
нагревании? |
Ответ: Q = 4,15 кДж.
9. Азот находится в закрытом сосуде объемом V = 3 л при те мпературе t1 = 27 °С и давлении р1 = 0,3 МПа. После нагревания давление в сосуде повысилось до р2 = 2,5 МПа. Найти температуру t2 азота после нагревания и количество теплоты Q, сообщенное азоту.
Ответ: T2 = 2500 K; Q = 16,5 кДж.
10. Двухатомному газу сообщено количество теплоты Q = 2,1 кДж. Газ расширяется при p = const. Найти работу А расширения газа.
Ответ: A = 600 Дж.
11. Двухатомный газ занимает объем V1 = 0,5 л при давлении р1 = 50 кПа. Газ сжимается адиабатически до некоторого объема V2 и давления p2. Затем он охлаждается при V2 = const до первоначальной температуры, причем его давление становится р0 = 100 кПа. Начертить график этого процесса. Найти объем V2
и давление р2.
Ответ: V2 = 0,25 л; р2 =132 кПа.
12. Масса m = 28 г азота, находящегося при температуре t1 = 40 °C и давлении p1 = 100 кПа, сжимается до объема V2 = 13 л. Найти температуру t2 и давление р2 азота после сжатия, если азот сжимается: а) изотермически; б) адиабатически. Найти работу А сжатия в каждом из этих случаев.
Ответ: а) Т2 = Т1 = 313 К; р2 = 0,20 МПа; А = - 1,80 кДж; б) Т2 = 413 К; р2 = 0,26 МПа; А = - 2,08 кДж.
13. Идеальная тепловая машина, работающая по циклу Карно, за цикл получает от нагревателя количество теплоты Q1 = 2,512 кДж. Температура нагре-
49
вателя T1 = 400 К, температура холодильника T2 = 300 К. Найти КПД машины, работу А, совершаемую машиной за один цикл, и количество теплоты Q2, отдаваемое холодильнику за один цикл.
Ответ: КПД = 0,25; Q2 = 1,88 кДж; A = 630 Дж.
14. Идеальная тепловая машина работает по циклу Карно. При этом n = 80 % количества теплоты, получаемого от нагревателя, передается холодильнику. Машина получает от нагревателя количество теплоты Q1 = 6,28 кДж. Найти КПД η цикла и работу А, совершаемую за один цикл.
Ответ η = 20 %, A = 1,26 кДж.
15.Найти приращение ∆S энтропии при превращении массы m = 1 г воды (t = 0 °С) в пар (tп = 100 сС).
Ответ: ∆S = 7,4 Дж/ К.
16.Найти изменение ∆S энтропии при переходе массы m = 6 г водорода
от объема V1 = 20 л под давлением p1 = 150 кПа к объему V2 = 60 л под давл е- нием р2 = 100 кПа.
Ответ: ∆S = m C |
ln |
p2 |
+ m C |
|
lnV2 |
= 70,6 Дж/ К. |
p |
|
|||||
µ V |
|
µ |
p |
V |
|
|
|
|
1 |
|
|
1 |
|
17. Изменение энтропии на участке между двумя адиабатами в цикле Карно ∆S = 4,2 кДж/К. Разность температур между двумя изотермами ∆T = 100 К. Какое количество теплоты Q превращается в работу в этом цикле?
Ответ: Q = 420 кДж.
18. Найти среднюю длину свободного пробега λ, молекул водорода при давлении p = 0,133 Па и температуре t = 50 °С. Эффективный диаметр молекул водорода d = 0,23 нм.
Ответ: λ = 14,2 см.
19. Какое количество теплоты Q теряет помещение за время t = 1 ч через окно за счет теплопроводности воздуха, заключенного между рамами? Площадь каждой рамы S = 4 м2, расстояние между ними d = 30 см. Температура помещения t1 = 18 °С, температура наружного воздуха t2 = - 20 °С. Диаметр мо-
лекул воздуха d = 0,3 нм. Температуру воздуха между рамами считать равной среднему арифметическому температур t1 и t2 , давление воздуха р = 105 Па.
Конвекцией пренебречь. Ответ: Q = 24 кДж.
2.5. Задачи для контроля
1.В воздухе содержится с1 = 23,6 % кислорода и с2 = 76,4 % азота (по массе) при давлении р = 100 кПа и температуре t = 13 °С. Найти плотность ρ воздуха и парциальные р1 и р2 давления кислорода и азота.
2.В сосуде объемом V = 2 л находится m = 16 г кислорода при давлении
р= 0,1 МПа. Какое количество теплоты Q надо сообщить газу, чтобы его объем увеличился в два раза при постоянном давлении? Какая при этом совершена работа A, чему равно изменение внутренней энергии ∆U ?
50
3.При какой температуре t газа, состоящего из смеси азота и кислорода, наиболее вероятные скорости молекул азота и кислорода будут отличаться друг от друга на ∆v = 30 м/с?
4.Кислород в количестве ν = 1 кмоль, который находился при нормаль-
ных условиях (НУ: р0 = 105 Па, t0 = 0 °С), расширяется адиабатически от объема V1 до объема V2 = 5V1. Найти изменение внутренней энергии ∆U и работу A газа в этом процессе.
5.Один моль идеального газа расширяется изобарно от начального объема V1 до объема V2 в два раза больше начального. Затем газ охлаждается изо-
хорно до первоначальной температуры. Определить приращение внутренней энергии ∆U , работу А и количество теплоты Q, полученное газом. Изобразить процесс графически на диаграмме (p,V).
6. В закрытом сосуде объемом V = 1 м3 находится масса m1 = 1,6 кг кислорода и масса m2 = 0,9 кг воды. Найти давление р в сосуде при температуре t = 500 °С, зная, что при этой температуре вся вода превращается в пар.
7. Идеальная тепловая машина, работающая по циклу Карно, получает от нагревателя Q1 = 1,5 кДж тепла и отдает холодильнику n = 75 % полученной
энергии. Найти КПД η цикла, работу A за цикл, количество теплоты Q2 , отданное холодильнику, отношение температур нагревателя и холодильника T1  T2 .
T2 .
8. Тепловая машина, работающая по циклу Карно, совершает за один цикл работу А = 73,5 кДж. Температура нагревателя t1 = 100 °С, температура холодильника t2 = 0 °С. Найти КПД η машины и количество теплоты Q1 , полу-
ченное от нагревателя, и Q2 , отданное холодильнику.
9.Давление воздуха на уровне моря р0 = 100 кПа, а на вершине горы р1 = 78,6 кПа. Какова высота горы, если температура воздуха t = 15 °С?
10.Плотность газа ρ = 1,3 кг/м3, а средняя квадратичная скорость молекул vкв = 500 м/с. Найти давление р газа.
11.Найти изменение энтропии ∆S для m = 12,8 г кислорода при изобар-
ном нагревании от температуры t1 = 50 °С до температуры t2 =150 °С.
12. Найти изменение ∆S энтропии m = 6,6 г водорода при изобарном расширении от объема V до объема 2V.
