

42
4. МОЛЕКУЛЯРНАЯ ФИЗИКА И ТЕРМОДИНАМИКА
4.1. Лабораторная работа № 4 «Определение универсальной газовой постоянной»
Цель работы. Экспериментально определить универсальную газовую постоянную методом откачки воздуха.
Приборы и принадлежности. Стеклянный баллон, зажим, насос, вакуумметр, термометр, технические весы, вакуумные шланги.
Описание установки
Лабораторная установка (рис. 1) состоит из стеклянного баллона 1, прибора для измерения разрежения (вакуумметра) 5 и насоса 6, которые соединены между собой резиновыми шлангами 7 и 8. Краны 3 и 4 на подставке вакуумметра предназначены для перекрывания магистралей от баллона и насоса. Зажим 2 служит для перекрывания шланга от баллона во время его отсоединения от установки. Объем баллона указан на чехле, в который он помещен для безопасности. Воздух из баллона откачивается насосом, а разрежение измеряется вакуумметром. Вакуумметр показывает разность давлений ∆p в сосуде и
атмосферного воздуха. Цена деления вакуумметра С = 0,05 атм, класс точности прибора 1,5 %, абсолютная приборная погрешность измерения давления
∆p = 0, 045 атм.
|
|
5 |
7 |
3 |
4 |
2 |
8 |
|
|
1 |
|
6
Рис. 1
43
Методические указания
Параметры состояния идеального газа связаны между собой уравнением состояния, которое называют еще уравнением Менделеева - Клапейрона,
pV = m RT , |
(1) |
µ |
|
где р – давление, V – объем, Т – температура, m - масса, μ - молярная масса газа, R – универсальная газовая постоянная. Универсальная газовая постоянная одинаковая для всех газов и входит во многие физические законы и формулы. Ее физический смысл заключается в том, что при изобарическом нагревании одного моля идеального газа на 1К газ совершает работу, численно равную R. В СИ величина R =8,31 Дж/моль∙K.
Уравнение состояния (3) можно использовать для экспериментального определения универсальной газовой постоянной R. Для этого достаточно измерить изменение давления газа ∆p в сосуде с постоянным объемом V при
изотермическом (Т = соnst) |
изменении массы газа |
m в сосуде. |
||
Тогда из уравнения (3) |
следует, что |
|
||
|
R = |
µV∆p |
. |
(2) |
|
|
|||
|
|
T∆m |
|
|
В настоящей работе при постоянной комнатной температуре, которая измеряется лабораторным термометром, из сосуда 1 откачивают часть воздуха m при помощи насоса 6 и измеряют изменение давления ∆p при этом с помощью
вакуумметра 5. Изменение массы m находят как разность масс баллона с воздухом m1, при атмосферном давлении и m2 при давлении воздуха в баллоне после откачки: ∆m = m1 − m2 . Молярную массу воздуха считают равной
μ = 0,029 кг/моль.
Порядок выполнения работы
1.Определить массу m1 баллона 1 при атмосферном давлении воздуха в нем. Зажим 2 должен находиться на шланге 7, не пережимая его. Чтобы баллон не катался по чашке весов, подвесить его к коромыслу на нитке. Взвешивание произвести с максимальной точностью. Предварительно весы уравновесить и определить цену деления шкалы весов.
2.Установить баллон 1 на подставку и подсоединить шланг 7 к крану 3 вакуумметра. Открыть краны 3 и 4, повернув их вдоль трубок.
3.При помощи насоса 6 откачать из баллона как можно большее количество воздуха и быстро перекрыть кран 4, повернув его поперек трубки.
4.Подождав около минуты, снять показания вакуумметра 5, который дает разность давлений ∆p в баллоне и атмосферного воздуха. После чего сразу же
пережать шланг 7 зажимом 2, чтобы наружный воздух не попадал в баллон.
5.Осторожно отсоединить шланг 7 от крана 3 и на тех же технических весах
с максимальной точностью определить массу т2 баллона с оставшимся в нем воздухом.
6.Измерить температуру воздуха в лаборатории вблизи установки.
44
7.Отпустить зажим 2 на шланге и наполнить баллон атмосферным воздухом. Опыт повторить три раза согласно пунктам 1 - 6. Результаты всех измерений занести в таблицу.
8.Определить погрешности прямых измерений. Найти массу ∆m = m1 − m2
откачанного газа.
9.По формуле (2) рассчитать универсальную газовую постоянную и ее погрешность в каждом из опытов. Затем найти среднее значение универсальной газовой постоянной. При расчетах все величины перевести в систему единиц СИ.
10.Оценить погрешности косвенных измерений, правильно записать результаты измерений и сделать выводы.
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
m , г |
m |
, г |
∆ |
, г |
∆(∆m), г |
Т, K |
∆ |
, K |
∆ |
, Па |
∆(∆P), Па |
|
|
1 |
2 |
|
|
m |
|
|
|
T |
|
P |
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Вопросы для допуска
1.Сформулируйте цель работы.
2.В чем состоит физический смысл универсальной газовой постоянной?
3.Какой газ называют идеальным?
4.Какими параметрами характеризуется состояние газа?
5.Каким прибором и как измеряется давление газа в баллоне? В каких единицах оно измеряется?
6.Для чего нужны краны на трубках вакуумметра?
7.Расскажите, как в данной работе определяется универсальная газовая постоянная.
8.Какой смысл имеют величины, входящие в уравнение состояния (3), каковы их размерности и единицы измерения?
9.Опишите порядок проведения работы.
10.Какие величины и какими приборами измеряются непосредственно в этой работе?
Контрольные вопросы и задания
1.Сформулируйте основные положения молекулярно-кинетической теории (МКТ)?
2.Что такое идеальный газ? При каких условиях реальный газ можно считать идеальным?
3.Какими параметрами характеризуется состояние газа? Что такое уравнение состояния? Запишите уравнение Менделеева - Клапейрона и поясните смысл всех входящих в него величин.
4.Что такое количество вещества, в каких единицах оно измеряется? Объясните смысл числа Авогадро.
45
5.Как объясняется давление газа на стенку вМКТ? Выведите формулу для давления газа, считая, что все молекулы движутся с некоторой средней скоростью.
6.Какой смысл имеет температура в МКТ? Как она связана со средней кинетической энергией молекул?
7.Перечислите известные изопроцессы, запишите их уравнения, изобразите изопроцессы графически.
8.Получите основное уравнение МКТ.
9.Сформулируйте закон Дальтона и выведите его изосновного уравненияМКТ.
10.Выведите рабочую формулу (2) для определения универсальной газовой постоянной.
11.Выведите формулу для подсчета погрешности ∆R универсальной газовой постоянной.
Приложение
1.Основные положения молекулярно – кинетической теории.
Молекулярно-кинетическая теория (МКТ) изучает свойства и строение веществ исходя из следующих трех основных положений:
а) все тела состоят из огромного числа мельчайших частиц – молекул; б) частицы находятся в непрерывном хаотическом (тепловом) движении; в) частицы имеют конечные размеры и взаимодействуют между собой
при столкновении и на расстоянии.
Подтверждениями МКТ могут служить: прямое наблюдение строения вещества (с помощью электронного микроскопа и т.д.), броуновское движение, диффузия и другие явления переноса
2.Идеальный газ. Простейшей моделью МКТ является идеальный газ, который рассматривается как совокупность беспорядочно двигающихся молекул - шариков, имеющих пренебрежимо малый собственный объем, соударяющихся абсолютно упруго между собой и не взаимодействующих друг
сдругом на расстоянии. Между столкновениями молекулы движутся прямолинейно.
Всякий реальный газ при достаточном разрежении, т.е. при низком давлении и температуре близок по своим свойствам к идеальному газу. Многие газы, такие, как водород, азот, кислород, воздух при обычных условиях, т.е. при комнатной температуре и атмосферном давлении, мало отличаются от идеального газа.
Как известно, состояние газа характеризуется тремя параметрами: давлением p, объемом V и температурой T. Эти параметры связаны между собой соотношение вида f (p,V ,T )= 0 , которое называется уравнением состояния га-
за. Для идеального газа уравнение состояния называется уравнением Менделеева – Клайперона и имеет виде
pV = m RT . |
(3) |
µ |
|
где m – масса газа, µ - молярная масса газа.
Уравнение состояния можно переписать в другом виде:

46
pV = νRT = νN AkT = NkT
или
p = nkT |
(4) |
Здесь ν – число молей газа, NA = 6,023 1023 моль-1 – число Авогадро (число ча-
стиц в одном моле вещества), k =1,38 10−23 Дж/K - постоянная Больцмана, n = N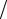 V - концентрация частиц, N - число частиц, R = NAk .
V - концентрация частиц, N - число частиц, R = NAk .
Если учесть, что средняя кинетическая энергия  ε
ε поступательного движения молекул газа пропорциональна температуре газа
поступательного движения молекул газа пропорциональна температуре газа
ε = |
m < v2 |
> |
= |
3 |
kT , |
(5) |
2 |
|
2 |
||||
|
|
|
|
|
то получим из соотношения (5) основное уравнение МКТ
p = |
2 n ε . |
(6) |
|
3 |
|
3. Параметры состояния газа. Состояние газа характеризуется тремя параметрами: давлением p, объемом V и температурой T, которые называются параметрами состояния.
Давлением газа р называется физическая величина, равная отношению нормальной составляющей силы Fn , действующей на площадку ∆S , к величине
этой площадки
p = |
Fn |
(7) |
|
∆S |
|||
|
|
В системе СИ давление измеряется в паскалях: 1 Па = 1 H/м2. Однако в технике и быту широко используются другие единицы измерения давления. Среди них миллиметр ртутного столба, равный давлению столба ртути высотой в один миллиметр (1 мм. рт. ст. ≈ 133,3 Па), миллиметр водного столба, равный давлению столба воды высотой в один миллиметр (1 мм. вод. ст. ≈ 9,806 Па), атмосфера техническая (1 килограмм силы на 1 квадратный сантиметр (1 ат = 1 кгс/см2 ≈ 0,98∙105 Па) и атмосфера физическая (1 атм = 760 мм. рт. ст. ≈
1,013 105 Па).
Температура Т характеризует степень нагретости тел и является мерой интенсивности теплового движения молекул вещества. В молекулярной физике различают абсолютную, энергетическую и термодинамическую температуры. В системе СИ используется абсолютная шкала температур Т, которая измеряется в кельвинах (К). На практике широко распространена шкала температур Цель-
сия t , которая связана с абсолютной температурой выражением |
|
T = 273,15 + t . |
(8) |
Из смысла абсолютной температуры следует, что при T = 0 прекращается всякое тепловое движение молекул в веществе.
4. Давление газа на стенку. В МКТ давление газа объясняется ударами молекул о стенки сосуда. Будем считать, что все молекулы газа имеют одинаковую массу m и движутся хаотически со средней скоростью vcp . В силу

47
хаотического движения вдоль каждой из трех координатных осей движется в среднем одинаковое количество молекул, равное 1/3 от общего количества. Пусть ось х перпендикулярна стенке сосуда. Тогда в направлении стенки движется столько же молекул, как и от стенки, т.е. 1/6 общего количества. Будем считать удар молекул о стенку абсолютно упругим. Если перед ударом о стенку молекула имела импульс mvcp , а после удара −mvcp , то изменение импульса по
модулю будет 2mvcp . Если концентрация молекул газа n, то за время ∆t о пло-
щадку ∆S ударится ∆N = 16 nvcp∆S∆t молекул. Они передадут площадке
импульс 2mvcp∆N = 13 nmvcp2 ∆S∆t . Как известно из механики, скорость измене-
ния импульса равна действующей силе, а сила, отнесенная к площади, дает давление
p = |
2mvcp∆N |
= |
1 |
nmvcp2 |
= |
2 |
n |
mvcp2 |
= |
2 |
n ε . |
(9) |
|
∆S∆t |
3 |
3 |
2 |
3 |
|||||||||
|
|
|
|
|
|
|
|
4. Погрешности измерений. Абсолютная погрешность косвенного измерения величины R рассчитывается по формуле
|
|
|
|
|
∂R |
|
|
|
|
∂R |
|
|
|
∂R |
|
|
|
|
|
|
||||||
|
|
|
∆R = |
|
|
∆T + |
|
|
|
∆(∆m) + |
|
|
|
∆(∆p) = |
|
|
|
|||||||||
|
|
|
|
∂T |
|
|
∂∆m |
|
∂∆p |
|
|
(10) |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
µV∆p |
|
µV∆p |
|
|
|
|
|
µV |
|
|
|
|
|
∆T |
|
∆(∆m) |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
∆(∆p) |
|||||||||||||
= |
|
2∆ |
∆T + |
|
|
|
∆(∆m)+ |
|
|
|
∆(∆p)= R |
|
|
|
|
+ |
|
+ |
|
; |
||||||
|
∆ |
|
|
T∆m |
|
T |
∆m |
∆p |
||||||||||||||||||
|
T |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
m |
|
T m |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
где ∆T , ∆(∆m), ∆(∆p) - абсолютные погрешности прямых измерений.
Погрешность массы определяется по формуле
∆(∆m)= ∆(m1 −m2 )= ∆m1 + ∆m2 ≈ 2∆m1,
где ∆m1 - погрешность взвешивания. Погрешность измерения давления опреде-
ляется классом точности прибора с = 1,5 %, предельным значением
pmax = 3 атм и равна ∆p =3 1,5/100 = 0,045 атм. При расчетах давление необходимо перевести в основные единицы СИ.
Окончательный результат измерений записывается в виде
R =  R
R ±
± 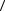 ∆R
∆R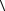 ,
,
где 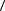 R
R и
и  ∆R
∆R - средние значения величин по проведенным измерениям.
- средние значения величин по проведенным измерениям.
Литература
1.Андроникашвили Э. Л. Лабораторные работы по физике. -М.: ГИФИЛ,
1961. – С. 81-83.
2.Савельев И.В. Курс общей физики. - М.: Наука, 1988, т. 1.- С. 273 – 277.

48
4.2.Лабораторная работа № 5 «Определение показателя адиабаты воздуха»
Цель работы. Экспериментально определить показатель адиабаты для воздуха и изучить термодинамические процессы в идеальном газе.
Приборы и принадлежности. Стеклянный баллон с резиновой пробкой, кран, стеклянная пробка, насос, водяной манометр, вакуумные шланги.
Описание установки
Лабораторная установка состоит из стеклянного баллона 1 емкостью 20 л, герметично закрытого резиновой пробкой 2. В резиновую пробку вставлена стеклянная трубка с пробкой 4 и стеклянный тройник, к которому при помощи вакуумных шлангов 7 подсоединены водяной манометр 5 и насос 6, которым воздух закачивается в баллон. Краном 3 перекрывают магистраль от насоса до баллона. Водяным манометром измеряется разность давлений ∆p возду-
ха в баллоне p1 и атмосферного воздуха
p0 : ∆p = p1 − p0 . При помощи пробки 4 кратковременно открывают трубку и выпускают воздух из баллона, выравнивая внутреннее и наружное давления. Давление водяным манометром измеряется в мм. вод. ст. (1 мм. вод. ст. ≈ 9,806 Па).
Методические указания
Описываемый ниже способ экспериментального определения показателя адиабаты основан на измерении параметров газа в двух состояниях, переход между которыми осуществлен адиабатически. В данной работе осуществляют быстрое расширение воздуха в баллоне из состояния 1 с параметрами p1 , V1 и
T1 в состояние 2 с параметрами p0 , V2 и T2 (рис. 2). Время расширения должно быть пренебрежимо мало по сравнению со временем установления теплового равновесия, чтобы процесс расширения можно было считать адиабатическим. В начальном состоянии
Рис. 1
р 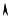
р1  1
1
T1 = const |
|
P2 |
|
Р0 pV γ = const |
2 |
0 |
V |
|
|
Рис. 2 |
|

49
температура T1 в баллоне давление р0: равна комнатной температуре, а давление p1 превышает атмосферное
p1 = p0 +ρgh1 , |
(1) |
где h1 - показания водяного манометра, ρ - плотность воды в манометре, g – ускорение свободного падения, ρgh1 - гидростатическое давление водяного
столба в манометре.
При кратковременном открывании пробки 4, воздух в баллоне быстро расширится практически адиабатически до атмосферного давления p0 и охла-
дится расширения до температуры T2 . Параметры идеального газа при
адиабатическом процессе связаны между собой уравнением Пуассона
p1V1γ = p0V2γ ,
где V2 - объем воздуха после расширения. В переменных p, T это уравнение имеет вид
γγ
p T 1−γ |
= p T 1−γ , |
(2) |
||
1 |
1 |
0 |
2 |
|
Отсюда можно определить γ, если известна температура T2 . Однако тем- |
||||
пература T2 не остается постоянной, |
т.к. |
вследствие теплообмена с |
||
окружающей средой, воздух в баллоне нагревается и его температура возрастает. Для исключения T2 из уравнения (2) проводится дополнительный процесс
изохорического нагревания воздуха, оставшегося в сосуде после адиабатического расширения, от температуры T2 до T1 . Для этого сосуд вновь закрывают
пробкой в момент, когда давление в нем станет равным атмосферному p0 (по-
казания манометра 5 будут равны нулю). Через некоторое время воздух в баллоне нагреется до температуры T1 и давление возрастет до величины
p2 = p0 +ρgh2 , |
(3) |
где h2 - показания водяного манометра 5 после достижения температуры T1 в баллоне. Так как нагревание происходит при постоянном объеме, то
|
|
|
|
Ò1 |
|
= |
|
p2 |
. |
|
|
|
|
|
|
(4) |
||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
Ò |
|
|
ð |
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
||
Подставив (4) в (2), после преобразований с учетом (1) и (3) получим |
|
|||||||||||||||||
|
ρgh |
|
|
|
|
|
ρgh |
|
|
γ |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
γ−1 |
|
|
|
||||||||||
1 |
+ p |
1 |
= |
|
|
+ |
|
2 |
|
|
|
|
(5) |
|||||
|
|
|
1 |
|
р |
. |
|
|||||||||||
|
0 |
|
|
|
|
|
|
|
0 |
|
|
|
|
|
||||
Так как ρgh2 р0 <<1, то по формулам приближенного вычисления имеем |
|
|||||||||||||||||
|
ρgh |
|
|
γ |
|
|
|
|
|
|
|
|
|
ρgh |
|
|
||
|
|
|
|
|
|
|
γ |
|
|
|
|
|
||||||
γ−1 |
|
|
|
|
|
|
|
|
|
|||||||||
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
. |
(6) |
|
|
|
≈1+ γ −1 |
|
|||||||||||||||
1+ |
р |
|
|
|
р |
|||||||||||||
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
Тогда из (5) и (6) получаем формулу для определения показателя адиабаты |
|
|||||||||||||||||
|
|
γ = |
|
h1 |
|
|
. |
|
|
|
|
|
|
(7) |
||||
|
|
h −h |
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
1 |
|
|
2 |
|
|
|
|
|
|
|
|
|

50
Порядок выполнения работы
1.Открыть кран 3 и осторожно накачать воздух насосом в баллон, доведя разность уровней воды в манометре до 200 - 250 мм.
2.Закрыть кран 3 и подождать 1 – 2 минуты, пока температура воздуха в баллоне сравняется с наружной температурой. При выравнивании температуры показания манометра будут уменьшаться. После того, как давление установит-
ся, произвести отсчет разности уровней в манометре h1. Результаты занести в табл. 1.
3.Открыть стеклянную пробку 4 и быстро в течение 1 – 2 секунд закрыть ее, как только уровни воды в обоих коленах манометра уравняются, и воздух прекратит истекать наружу, издавая шипящий звук. После этого подождать 1 – 2 минуты, пока температура воздуха в баллоне сравняется с наружной температурой и показания манометра перестанут изменяться. После установления
давления в баллоне произвести второй отсчет разности уровней в манометре h2. Результаты занести в табл. 1.
4.Повторить опыт 10 раз. Вычислить показатель адиабаты γ в каждом опыте.
Определить погрешности прямых измерений. Определить среднее значение  γ
γ и погрешность среднего, как для прямых измерений.
и погрешность среднего, как для прямых измерений.
|
|
|
Таблица 1 |
|
|
|
|
|
|
№ |
1 |
… |
10 |
|
h1, мм |
|
|
|
|
h2 , мм |
|
|
|
|
γ |
|
|
|
|
∆γ |
|
|
|
|
Вопросы для допуска
1.Каким способом определяется показатель адиабаты воздуха в данной работе?
2.Опишите устройство экспериментальной установки и назначение основных ее элементов.
3.Расскажите, как водяным манометром измерить давление.
4.Объясните, зачем надо ждать, перед тем, как снимать показания манометра.
5.Перечислите и опишите изопроцессы в идеальном газе.
6.Какие процессы и на каких этапах происходят с воздухом в баллоне в данной работе?
7.Дайте определения адиабатическому процессу и постоянной адиабаты.
8.Объясните, как в данной работе реализуется адиабатический процесс.
9.Расскажите порядок проведения работы.
10.Какие величины и какими приборами непосредственно измеряются в этой работе?

51
Контрольные вопросы и задания
1.Что называется теплоемкостью тела? Что такое молярная и удельная теплоемкости и как они связаны?
2.Расскажите про теплоемкость идеального газа при постоянном объеме CV
и постоянном давлении Cp .
3.Выведите уравнение Майера, связывающее теплоемкости CV и Cp .
4.Что такое число степеней свободы молекулы?
5.Сформулируйте и поясните закон о равномерном распределении тепловой энергии по степеням свободы молекул.
6.Выведите выражение для внутренней энергии идеального газа исходя из строения молекулы.
7.Как связаны молярные теплоемкости и показатель адиабаты идеального газа с числом степеней свободы его молекулы?
8.Опишите существующие виды теплообмена.Приведите примеры.
9.Дайте определение работы термодинамической системы. Определите работу идеального газа в изопроцессах.
10.Сформулируйте и запишите первое начало термодинамики.
11.Выведите уравнение адиабатыПуассона для идеального газа.
12.Получите уравнение адиабатыПуассона в переменных (р,V), (р,Т) и (V,Т).
Приложение
1. Внутренняя энергия идеального газа. Внутренняя энергия одного моля идеального газа равна средней энергии молекулы  ε
ε , умноженной на
, умноженной на
число Авогадро N A . Согласно закону о равномерном распределении энергии по степеням свободы на каждую поступательную и вращательную степень свободы молекулы приходится в среднем одинаковая энергия, равная 12 kT , где k -
постоянная Больцмана. На каждую колебательную степень свободы приходится энергия, равная kT , т.к. это движение связано с запасами кинетической и потенциальной энергий.
Числом степеней свободы молекулы i называют количество независимых величин, при помощи которых может быть однозначно задано положение молекулы в пространстве. Так, одноатомная молекула имеет три поступательных степени свободы (i = 3); «жесткая» (без взаимных колебаний) двухатомная молекула имеет пять степеней свободы (три поступательных и две вращательных, i = 5); «жесткая» трехатомная молекула имеет шесть степеней свободы (три поступательных и три вращательных, i = 6). Таким образом, средняя энергия
«жесткой» молекулы идеального |
газа< ε >= |
i |
kT . Следовательно, |
внутренняя |
|||||
|
|||||||||
|
|
|
|
2 |
|
|
|
|
|
энергия одного моля идеального газа будет |
|
|
|
|
|||||
U = N |
A |
ε = |
i |
RT , i =i |
+ i |
+ 2i |
. |
(8) |
|
|
|||||||||
|
2 |
пост. |
вр. |
кол. |
|
|
|||
|
|
|
|
|
|
|
|
||

52
где NA = 6,02 1023 моль-1 - число Авогадро; R = kNA - универсальная газовая
постоянная.
2. Теплоемкость. Теплоемкостью тела называется величина, равная отношению количества теплоты dQ , которое сообщено телу, к изменению его
температуры
c = dQ . |
(9) |
dT |
|
Теплоемкость одного моля вещества называется молярной теплоемкостью С, а теплоемкость единицы массы - удельной теплоемкостью с. Для газов обычно используется молярная теплоемкость, а для твердых и жидких тел – удельная.
По I началу термодинамики для молярной теплоемкости получим
C = dQdT = dUdT + p dVdT .
Отсюда видно, что теплоемкость зависит от способа нагревания газа. При постоянном объеме dV = 0 и теплоемкость газа определяется выражением
C |
= dU . |
(10) |
V |
dT |
|
С учетом (8) для теплоемкости в этом случае получаем
C |
= |
i |
R . |
(11) |
|
||||
V |
2 |
|
|
|
Молярная теплоемкость идеального газа при постоянном давлении равна
Cp = |
dQ |
= |
dU |
dV |
dV |
(12) |
||
dT |
dT |
+ p |
|
= CV + p |
. |
|||
|
|
dT p |
dT p |
|
||||
Первое слагаемое в правой части уравнения (15) представляет собой молярную теплоемкость CV . Второе слагаемое
dV |
= p |
d |
|
RT |
= R . |
||
p |
|
|
|
|
|
||
|
|
||||||
dT p |
|
|
|
p |
|
|
|
|
dT |
|
|
||||
Таким образом,
C p =CV + R .
Уравнение (14) называют уравнением Майера. С учетом (11), получим
C p = i +2 2 R .
(13)
(14)
(15)
С учетом (11) внутренняя энергия одного моля идеального газа определяется выражением
U =CV T . |
(16) |
3. Адиабатический процесс. Адиабатическим называется термодинамический процесс в теплоизолированной системе, при котором система не обменивается теплом с окружающими телами. В природе существует три вида теплообмена: теплопроводность, конвекция и излучение. I начало термодинамики для адиабатического процесса имеет вид
53
dU + pdV = 0. |
(17) |
Возьмем дифференциалы от выражений U =CV T и pV = RT :
dU =CV dT , |
pdV +Vdp = R dT . |
|
|
Подставив эти дифференциалы в (17), после преобразований получим |
|||
дифференциальное уравнение |
(CV + R)dV . |
|
|
dp = − |
|
||
p |
C |
V |
|
|
V |
|
|
Решением этого уравнения является функция |
|
||
pV γ = const , |
(18) |
||
где γ = Cp CV - показатель адиабаты. Уравнение (18) |
называется адиабатой |
||
Пуассона, которая связывает параметры идеального газа в адиабатическом процессе. Используя уравнение состояния идеального газа, адиабату Пуассона можно представить в виде
γ
pT 1−γ = const , TV γ−1 = const .
Показатель адиабаты идеального газа можно выразить через степени свободы молекул газа по формуле
|
|
|
|
γ = |
C p |
= |
i |
+ 2 |
. |
|
|
(19) |
|
|
|
|
C |
|
i |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
V |
|
|
|
|
|
|
|
3. Работа газа в изопроцессах. Изопроцесса- |
p |
|
|
|||||||||
ми называют процессы, в которых один из параметров |
|
|
|
|||||||||
состояния |
газа |
не |
изменяется: |
изотермический |
p |
|
|
|||||
(T = const ), |
изобарный |
( p = const ) |
и |
|
изохорный |
|
|
|||||
|
|
|
|
|||||||||
(V = const ). На диаграмме (p,V) эти изопроцессы изоб- |
|
|
|
|||||||||
ражены кривыми T, p и V (рис. 3). Кривой а на рисунке |
|
|
T |
|||||||||
отмечена адиабата, которая проходит круче, чем изо- |
V |
|
а |
|||||||||
терма. Найдем работу газа в этих процессах. |
|
|
|
|
||||||||
В изотермическом процессе T = const |
и давление |
|
Рис. 3 |
V |
||||||||
выражается формулой |
p = p1V1 V , где индексом 1 от- |
|
|
|||||||||
|
|
|
||||||||||
мечены начальные параметры. Тогда работа газа при |
|
|
|
|||||||||
изменении объема от V1 |
до V2 будет |
|
|
|
|
|
|
|
|
|||
V2 |
V2 |
p V |
V |
V |
|
A = ∫pdV = ∫ |
1 |
1 |
2 |
2 |
|
|
|
dV =p1V1 ln V |
= νRT ln V . |
||
V |
|
||||
V1 |
V1 |
|
|
1 |
1 |
В изобарном процессе p = const и работа равна
V2
A = ∫pdV =p∆V = p(V2 −V1).
V1
В изохорном процессе объем газа не изменяется и работа не совершается. 4. Погрешности измерений. Абсолютная погрешность определения
показателя адиабаты рассчитывается по формуле

54
∆γ = |
|
∂γ |
|
∆h + |
|
∂γ |
|
∆h = |
h2∆h1 |
|
+ |
h1∆h2 |
|
= |
h1 + h2 |
∆h , |
(21) |
||||
|
|
∂h1 |
|
1 |
|
∂h2 |
|
2 |
(h − h |
)2 |
|
(h − h |
)2 |
|
(h − h |
)2 |
|
|
|||
|
|
|
|
|
|
|
|
|
1 |
2 |
|
|
1 |
2 |
|
|
1 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
где ∆h = ∆h1 = ∆h2 = 0,5 мм – погрешность измерения разности уровней жидкости h1 и h2 в манометре, равная половине цены деления шкалы манометра.
Литература
1.Физический практикум. Механика и молекулярная физика. Под ред. В.И. Ивероновой. - М.: Наука, 1967, с. 203-206.
2.Савельев И.В. Курс общей физики. - М.: Наука, 1982, т1. С.277-282.
4.3.Лабораторная работа №6 «Определение коэффициента вязкости воздуха ме-
тодом Пуазейля» (для получения дополнительных баллов)
Цель работы. Экспериментально определить коэффициент внутреннего трения, рассчитать среднюю длину свободного пробега и эффективный диаметр молекул воздуха.
Приборы и принадлежности. Стеклянный баллон с жидкостью, закрытый резиновой пробкой, капилляр, водяной манометр, термометр, технические весы, химические стаканы, секундомер, резиновые шланги.
Описание установки
Экспериментальная установка (рис. 1) состоит из стеклянного баллона 1 с краном 3, заполненного на 3/4 водой. Баллон закрыт сверху резиновой пробкой, в которую вставлен капилляр 2, через который баллон сообщается с атмосферой, и стеклянная трубка, через которую баллон подсоединен при помощи шланга 6 к U- образному водяному манометру 5. Во время эксперимента кран 3 открывают и вытекающую из баллона воду собирают в стакан 4. Длина и диаметр капилляра указаны на установке.
Методические указания
Экспериментально коэффициент вязкости можно определить при по-
мощи формулы Пуазейля, согласно
Рис. 1

55
которой объем газа q, который, проходит через трубку малого диаметра (капилляр) радиуса r и длиной l при ламинарном течении под действием разности давлений ∆p на его концах за единицу времени определяется формулой
q = V |
= |
πr4 |
∆p , |
(1) |
t |
|
8lη |
|
|
где η - коэффициент вязкости газа.
Отсюда, если измерить время протекания t некоторого объема газа V через капилляр под действием перепада давлений ∆p , то его коэффициент вязкости
можно рассчитать по формуле
η = |
πr4t |
∆p . |
(2) |
|
8lV |
|
|
При этом предполагается, что длина капилляра достаточно мала, чтобы разность давлений газа ∆p на концах капилляра не влияла на плотность газа.
В настоящей работе разность давлений ∆p определяют при помощи водяного манометра: ∆p = ρвgh , где ρв = 998 кг/м3 - плотность воды, g - ускорение свободного падения, h - разность уровней в коленах манометра. Объем газа V
считают равным объему воды, вытекшей за время t из баллона V = m2 −m1 , где
ρв
m2 - масса стакана с вытекшей водой, m1 - масса пустого стакана.
С учетом сказанного, рабочая формула для расчета коэффициента вязкости приобретает вид
|
πρ ghr4t |
|
||
η = |
в |
|
. |
(3) |
8l(m |
−m ) |
|||
|
2 |
1 |
|
|
Среднюю длину свободного пробега молекул воздуха λ можно определить по формуле
λ = |
3η |
|
πµ |
|
, |
(4) |
|
ρ |
8RT |
||||||
|
|
|
|
||||
где R - универсальная газовая постоянная, Т - абсолютная температура газа, р - давление газа, µ - молярная масса газа (для воздуха µ = 0,029 кг/моль).
Эфективное сечение σ и эффективный диаметр d молекул газа можно определить по формулам
|
|
1 |
|
2 |
|
|
|
σ |
|
|
2 |
|
µRT |
|
|
|
|
σ = |
|
= |
|
µRT |
, d = |
= |
|
, |
(5) |
||||||||
|
|
|
3ηNA |
|
π |
π |
3πηNA |
|
π |
||||||||
2nλ |
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
где NA - постоянная Авогадро.
Порядок выполнения работы
1. Измерить давление р и температуру Т воздуха в лаборатории. Определить массу т1 пустого стакана № 1. Данные занести в таблицу.

56
2.Проверить уровень воды в баллоне. Вода должна быть залита на 3/4 объема баллона заранее с тем, чтобы ее температура была равна температуре окружающего воздуха.
3.Подставить под кран стакан № 2 и открыть кран. Через 10-20 с процесс истечения воды из крана установится, и показания манометра не будут изменяться. После этого быстро заменить стакан № 2 на стакан № 1, одновременно включить секундомер и определить разность уровней в коленах манометра h1.
4.После заполнения стакана примерно на 1/3, определить разность уровней в коленах манометра h2, закрыть кран 3 и одновременно выключить секундомер.
5.Снять показания секундомера t. В качестве показания манометра взять
среднее арифметическое h = 12 (h1 + h2 ) уровней в начале и в конце опыта. Результаты измерений занести в табл. 1.
6.Определить погрешности прямых измерений.
7.По формуле (3) определить коэффициент вязкости воздуха и погрешность косвенных измерений.
8.Убедится в том, что коэффициент вязкости воздуха определялся при ламинарном течении через капилляр. Для этого надо подсчитать число Рейнольдса
Re = ρudη , где u = πVr2t - средняя скорость течения газа по капилляру, d = 22 -
диаметр капилляра, ρ = pµ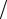 RT - плотность воздуха, η - коэффициент вязкости
RT - плотность воздуха, η - коэффициент вязкости
воздуха, определенный в эксперименте. Течение воздуха будет ламинарным, если Rе < 2000.
9.Опыт повторить 3 раза. Результаты измерений занести в табл. 1.
|
|
|
|
|
Таблица 1 |
|
|
|
|
|
|
|
|
№ |
h1, мм |
h2 , мм |
m2 , г |
η |
∆η |
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
p , Па |
|
T, К |
m1 , г |
|
|
10.Найти среднее значение коэффициента вязкости воздуха и его погрешность, как среднее арифметическое по всем измерениям.
11.По формулам (4) и (5) рассчитать среднюю длину свободного пробега λ и эффективный диаметр d молекул воздуха и их погрешности.
Вопросы для допуска
1.Сформулируйте и поясните цель работы.
2.Дайте определения вязкости газа, длине свободного пробега и эффективному диаметру молекулы.

57
3.Опишите экспериментальную установку и объясните назначение отдельных ее элементов.
4.Расскажите идею эксперимента.
5.Какие прямые измерения проводятся в данной работе и какими прибора-
ми?
6.Как производится измерение разности давлений воздуха в баллоне и снаружи в данной работе?
7.Изложите порядок выполнения работы.
8.Почему сразу после открытия крана напор вытекающей струи заметно уменьшается.
Контрольные вопросы и задания
1.Объясните механизм вязкости, диффузии и теплопроводности в газах с точки зрения МКТ?
2.Что такое средняя длина свободного пробега, среднее время между столкновениями и среднее количество столкновений молекул и как они связаны между собой?
3.Выведите выражение для средней длины свободного пробега молекул газа. Как она связана с параметрами газа?
4.Выведите формулы для вязкости, теплопроводности и диффузии газа исходя из МКТ.
5.Запишите общее уравнение для явлений переноса и прокомментируйте его.
6.Перечислите явления переноса и охарактеризуйте общие свойства явлений переноса.
7.Запишите формулу Пуазейля и объясните все входящие в нее величины.
8.Объясните, почему длина капилляра должна быть ограничена.
9.Объясните, почему при вытекании воды из баллона давление воздуха в нем уменьшается. Как это связано с размерами капилляра?
10.Как изменится время вытекания воды из баллона при изменении: а) размеров капилляра; б) уровня воды в баллоне; в) температуры окружающей среды?
11.Получите рабочие формулы для подсчета коэффициента вязкости, среднейдлины свободного пробега и эффективного диаметра молекул воздуха.
12.Выведите формулы для расчетапогрешностей косвенных измерений.
Приложение
1. Средняя длина свободного пробега молекул. Молекулы газа при движении сталкиваются между собой. Среднее расстояние, которое проходит молекула между двумя последующими столкновениями называется средней длиной свободного пробега λ. Будем считать, что концентрация молекул в газе n, все молекулы являются шариками диаметром d и движутся со средней скоростью  v
v . Перейдем в систему отсчета, в которой все молекулы неподвижны, а
. Перейдем в систему отсчета, в которой все молекулы неподвижны, а
одна движется со средней относительной скоростью  vom
vom  . Две молекулы
. Две молекулы
столкнутся, если траектория одной молекулы относительно другой будет проходить на расстоянии меньше, чем 2d. Между столкновениями молекула

58
движется прямолинейно. При каждом столкновении траектория молекулы резко изменяется и представляет собой ломаную линию. За время ∆t молекула
пройдет расстояние ∆S =  vom
vom  ∆t и столкнется с молекулами, которые находятся в объеме в виде ломаного цилиндра длиной ∆S с поперечным сечением σ = πd 2 , которое называется эффективным сечением молекулы. В этом объеме
∆t и столкнется с молекулами, которые находятся в объеме в виде ломаного цилиндра длиной ∆S с поперечным сечением σ = πd 2 , которое называется эффективным сечением молекулы. В этом объеме
находится |
∆N = vom nσ∆t молекул, с которыми |
произойдет столкновение. |
||||||||||||||||
Среднее |
|
число |
столкновений |
молекулы |
за |
одну секунду |
ν будет |
|||||||||||
ν = ∆N ∆t = vom nσ, а |
среднее |
время |
τ |
между двумя |
столкновениями |
|||||||||||||
τ = |
1 = |
|
|
1 |
|
. Умножив среднюю скорость |
|
v |
на время τ, найдем среднее |
|||||||||
|
v |
|
nσ |
|
||||||||||||||
|
ν |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
om |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
расстояние между двумя столкновениями |
|
v |
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
λ = |
v τ = |
|
|
. |
|
|
(6) |
|||
|
|
|
|
|
|
|
|
|
v |
|
nσ |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
om |
|
|
|
|
|
|
|
|
Рассмотрим две молекулы, скорости которых равны v1 и v2 . Относитель- |
|||||||||||||||||
ная |
скорость |
будет |
равна |
vom = v2 −v1. |
Модуль |
этой |
скорости |
|||||||||||
v2 |
= v2 |
− |
2v v |
+v2 |
. Среднее значение модуля относительной скорости будет |
|||||||||||||
om |
2 |
|
|
|
1 2 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
 vom
vom  =
= 
 2
2 v
v . Среднее значение второго слагаемого равно нулю из-за хаотиче-
. Среднее значение второго слагаемого равно нулю из-за хаотиче-
ского движения молекул. Подставляя это выражение в (6), найдем среднюю длину свободного пробега молекул газа
λ = |
|
1 |
. |
(7) |
||
|
|
|
||||
2nσ |
||||||
|
|
|
|
|||
2. Общая теория явлений переноса. Пусть некоторая величина G,
характеризующая средние параметры молекул газа (например, средняя энергия,
средняя скорость упорядоченного движения и т.д.) |
G |
|||
изменяется вдоль координаты х по некоторому зако- |
|
v |
||
ну G(x) |
(рис. 2). Из-за хаотического движения |
|
||
молекулы газа будут пересекать эту площадку и пе- |
|
|
∆S |
|
реносить величину G. В среднем количество |
|
|
||
|
|
|
||
молекул, пересекающих площадку ∆S с координа- |
|
|
|
|
той х, за время ∆t в противоположных направлениях |
|
|
|
|
одинаково и равно |
|
|
|
|
Рис. 2 |
x |
|
∆N = |
|
|
|
1 n v ∆S ∆t . |
|
||
|
6 |
|
|
Подробнее вывод формулы приведен в лабораторной работе № 4.1. Последний раз перед пересечением площадки молекулы столкнутся на расстоянии, равном
средней длине свободного пробега λ. При этом для молекул слева значение переносимой величины будет G(x − λ), а для молекул справа - G(x + λ). Т.к.
значение G по разные стороны площадки различное, то через площадку будет перенос величины G, поток которой найдем по формуле

59
∆G = ∆N(G(x − λ)−G(x + λ))= −13 n v
v λ dGdx ∆S ∆t .
λ dGdx ∆S ∆t .
Здесь знаками учтено направление потоков слева и справа, и то, что для малых λ справедливо приближенное выражение G(x ± λ)=G(x)± dGdx λ.
Основной характеристикой переноса является плотность потока qx , равная отношению потока к величине площадки и ко времени
qx = |
∆G |
= − |
1 n v λ dG . |
(8) |
||
∆S ∆t |
||||||
|
|
3 |
dx |
|
||
Формула (8) дает плотность потока вдоль оси х. |
Аналогичные формулы |
|||||
получаются для потоков qy и qz вдоль двух других координатных осей. Общая плотность потока будет определяться выражением
q = qxi + qy |
j + qzk = − |
1 n v λ G . |
(9) |
|
|
3 |
|
Уравнение (9) является основным уравнением в теории переноса. Из этого уравнения следуют основные законы явлений переноса:
−перенос величины наблюдается тогда, когда она неоднородна по пространству ( G ≠ 0).
−плотность потока переносимой величины пропорциональна ее градиенту (q ~ G ).
−поток переносимой величины направлен противоположно градиенту, т.е. на выравнивание ее значений.
3.Явления переноса. Явлениями переноса называются процессы, возникающие в системе вследствие нарушения равновесия и сопровождающиеся возникновением потоков тепла, массы, импульса и т. д. Примерами явлений переноса могут служить - диффузия, внутреннее трение и теплопроводность.
Диффузией называется взаимное проникновение веществ в различных смесях, обусловленное тепловым движением молекул.
Концентрации каждой компоненты стремятся выровняться, возникают потоки массы компонент, направленные в сторону выравнивания их концентраций. Плотность потока массы i-й компоненты вдоль оси х описывается законом Фика
j |
m |
= −D |
∂ρi |
, |
(10) |
|
|||||
|
|
∂x |
|
||
|
|
|
|
||
где D - коэффициент диффузии, ρi - плотности компонент смеси.
Теплопроводностью называется перенос тепла молекулами в процессе их теплового движения. Явление теплопроводности заключается в том, что средняя энергия хаотического движения молекул, которая пропорциональна температуре тела Т, передаётся при столкновениях молекул между собой. При теплопроводности плотность потока тепла вдоль оси х описывается законом Фурье

|
60 |
|
|
|
j = −χ |
∂T |
, |
(11) |
|
|
||||
T |
|
∂x |
|
|
|
|
|
|
|
где χ- коэффициент теплопроводности.
Внутренним трением называется свойство текучих тел (жидкостей и газов) оказывать сопротивление перемещению одной их части относительно другой.
Если при ламинарном (слоистом) течении газа или жидкости, какие либо
соседние слои движутся с |
некоторой |
скоро- |
z |
|
стью друг относительно |
друга, то |
обмен |
||
vy (z + dz) |
||||
молекулами между слоями приводит к обмену |
||||
τ |
||||
импульсами, в результате чего скорости слоев |
|
|||
выравниваются. Выравнивание скоростей от- |
|
|||
дельных слоев сопровождается превращением |
vy (z) |
|||
кинетической энергии упорядоченного движе- |
||||
|
||||
ния в энергию теплового движения. При |
|
|||
плоском течении газа вдоль оси у (рис. 3) меж- |
y |
|||
ду слоями возникает сила трения. Напряжение |
x |
|||
трения τ (сила трения, отнесенная к площади) в |
Рис. 3 |
|||
слое перпендикулярном оси z описывается законом вязкого трения Ньютона
τ = −η ∂∂vzy ,
где η - коэффициент вязкости (внутреннего трения), dvy  dz - градиент скорости
dz - градиент скорости
вдоль оси z. В СИ коэффициент вязкости измеряется в Па·с.
Согласно II закону Ньютона взаимодействие двух слоев можно рассматривать как обмен импульсами. Тогда плотность потока импульса j p будет
jp = −η |
∂vy |
. |
(12) |
|
∂z |
||||
|
|
|
Подставляя выражение для импульса G = mvy в общее уравнение переноса (8), получим
j |
p |
= −1 n v λ |
dm0vy |
= |
1 nm |
v λ |
dvy |
. |
(13) |
|
|
|
|||||||||
|
3 |
dz |
3 |
0 |
|
dz |
|
|||
|
|
|
|
|
||||||
Сравнивая (12) и (13), найдем выражение для коэффициента вязкости газа
η= |
1 |
< v > λρ, |
(14) |
|
3 |
|
|
где ρ = m0 n - плотность газа, m0 – масса одной молекулы.
4. Анализ коэффициентов переноса. Выпишем для сопоставления и анализа все три коэффициента рассмотренных явлений переноса:
D = 1 |
< v > λ, |
η= 1 |
< v > λρ, |
χ = |
1 < v > λρc |
(15) |
|
3 |
|
3 |
|
|
3 |
V |
|
|
|
|
|
|
|||
1. Определив по эмпирическим формулам коэффициенты D, η и χ, имеем возможность с помощью формул (14) вычислить среднюю длину свободного

61
пробега λ и диаметр d молекул. При этом следует иметь в виду, что полученные значения заметно зависят от того, на основании какого коэффициента их вычисляют.
Используя формулу (15), можно определить среднюю длину свободного пробега молекул воздуха. С учетом того, что
< v >= |
8RT |
, |
ρ = |
µp |
, |
(16) |
|
πµ |
RT |
||||||
|
|
|
|
|
где R - универсальная газовая постоянная, Т - абсолютная температура газа, р - давление газа; μ - молярная масса газа (для воздуха µ = 0,029 кг/моль), получим
|
|
|
|
|
λ = |
|
3η |
= |
3η |
|
|
πµ |
|
. |
|
|
|
|
(17) |
|||||
|
|
|
|
|
ρ |
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
ρ v |
|
|
8RT |
|
|
|
|
|
||||||||
Учитывая, что эффективное сечение молекул σ = πd 2 , из выражений (15) и |
||||||||||||||||||||||||
(17) получим формулу для определения диаметра молекул |
|
|||||||||||||||||||||||
|
|
|
|
|
= |
|
|
1 |
|
|
|
|
2 |
|
|
|
|
|
. |
|
||||
|
d = |
|
σ |
|
|
= |
|
|
|
µRT |
(18) |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
3πηN A |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
π |
|
2 |
πλn |
|
|
|
π |
|
|||||||||||||
2. |
Все три коэффициента, D, η и χ, с возрастанием температуры Т увели- |
|||||||||||||||||||||||
чиваются, так как < v > ~ |
T |
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
3. |
Посколькуλ~1 n , а n~ρ, то, как вязкость η, так и теплопроводность χ |
|||||||||||||||||||||||
не зависят от концентрации, а значит и от давления (при неизменной температуре).
5. Погрешности измерений. Абсолютные погрешности косвенных измерений рассчитываются по формулам:
коэффициента вязкости воздуха
∆η = |
|
∂η |
|
|
∆h |
+ |
|
∂η |
|
∆t + |
|
∂η |
|
∆m + |
|
|
∂η |
|
|
∆m |
= |
|||||||||||||||||||||
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||
|
∂h |
|
|
∂t |
|
∂m |
∂m |
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
2 |
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
2 |
|
|
|
|
(19) |
|||
|
|
|
∆h |
|
∆t |
|
|
|
|
|
|
|
|
∆m1 |
|
|
|
|
|
|
|
∆m2 |
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
h + t |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
= η |
|
|
|
|
+ (m |
−m ) + (m |
|
−m ) ; |
|
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
1 |
|
|
2 |
1 |
|
|
|
|||||||||||
среднего диаметра молекул: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
∆d = |
|
∂d |
|
∆T + |
|
∂d |
|
∆η= |
|
|
|
d |
|
∆T + 1 d |
∆η; |
(20) |
||||||||||||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||
|
∂T |
|
∂η |
|
|
4T |
|
|||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 η |
|
|
|
||||||||||||||||
средней длинны свободного пробега молекул |
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
∆λ = |
|
∂λ |
|
∆η+ |
|
|
∂λ |
|
|
∆T = |
λ |
∆η+ |
|
λ |
∆T . |
(21) |
||||||||||||||||||||||||||
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||
|
∂η |
|
|
|
∂T |
|
η |
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2T |
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Литература
1.Кортнев А.В., Рублев Ю.В., Куценко А.Н. Практикум по физике. - М,: Высшая школа, 1965, С. 121-122.
2.Савельев И.В. Курс общей физики. - М: Наука, 1982, т1. С.255-258; 400-416.
