
Эпизоотология туберкулёза крупного рогатого скота
Эпизоотический процесс при туберкулёзе животных
Как известно, эпизоотический процесс может возникать и развиваться только при наличии и взаимодействии трёх его звеньев: источника возбудителя инфекции, факторов передачи и восприимчивых животных, которые и являются движущими силами эпизоотического процесса [8].
Попадание возбудителя от его источника к здоровым животным осуществляется с помощью механизма передачи возбудителя инфекции — эволюционно сложившейся биологической приспособленности каждого вида патогенных микробов к определенным путям перемещения от источников возбудителя. При этом выявляется зависимость между механизмом передачи и клинической формой болезни (легочный туберкулез при воздушно-капельной передаче и туберкулез кишечника при алиментарном заражении).
Факторы передачи M. bovis весьма разнообразны: вдыхаемый воздух, корм, молоко и обрат, вода. Патогенные микробы попадают в корма и воду с выделениями больных животных (в том числе с экскретами грызунов), с навозом, почвой. Перезаражению животных способствует использование общих кормушек, водопойных корыт. Трупы животных, погибших от болезней, возбудители которых длительное время сохраняются во внешней среде, к которым относиться и туберкулез, также являются одним из важных факторов передачи возбудителя инфекции. Неправильная и несвоевременная уборка таких трупов ведет к заражению почвы, воды и надолго делает опасным использование больших участков пастбищ, водоемов. Следует также учитывать, что дикие плотоядные, собаки, хищные птицы могут растащить контаминированные останки животных на значительные расстояния
На возникновение и течение эпизоотического процесса существенное влияние оказывают и его вторичные факторы: природно-географические, хозяйственно-технологические, социально-экономические и др. Первичные и вторичные факторы совместно обуславливают непрерывность развития эпизоотического процесса.
На основании многолетних наблюдений за распространением туберкулеза крупного рогатого скота, обследования эпизоотических очагов и проведения производственных экспериментов позволили С. А. Джупине (2001; 2007) [15; 16] отнести туберкулез крупного рогатого скота к факторным инфекционным болезням с эстафетной передачей возбудителя инфекции. Это значит, что возбудитель инфекции, как облигатный микроорганизм, переживает в организме клинически здоровых животных, которые при определенных обстоятельствах (факторов) заболевают. Такое переживание характеризуется продолжительным скрытым микробоносительством, сравнительно непродолжительным периодом тяжелого переболевания, сенсибилизацией организма и, соответственно, возможностью в определенные сроки аллергически диагностировать болезнь. Для болезней этой группы свойственна как горизонтальная, так и вертикальная передача возбудителя инфекции. При этом потомство, как правило, длительное время клинически не болеет и весьма часто даже не реагирует на введение аллергенов.
Как указывает автор, весьма важным фактором распространения туберкулеза крупного рогатого скота являются интродукции скрытых носителей возбудителя инфекции в благополучные стада. В этом случае в период развития вспышки эпизоотическая ситуация формируется горизонтальной передачей возбудителя инфекции. [15; 16].
В.В. Макаров (2001) [26] основным инструментом изучения закономерностей развития эпизоотического процесса называет эпизоотологический метод исследования – это совокупность разнообразных методических приемов и способов, объединенных на основе единства предмета исследования - заболеваемости и предназначенный для обеспечения наиболее полной и всесторонней характеристики этого предмета как комплексного явления биологической и социальной природы. Целью эпизоотологического метода исследования является обоснование, проверка, всестороннее доказательство эпизоотологических проблем, в частности, оценка эпизоотологического риска и в конечном итоге обоснование мероприятий по профилактике, снижению и ликвидации заболеваний и определение их эффективности.
Эпизоотологический метод предусматривает применение ряда приемов – аналитические, математические, описательно-оценочное. К последним, в частности, относятся сравнительно-географическое и сравнительно-историческое исследование.
Сравнительно-географическое исследование имеет поисковый характер и используется в самых разных масштабах – от областного до уровня отдельных хозяйств. Этот прием позволяет выявить различия в обстановке, в особенностях проявления эпизоотического процесса. Исходя из позиции нозогенности (свойств территории, обеспечивающих реализацию предпосылок возникновения и распространения инфекции), обеспечивается комплексная оценка территории с использованием многочисленных характеристик. Отсюда вытекает возможность и целесообразность применения методов картографического и информационно-логического анализа. Поэтому сравнительно-географическое описание иногда называют анализом пространственных систем. Вначале необходимо изучить закономерности территориального распространения, установить ареал, а затем искать причины, обуславливающие эти закономерности в проявлении болезни [29].
Констатируя различия в эпизоотической обстановке, некоторые авторы связывают их с особенностями природно-климатических условий и хозяйственно-экономическими факторами.
А. А. Ткаченко [43] на примере Ровенской области Украины показал, что в Полесье с торфянистыми почвами, в отличие от лесостепной зоны, регистрировали лишь единичные случаи болезни.
В Саратовской области Н. А. Александров [1, 2] отмечал наиболее сложную эпизоотическую обстановку в хозяйствах с преобладанием чёрно-пестрого скота. По мнению автора, такая распространенность болезни объясняется завозом зараженного скота на фоне слабого контроля инфицированности и неблагоприятных условий содержания и кормления.
Необходимо признать, что существуют территориальные различия обстановки по туберкулёзной инфекции, оцениваемой по основным эпизоотологическим показателям: количеству неблагополучных пунктов и заболеваемости животных. Эти различия проявляются при сравнении ситуации на территориях самых разных масштабов – от крупных регионов до отдельных хозяйств. Причины различий неоднородны, при этом имеет значение обширный комплекс природно-хозяйственных условий. Зачастую учитываются лишь отдельные факторы, что затрудняет интерпретацию полученных данных, в связи с этим методика сравнительно-географического описания должна совершенствоваться.
Сравнительно-историческое описание – также необходимый прием эпизоотологического исследования. Ретроспективное изучение проявлений эпизоотического процесса может проводится как для крупного региона страны, так и для отдельных хозяйств. Выявление закономерных изменений в многолетней динамике показателей, характеризующих ситуацию, существенно расширяет возможности эпизоотологического анализа.
Ретроспективное изучение проявлений эпизоотического процесса связано с определёнными трудностями. При туберкулёзной инфекции возникает необходимость учёта многих обстоятельств, связанных с особенностями болезни. Изменяются качество и эффективность диагностических, профилактических, организационно-хозяйственных мероприятий, критериев учета неблагополучия.
Важнейшее значение для исследования особенностей периодичности и сезонности эпизоотий, т. е. для выявления закономерностей развития эпизоотического процесса при туберкулёзе, имеет анализ его динамических показателей. Статистическая зависимость, какой бы она ни была выраженной, никогда не может установить причинной связи между периодичностью и заболеваемостью животных.
Поэтому многие исследователи не ограничиваются изучением динамики проявлений эпизоотического процесса, а дополнительно к нему проводят целенаправленное обследование неблагополучных хозяйств, объективно оценивая гипотезы, возникшие в процессе исследования.
Существует большое количество работ, в которых авторы отмечали цикличность эпизоотического процесса, основываясь на данных ретроспективного анализа соответствующих показателей.
А. И. Кузиным [23; 24] установлено, что в Волгоградской области подъемы интенсивности эпизоотического процесса при туберкулёзе повторяются через 3,5–4,5 года. Выборочное эпизоотическое обследование хозяйств показало, что причиной таких подъемов является активация туберкулёза у животных после длительного течения инфекции в форме латентного микробизма.
А. А. Щеткин [53] отмечал 8–9-летнюю цикличность эпизоотического процесса в Курганской области. Автор констатирует, что повышение уровня чувствительности АДП приводит к сохраняющемуся в течении трех лет увеличению выявляемости больных животных. В последующие 5–6 лет выявляемость крупного рогатого скота с помощью туберкулиновой пробы снижается.
В Новосибирской области Н. А. Шкиль [52] также было установлено наличие 9-летнего цикла колебаний интенсивности эпизоотического процесса, при этом каждый новый цикл начинался с уровня, превышающего показатели предыдущих циклов. По мнению автора, очередные подъемы заболеваемости происходят вследствие проявления туберкулёза у оставшихся в якобы оздоровленных стадах животных с латентной формой инфекции.
И. И. Гуславский и В. М. Фомин [10] обнаружили сходство динамики заболеваемости в двух пограничных областях Западно-Сибирского региона Российской Федерации. Подъемы и спады заболеваемости чередовались с интервалами в 4–6 лет. Приведенные данные свидетельствуют о заметных изменениях интенсивности эпизоотического процесса при туберкулёзе крупного рогатого скота с интервалами от трех до десяти лет.
В. П. Урбаном [42] при изучении динамики показателей заболеваемости и выявления неблагополучных пунктов в Нечерноземной зоне не отмечено никакой строгой закономерности колебаний выявляемости неблагополучных пунктов.
А. Ф. Ильясов [20; 21], проанализировав изменения показателей заболеваемости животных туберкулёзом в Уральской области, сделал вывод, что в хозяйствах молочного направления заболеваемость варьировала в пределах 3–8 % к общему поголовью, а в отдельные годы резко возрастала. В хозяйствах мясного направления заболеваемость была значительно ниже – 1,2–1,4 % и постепенно снижалась.
Анализируя изменения обстановки по туберкулёзу крупного рогатого скота, некоторые исследователи учитывали показатель очаговости, отражающий число заболевших животных в расчете на один неблагополучный пункт.
Значительное количество неблагополучных пунктов при относительно низкой заболеваемости в 60–70‑е годы было связано с ростом масштабов диагностических исследований, с выявлением и регистрацией очагов в населенных пунктах [32; 36]. Такое соотношение заболеваемости и числа неблагополучных пунктов обусловило низкие показатели очаговости.
По данным А. И. Кузина [24] показатели выявления туберкулёза на мясокомбинатах в отдельные годы варьируют в значительных пределах, но все же медленно снижались. При этом результаты аллергических и послеубойных исследований крупного рогатого скота коррелировали.
Уменьшение патологоанатомических изменений при диагностических убоях объясняется улучшением диагностики, более частым латентным течением инфекции, ранним убоем реагирующих животных.
А. А. Щеткин [53], анализируя данные по Курганской области, указывал на преобладание положительной корреляции между показателями заболеваемости по данным аллергических исследований и числом случаев обнаружения туберкулёза у убойного скота. В районах с наиболее сложной эпизоотической ситуацией по туберкулёзной инфекции такой взаимосвязи показателей не было.
С помощью ретроспективного анализа многолетней динамики проявлений эпизоотического процесса при туберкулёзной инфекции исследователи учитывали все данные официальной ветеринарной статистики: уровень диагностических исследований, заболеваемость, количество имеющихся, вновь выявленных и оздоровленных неблагополучных пунктов, уровень передержки больного скота, данные статистики о регистрации случаев обнаружения патологоанатомических изменений. Использовали также комбинированные показатели очаговости, отражающие число заболевших животных в расчете на один неблагополучный пункт.
Одним из важнейших характеристик эпизоотического процесса при туберкулёзе, количественно и качественно оценивающим его и существенно расширяющим информативность исследований, является скорость эпизоотического процесса в период развития эпизоотии. Г. А. Объедков [31] В. Е. Симбирцев с соавт. [37] отмечали, что в целях прогнозирования динамики эпизоотического процесса и объективной оценки ситуации необходимо учитывать весь комплекс доступных показателей и иметь единые критерии их оценки.
Некоторые исследователи рекомендуют дифференцировать хозяйства, неблагополучие которых связано с заносом болезни, от хозяйств, для которых характерно повторное возникновение туберкулёза. С. И. Джупина [14] предложил разделить неблагополучные пункты на две «эпизоотологические категории»: вновь выявленные и стационарно неблагополучные.
Эпизоотологическое обследование также должно давать ответ на вопрос о путях заноса болезни. По данным А. И. Кузина [23], занос туберкулёзной инфекции в благополучные хозяйства происходит преимущественно при вводе племенного молодняка, с необезвреженным обратом, молоком, при контакте с животными неблагополучных стад.
Отличительным признаком заноса туберкулёза с молоком и обратом, как отмечают А. И. Кузин [24] и А. Ф. Филимонова [49], является первичное выявление реагирующих животных среди телят и телок. Значение молока и обрата как главных факторов передачи возбудителя туберкулёза животным указанных возрастных групп является общепризнанным. Некачественная пастеризация сборного обрата, поступающего в благополучные хозяйства, может привести к быстрому и широкому распространению инфекции.
О вспышках туберкулёза, связанных с заражением животных на пастбищах, свидетельствуют данные выявляемости реагирующих животных в летний период, а чаще при осенних диагностических исследованиях с помощью кожного теста (туберкулинизации).
Существенное значение инфицированных пастбищ, водоемов и других объектов внешней среды как факторов передачи возбудителя болезни также общепризнано и во многом обусловлено высокой устойчивостью МБТ во внешней среде.
По данным П. М. Тихонова [42] в летний период эпизоотическое значение имеют зараженные водоисточники, в которых возбудитель туберкулёза может сохранятся до 23 месяцев.
В. П. Урбан [48] и Н. И. Прокопьева [34] экспериментально доказали возможность выноса возбудителя туберкулёза из почвы растениями. По мнению авторов это происходит за счёт мельчайших почвенных частиц, обнаруживаемых в пазах растений.
Учитывая многократную «рецидивность» туберкулёза, давность неблагополучия, высокий уровень заболеваемости, ряд ученых [5; 19; 22] рекомендуют проводить оздоровление хозяйств методом полной замены поголовья. Однако риск повторных вспышек туберкулёза полностью не устраняется в хозяйствах, оздоровленных методом полной замены поголовья крупного рогатого скота.
Указываются и конкретные причины новых заносов болезни, не полное освещение данных эпизоотического состояния соседних хозяйств, зараженность пастбищ и водоемов патогенными микобактериями, а также инфицированность скота частного сектора и пр. [38; 50; 70].
Контроль за эпидемической ситуацией по туберкулёзу ведётся с помощью периодических контрольно-диагностических убоев реагирующих на туберкулин фермерских животных, отлова и убоя барсуков и оленей. Таким образом в период с 1935 по 1993 гг. число реагирующих животных на кожный тест среди фермерских животных сократилось с 40 % до 0,06 %
По обобщающим данным на начало 2000 года на территории СНГ в неблагополучных по туберкулёзу хозяйствах ежегодно положительно реагировали на туберкулин 25–27 тыс. животных, а прирост заболеваемости туберкулёзом крупного рогатого скота составляет 24 %, что в 2,7 раза больше чем среди населения [37], хотя эпидемиологическая ситуация по туберкулёзу в странах СНГ оставалась крайне сложной и угрожающей. За 1990–1998 гг. заболеваемость всеми формами туберкулёза увеличилась на 72,5%, причем заболеваемость сельского и городского населения в последние годы равна. И в настоящее время туберкулёз является одной из самых распространенных инфекционных заболеваний.
Дикие животные как резервуар возбудителя туберкулеза
Источники возбудителя инфекции и пути заноса инфекционного начала в благополучные или оздоровленные хозяйства многочисленны и разнообразны. Это связано с широким кругом восприимчивых к туберкулёзу животных (сельскохозяйственные, домашние, дикие), представляющих первое звено эпизоотической цепи. Не менее важны высокая устойчивость и длительное сохранение возбудителя во всех объектах внешней среды, которые служат факторами передачи. Этим объясняются возникающие при эпизоотологическом обследовании трудности. Множественность и разносторонность возбудителя инфекции часто делают невозможным не только предвидение возникновения болезни, но и как отмечал В. П. Урбан [48], установления путей заноса её на ферму.
При эпизоотологическом обследовании неблагополучных пунктов необходим сбор сведений о разнообразии фауны на прилегающей территории, данных о видовом составе и численности диких животных, о фактах регистрации у них туберкулёза.
Anon [58], J. A. Brown et al. [60] напоминают, что M. bovis – инфекция, опасная как для животных разных видов, так и для людей и является проблемой Европейского Союза и персистирует у рогатого скота на территориии Испании, Англии и Ирландии.
Как указывают Бусол В.О. и Мазур В.М. (2012) [6], aналитические исследования показывают, что эволюционный процесс в царстве болезнетворных микобактерий продолжается в направлении повышения паразитизма и расширения круга восприимчивых биологических объектов, как среди млекопитающих, так и холоднокровных, беспозвоночных, насекомых и других живых существ. Это обусловливается миграцией микобактерий в антропогенной и дикой фауне, функционированием трофических связей на разных уровнях биоценоза. В пищевых цепях дикой фауны микобактерии туберкулеза мигрируют от травоядных и хищников, птиц, беспозвоночных, в абиотичную среду и, как следствие, их выделяют из торфа, комбикормов, силоса, почвы выгульных площадок неблагополучных по туберкулезу ферм крупного рогатого скота.
Инфицированные и больные туберкулёзом обитатели дикой фауны способствуют передаче возбудителя инфекции из природных резервуаров (барсуки, олени) рогатому скоту животноводческих ферм. Дикие олени и другие обитатели дикой фауны являются постоянной угрозой заноса туберкулёзной инфекции [62]. Заслуживает внимание сообщение о случаях туберкулёза у диких кабанов. Исследования А. К. Стародыновой [40] показали, что дикие свиньи восприимчивы к туберкулёзу бычьего вида и при большой плотности инфицированных животных этой популяции могут иметь существенное эпизоотологическое значение.
На протяжении многих десятилетий в Англии, Австралии, Новой Зеландии и других странах ветеринарные службы не могут обеспечить разрыв эпизоотической цепи вследствие невозможности контролирования природного источника возбудителей туберкулёза – грызунов (барсуков, хомяков и опоссумов). В государственные программы этих стран в обязательном порядке входят мероприятия по уменьшению популяций этих животных, иммунизация их вакциной БЦЖ [77].
На основании исследований, проведенных с 1980 по 1996 гг. учеными J. D. Coleman, M. M. Cooke, R. Jackson [63] установлено, что существует корреляционная зависимость между течением туберкулёзной инфекции в стадах рогатого скота животноводческих ферм и популяциях опоссумов: число инфицированных и больных туберкулёзом M. bovis на животноводческих фермах и в популяции опоссумов в процентном отношении равны.
В Новой Зеландии, на острове Хохотака проведено изучение возможности занесения возбудителя туберкулёза бычьего вида от опоссумов рогатому скоту. Изучив процент зараженности природного резервуара (опоссумов) M. bovis, степень инфицированности стад рогатого скота ученые J. M. Kean, N. D. Barlow, G. J. Hickling [68] пришли к выводу, что от опоссумов заражение скота происходит в 20 % случаев.
Ирландскими учеными G. O. Denny, J. W. Wilesmith [64] изучались механизмы передачи возбудителя туберкулёза M. bovis, инфицированность возможных источников возбудителя инфекции в природных очагах (барсуки) и пути занесения возбудителя M. bovis в стада крупного рогатого скота. Было доказано, что возможность заражения скота от барсуков, инфицированных возбудителем туберкулёза бычьего вида значительно преувеличена, но сбрасывать её со счетов нельзя.
Сполиготипирование микобактерий, проведенное в конце ХХ века в Испании, позволило установить идентичные сполиготипы у кабана, оленя и крупного рогатого скота, что предположительно может свидетельствовать как о межвидовой передаче M. bovis, так и наличии резервуара возбудителя в дикой природе. [73]
Межвидовая передача M. bovis среди диких (оленей и барсуков) и сельскохозяйственных животных (крупный рогатый скот, овцы, козы и свиньи) также была установлена в Ирландии, а передача между крупным рогатым скотом и дикими кабанами подозревалась в северной Италии
RJ Delahay [at all.] (2013) [69] описывают эпизоотологические тенденции развития инфекции M.bovis в популяции барсука в дикой природе. Данные были получены авторами путем исследования клинических проб от 1803 барсуков микробиологическими и серологическими методами на протяжении 24 лет. При этом было сделано вывод, что заболеваемость животных и распространенность возбудителя увеличивается с течением времени, что подтверждается увеличением частоты положительных серологических тестов. Риск развития серологических реакций увеличивался с возрастом барсуков, и изменялся сезонно. Доказательством высокой вирулентности возбудителя туберкулеза авторы считают установленное развитие инфекционного процесса у детенышей барсука
Данные о роли барсуков и опоссумов Великобритании и Новой Зеландии соответственно, как резервуарных хозяев возбудителя туберкулеза крупного рогатого скота в дикой природе приведены и в сообщениях C.M.O’Connor [atall.] [72] и WD Walter [at all.] [74]. Также авторы, наблюдая за местами обитания вирджинского опоссума и енота в северной части полуострова штата Мичиган при помощи GPS-технологии, установили, что уровень инфицированности этих животных M.bovis на неблагополучных фермах был достаточно высоким, тогда как в благополучных только один опоссум дал положительный результат. Также распространенность опоссума в хозяйствах, где КРС реагировал на введение туберкулина, была выше, чем в хозяйствах, в которых у скота таких реакций не наблюдали.
Кроме, того, большинство исследований из Мичигана (США), отмечали корреляционную зависимость между сосредоточенностью и высокой плотностью белохвостых оленей и скоростью передачи M. bovis крупному рогатому скоту при выпасании их на общих пастбищах [74].
Представляют интерес появившиеся в последние годы сообщения о инфицированности M. tuberculosis слонов, содержащихся в зоопарках США. На протяжении 1994-2006 гг. в США от этих животных получено 36 культур возбудителя [66]. Кроме того, 2010 году в австралийском зоопарке у клинически здоровых азиатских слонов были выделены микобактерии туберкулеза человеческого вида, а через год в этом же зоопарке, туберкулез установлен у шимпанзе. При этом среди обслуживающего персонала носителей М.tuberculosis выявлено не было. При этом авторы констатируют, что механизм передачи возбудителя туберкулеза в системе человек–слон–шимпанзе требует дальнейшего изучения. [75]
В работе V.Obanda[atall.] (2013) сообщается о первом случае фатального туберкулеза у африканского слона старше 12-ти лет в дикой природе (национальный парк Тсабо, Кения). Инфицирование этого животного микобактериями туберкулеза было подтверждено и гистологические исследованиями. Этот случай уникален тем, что за время своей жизни слон имел контакт как с людьми, так и дикими слонами. Полученные результаты свидетельствуют, что дикие слоны могут поддерживать резервуар возбудителей туберкулеза человека в дикой природе [67].
Необходимо отметить , что инфицирование слонов M.bovisвсречается значительно реже. [76].
G Zanella [at all.], указывают, что в 2011-2002 гг. было диагностировано заражение оленя и дикого кабана в дикой природе Франции. Проведенное моделирование развития эпизоотического процесса в популяциях этих животных, позволило сделать вывод, что источником передачи M. bovis в этой области явились инфицированные отходы пищи, оставленные охотниками а наиболее реалистичным сценарием управления эпизоотическим процессом будет депопуляция этих животных [70].
Комплексным методом диагностики (эпизоотологическим, клиническим, патологоанатомическим, бактериологическим) с последующим выделением и идентификацией возбудителя туберкулеза у пятнистых уссурийских оленей был зарегистрирован туберкулез крупного рогатого скота и в Калининградской области [13]. В 52,9% случаев установлен аэрогенный путь заражения, в 23,0% -алиментарный. Основными причинами, способствующими распространению туберкулезной инфекции в стаде рогачей явились: длительное использование несменяемых пастбищ; несоответствие нормы площади пастбищ на 1 животное; длительная эксплуатация рогачей как основного производителя пант; снижение защитных сил организма из-за действия различных стресс-факторов, в том числе антропогенных.
Как указывают Бусол В.О., Мазур (2012) [6], одной из экологических ниш для микобактерий туберкулеза среди беспозвоночных являются дождевые черви и личинки майского жука. Циркуляции микобактерий туберкулеза способствуют некоторые виды иксодовых и аргасовых клещей.
На возможность трансмиссивного пути передачи микобактерий указывает В.А. Поляков [33]. По данным Я.А. Благодарного и соавт. [4] в организме зараженных клещей микобактерии человеческого вида сохраняются снижая свою вирулентность более 2 лет, а птичьего – 5 лет. Особенностью такого естественного резервуара микобактерий является то, что последние передаются через все фазы развития клещей в процессе метаморфоз - от личинок до половозрелой формы.
Важным для понимания экологии микобактерий и эпизоотологического значение водоемов является исследование, результаты которого доказывают, что у личинок кровососущих комаров наблюдается трансфазовая передача атипичных микобактерий, а сами они являются хорошей средой для развития и сохранения микобактерий в природе [33]. Учитывая, что личинки этих насекомых развиваются в водоемах, расположенных вблизи животноводческих помещений и на пастбищах, они, в том числе и контаминированные микобактериями, через воду могут попадать в организм животных и птиц.
В А. Бусола и соавт. [6] интересовало участие других бионтов водоемов в поддержке эпизоотического неблагополучия сельскохозяйственных животных по туберкулезу. Предыдущие эпизоотологические исследования ориентировали авторов на целесообразность поиска природного резервуара M. bovis среди ондатр внутренних водоемо на Украины. При проведении патологоанатомического вскрытия отловленных ондатр патологических признаков туберкулезного процесса не было выявлено. Однако, при посеве суспензии из внутренних органов животных на плотную питательную среду обнаружены первичные признаки роста микобактерий на 50 сутки. Зрелые колонии микроорганизмов имели шаровидную форму, цвет слоновой кости с гладкой поверхностью. Микроскопически микроорганизмы изолята имели прямые, короткие, толстые, рубиново-красные палочки, расположены поодиночке или скоплениями. Фенотипические признаки микобактерий были характерны для M. bovis. Идентификацию микобактерий полученного изолята проводили в биопробе. Полученные данные биопробы подтвердили высокую вирулентность микобактерий, изолированных от ондатр, но не позволили установить вид микобактерий по официально определенной методике. Способность исследуемых микроорганизмов вызвать интенсивное развитие туберкулезного процесса у всех видов лабораторных животных указывает с высокой долей вероятности, что их можно считать патогенными и для человека. Данные полимеразной цепной реакции микобактерии исследуемого изолята позволили отнести их к M. bovis.
Развитие эпизоотической ситуации по туберкулезу
В этом подразделе мы уделили значительное внимание историческим аспектам состояния эпидемической и эпизоотической ситуации по туберкулезу, поскольку эти данные имеют важное значение для понимания тенденций развития заболевания и представляют интерес для фтизиатров как в гуманной так и ветеринарной медицине, но недоступны широкому кругу специалистов.
История эпидемии туберкулеза
Изучение материалов публикаций о возникновении и распространении туберкулеза среди людей и животных [11; 25; 35; 44; 45; 46] указывает на многогранность и туберкулеза как инфекции и давность его возникновения. Придерживаясь этого постулата Т.М. Даниел и соавт. (2002) [12] обращают внимание на эпоху палеолита, когда люди вели кочевой образ жизни, не создавали постоянных и больших сообществ. В этот период заболевание людей туберкулезом, подобно другим инфекциям, были спорадическими и не приобретали характера эпидемий. Примерно за 8000 дет до н.э. с появлением примитивного сельского хозяйства стали возможными более постоянные поселения и началось приручение скота (коровы, овцы, свиньи). По всей вероятности, туберкулез в таких поселениях стал несколько более частым явлением. По некоторым подсчета, минимальный коллектив, в котором возможно развитие эпидемии туберкулеза, должен объединять от 180 до 400 людей. Можно также предположить, что эпизоотии туберкулеза происходили у животных задолго до возникновения этого заболевания у человека, а микобактерии бычьего типа были возбудителями первых случаев туберкулеза людей. В то же время, инфицирование M.tuberculosisвыявлено у всех приматов, а это позволяет предполагать возможность заражения ими еще предков, общих для человека и человекообразных обезьян.
Эпидемии туберкулеза начались по всему земному шару в результате перемещения больных европейцев и колонизации отдаленных стран [65]. В XVIIIи началеXIXвека распространение туберкулеза достигло пика в Западной Европе и США, когда туберкулез стал ведущей причиной смертности [59].
Важно констатировать, что туберкулез оставался не столь распространенным заболеванием в Феодальной Европе до тех пор, пока не сложились соответствующие условия окружающей среды, вызвавшие эпидемию, получившую название «Большая белая чума» [61]. В начале XVIIв. заболеваемость туберкулезом в Англии стала быстро увеличиваться, а в последующие два столетия эпидемия нарастала и захватила всю западную Европу. В течении данного периода почти все население континента было инфицировано возбудителем туберкулеза, а каждый четвертый случай смерти был вызван этим заболеванием. Плотность населения в постоянно растущих городах того времени увеличивалась, чему способствовал аэрогенный путь распространения возбудителя инфекции.
Необходимо отметить, что к 1880–му году туберкулез редко встречался в России, он был нехарактерен для Индии того периода. До 1908 года заболевание почти не было известно в глубинных районах Африки южнее Сахары, до 1920-го года – в Новой Гвинее.
Эмигранты из Европы привезли туберкулез и в Северную Америку. В первые годы XIXвека смертность в больших городах Америки составляла 650-750 случаев на 100 тыс. жителей, в последующие годы этот показатель последовательно уменьшался и к 1860-1870-м годам снизился в 1,5-2 раза. Это может быть связано со сменой поколений восприимчивых к туберкулезу особей на более устойчивых к этой инфекции.
В настоящее время туберкулез человека достаточно широко распространен в Восточной Европе, Азии, Африке, и Южной Америке.
Эпизоотическая ситуация по туберкулезу животных в Европе и мире на рубеже XIX – XX веков
В монографических работах и научных статьях, а также информационной статистике ветеринарных служб и боенских предприятий разных стран [7, 9, 35, 44] и др. авторов представлены обширные данные о распространении преимущественно туберкулеза крупного рогатого скота.
Ф. Гутира и И. Марек (1910) [11], обобщив многие публикации о распространении болезни в последние 10 лет XIXвека и в началеXXвека, делают вывод, что распространение туберкулеза среди крупного рогатого скота и свиней в значительной степени зависит от развития животноводства. Этому способствовали в первую очередь скученность скота в помещениях, практически полное его стойловое содержание, а также высокая скорость роста и скороспелость животных. Авторы делают акцент на роли активных перемещений животных из стада в стадо. Подтверждением этому является тот факт, что на пастбищах Северной Америки, в Центральной Африке, на многих островах (Исландия, Сицилия) туберкулез практически отсутствует. В восточной части Европы болезнь также встречалась крайне редко среди степного скота. В то же время в центральных и западных странах континента среди крупного рогатого скота разных пород, и особенно в наиболее плотно населенных местностях, вблизи больших городов, заболевание стало стационарным и имело значительную скорость распространения.
Было констатировано, что наиболее часто туберкулезом болели животные крупных хозяйств, тогда как в мелких хозяйствах, а также среди молодого скота, который выпасался на горных пастбищах, оно появлялось гораздо реже. Среди степного скота, который постоянно находился на выпасе, болезнь регистрировалась как исключение, чего нельзя сказать о рабочих волах.
Было также отмечено, что у свиней туберкулез стали чаще наблюдать после того, как возникли крупные молочные товарные фермы и собранное молоко из которых стали в больших количествах скармливать свиньям. Среди других домашних животных туберкулез встречался реже, за исключением птицы.
В 1880-1905 годах туберкулез крупного рогатого скота приобрел такое распространение и проявление, что стал негативно влиять на воспроизводимость стада и из ветеринарной проблемы превратился в экономическую и социальную. Это связано с тем, что прямо пропорционально распространению туберкулеза уменьшается средняя продолжительность продуктивной жизни животных вследствие вынужденной выбраковки больных животных. В этих условиях все труднее стало выращивать молодняк связи с увеличением его заболеваемости туберкулезом. У больных коров снижались надои, а исхудание животных снижало их индивидуальную ценность. Недопущение в пищу мяса больных животных само по себе обуславливало значительный экономический ущерб и снижало благосостояние нации.
Наиболее полная оценка распространения туберкулеза крупного рогатого скота на то время была проведена в Германии. Полагаясь на данные KaiserlиGesundheitsamt, Ф. Гутира и И. Марек [11] указывают, что в 1888-1889 годах клинически заболевание проявлялось у 2-8% исследуемого скота, а при исследовании мясо туш туберкулезные поражения встречались еще чаще. В 1895-1897 годах на бойнях Саксонии, Пруссии и Баварии 13,1% забитого скота имели туберкулезные поражения. Из 353 162 голов забитого крупного рогатого скота, имевшего клинические признаки туберкулеза, мясо 18 322 туш было допущено в пищу в специальных магазинах (Fraebank) в стерилизованном виде, 9 705 туш не были допущены в пищу, а среднегодовой экономический ущерб от туберкулеза крупного рогатого скота составлял 6,5 млн. марок.
В этот период в вышеназванных регионах при забое свиней туберкулезные поражения выявлялись у 1,22% туш, причем в пищу не допускалось мясо около 2 600 свиней, а 40 000 разрешалось реализовывать в сети Fraebank. По подсчетам аналитиков, убытки от заболевания свиней туберкулезом достигали 1,75 млн. марок в год.
Авторы(1910) приводят данные заболеваемости туберкулезом домашних животных (табл.5), которые указывают, что наиболее широкое распространение туберкулеза в начале ХХ столетия в Германии было среди взрослого поголовья крупного рогатого скота, на втором месте – свиньи, на третьем – козы и собаки, на четвертом – телята, на пятом – лошади.
Таблица 5. Выявление туш, пораженных туберкулезом в Германской империи (% от обследованных) (Ф. Гутира и И. Марек (1910) [11])
|
Годы |
КРС |
телята |
свиньи |
овцы |
козы |
лошади |
собаки |
|
1904 |
17,89 |
0,26 |
2,46 |
0,20 |
0,69 |
0,15 |
0,86 |
|
1905 |
19,16 |
0,30 |
2,78 |
0,20 |
0,76 |
0,16 |
- |
Подтверждением широкого распространения туберкулезной инфекции в Германии также свидетельствуют данные туберкулиновой пробы. Так, в Саксонии за период 1891-1897 гг. процент реагирующих животных колебался от 57 до 84. При этом специфичность туберкулиновой пробы составляла около 97,0% – из 7327 голов, позитивно реагирующих на туберкулин, при вскрытии туберкулез подтвержден у 204 случаях.
Во Франции в конце XIX– началеXXвека туберкулез также приобрел значительное распространение. Так, по данным наблюдений ветеринарных врачей, в некоторых местностях заболеваемость крупного рогатого скота составляла 30-40%, а средний показатель по стране составлял 10%. При проведении туберкулинизации животных молочных ферм, считавшихся свободными от туберкулеза, реагировало 50-80% коров. В 1899 году на бойнях Парижа выявляли 0,31% туш телят с признаками туберкулезных поражений, в последующие 4 года этот показатель снизился вдвое. При вскрытии трупов (1900-1904 гг.) собак и котов признаки туберкулеза установлены у 3,0-9,1 и 2,0% обследованных соответственно.
В Великобритании в период 1890-1899 годов на туберкулин реагировало в среднем 26,6% крупного рогатого скота. Только отдельные хозяйства, которые имели более 30 голов скота, были благополучными, а в некоторых инфицированность возбудителем туберкулеза достигала 80% и более.
В Австрии туберкулез встречался во всех коронных землях. Так, в Моравии при туберкулинизаци 2 314 голов крупного рогатого скота, проведенной в 1896 и 1987 годах, выявлено 39,8% инфицированных возбудителем туберкулеза и 4,4% подозрительного в заражении скота. В хозяйствах Зальцбурга в начале 90-х годов на туберкулин реагировало от 40- 44% , а в Силезии – 25-40%, Нижней Австрии – до 53,4%, в Галиции (нынешняя территория Украины) – 14,2-60,3% (в зависимости от породы) животных. В то же время показатели боенской статистики в этот период содержат достаточно низкие показатели обнаружения туберкулезных изменений в тушах – до 2,9 %, что позволяет усомниться в их объективности.
Анализ имеющихся данных свидетельствует, что на рубеже XIX-XXвеков наиболее полную и объективную картину относительно распространения туберкулеза животных имела Венгрия, о чем свидетельствуют данные статистики боен Будапешта относительно поражения туберкулезом туш (табл. 6) и туберкулиновой пробы (табл. 7).
Авторы отмечают такой факт, что если в 20-ти исследованных больших ферм на туберкулин реагировало 75,36% взрослых животных и 35,18% молодняка, то в 117-ти дворовых хозяйств эти показатели составляли 25,7% и 1,0% соответственно. При этом неблагополучными по туберкулезу оказалось 64 двора из 117, причем расположены они были неподалеку от больших ферм, а их хозяева часто покупали там выбракованный скот.
В Бельгии в 1896 году среди 19 004 голов крупного рогатого скота выявлено реагирующих на туберкулин 9 274 головы, в 1890 году было забито 10 269 больных туберкулезом животных, а перед Первой Мировой войной процент реагирующих на туберкулин животных составляют 45-52% от числа исследованных животных.
Таблица 6. Частота выявления туберкулезных поражений в тушах сельскохозяйственных животных (% от обследованных) (Ф. Гутира и И. Марек (1910) [11])
|
Год |
КРС длиннорогой породы |
КРС цветных пород |
телята |
буйволы |
свиньи |
|
1899 |
12,2 |
13,6 |
0,006 |
0,07 |
|
|
1901 |
14,1 |
13,9 |
0,01 |
0,26 |
|
|
1903 |
15,0 |
16,9 |
0,01 |
0,07 |
2,6 |
|
1905 |
16,6 |
21,6 |
0,03 |
0,11 |
1,42 |
|
1906 |
19,8 |
25,2 |
0,01 |
0,89 |
1,41 |
Таблица 7. Инфицированность возбудителем туберкулеза крупного рогатого скота (Ф. Гутира и И. Марек (1910))
|
Год |
Кол-во происследо-ванных хозяйств |
КРС, возраст до 2,5 лет |
КРС, возраст до 2,5 лет |
Кол-во хозяйств, свободных от туберкулеза КРС | |||
|
кол-во про-исследо- ванных животных |
реагиро-вало, % |
кол-во про-исследо- ванных животных |
реагиро-вало,% | ||||
|
1902 |
34 |
1723 |
9,8 |
1871 |
13,3 |
3 | |
|
1903 |
36 |
1145 |
14,4 |
2588 |
12,5 |
7 | |
|
1904 |
56 |
2847 |
8,1 |
3639 |
26,8 |
8 | |
|
1905 |
85 |
3152 |
9,0 |
4404 |
23,4 |
22 | |
|
1906 |
93 |
3859 |
7,5 |
5999 |
16,5 |
12 | |
Bо Франции начало ХХ века характеризуется достаточно широким распространением инфекции. Средний уровень инфицированности крупного рогатого скота составляет 30-40%, а в некоторых молочных хозяйствах Франции положительные реакции на туберкулин наблюдались у 50-80% коров, а средние показатели зараженности 70% [7].
В северных государствах Европы на рубеже XIX-XXвеков эпизоотическая ситуация по освещаемому заболеванию была неоднородной. Так, на бойнях Нидерландов выявляли 2-13% животных с туберкулезными поражениями. В целом Швейцария имела значительно более низкий процент больного скота, чем в вышеназванных странах, хотя в некоторых кантонах туберкулез выявляли в 19% забитых коров, а процент положительно реагирующих животных достигал 50%.
Вследствие завоза больших партий скота из неблагополучных Англии, Швейцарии, Шлезвиг-Голштинии (Германия), Дании, к концу XIXвека заболевание приобрело чрезвычайно широкое распространение. Так, при проведении туберкулинизации на протяжении 1893-1904 гг. положительную реакцию имели 24,0% из 404 651 головы 17 268 хозяйств. В 1986 году в некоторых хозяйствах процент туберкулезных животных достигал 75%. По состоянию на конец 1903 года было выявлено 2 664 хозяйств, свободных от туберкулезной инфекции из 10 344 обследованных (27,5%), причем в большинстве из них содержалось меньше 25 голов скота, а в 153 – 26-55 животных.
За период с 1895 по 1904 год в Норвегии выявлено 18,3% неблагополучных по туберкулезу хозяйств, в Швеции этот показатель составил 60,2%. В Финляндии в последние 10 лет XIXвека средний показатель реагирующего на туберкулин скота составил 13,7%.
Как указывают Ф. Гутира и И. Марек (1910) [11], на протяжении характеризуемого периода, туберкулез крупного рогатого скота имел значительное распространение в Северной и Средней Италии, Испании и Португалии. Авторы также отмечают, что в хозяйствах России, Румынии, Сербии, Боснии и Герцеговины, занимающихся разведением западноевропейских пород, болезнь распространена на том же уровне, что и в Западной Европе. В то же время степной скот, который свободно выпасается, а также аборигенных не улучшенных пород, на туберкулез практически не болеет. Так, среди сербского скота, который забивали на бойнях Будапешта, туберкулезные поражения выявляли у 0,20-0,23% осмотренных туш.
На других континентах распространение туберкулеза также было связано с сельскохозяйственными животными западноевропейских пород, которые использовались для скрещивания с местным поголовьем. В частности, после завоза племенных свиней на бойнях Буенос-Айреса (Аргентина) процент свинных туш с туберкулезными поражениями достигал 10%, что было выше соответствующего показателя относительно крупного рогатого скота.
В Соединенных Штатах Америки 1905-1908 гг. по разным данным на туберкулин ежегодно реагировало от 36,8% до 5,6%, а доля пораженных туберкулезом туш составлял около 1%.
Значительное увеличение распространенности туберкулеза крупного рогатого скота в этот период наблюдалось в Чили, ряде стран Северной Африки, а также Австралии. Интересно отметить, что в Японии, несмотря на давность и значительную степень заболеваемости людей, среди крупного рогатого скота заболевание стало выявляться после завоза племенных животных из Канады, а затем болезнь приобрела широкое распространение.
Распространение туберкулеза крупного рогатого скота в 20-30-е годы ХХ века
На протяжении 1913-1930 гг. доля реагирующего на туберкулин скота колебалась в пределах 2,8-8,5%. Наиболее высокие показатели инфицированности были получены в годы Первой мировой войны и в послевоенный период (1915-1926 гг.). В Литве в 20-е годы процент реагирующих на туберкулин животных также был невысоким (5-6%), а при санитарном осмотре убитого скота обнаруживалось в среднем 2,2% пораженных туберкулезом животных. Такая небольшая разница этих двух показателей может быть объяснена квалифицированным ветеринарным контролем туш в этой стране [7]. В тоже время уже в 1933 году выявлен значительно больший процент коров – 17,6 с позитивными аллергическими реакциями, а около 2% из них имели открытую форму заболевания.
В отличие от вышеназванных стран, Эстония на то время имела достаточно высокий уровень пораженности крупного рогатого скота возбудителем туберкулеза, хотя его распространение с годами имело тенденцию к снижению. Так, если в 1924 году реагирующие на туберкулин животные составляли 56,3% от обследованных особей, то в 1933 году – 31,1%.
В Швеции в 1915 году процент реагирующих на туберкулин животных составил 26,4%, в 1917-1918 гг. достиг пика, когда равнялся 31,3%, в последующем этот показатель начал снижаться и в 1928 году положительные реакции были зафиксированы у 18,7% скота. При этом данные боенского осмотра свидетельствует, что средний показатель пораженных туберкулезом туш за период с 1921 по 1928 год составил 28,6% от общего количества убитого скота.
Официальная статистика Дании зафиксировала снижение уровня реагирующего на туберкулин крупного рогатого скота в 2 раза за восьмилетний период наблюдений (1920-1927 гг.) с 10,3% до 5,3%. Как указывает П.П. Вишневский (1937) [7], это было достигнуто в основном за счет систематического проведения аллергических исследований и сдаче на убой скомпрометированных животных.
В Голландии в 1923 году с помощью туберкулинового теста выявлено, что инфицированы возбудителем болезни были 31,8% животных, в 1930-м – 17,0%, а в 1935-м – 7,2%. На бойнях в отдельные годы и на разных территориях процент пораженных туш варьирует от 1,33 до и 33,4%. Обращают на себя данные 1935 года о том, что из происследованных 3 378 проб молока 12% содержали туберкулезные бациллы, что свидетельствует о значительной встречаемости у коров открытой формы заболевания.
Бельгия на конец 20-х – начало 30-х годов имела около 65% неблагополучных хозяйств, в которых процент реагирующего на туберкулин скота составлял до 24,1%, при этом показатели напряженности эпизоотической ситуации имели тенденцию к ухудшению [7].
Имеющиеся в литературе данные по Франции за 1914-1916 годы свидетельствуют, что процент инфицированного скота составлял в этот период 21, 2– 37,8, при этом средний показатель боенской статистики пораженных туберкулезом туш составил 2,5%.
Несмотря на отсутствие четкой и достоверной статистики распространения туберкулеза в Италии, разрозненные данные свидетельствуют о значительном распространении заболевания – в 1931 году в некоторых провинциях положительно реагирующий скот составляет 30,8% а среди молочного стада– до 39,4% от происследованных особей. П.П. Вишневский (1937) [7] констатирует, что приводимые при этом показатели боенской статистики относительно пораженных туберкулезом туш (5-6%) имеют малодостоверный характер.
В Турции применение аллергической пробы, начатое в1933-1936 годах, позволило выявить до 7,3% инфицированного возбудителем туберкулёза скота, причем поражен был преимущественно «улучшенный» скот, полученный при скрещивании с европейскими породами.
ВГермании на протяжении анализируемого периода эпизоотическая ситуация по туберкулезу продолжала оставаться достаточно напряженной. Так, 1914 году «туберкулинизированный» скот реагировал примерно в 64% случаев, хотя в северных районах этот показатель составлял 25%. В связи с войной официальная статистика по туберкулезу животных за 1914-1922 годы отсутствует, а с 1922 по 1933 год имеются лишь данные относительно клинически больных животных. Их анализ свидетельствует, что процент таких животных в 1929 году составлял 7,05%, в 1930 и 1931 гг. – 8,0%. Известный ветеринарный специалист Гаупт считал, что на тот момент в Германии не осталось ни одного свободного от туберкулеза хозяйства.
Туберкулез в Великобритании также оставался серьезной проблемой, которая продолжала усугубляться, о чем свидетельствуют данные МЭБ (табл. 8). [7].
Таблица 8. – Количество клинически больных туберкулезом животных, убитых по распоряжению властей (Англия, Уэльс и Шотландия)
|
Год |
1926 |
1927 |
1928 |
1929 |
1930 |
1931 |
1932 |
|
Количество туш |
17 348 |
17 381 |
16 759 |
15 382 |
15 263 |
18 603 |
19 127 |
Нужно отметить, что, по имеющимся данным, на убой сдавалось более 98% больного скота, количество которого по отношению к обследованному в тот период составляло 6,3-6,9%.
Достаточно показательны в плане характеристики эпизоотической ситуации по туберкулёзу сообщения отдельных исследователей и боенская статистика. Так, известный исследователь по туберкулезу Бакстон утверждал, что средний процент по стране реагирующих на туберкулин животных в 1927 году составлял около 40%, а в 1932 году приблизился к 50%. В качестве аргументации он приводит боенскую статистику, регистрирующую от 35 до 40% туберкулезных туш среди убитых коров. Кроме того, на рынках Англии в 1926-1929 годах было обнаружено от 42,0% до 51,0% коров с признаками заболевания. По данным МЭБ в Ирландии в период 1928-1931 гг. среднее количество зараженного туберкулезом скота составляло: среди коров – 28,9%, среди телят –5,3%, среди волов – 7,1%.
Характеризуя развитие эпизоотической ситуации относительно туберкулеза крупного рогатого скота в 20-30-х годах ХХ века в США, необходимо отметить, что с 1917 года в этой стране началась планомерная работа по его искоренению. В результате за 15-летний период количество реагирующих на туберкулин животных сократилось в 2 раза – с 3,2 % в 1917 году до 1,6 % в 1931.
Для Канады, где также активно поводились противотуберкулезные мероприятия, характерно еще более выраженное уменьшение количества реагирующих на туберкулин животных: если в 1915 году инфицированными признано 9,9% исследованного крупного рогатого скота, то в 1932 – 0,5%, т.е. показатель распространения туберкулеза снизился в практически в 20 раз.
Не смотря на то, что литературные данные относительно эпизоотической ситуации в странах Африканского континента разрозненные и неполные их анализ дает основание сделать вывод о достаточно широком распространении туберкулеза животных в некоторых из них. Так, доля туш, признанных тубекрулезными в течении 1933-1934 гг. на общественных бойнях Каира (Египет) составляла: для взрослого крупного рогатого скота – 12%, взрослых буйволов – 9%, свиней – 14%, верблюдов – 2,2%. В некоторые годы туберкулез встречался у 60% крупных старых жвачных. В этой стране значительное влияние на распространение туберкулеза оказывали буйволы, которые были основными производителями молока и мяса, а их восприимчивость к возбудителю туберкулеза сходна с таковой у крупного рогатого скота.
На бойнях Марокко количество туш с туберкулезными поражениями составляло 5,0%, тогда как Алжира и Туниса – 0,1%. Среднее количество животных, реагирующих на туберкулин в Южной Африке составляло 5,0%, однако в некоторых регионах достигало 39,0%.
Такая же картина наблюдалась в восточных странах: в Индии на протяжении 1920-1935 гг. зафиксирован рост инфицированных микобактериями туберкулеза коров с 3 до 25%, на острове Фиджи этот показатель составил 16,4%. В Индокитае в 20-е годы 0,03-0,2% туш имели признаки заболевания, на о. Ямайка – до 3,0%.
По состоянию на 2007 год по данным МЭБ неблагополучными по туберкулезу КРС в странах Средней Азиии и Северной Африки были Алжир, Египет, Иордания, Иран, Кувейт, Марокко, Тунис и Турция [18].
Особенности эпизоотической ситуации по туберкулезу крупного рогатого скота в России
В России туберкулез крупного рогатого скота начали регистрировать с 1894 года [39]. Приступая к рассмотрению закономерностей развития туберкулеза крупного рогатого скота в России, необходимо сделать существенную оговорку, что статистика заболеваемости животных в стране в конце XIX– началеXXвеков далека от истинного состояния.
Несмотря на это, даже разрозненные данные аллергических и патологоанатомических (статистика скотобоен) исследований в отдельных стадах и земствах дают достаточно оснований для доказательств того, что к началу прошлого века рассматриваемая инфекция, как указывал С. Г. Гринцер (1914) «свила себе в некоторых местностях Империи прочные гнезда, из которых она медленно и верно губительно воздействовала на скотоводство» [9]. Подтверждением этому являются данные табл. 9.
Таблица 9. Динамика напряженности эпизоотической ситуации по туберкулезу в Росси [9]
|
Показатель |
Год | |||||||
|
1894 |
1904 |
1905 |
1906 |
1907 |
1908 |
1909 |
1910 | |
|
Число неблагополучных: | ||||||||
|
Губерний |
19 |
36 |
41 |
34 |
35 |
43 |
51 |
53 |
|
Уездов |
|
84 |
77 |
83 |
86 |
157 |
169 |
166 |
|
Пунктов |
|
228 |
156 |
223 |
252 |
484 |
637 |
502 |
|
Количество КРС, голов: | ||||||||
|
Заболело |
377 |
584 |
466 |
530 |
527 |
958 |
1315 |
1191 |
|
пало |
376 |
210 |
132 |
137 |
149 |
142 |
202 |
176 |
|
Убито |
283 |
290 |
343 |
349 |
525 |
810 |
690 | |
Наиболее неблагополучными были Новгородская, Саратовская, Воронежская, Полтавская и Харьковская губернии.
Такое широкое распространение туберкулеза требовало изменить подход к диагностике болезни, т.е. кроме клинических исследований использовать и туберкулиновую пробу. Однако внедрение нового метода в диагностическую практику проходило медленно, с большим сопротивлением со стороны владельцев животных, не желавших выбраковывать реагирующих на туберкулин животных. Действительно, за семилетний период количество исследованных животных практически не увеличивалось и составляло: в 1904 году – 9 372 головы, в 1905 году – 7 765 голов, в 1906 – 8 711, в 1907 – 5 268, в 1908 – 7 657, в 1909 – 6 998 и в 1910 году – 6 958 голов.
В эти годы туберкулинодиагностику применяли преимущественно в Харьковской, Московской, Курской, Варшавской, Санкт-Петербургской, Орловской, Приморской и Донской губерниях.
Необходимо отметить, что табличные данные отражают лишь динамические процессы развития эпизоотии и не соответствуют истинным показателям заболеваемости. Так, если за первые семь анализируемых в таблице лет заболело 4 757 животных, то, по данным С. Г. Гринцера (1914) [9], только в 1909 году и лишь на скотобойнях выявлено 71 148 явно пораженного туберкулезными процессом крупного рогатого скота. К этому можно добавить, что не все клинически больные и истощенные животные забивались на организованных убойных площадках.
В этот период диагностика туберкулеза была несовершенной, туберкулез в основном регистрировали на скотобойнях. Так, в 1894 г. туберкулез был зарегистрирован в 19 губерниях, в 1912 г. - в 56 губерниях. В 1904 г. было исследовано туберкулиновой пробой всего 9 372 голов крупного рогатого скота, а в 1910 г. – 6 958. В 1912 г. при туберкулинизации выявлено 1861 реагирующее животное, при послеубойном осмотре на скотобойнях обнаружена 92 291 туша с характерными для туберкулеза изменениями. Причем, в этот период не всех животных убивали на скотобойнях (где осуществлялся ветеринарный надзор), значительное количество животных убивали подворно - без всякого контроля. Кроме того, в этот период в России не было государственных узаконенных мероприятий по оздоровлению от туберкулеза. Первое постановление о мероприятиях по борьбе с туберкулезом крупного рогатого скота было издано в 1899 году. "Обязательное постановление о мерах предупреждения и прекращения туберкулеза на свиньях и рогатом скоте в Симбирской губернии" [39].
П.П. Вишневский (1937) [7] отмечает, что основным и самым надежным методом, с помощью которого можно получить верное и ясное представление о санитарном состоянии всего поголовья скота, является ветеринарно-санитарная статистика. Хорошо организованная, современно информирующая, охватывая широкие массы скота, статистика может и должна служить источником для изучения размеров, причин и следствий болезни как массового явления и отправной точкой для построения мероприятий.
К сожалению, не всегда и везде санитарная статистика стоит на высоте своих задач: в большинстве случаев она не отражает во-время и с исчерпывающей полнотой санитарного состояния скота, в частности, положения дел с туберкулезом. В некоторых странах она совсем не разрабатывается или же не публикуется для общего обсуждения. Поэтому, чтобы составить более полную картину в этом отношении, необходимо использовать другие источники.
С организацией Международного эпизоотического бюро (МЭБ) сведения об эпизоотической ситуации по туберкулезу в разных странах начали приобретать более упорядоченный характер, но по большинству стран эти сведения отсутствуют. Для более полной и правильной оценки распространения туберкулеза животных необходимо разграничивать статистические данные, полученные при туберкулинизации и при убое животных. Первые более верно и реально отражают распространение заболевания в стране, а другие во многом характеризуют напряженность эпизоотического процесса, хотя претерпевают влияние побочных и субъективных факторов (контингент убиваемого скота, район, обслуживаемый бойней, организация осмотра и др.).
Динамика эпизоотической ситуации в Российской Федерации
Первое в России «Наставление о мероприятиях против туберкулеза крупного рогатого скота», утвержденное Наркомземом и Наркомздравом РСФСР 04.06.1926 г., было разработано сотрудниками отдела по изучению туберкулеза ВИЭВ С.Н. Вышелесским, В.Н. Матвеевым и П.П. Вишневским Предложенные ими методы диагностики и меры борьбы с туберкулезом были одобрены на 1-м Всероссийском научно-организационном съезде (1926 г.) и рекомендованы для практики. Эта система мероприятий по борьбе с туберкулезом с/х животных неоднократно дополнялась и совершенствовалась сотрудниками лаборатории совместно со специалистами Главного управления ветеринарии МСХ СССР и РФ и ведущими специалистами по проблеме туберкулеза других научно-исследовательских учреждений (всего было разработано и утверждено 8 наставлений и инструкций). [28; 39],.
Как указывает И.В. Солодова (2011) [39], в годы Второй мировой войны заболеваемость туберкулезом увеличилась за счет завоза на территорию страны крупного рогатого скота из Германии и перемещения животных с запада на восток. Длительные перегоны приводили к переутомлению животных, неполноценному кормлению, более тесному контакту больных и здоровых животных, что в конечном итоге способствовало широкому перезаражению туберкулезом.
Широкомасштабные мероприятия по борьбе с туберкулезом крупного рогатого скота в России стали проводить с 1951 года — после выяснения эпизоотической ситуации по туберкулезу в стране на основе результатов внутрикожной туберкулиновой пробы. По состоянию на 01.01.51 г. в Российской Федерации было зарегистрировано 9833 неблагополучных пунктов, а заболело туберкулезом — 86 894 голов крупного рогатого скота.
Анализ изменений эпизоотической ситуации по туберкулезу крупного рогатого скота в Российской Федерации показывает, что наиболее сложная обстановка сложилась в 1951-1960 гг., то есть в первом десятилетии проведения широкомасштабных мероприятий по борьбе с туберкулезом. Так, на 01.01.1951 г. было зарегистрировано 9 833 неблагополучных пункта, в течение 1951 г. было оздоровлено 6 497 н.п., выявлено новых -4 014 н.п., коэффициент очаговости - 6,3 [39].
В дальнейшем, по мере проведения оздоровительных мероприятий, количество н.п. стало постепенно уменьшаться. Так, в 1960 г. было 2239 н.п., в 1961-1970 гг. – 2503-1795 н.п., в 1971-1980 гг. – 1814-1269 н.п., в 1981-1990 гг. – 1232-1440 н.п., в 1991-2000 гг. – 1124-444 н.п., в 2001-2009 гг. – 377-49 н.п. [39].
Данные ветеринарной статистики свидетельствуют, что эпизоотическая ситуация по туберкулезу на территории Российской Федерации в последние 3 года оставалась эндемической, а ее напряженность имела колебательный характер. Так, 2010 году было зарегистрировано 20 новых неблагополучных по этому заболеванию пунктов [54], за 11 месяцев 2011 года – 8 новых неблагополучных пунктов, в т.ч. по 2 пункта в Оренбургской и Новосибирской областях, по 1 пункту в Республиках Татарстан, Мордовия, Ингушетия и Тульской области. На 1 ноября 2011 года в Республике Северная Осетия-Алания числились 2 неблагополучных пункта по туберкулезу крупного рогатого скота, по 1 пункту в Курской области, Кабардино-Балкарской, Чеченской Республиках и Ставропольском крае. В Белгородской области в 2012 году зарегистрировано два неблагополучных пункта по туберкулезу крупного рогатого скота http://vet73.ulgov.ru/about/230/825.html[56].
ПО данным ФГБУ «Центр ветеринарии» за 11 месяцев 2012 года было зарегистрировано 11 новых неблагополучных пунктов по туберкулезу крупного рогатого скота в Белгородской, Амурской, Саратовской областях, Республике Мордовия, Краснодарском и Алтайском краях, а также в Кабардино-Балкарской Республике. На 01.12.2012 года неблагополучными по туберкулезу КРС числились 10 регионов: Курская, Белгородская, Саратовская, Новосибирская, Амурская области, Республики Мордовия, Татарстан, Краснодарский и Алтайский края, Кабардино-Балкарская Республика [55]. В первом квартале 2013 года зарегистрировано 4 новых неблагополучных пункта по туберкулезу КРС в Тульской, Самарской областях, республике Мордовия и Красноярском крае. Также заболевание регистрировалось в Белгородской, Курской областях и республике Татарстан. Аналитики делают вывод, что ситуация по туберкулезу крупного рогатого скота стабильная, а краткосрочные тренды убывающие. [57]
Анализ эпизоотической ситуации по туберкулезу крупного рогатого скота также показывает, что в последние годы, по мере оздоровления н.п. и сокращения количества заболевших туберкулезом животных, увеличивается выявление неспецифических реакций на туберкулин. В 2011 г. всего было выявлено реагирующих — 33 798, из них в н.п. — 1634 (43%), а в благополучных хозяйствах — 32 164, т.е. 95,2% реагирующих животных.
Поэтому проблема выявления неспецифических реакций на туберкулин становится самой актуальной проблемой при диагностике туберкулеза крупного рогатого скота. В последние годы в стране сложилась такая ситуация, когда количество реагирующих животных в благополучных хозяйствах значительно превышает число реагирующих в неблагополучных хозяйствах. В практических условиях, опасаясь пропустить туберкулез, во многих благополучных хозяйствах всех реагирующих животных сдают на убой и, как следствие этого, несут значительный экономический ущерб. При контрольном убое реагирующих на туберкулин животных характерных для туберкулеза изменений не обнаруживают. При бактериологическом исследовании биоматериала от таких животных выделяют быстрорастущие микобактерии или получают отрицательные результаты [30].
Эпизоотическая ситуация по туберкулезу на Украине
Нашими исследованиями был установлена динамика эпизоотической ситуации по туберкулезу крупного рогатого скота на Украине за период с 1994 по 2000 гг. Изучение интенсивности эпизоотического процесса при туберкулёзе крупного рогатого скота проводили, используя комплексный анализ данных ветеринарной статистики. При этом учитывали:
— частоту выявления реагирующих на туберкулин животных в сельскохозяйственных предприятиях,
— уровень заболеваемости животных туберкулёзом,
— динамику выявления и оздоровления неблагополучных пунктов,
— материалы статистики на бойнях по установлению патологоанатомических изменений, характерных для данной инфекции.
Использовали данные литературы о пространственно-временной динамике интенсивности эпизоотического процесса при туберкулезе крупного рогатого скота.
Данные табл. 10 свидетельствуют о тенденции повышения выявления новых неблагополучных пунктов в разрезе областей и находящихся в них данных, не отражающих в полном объеме эпизоотическую ситуацию по туберкулезу.
В Харьковской, Сумской и Кировоградской областях за 1994 г. выявлено по 10, 13, 14 неблагополучных пунктов, в которых насчитывалось 1895 4636, 3439 голов крупного рогатого скота соответственно. А в 1996 г. в Харьковской, Киевской и Луганской областях было выявлено 46, 32 и 11 неблагополучных пунктов, в которых насчитывалось 4706, 8608, 3543 голов.
В Киевской области за 1997 г. выявлено рекордное количество неблагополучных пунктов – 48. По 13 неблагополучных пунктов с поголовьем 2825 и 768 голов соответственно выявлено в Днепропетровской и Николаевской областях в 1997 году. В этом же году в Харьковской и Запорожской областях выявлено по 12 неблагополучных пунктов с поголовьем 1697 и 858 голов крупного рогатого скота.
За 1998 г. в Днепропетровской области выявлено 24 неблагополучных пункта с поголовьем 1812 голов, а в Киевской и Кировоградской – по 10 неблагополучных пунктов с поголовьем 5952 и 1771 голов крупного рогатого скота соответственно.
В 2000 г. выявлено 11 неблагополучных пунктов (1170 голов) в Запорожской области и 10 (935 голов) – в Херсонской области.
Динамика выявляемости неблагополучных пунктов по туберкулезной инфекции на Украине за 1994–2000 гг. представлена на рис. 20. Этот показатель в 1995 г. понизился на 30 % по сравнению с 1994 г., когда было выявлено 90 неблагополучных пунктов.
В дальнейшем этот показатель стремительно рос и за 1996 г. было выявлено 139, а за 1997 год – 144 неблагополучных пункта.
Стремительное понижение выявляемости новых неблагополучных пунктов до 55 в 2000 г. коррелирует со стремительным понижением общего числа крупного рогатого скота на Украине.
За анализируемый период были свободны от туберкулеза Ровенская область и Автономная Республика Крым.
Единичные случаи выявления неблагополучных пунктов регистрировали в Закарпатской – 1 неблагополучный пункт (69 голов) в 1997 г., Волынской – 2 (255 голов) в 1996 г., Черновицкой – 2 (33 головы) в 1998 г., Полтавской – 3 неблагополучных пункта, 2 из них – в 1994 г. (326 голов) и 1 – в 2000 г. (11 голов). В других областях Украины количество выявленных неблагополучных пунктов колебалось за исследуемый период с 2 до 9.
Данные табл. 10, рис. 20 и 21 свидетельствуют об уменьшении выявления неблагополучных пунктов и реагирующих на ППД-туберкулин животных, как в отдельных областях, так и в целом по Украине, на фоне значительного уменьшения поголовья крупного рогатого скота за последние 3 года.
Таблица 10. Динамика изменений эпизоотологической ситуации по туберкулезу крупного рогатого скота на Украине (1994–2000 гг.)
|
Показатель |
Годы | ||||||
|
1994 |
1995 |
1996 |
1997 |
1998 |
1999 |
2000 | |
|
Количество неблагополучных пунктов на 1.01. |
149 |
169 |
168 |
149 |
182 |
194 |
144 |
|
Оздоровлено неблагополучных пунктов |
95 |
86 |
80 |
106 |
132 |
150 |
93 |
|
Доля животных с патологоанатомическими изменениями от числа убитых реагирующих на туберкулин, % |
16,9 |
18,7 |
19,4 |
21,2 |
25,7 |
26,8 |
16,2 |
Основной движущей силой эпизоотического процесса при данном заболевании являются больные туберкулезом животные (источники возбудителя инфекции) с явно выраженными патологоанатомическими изменениями туберкулезного характера.
Данные последней строки табл. 10, свидетельствуют о том, что количество выявленных с патологоанатомическими изменениями животных по отношению к числу реагирующих на туберкулин возросло с 16,9 % в 1994 г. до 26,8 % в 1999 г., хотя в 2000 г. этот показатель составил 16,2 %.

Рис. 20. Динамика выявления неблагополучных пунктов на Украине в период с 1994 по 2000 гг.

Рис. 21. Динамика выявления реагирующих на туберкулин животных в неблагополучных хозяйствах Украины в период с 1994 по 2000 гг.
При проведении бактериологических исследований патологоанатомического материала от реагирующих на туберкулин (5–50 %) животных за 2000 г. выделено 181 эпизоотический штамм микобактерий туберкулеза M. bovis, а в Запорожской и Хмельницкой областях от крупного рогатого скота выделены и типированы две культуры микобактерий человеческого вида.
За период исследований с 1994 по 2000 гг. ежегодно, по состоянию на 1.01, числилось от 144 до 194 неблагополучных пунктов, а оздоровлялось ежегодно от 80 до 150 хозяйств, количество выявленных реагирующих на туберкулин животных в неблагополучных пунктах Украины (рис. 21) понизилась с 33474 голов в 1994 году до 10373 голов в 2000 году, что позволяет прогнозировать постоянное наличие этой инфекции во всех стационарно неблагополучных регионах.
Для сравнительной оценки интенсивности эпизоотического процесса (уровня заболеваемости) на изучаемой территории определяли индекс заболеваемости (ИЗ) – отношение числа заболевших животных к общему числу восприимчивых животных (в %) – по формуле:
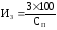 (%)
(%)
где: З – количество заболевших животных за год,
СП– среднегодовое поголовье животных.
Наивысший индекс заболеваемости туберкулезом 0,69±0,37 % был отмечен в Киевской области с 1995 по 1998 гг., который в последующие два года – с 1999 по 2000 гг. – снизился в 5,3 раза и был равен 0,13±0,06 %. В Харьковской области этот показатель достигал максимальной величины 0,25 % в 1996 г., в Луганской – 0,27 % в 1995 г., в Херсонской – 0,19 % в 1995–1996 гг., в Днепропетровской – 0,29 % в 1998 г., а в Кировоградской – 0,31 %, 0,32 %, 0,22 % в 1998, 1999, 2000 гг. соответственно.
В целом по Украине заболеваемость крупного рогатого скота возрастала до 1998 г. и равнялась 0,12±0,003 %, а уже к 2000 г. этот показатель понизился в 1,5 раза и был равен 0,08±0,01 % (рис. 22).
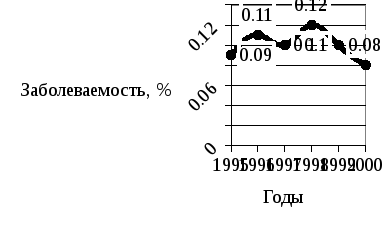
Рис. 22. Заболеваемость туберкулёзом крупного рогатого скота (на 100 голов) на Украине (1995–2000 гг.).
Анализируя средние показатели заболеваемости за 6 лет – с 1995 по 2000 гг. следует отметить, что самые высокие показатели по убывающей были в Киевской – 0,4±0,1 %, Кировоградской – 0,19±0,004 %, Сумской – 0,18±0,04 %, Луганской – 0,14±0,03 %, Херсонской – 0,13±0,03 %, Днепропетровской, Николаевской и Запорожской областях – 0,1±0,04 %.
Для количественной оценки эпизоотической ситуации проведен расчёт коэффициента напряженности эпизоотической ситуации за 1994–2000 гг.
Значение коэффициента (НЭП) определяли по формуле:

где: Д – показатель доли неблагополучных пунктов (отношение числа неблагополучных по болезни пунктов к общему числу неблагополучных пунктов на определенной территории),
ИЭ– индекс эпизоотичности (отношение числа дней, месяцев, лет, в течении которых регистрировалась данная болезнь к числу дней, месяцев, лет наблюдения,
КИ– коэффициент интенсивности заболеваемости (отношение числа выявленных больных к числу исследованных, восприимчивых животных или число больных к стандартному показателю на 100, 1000, 10000, 100000 голов).
Наиболее высокая напряженность эпизоотической ситуации по туберкулезу крупного рогатого скота – свыше 0,0001 – в период 1994–1997 гг. была в Киевской – 0,00067±0,0004, Днепропетровской – 0,00042±0,0002, Луганской – 0,00032±0,00015, Кировоградской – 0,00029±0,0001, Сумской – 0,00029±0,00008, Харьковской – 0,00021±0,00011, Херсонской – 0,00019±0,00008, Черкасской – 0,00017±0,000078.
Коэффициент напряженности эпизоотической ситуации находился в пределах 0,0001–0,00009 в Черниговской, Житомирской, Хмельницкой, Винницкой, Одесской, Волынской и Закарпатской областях.
В Полтавской, Донецкой, Тернопольской, Львовской, Ивано-Франковской и Черновицкой областях коэффициент напряженности эпизоотической ситуации достигал самых низких значений и был в пределах от 0,00001 до 0,000009.
За последующих три года – с 1998 по 2000 гг. – коэффициент напряженности эпизоотической ситуации по туберкулезу крупного рогатого скота в целом по Украине возрос, в связи с тем, что к первой группе регионов с напряженностью эпизоотического процесса свыше 0,0001 присоединились Запорожская и Николаевская области.
Анализ полученных данных дает основание утверждать, что эпизоотическая ситуация по туберкулезу крупного рогатого скота за исследуемый период на Украине остается сложной:
— заболеваемость животных практически колеблется на уровне от 0,08 до 0,12 %;
— выявляемость животных с патологоанатомическими изменениями туберкулезного характера к числу убитых реагирующих животных колеблется от 16,2 до 26,8 %;
— показатели выявляемости новых неблагополучных пунктов (169±25) превышают в 1,5 раза показатели оздоровления (115±35).
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
Александров Н.А., Алексеев К.К., Мендельман З.И. Некоторые вопросы оздоровления длительно неблагополучных по туберкулёзу хозяйств // Труды Саратовской НИВС.-1974.-т.9.-С.51-54.
Александров Н.А., Ковалев Г.К. Значение зооантропонозных инфекций в системе мероприятий по охране окружающей среды (на модели туберкулёза)// Труды Саратовской НИВС.-1978.,т.12.-С.17-21.
Бакулов И.А. и соавт. Метод эпизоотологического исследования // Труды Всесоюзной конф. по эпизоотологии.-т.74.-М., 1974.-С.41-49.
Благодарный Я.А., Макаревич Н.М., Блехман И.М. Выделение атипичных микобактерий от спонтанно инфицированных птичьих клещей // Пробл. туберкулеза. 1971. - № 6. - С. 74 - 76.
Бокун А.О. Сезонность в проявлении туберкулиновых реакций у крупного рогатого скота в Ростовской области // Сб.науч.трудов Сев.Кавк.ЗНИВИ.-1976.,вып 16.-С23-25.
Бусол В.О., Мазур В.М. Потенційні джерела та резервуари в екологічному середовищі mycobakterium bovis http://www.sworld.com.ua/index.php/en/veterinary-medicine-and-pharmaceuticals-112/veterinary-medicine-and-zooengineers-112/12813-112-793
Вишневский П.П. Туберкулез крупного рогатого скота //М.: «СЕЛЬХОЗГИЗ», 1937.– 245 с.
Гаврилова, Г.А. Эпизоотический процесс туберкулеза и лейкоза крупного рогатого скота на Дальнем Востоке и совершенствование методов диагностики: Дис.докт. вет. наук: 16.00.03 / Г.А. Гаврилова. -Благовещенск. 2005. - 372 с.
Гринцер, С.Г. Современное положение ветеринарного дела в России./ С.Г. Гринцер.//С.-Пб, 1914.– 376 с.
Гуславский И.И., Фомин В.М. Некоторые аспекты туберкулёза крупного рогатого скота в Западной Сибири // Сб.науч.трудов ИЭВСиб.и ДВ. -1986. -С.17-21.
Гутира Ф. Частная патология и терапия домашних животных./ Ф.Гутира, И Марек.//М., 1931.– С.609-755.
Даниел. Г.М. , Дж. Х. Байнтс, К.А. Доунес . История туберкулеза /Туберкулез. Патогенез, защита, контроль.: Пер с англ./Под ред. Б. Блума.–М.:Медицина, 2002.–С 12-24.
Данко, Ю. Ю. Туберкулез пятнистых уссурийских оленей в условиях Северо-Запада России//– С.-Пб., 2009.– 19 с.
Джупина С.И. Методы оздоровления крупного рогатого скота от туберкулёза // Сб.науч.трудов ИЭВСиб.и ДВ.-1986.-С.3-11.
Джупина С.И. Рациональная эпизоотологическая классификация инфекционных болезней сельскохозяйственных животных. Вестник РАСХН. – 2001, №2.– С.71-75.
Джупина С. И. Кризис ветеринарии./ С. И. Джупина// 2007.– http://cow-leech.ru/docs/index-1277.html
Донченко А.С., Смолянинов Ю.И. Сравнительная экономическая оценка оздоровительных мероприятий при туберкулёзе крупного рогатого скота// Зооантропонозные болезни, меры профилактики и борьбы.-Гродно.-1997.-С.78-80.
Дудникова, Н.С., Краткий обзор эпизоотической ситуации в странах Северной Африки и Средней Азиии по особо опасным болезням животных. Н.С. Дудникова, О.Н. Петрова // Владимир, ФГУ «ВНИИЗЖ», 2008.– 61 с.
Замена больного туберкулёзом скота здоровым –один из методов ликвидации этого заболевания // опина С.И. с соав. Эффективность мероприятий по борьбе с туберкулёзом животных: Тез.докладов.конф..-Киев.-1982.-С.91-92.
Ильясов А.Ф. Пути профилактики и оздоровления хозяйств мясного направления от туберкулёза крупного рогатого скота: Автор. Дисс. ..канд.вет.наук..-Новосибирск.-1981.-с.19.
Ильясов А.Ф. Пути профилактики и оздоровления хозяйства мясного направления от туберкулёза крупного рогатого скота.-Автореф.дисс..канд.вет.наук.-Новосибирск.- 1981.-с.16.
Крюков С.Я., Хайкин Б.Я., Новицкий А.А. Ликвидируем хронические инфекции // Ветеринария.-1985.-№4.-С.10-12.
Кузин А.И. Латентная туберкулёзная инфекция и ее значение в эпизоотологии туберкулёза крупного рогатого скота // Автореф.дисс. .. док.вет.наук.-М.,1977.-с.32.
Кузин А.И. Оздоровление животноводческих хозяйств от туберкулёза.-М.: Россельхозиздат.,1982.-с.103.
Кузин А.И. Туберкулез сельскохозяйственных животных и его профилактика//– М.:Росагропромиздат, 1992.– 189 с.
Макаров В.В. Эпизоотологическая методология.// М.:РУДН, 2001. – 224 с.
Мельник В.М. Туберкулёз на Украине: состояние, проблемы и прогноз (медико-статистические исследования)// Проблемы туберкулёза.-2000,№2.-С.28-31.
Найманов А.Х. Современные особенности эпизоотической ситуации по туберкулезу КРС http://vetlifegazeta.ru/category-22/page-322/
Нуйкин Я.В. К вопросу прогнозирования эпизоотий // Сб.науч.трудов МВА.-1975.,т.79.-ч.1.-С.102-105.
Обоева Н. А. Оптимизация методов контроля благополучия стад крупного рогатого скота по туберкулезу //Автореферат дис… к вет. н. – Новосибирск, 2010. – 19 с.
Обьедков Г.А. Усовершенствование эпизоотологической терминологии при зоонозах // Актуальные вопросы эпизоотологии:Тез.докл..-Казань,1983.-С.31.
Олениченко В.И. с соав. Некоторые эпизоотологические данные по туберкулёзу крупного рогатого скота в Одесской области // Сб.науч.трудов Одесского СХИ.-1972.-С.3-9.
Поляков В.А. Трансфазная передача атипичных микобактерий у кровососущих комаров / В.А. Поляков, В.И. Гольшевская, Р.М. Ермакова // Сб.науч. тр. Всерос. НИИ вет.-сан. Гигиены и экологии. – 1995. – Т. 98. – С. 3-9.
Прокопьева Н.И. Почва как фактор передачи возбудителя туберкулёза // Сб.науч.тр. ЯкутскогоНИИСХ.-1987.-С.48-52.
Ротов В.И., Кокуричев П.И, Савченко П.Е. Туберкулёз сельскохозяйственных животных // К.:Урожай, 1973.-384 с
Сафин М.А. Эпизоотология туберкулёза крупного рогатого скота в Татарской АССР // Учен.зап. Казанского вет.и-та.-1976.-т.123.-С.16-22.
Симбирцев В.Е. с соавт. О соотносительности статистических показателей при оценке эпизоотического состояния животноводства по туберкулёзу // Актуальные вопросы эпизоотологии : Тез.науч.док.науч.конф.-Казань.-1983.-С.39.
Смолянинов Ю.И., Шкиль Н.А. Эпизоотологическое обоснование оздоровления ферм крупного рогатого скота от туберкулёза методом замены поголовья // Сб.науч.тр. ИЭВСиб.иДВ.-1986.-С.39-45.
Солодова, И.В. Ретроспективны анализ изменения эпизоотической ситуации по туберкулезу крупного рогатого скота в Российской Федерации за 1951-2009 гг./ И.В. Солодова// Автореф. дисс. ….канд. вет. н. – М., 2011.– 24 с.],
Стародынова А.К. Локализация и степень проявления туберкулёзных поражений у диких свиней // Труды Завидовского гос.науч.запов.-1974.,вып.3.-С.185-194.
Таршис М.Г. и соавт. Контролируемые эпизоотологические опыты и оптимизация специфической профилактики// Ветеринария.- №12.-1978.-С.71-74.
Тихонов П.М. Обеззараживание навоза при туберкулёзе // Эффективность мероприятий по борьбе с туберкулёзом животных:Тез.док.конф.- Киев,1982.-С.82-84.
Ткаченко А.А. Парааллергические реакции на туберкулин // Ветеринария.-1985.-№4.-С.29-31.
Туберкулез сельскохозяйственных животных и меры борьбы с ним./ Ю.Я. Кассич, А.Т. Борзяк, А.Ф. Кочмарский и др.: Под ред. Ю.Я Кассича. // К.:Урожай, 1990.-304 с.;
Туберкулез сельскохозяйственных животных./ А.М. Колычев, Ю.Я Кассич, О.В. Мартма и др.: Под ред. В.П. Шишкова, В.П. Урбана.// М.:Росагропромиздат, 1991.– 225 с.
Тузова, Р.В. Туберкулез сельскохозяйственных животных и птицы./ Р.В. Тузова.// Минск:Урожай, 1983.-263 с.;
Урбан В.П. О природе повторных вспышек туберкулёза // Ветеринария .-1982.-№10.-С.12-14.
Урбан В.П. Туберкулёз // Краевая эпизоотология Нечерноземной зоны РСФСР/ Под редакцией Урбана В.П, Таршиса М.Г..-М.: Колос,1980.-С.75-84.
Филимонов А.В. Причины повторного возникновения туберкулёза крупного рогатого скота в оздоровленных хозяйствах: Автореф.дисс. .канд.вет.наук..-М.,1983.-с.16.
Хазипов Н.З.,Сафин М.А.,Идрисов Г.З. Туберкулёз крупного рогатого скота //М., Агропромиздат,1985.-125с.
Хоменко, А Г. Туберкулез как международная и национальная проблемма//Пробл. туб.– № 2.–С.2-4
Шкиль Н.А. Эпизоотология и зональные особенности проявления эпизоотического процесса при туберкулёзе крупного рогатого скота // Сб.науч.тр.ИЭВСиб.иДВ.,1986.-С.34-39.
Щеткин А.А. Цикличность и корреляционная зависимость некоторых показателей эпизоотического процесса туберкулёза крупного рогатого скота // Науч.тех. бюлл. ИЭВСиб.ДВ., 1984., вып.30., С.3-9.
Эпизоотическая ситуация в РФ (1-й квартал 2011 года) • С.А. Дудников и соавт http://fsvps.ru/fsvps-docs/ru/iac/2011/files/iac2011_1kv.pdf
Эпизоотическая ситуация по особо опасным болезням животных на территории Российской Федерации в 2011 году по данным ФГУ «Центр ветеринарии»http://vet73.ulgov.ru/about/230/825.html
Эпизоотическая ситуация по особо опасным болезням животных на территории Российской Федерации в 2012 году http://www.vet-center.ru
Эпизоотическая ситуация в Российской Федерации 1-й квартал 2013 год/ С.А. Дудников и соавт http://www.fsvps.ru/fsvps-docs/ru/iac/2013/2013_1.pdf
Anon // Vet.Record.-1993, N133.-P.607-612.
Bloom, B.R. Tuberculosis: commentary on a reemergant killer./ B.R. Bloom, C.J. Murray//Science.– 1992. – Vol.257.– P. 1055-1064
Brown J.A., Harris S., White P.C. // Trends in Mycrobiology.-1994, N2.-P.43-53.
Castrioni, A. History of tuberculosis./Med.Life.–1933.–P. 1–96.
Clifton-Hadley R.S., Wilesmith J.W.// Vet.Record.-1991, 129. -P.5-12.
Coleman J.D., Cooke M.M., Jackson R. Temporal patterns in bovine tuberculosisin a brushtail possum population contiguous with infected cattle in the Ahaura valley, Westland // New Zealand Vet.J. 1999, 47: 4, 119-124.
Denny G.O., Wilesmith J.W. Bovine tuberculosis in Northern Ireland: a case control study of herd risk factors // Vet.Rec. 1999, 144: 12, 305-310.
Diamond, J.M. The arrow of disease//Discover.–1962.– Vol.13.– N 10.– P. 64-73.
Elephant diseases http://www.elephant.se/mycobacterium_tuberculosis. php?open=Elephant%20diseases]
[First reported case of fatal tuberculosis in a wild African elephant with past human–wildlife contact// V. Obanda [at all.]// Epidemiology and Infection.–Vol. 141/– P.1476-1480.]
Kean J.M., Barlow N.D., Hickling G.J. Evaluating potential sources of bovine tuberculosis infection in a New Zealand cattle herd // New Zealand J.Agricultural Research. 1999, 42: 1, 101-106.
Long-term temporal trends and estimated transmission rates for Mycobacterium bovis infection in an undisturbed high-density badger (Meles meles) population. RJ Delahay [at all.]//Epidemiol Infect.– 2013.– Vol. 28– P.1-12.
Modelling transmission of bovine tuberculosis in red deer and wild boar in normandy, france./ G Zanella [at all.]//Zoonoses Public Health.–2012.–Vol.59, N 2. P. 170-178.
Newell D.G., Hewinson R.G. Control of bovine tuberculosis by vaccination // J.Vet.Record.-1995, N 136.-P.459-463.
O’Connora, C. M. An ecological and comparative perspective on the control of bovine tuberculosis in Great Britain and the Republic of Ireland/. C. M. O’Connor, D. T. Haydonb, R.R. Kaoa// Preventive Veterinary Medicine.– 2012. – Vol.104, Iss.3–4. – Р. 185–197.
[Rastogi, N. The mycobacteria: an introduction to nomenclature and pathogenesis./ N. Rastogi, E. Legrand C. Sola //Rev. sci. tech. Off. int. Epiz.– 2001. –№ 20 (1). –Р. 21-54
Surveillance and movements of Virginia opossum (Didelphis virginiana) in the bovine tuberculosis region of Michigan./ WD Walter [at all.] Epidemiol Infect.– 2013.– Vol. 26.– P. 1-11.
Transmission of Mycobacterium tuberculosis from an Asian elephant (Elephas maximus) to a chimpanzee (Pan troglodytes) and humans in an Australian zoo. N. Stephens [at all.]// Epidemiology and Infection.–Vol. 141/– P. 1488-1497.
Tuberculosis in Elephants: Antibody Responses to Defined Antigens of Mycobacterium tuberculosis, Potential for Early Diagnosis, and Monitoring of Treatment K. P. Lyashchenko //Clin Vaccine Immunol.– 2006.–Vol. 13, N 7.– P. 722-732.
Wilkinson D., Smith G.C.et al The effects of bovine tuberculosis (Mycobacterium bovis) on mortality in a badger (Meles meles) population in England // J.Zoology.-2000, 250: 3, 389-395.
ДИАГНОСТИКА ТУБЕРКУЛЁЗА
Диагностика туберкулеза животных вообще и крупного рогатого скота в частности, остается недостаточно эффективной. В настоящее время нет ни одного теста, который отвечает критериям, необходимым для выявления всех инфицированных животных. Поэтому для достижения адекватного уровня выявления животных на разных стадиях развития инфекционного процесса необходимой является комплексность методических подходов с учетом чувствительности и специфичности диагностических тестов.
Полезность того или иного диагностического теста зависит от задач, которые должны быть решены путем его применения. В большинстве случаев испытания должны выявлять всех зараженных животных, однако нужно учитывать экономическую целесообразность проведения диагностических мероприятий с учетом эпизоотической значимости инфицированных животных с целью контроля заболевания на национальном уровне и в перспективе.
Определяющими характеристиками любого диагностического теста являются его чувствительность и специфичность. Как указывают S.A.Strainи соавт. (2011) [60] чувствительность может быть определена как вероятность того, что действительно инфицированное животное при исследовании даст положительный результат, а специфичность – как вероятность того, что при исследовании неинфицированного животного будет получен негативный результат. Диагностический тест с высоким уровнем этих характеристик называют «золотым стандартом». Относительно туберкулеза приближенным к «золотому стандарту» можно назвать культуральный метод диагностики, при котором специфичность может быть достаточно высокой (до 99,0%), но чувствительность, в силу ряда причин, относительно низкая. По даннымDownsи соавт, (2011) [50] реальная цифра чувствительности внутрикожного туберкулинового теста, вероятнее всего находится пределах 50%.
Существующие методы диагностики туберкулеза у крупного рогатого скота можно разделить на ряд категорий – посмертные и прижизненные, прямые и косвенные тесты. Прямые тесты основаны на визуальном выявлении признаков или возбудителей туберкулеза. К этой категории относятся клинический, патологоанатомический, гистологический биологический и культуральный (бактериологический) методы, полимеразно-цепная реакция.
Тесты, основанные на выявлении иммунологических маркеров, определяющих уровень реактивности животного организма на микобакетриальную инфекцию, относятся к категории непрямых. В свою очередь их можно разделить на 2 подкатегории: базирующиеся на клеточном (внутрикожная аллергическая проба и γ-интерфероновый тест) и гуморальном иммунитете (РСК,ELиISAдр.) [60].
Согласно действующей в нашей стране «Инструкции по борьбе с туберкулёзом животных» диагноз на туберкулёз устанавливается на основании результатов патологоанатомического, бактериологического, включая биологическую пробу, аллергического методов с учетом эпизоотологических данных и клинических признаков болезни.
В основу эпизоотологического метода исследования положена оценка эпизоотической ситуации по данным аллергических, патлогоанатомических и бактериологических исследований. В связи с продолжительным развитием инфекционного процесса и особенностями его проявления в различных органах клинический метод диагностики является малоинформативным и запоздалым в установке развития заболевания у животных. [8; 11; 36].
Формы клинического проявления туберкулеза у крупного рогатого скота многообразны, и подробно описаны в разделе «Патогенез». Они варьируют в зависимости от локализации и развития процесса. Первичный комплекс протекает чаще всего без видимых симптомов. При туберкулезе легких вначале появляется сухой, позже влажный кашель. При аускультации прослушиваются свистящие хрипы в области легких. Туберкулез матки приводит к бесплодию, в этом случае ректально пальпируются узлы и уплотнения на стенке матки и фаллопиевых труб. При туберкулезе вымени паренхима и лимфатические узлы уплотняются и увеличиваются. Туберкулез может поражать все органы.
Клинические симптомы наиболее выражены при генерализированном туберкулезе (ранняя и поздняя формы). Отмечаются лихорадочное состояние и все признаки тяжелой формы заболевания. Животное быстро ослабевает, через несколько недель наступает гибель [21].
При патоморфологическом исследованиях в лимфоузлах больных туберкулезом животных узелковые поражения. Милиарные туберкулемы необходимо отличать от узелков паразитарного и микотического происхождения. Паразитарные узелки содержат легко и полностью вылущиваемую некротическую массу, внутренняя поверхность их стенки гладкая и блестящая. Микозные узелки на вскрытии трудно дифференцировать от туберкулёзных. В сомнительных случаях проводят гистологическое исследование узелковых поражений. На туберкулёз указывает обнаружение эпителиодных и гигантских клеток, характерных для туберкулёзной гранулемы. У птиц, ввиду отсутствия у них лимфоузлов, на вскрытии обращают внимание прежде всего на печень, которая при туберкулёзе поражается всегда. Признаки болезни не характерны и выражаются нарушением деятельности пищеварительных органов и более или менее быстро наступающим истощением. В некоторых случаях наблюдаются расстройства движения, поражения Дыхательных путей, изменения в ротовой полости в форме язв или опухоли суставов, кожи и костей.
Анатомические изменения в виде отдельных мелких или сливающихся более крупных узелков находят преимущественно в печени, селезёнке, кишечнике, реже - в лёгких. В кишечнике узелки, после их перерождения распада, переходят в язвы.
Туберкулёз кур диагностируют бактериологическим анализом патологического материала, а при необходимости массовых исследований в крупных птицехозяйствах - внутрикожной туберкулиновой пробой. Туберкулин готовится из птичьих штаммов и инъицируется в кожу одной из бородок в дозе 0,1 мл тонкой иглой. Реакцию учитывают через 24 и 48 часов. Положительной реакцией считается ясно выступающее разлитое отёчное опухание бородки, в которую вводился туберкулин. В отличие от кратковременной неспецифической, положительная реакция держится не менее 48 часов.
Интенсивность развития и манифестация туберкулёзного процесса зависит от патогенности и вирулентности эпизоотического штамма возбудителя туберкулёза, места локализации первичного очага в организме. На характер развития туберкулёзной инфекции также оказывают влияние условия содержания, кормления, физиологическое состояние животного, интенсивность лактации и др. [21; 37; 42; 43; 46].
Диагноз на туберкулёз считается установленным только на основании выявленных патологоанатомических изменений, свойственных туберкулёзной инфекции или положительных результатов бактериологических исследований. Необходимо отметить, что в хозяйствах, где активно проводят плановые мероприятия по ликвидации туберкулёза, больные животные положительно реагируют на туберкулин, но большинство клинических и патоморфологических признаков у них просто не успевают развиться.
Методы бактериологического исследования микобактерий широко описаны в разделе «Возбудители туберкулеза и их изменчивость». Хотелось бы отметить, что применение только стандартных микробиолгических методик недостаточно для эффективной бактериологической диагностики туберкулеза. Известная олигобациллярность образцов диагностического материала, обнаруженная сниженная жизнеспособность и ферментативная активность микобактерий их очагов внелегочного туберкулеза обосновывают и диктуют необходимость использования посева на L-формы для повышения эффективности бактериологической диагностики туберкулеза [32].
В силу того, что туберкулиновая проба не является видоспецифичной из-за общих антигенов многочисленных видов микобактерий, способных сенсибилизировать животных, а некоторые условно-патогенные микобактерии вызывают у животных поражения, сходные с таковыми при туберкулезе, вызванномM.bovisиM.tuberculosis. Биологическая проба со слабовирулентными штаммами микобактерий туберкулеза нередко дает неопределенные результаты, схожие с воздействием условно-патогенных видов. В этих случаях большое значение имеют бактериологические исследования с углубленным изучением культурально-биохимических и хемотаксономических свойств выделенных штаммов микобактерий А.А.Лозовская и соавт. (2006) [28] описывают некоторые эпизоотологические клинические и патологоанатомические особенности распространения и проявления микобактериальной инфекции, вызваннойM.xenopy. Используя разные методы идентификации выделенных микобактерий авторы пришли к выводу, что наиболее эффективными методом идентификации этого вида возбудителя туберкулеза является определение состава высокомолекулярных эфиров жирных миколовых кислот с числом углеродных атомов 22, 24 и 26 с типичными двойными пиками насыщенных и ненасыщенных кислот.
Идентификация микобактерий
Существенное значение для постановки диагноза на туберкулез имеет своевременная и точная идентификация выделенных из клинического образца культур микобактерий. В настоящее время существует ряд способов идентификации микобактерий. Методы выделения их на плотных (в первую очередь Левенштейна-Йенсена) и жидких (Middlebrook7H9) средах с последующей культуральной и биохимической идентификацией сохраняет свое значение и в наше время. Однако все большее место занимают молекулярно-генетическия методы и высокоэфективная газожидкостная хроматография (ВЭЖХ), так как они значительно сокращают время получения результатов. Метод ВЭЖХ был предложен в 1985 году и уже в конце 80—х годов прошлого столетия было сделано заключение о необходимости его широкого применения в медицинской практике. В 1989 году в США ВЭЖХ была включена в обязательный набор тестов для стандартных методов для идентификации микобактерий.
В нашей стране использование этот метод для исследования микобактерий не использовался. М.В. Макаров и соавт. (2009) [27], сообщают, что применение ВЭЖХ для идентификации микобактерий основано на анализе состава высокомолекулярных миколовых кислот клеточной стенки микобактерий. Этот показатель является устойчивым фенотипическим признаком, что позволяет получать воспроизводимые результаты для определенного вида микобактерий. Высокая чувствительность метода дает возможность анализировать культуры, полученные на жидких питательных средах. По заключению авторов статьи, в целом совпадения результатов, полученных с помощью ВЭЖХ и бактериологических методов, имело место в 96,1% случаев, в том числе среди быстрорастуших туберкулезных микобактерий в 96,2%, медленно растущих – 95, 3%, M.tuberculosis– 97,0%. Частичные несовпадения результатов идентификации можно объяснить, с одной стороны, вариабельностью бактериологических свойств одного и того же вида микобактерий, с другой – схожестью свойств разных видов, а также субъективизмом в оценке результатов, полученных с помощью микробиологических тестов. В то же время идентификация методом ВЭЖХ является более точной и быстрой– результат удается получитьв течениии24 часов).
М.А. Иванова и соавт. (2009) [44] обращают внимание на принципиально новый экспресс-метод идентификации микробов – лазерно-флюоресцентный. Он основан на способности специфических органических молекул биологического субстрата флюоресцировать при поглощении лазерного излучения видимого и ультрафиолетового диапазона. Установлено, что по спектрам флюоресценции разные виды микобактерий отличаются друг от друга по форме, пикам и интенсивности свечения. Для повышения интенсивности свечения авторы предложили воздействовать на микобактерии разрушающим структуру клеточной стенки микроорганизмов нефлюоресцирущим детергентом – мирамистином. Разработанная технология идентификации микобактерий на основе явления флюоресценции, индуцированной лазером, имеет специфичность 80–90%.
Одновременно с использованием рутинных методов выявления туберкулезного процесса исследователи занимались разработкой новых диагностических тестов. Ю.И. Макаров и соавт (2006) получили патент на разработанный способ выявления некультивируемых микобактерий туберкулеза крупного рогатого скота, включающий отбор пробы для анализа, посев на питательную среду и выявление микобактерий туберкулеза, отличающийся тем, что перед посевом на питательную среду отобранной пробой заражают морских свинок и осуществляют пассирование зараженного биоматериала через организм морских свинок с интервалом в 21 день, которым одновременно вводят внутримышечно кортизон в дозе 12,5 мг на голову.
Одним из современных методов прямого обнаружения возбудителей туберкулеза также является полимеразная цепная реакция (ПЦР) [33]. С помощью этого метода можно получать микрограммы ДНК или РНК, даже когда они присутствуют в препарате в виде единственной молекулы.
Вся полимеразная цепная реакция осуществляется invitroс использованием ДНК-полимеразы и олигонуклеотидных праймеров комплементарных двум 3’-концам участков, ограничивающих амплифицируемый дуплексный сегмент.
Возможность быстрой диагностики инфекционных заболеваний путём прямого скрининга ограничивается отсутствием достаточно чувствительных методов детекции. Молекулярно-биологические методы, основанные на использовании специфических зондов для обнаружения патогенных микроорганизмов, имеют ряд преимуществ перед классическими методами культивирования invitroс последующим биохимическим и серологическим тестированием. Однако, хотя они и не требуют применения биохимических и иммунологических методов, их чувствительность тоже недостаточна для прямой идентификации микроорганизмов в таких сложных клинических образцах, как кал или моча. Чувствительности и специфичности, необходимых для обнаружения экзогенных нуклеотидных последовательностей непосредственно в клинических образцах, можно достичь, если перед гибридизацией с зондами провести ПЦР-амплификацию. Это позволяет получить за несколько часов миллионы копий искомой последовательности-мишени. С помощью ПЦР можно амплифицировать и обнаружить всего одну молекулу ДНК на фоне огромного числа молекул геномной ДНК, присутствующих в образце.
ПЦР-продукты можно анализировать несколькими способами. Их можно зафиксировать на твёрдой подложке (фильтре) и гибридизовать с меченными зондами или провести гибридизацию в растворе, а затем гель-электрофорез и радиоавтографию. Амплифицированную нуклеиновую кислоту-мишень можно обнаружить непосредственно в агарозном геле, окрашенном бромистым этидием. Традиционные микробиологические исследования играют большую роль в специфической диагностике туберкулеза. Однако в связи с его недостаточной чувствительностью и длительностью метода посева роль данных методов в диагностике туберкулеза остается ограниченной. В медицинской фтизиатрической диагностической практике молекулярно-генетические методы, в частности ПЦР, применяются с начала 90-х годов прошлого века. Однако этот диагностический тест не удовлетворяет в полной мере диагностов. Он может быть полезен для выявления раннего периода туберкуловыделения из организма больных.
Полимеразная цепная реакция (ПЦР) представляет собой метод для идентификации специфических последовательностей ДНК бактерий. В принципе, метод представляет собой очень привлекательный способ идентификации патогенов, за короткий срок, он может быть легко стандартизирован, имеет высокую чувствительность и способен обнаружить низкие количества ДНК.
Как указывают S.AStrainи соавт. [60], ПЦР очень широко применяется в области вирусологии, но ввиду особенностей биологии микобактерий использование этого метода для диагностики туберкулеза достаточно ограничено – тесты включают в себя скрининг патматериала, проб окружающей среды, в том числе фекалии, истечения из дыхательных путей и т.п.
Учеными проведен значительный объем исследований, направленный на разработку надежных методов обнаружения ДНК микобактерий как в гуманной, так и ветеринарной медицине. Однако на сегодняшний день ни одна из версий этого метода не может в достаточной мере обеспечить диагностику туберкулеза. Так, исследованиями, проведенными в 2008 году показано, что специфичность ПЦР-анализа патологического материала от больного туберкулезом крупного рогатого скота составляет 61-65% по сравнению с обычными патологоанатомическим и культуральным методами. Аналогичный вывод сделан в 2010 г. относительно диагностики туберкулеза у барсуков [60].
Среди основных причин, которые не позволяет реализовать потенциал ПЦР для диагностики туберкулеза можно назвать трудности извлечения ДНК из-за прочной клеточной стенки, а также «проблему выборки» – биологические образцы содержат недостаточное количество возбудителя и ингибиторы, препятствующие проведению эффективной ПЦР [60]. Кроме того, вариант теста, предназначенный для определения очень низких уровней ДНК, требует соблюдения очень строгих лабораторных процедур, чтобы избежать ложных положительных результатов. Для преодоления этой проблемы была разработана система GeneXpert, которая позволяет максимально автоматизировать процессы разрушения бактериальной клетки, выделения нуклеиновых кислот и амплификации внутри одноразового картриджа, а продолжительность анализа составляет 2 часа [60].
В исследованиях мокроты человека BoehmeC.C. и соавт. (2010) [58] показано, что чувствительность вышеописанной системы составляет 98,2% против 72,5% эффективности микроскопии мазка.
Возможно, этот тип технологии может использоваться как експресс-метод диагностики бычьего туберкулеза, однако стоимость этого может ограничить широкое их использование.
Для повышения специфичности и чувствительности традиционного ПЦР-анализа А.А. Александров и соавт. (2006) [36] предложили новый способ пробоподготовки, основанный на использовании иммуномагнитной сепарации микобактерий из биологического материала (мокроты). По результатам авторов, чувствительность ПЦР-анализа при использовании этого приема, составила 76,0%, а специфичность – 99,4%.
Возможно, вышеописанный методический поход в постановке ПЦР найдет применение и в ветеринарной практике для подтверждения наличия возбудителя в первую очередь в органах и тканях, где туберкулезный процесс находится на начальных этапах развития. Оценивая ПЦР А.Г. Найманов и соавт [30] делают вывод, что его можно использовать только как дополнительный экспресс-диагностический тест при исследовании патматериала и для идентификации M.bovis.
В целом современных молекулярных инструментов недостаточно для прямого обнаружения M. bovis в биологическом материале, однако сполиготипированиие широко используется для дальнейшей характеристики микобактерий, выделенных с помощью рутинных культуральных методов и их окончательной идентификации.
Значение аллергической диагностической пробы для выявления инфицированных и больных животных
Основным методом прижизненной диагностики является аллергическая кожная проба с помощью ППД-туберкулина для млекопитающих, которая в ветеринарной медицине применяется более ста лет [9]. Этот метод основан на определении повышенной чувствительности замедленного типа к туберкулину, возникшей в результате заражения вирулентными микобактериями туберкулёза. Впервые этот феномен был описан Р. Кохом. Однако первым термин «аллергия» использовал австрийский ученый Пирке в 1907 году, когда предложил диагностический тест-пробу Пирке. Слово «аллергия» происходит от греческого «аллос» – отклонения от первоначального состояния и «ергос» – чувствительность, т. е. измененная чувствительность. Туберкулин впервые был получен Р. Кохом в 1890 году и носил название АТК (Alt-tuberculinum Kochi) и представлял собой фильтрат 6–9-недельной культуры МБТ, выращенных на мясопептонном 5 % глицериновом бульоне, простерилизованном текучим паром в течении 1 часа и сгущенном до 1/10объема при температуре 90°С. В настоящее время для нужд ветеринарии готовят безальбумозный туберкулин на синтетической среде [12].
Сухой очищенный туберкулин PPD (Puricid protein derivative) в нашей стране был впервые получен в 1939 г. М. А. Линниковой [20].
По месту введения туберкулина его разделяют на внутрикожный подкожный, внутривенный, внутрибрюшинный, глазной и интрапальпебральный диагностические тесты [7; 31; 35].
Для аллергической диагностики туберкулёза применяют сухой очищенный туберкулин для млекопитающих, птиц, а для дифференциальной диагностиики и аллерген (сенситин) из атипичных микобактерий – КАМ.
Очищенный туберкулин для млекопитающих является продуктом аутолиза и водотермического гидролиза микобактерий туберкулёза бычьего вида штамма №8, выделенного в 1934 году от больной туберкулёзом коровы во Всероссийском институте экспериментальной ветеринарии. Выращивание микобактерий туберкулёза проводится на жидкой синтетической среде, в течение 50–55 дней, а концентрирование и очистка препарата проводится с применением трихлоруксусной кислоты, сернокислого аммония.
В 1 мл туберкулина, при концентрации белка 1 мг/мл содержится 50–55 тысяч туберкулиновых единиц, 80–85% белка, 5–8% полисахаридов, 3–6% нуклеиновых кислот и небольшое количество липидов.
Сухой очищенный туберкулин для птиц, изготавливается по типу ППД млекопитающих, но из продуктов аутолиза и воднотермического гидролиза микобактерий птичьего вида штамма № 2282.
КАМ – аллерген из продуктов аутолиза воднотермического гидролиза одного из штаммов атипичных микобактерий. Название КАМ – как «комплекс атипичных микобактерий» является не правомочным, т.к. содержит продукты деструкции одного штамма а не их комплекса. Это название предложено А.Г.Шаровым и применяется только в России.
В качестве растворителя сухих очищенных аллергенов или в стандартном разведении используется физиологический раствор с добавлением 10% глицерина и 0,25% фенола. Наличие фенола и глицерина в растворителе негативно отражается на проявлении офтальмореакций на туберкулин.
Альттуберкулины в настоящее время не изготавливаются из-за содержания в МПКГБ балластныых веществ такие как белки мяса, экстрактивные вещества картофеля, пептона, которые могут вызывать неспецифические реакции у животных, за исключением альттуберкулина для птиц, предназначенного для аллергической диагностики паратуберкулёза.
В некоторых странах вместо МПКГБ для получения альттуберкулинов или точнее безальбумозных нативных туберкулинов выращивание микобактерий туберкулёза проводится на синтетической жидкой среде. Это связано с тем, что в МПКГБ а также низким накоплением бакмассы – до 0,3–0,5% вместо 1,2–1,5% на средах, состоящих из химических известных ингредиентов.
Для диагностики туберкулёза применяли различные методы и реакции, в т.ч. РСК. Антиген для РСК изготавливался из водно-спиртовых экстрактов микобактерий туберкулёза бычьего вида с добавлением в качестве шлеппера водного экстракта из лёгких здорового крупного рогатого скота. Позитивную сыворотку для РСК получали иммунизацией автоклавированной туберкулёзной культурой крупного рогатого скота.
Целесообразно при этом учитывать разную этиологию явления аллергии и аутоиммунитета. Несмотря на то, что деструкция тканей, органов часто имеет место при туберкулёзе, а в сыворотке крови обнаруживаются антитела к ДНК, легочному антигену или из других органов, тканей сосудов, нет пока обоснованных данных о том, что аутоиммуный компонент играет роль в патогенезе туберкулёза и тем более имеет аллергическую природу.
Подобные антитела не отражают аллергического компонента микобактериальной клетки, т.к. они вырабатываются не к бактериальным антигенам органов и тканей, повергшихся разрушению в результате заболевания.
С учетом вышеуказанных позиций, вероятно, неправомочно использовать экстракт из лёгких здорового крупного рогатого скота в качестве дополнительного компонента к антигену для постановки РСК. Помимо РСК и аллергической диагностики туберкулёза животных, птиц широкое применение приобретают методы люминесцентной микроскопии, РДП, РНГАг, реакция повреждения нейтрофилов, агломерации лейкоцитов, бласттрансформации, радио- и иммуноферментные методы и полимеразная цепная реакция (ПЦР).
Установлено, что в результате взаимодействия аллергена с клетками-носителями антител (лимфоциты, макрофаги) часть этих клеток погибает, причем возникает воспаление, характерное для положительной туберкулиновой реакции, которая проявляется на коже в месте введения туберкулина. Патоморфология кожной туберкулиновой реакции в начальной стадии (первые 24 часа) проявляется отёком и экссудацией, а в более поздние сроки (72 часа) – мононуклеарной гистиоцитарной реакцией. Гиперэргические реакции сопровождаются выраженным некрозом, обнаруживаются специфические элементы с эпителиоидными и гигантскими клетками в месте введения аллергена [21].
Интенсивность реакций на туберкулин зависит от количества и вирулентности возбудителя инфекции, чувствительности и реактивности организма. Под влиянием постепенно нарастающих доз, применяемых со значительным промежутком времени, чаще происходят десенсибилизация и снижение туберкулиновой чувствительности, что используется при туберкулинотерапии.
К сожалению, аллергический метод диагностики туберкулеза не всегда позволяет получить адекватный результат из-за влияния большого количества факторов на иммунный ответ к введенному туберкулину. Кроме того, при туберкулезной инфекции зачастую развивается состояние анерги, которое является причиной ложноотрицательных результатов внутрикожной пробы [3; 13; 53].
На несовершенство аллергического метода прижизненной диагностики туберкулеза указывают и медицинские исследователи [24].
Анализируя эффективность разных способов введения туберкулина (подкожный, внутрикожный, глазной, внутривенный и др.), Нуратинов Р.А., 2000, [31] и Зеленская М. (2003) [15] указывают, что среди разнообразных методов диагностики нет ни одного, который бы давал возможность определять этиологический фактор сенсибилизации микобактериями. Некоторые исследователи констатируют, что после туберлинодиагностики в неблагополучном по туберкулезу стаде остается с невыявленной инфекцией до 10% зараженныхM.bovisживотных.
Так, состояние анергии развивается у крупного рогатого скота с генерализованной формой туберкулёза, истощенных животных [5, 34]. Аллергическая реактивность животных изменяется в зависимости от физиологического состояния организма, сезона года, кормления животных [16; 17; 23].
Чувствительность внутрикожной туберкулиновой пробы по данным некоторых авторов колеблется от 42 до 95 % у разных физиологических групп крупного рогатого скота [49]. Для повышения специфичности внутрикожного теста диагностики туберкулеза рекомендуют добавление к существующим аллергенам рекомбинантного антигена Rv3615c. Это позволяет повысить диагностическую чувствительность теста с сохранением его спeцифичности [52].
Подкожная туберкулиновая проба не нашла практического применения [9] в связи с десенсибилизирующим эффектом.
Глазная проба для истощенного крупного рогатого скота является более достоверной, чем внутрикожная [16]. При проведении диагностического убоя животных, реагирующих на офтальмопробу и кожную пробу достоверно большее количество коров с патологоанатомическими изменениями туберкулёзного характера выявлено в группе животных, преимущественно реагирующих на глазную пробу [1].
До настоящего времени не выработаны общие подходы к учёту результатов диагностической туберкулиновой пробы. Так, N. Plum [57] считает, что при применении очищенного туберкулина диагностически достоверным является утолщение кожной складки более 4 мм, а С. Н. Вишелесский (цит. по Тузовой [39]) – что внутрикожная проба является положительной при наличии характерного тестообразного, резко ограниченного воспалительного процесса в месте введения аллергена, а толщина кожной складки играет второстепенную роль.
При учете кожного теста на туберкулин необходимо учитывать ее трехфазный характер. В первой фазе, длящейся 10–15 часов, развивается неспецифическая воспалительная реакция на раздражительность с экссудацией полиморфонуклеаров. Вторая фаза развивается через 15–20 часов, она является специфической и характеризуется реакцией тканей на повреждение и вовлечение в инфильтрат пролиферирующих местных элементов и клеток, мигрировавших из сосудов. При вялом течении или при нахождении организма в состоянии анергии проводится повторное введение туберкулина.
Существуют противоречивые данные и по поводу диагностической ценности повторного введения туберкулина. Одни авторы [39] утверждают, что однократное введение туберкулина недовыявляет до 67 % больных туберкулёзом, другие авторы [43] указывают, что повторное введение туберкулина выявляет в три раза больше реагирующих животных, третьи [14] – дополнительно до 33,3% реагирующих животных.
В. П. Урбан [43] предлагает при применении двукратной туберкулиновой пробы проводить повторное введение туберкулина через 48 часов, а учёт реакции проводить только через 24 часа, что позволяет выявить дополнительное количество реагирующих животных.
Однако А. Х. Найманов [30] считает, что ППД-туберкулин для млекопитающих – активный аллерген и его необходимо применять однократно в хозяйствах с различной эпизоотической ситуацией.
Неспецифические аллергические реакции условно можно разделить на две группы: парааллергические и псевдоаллергические.
Одной из главных причин возникновения парааллергических реакций является сенсибилизация животных нетуберкулёзными, сапрофитными микобактериями [40]. Многие исследователи причиной псевдоаллергических реакций считают различные инвазии (фасциолез, дикроцелиоз, эхинококкоз), лейкоз, паратуберкулез, грибковые инфекции, белковый перекорм и др. [19; 23; 60].
В наших экспериментальных исследованиях была изучена роль ретровирусной инфекции в формировании псевдоаллергической реакции на ППД-туберкулин для млекопитающих и птиц а также на проявление аллергичесих реакций при заражении овец М. avium.
Для достижения поставленной цели экспериментальные исследования были проведены на 3-х группах овец 5-6 месячного возраста. На первом этапе опыта животные 1-й группы (n=3) были заражены вирусом лейкоза крупного рогатого скота (ВЛКРС) путем введения крови больной лейкозом коровы. На 140-й день опыта (второй этап) овец первой и второй групп (n=4) инфицировали культурой M. avium (по 1 мг бакмассы на кг массы тела подкожно в средней трети шеи). Животные 3-й группы (n=3) оставались контрольными.
Через 30 и 120 дней после заражения лейкозом и 120, 150, 180 и 210 дней после инокуляции микобакетрий животные всех групп подвергались туберкулинизации путем введения внутрикожно по 0,2 мл ППД-туберкулина для млекопитающих (в правое бедро) и ППД-туберкулина для птиц (в левое бедро). Учет результатов реакции проводили через 48 и 72 часа после введения аллергенов.
О динамичном развитии лейкозного процесса свидетельствует тот факт, что на 14-й день после заражения ВЛКРС в цельной сыворотке двух овец первой группы в РИД были выявлены антитела против ВЛКРС, а на 28-й день – у всех животных. В течении 4,5 месяцев титр специфических антител у двух овец достиг 1:8, у одной – 1:4. В этот период исследований инфицирования исследований у животных не выявлено состояния аллергии на внутрикожно введенные аллергены. Полученные данные указывают на отсутствие развития псевдотуберкулиновых реакций при ретровирусной инфекции и опровергают утверждение некоторых исследователей об увеличении числа реагирующего на аллерген крупного рогатого скота в неблагополучных по лейкозу стадах за счет параспецифических реакций у инфицированных ВЛКРС животных.
Уже на 30-й день после инфицирования опытных животных M.аviumс помощью аллергической туберкулиновой пробы у овец первой и второй групп выявлено развитие микобактериального процесса. Так, через 48 часов после введения ППД-туберкулина для птиц у овец первой группы признаки аллергии отсутствовали, а через 72 часа реакция выявлена у двух из трех животных. В то же время у всех овец второй группы состояние аллергии выявлено через 48 часов после введения диагностикума.
В последующие 180 суток опыта овцы изучаемых групп проявляли существенные качественные различия аллергической реакции на оба аллергена (табл. 11).
Таблица 11. Интенсивность (мм) аллергической реакции у овец опытных групп на ППД-туберкулин для птиц
|
ДДни ппосле введе-ния M.avium |
1-я группа |
2-я группа | |||||||||
|
часов после введения туберкулина |
часов после введения туберкулина | ||||||||||
|
48 |
72 |
48 |
72 | ||||||||
|
% реаг. |
мин–макс |
% реаг. |
мин–макс, мм |
% реаг. |
мин–макс, мм |
% реаг. |
мин–макс | ||||
|
120 |
100 |
7х7 –14х17 |
100,0 |
6 х 7 –11х12 |
100 |
5х8 –20х18 |
100,0 |
5х7 – 20 х 21 | |||
|
150 |
100 |
5х4 –10х10 |
100,0 |
5х7 – 9х7 |
100 |
4х5 –20х18 |
100,0 |
5х5 –20х25 | |||
|
180 |
33,3 |
4х4 |
66,6 |
3х5 – 4х4 |
75,0 |
8 х 9 –16х13 |
100,0 |
4х5 –11 х 15 | |||
|
210 |
66,6 |
5х6 –8х10 |
33,3 |
6х6
|
75,0
|
6х10 – 8 х9 |
25,0 |
5х5
| |||
Данные таблицы свидетельствуют о более низком иммунном ответе у овец первой группы на ППД-туберкулин для птиц.
Аналогичная закономерность имела место в показателях аллергической реакции на внутрикожное введение ППД-туберкулина для млекопитающих, однако интенсивность реакции на этот аллерген была менее выражена, чем на ППД-туберкулин для птиц: у овец первой группы не превышала 4х5 мм, а второй – 10х6 мм. На основании полученных результатов можно сделать вывод, что ретровирусный инфекционный процесс обуславливает замедление проявления реакции на ППД-туберкулин для птицы на 24 часа у овец на начальных этапах микобактериоза, вызванного М. avium.
Ряд авторов также указывает на возможное влияние на реактивность животных к туберкулину антибиотикотерапии, вакцинаций, ко-инфекций (вирусных, бактериальных и паразитарных заболевание). К маскирующим инфекциям можно отнести микобактериозы, вызываемые микобактериями, относящихся к комплексу avium-intracellulare, в том числе М.aviumparatuberculosis[40; 59].
В связи с этим проводятся исследования по установлению влияния на чувствительность или ареактивность, десенсибилизацию животных к туберкулину при иммунизации формолвакцинами, после приема ряда антигельминтных препаратов, скармливание мочевины, карбамида и состояние чувствительности при фасциолезе, мастите и некробактериозе у коров, а у свиней, больных липтоспирозом, пастереллезом и с синдромом гипогликемии, а также влияние учащенной туберкулинизации.
При этом установлена ареактивность к туберкулину у коров, больных некробактериозом с разной степенью патологии. При проведении трехкратной двойной внутрикожной и глазной туберкулинизации с туберкулином ППД для млекопитающих и птиц, КАМ, ни у одного животного увеличение кожной складки на 3 мм и более не отмечалось (рис. 23).
Рис. 23. Симультанная аллергическая проба с использованием ППД туберкулина и КАМ
Совпадение реакций на аллергены не наблюдается, обычно они нестабильные и в последующих исследованиях выпадают. Офтальмопроба во всех случаях не проявляется.
Аналогичная ареактивность на туберкулин установлена у крупного рогатого скота при мастите и фасциолезе, и у свиней, больных лептоспирозом, пастереллезом с синдромом гипогликемии.
При изучении влияния формолвакцины против ящура и паратифа у реагирующего крупного рогатого скота со средним увеличением кожной складки на введение туберкулина 9–12 мм установлено снижение чувствительности на 50–60%, а при реакции в 3–6 мм на 70–90%, которое сохранялось свыше 30–35 дней.
Добавление в корм крупному рогатому скоту мочевины в дозе 30–50 г. на голову в течение 10–15 дней не вызывало повышение чувствительности к туберкулину на двухкратное его внутрикожное введение. При этом у животных отмечено увеличение специфических белков глобулиновой фракции в сыворотке крови. Следовательно, использование мочевины для сбалансирования рациона не только по общему количеству протеина, но и по аминокислотам, не вызывает аллергизации организма животных к туберкулину.
Антигельминтные препараты фенотиазин, гексахлорэтан (фасциолин), дертил «О», «Б» (нихлофолан) – 1–4 таблетки полностью подавляют первоначальную чувствительность кожи к туберкулину у крупного рогатого скота в пределах 6–9 мм. Частичное восстановление чувствительности кожи к туберкулину проявляется через 30–35 дней. Внутримышечное введение четыреххлористого углерода в форме 50% раствора в минеральном масле в дозе 0,1 мг/кг у коров не вызывает появлений реакций на туберкулин, а у ранее реагирующих животных на аллерген подавляет чувствительность.
Из вышеуказанных данных следует, что не эффект дезинвазии фасциолеза, а различная фармакодинамика антигельминтных средств является депрессирующей (причиной снижения) для аллергической реактивности животных к туберкулину.
Одновременное введение формолвакцин против ящура или паратифа полностью подавляет первоначальную реакцию в пределах 10–14 мм у коров на туберкулин в течение 35 дней.
С учетом того, что для дезинфекции и инактивации вирусов и др. микроорганизмов при изготовлении вакцин и анатоксинов используется формалин, β-пропилактон, глутаровый альдегид и полиэтиленгликоль было проведено изучение влияния указанных препаратов на аллергенные свойства туберкулина. Установлено, что аллергенная активность туберкулина ППД для млекопитающих в объеме 1 мг/мл полностью инактивируется в смеси с указанными препаратами при исследовании на реагирующем крупном скоте на туберкулин. При этом такой туберкулин способен десенсибилизировать чувствительность животных к аллергену.
Для дифференциации аллергических реакций рекомендовано использование сенситинов из атипичных микобактерий и комплексного аллергена из атипичных микобактерий (КАМ), а также одновременне применение туберкулина для млекопитающих и птиц удается дифференцировать парааллергические реакции [25].
По заключению ряда авторов [22; 42; 55] использование симультанной пробы с одновременным применением сенситинов из атипичных микобактерий дает возможность дифференцировать аллергические реакции.
По данным А. Н. Шарова с соавт. [45] животные, сенсибилизированные атипичными микобактериями в большей степени реагируют на КАМ, а в неблагополучных по туберкулёзу хозяйствах крупный рогатый скот преимущественно реагирует на ППД-туберкулин для млекопитающих.
С целью улучшения специфичности и активности туберкулинов В. П. Урбаном с соавт. [43] из штамма № 1165 был изготовлен аллерген ЛВИ, а безальбумозный туберкулин А. А. Евглевским [12], которые по специфичности и активности превосходили стандартный ППД-туберкулин Курской биологической фабрики.
Из приведенных литературных данных можно сделать вывод, что проблема дифференциации неспецифических аллергических реакций в связи с их многопричинностью выходит на первый план и её безотлагательное решение может значительно сократить экономические затраты на диагностические исследования. Более глубокое изучение механизмов аллергических реакций поможет в будущем решить эти проблемы.
Механизмы развития аллергических реакций при туберкулезе
Необходимо отметить, что туберкулёз относится к заболеваниям, при которых аллергия участвует как обязательный компонент основного патологического процесса. Поэтому диагностика аллергического состояния организма есть диагностика основного заболевания. Клиническое проявление аллергического процесса весьма разнообразно, механизм его пока недостаточно изучен. Кроме специфической аллергии, организм в одних случаях проявляет одновременно повышенную чувствительность к некоторым химическим родственным аллергенам – пример поливалентной аллергии, в других случаях проявляется чувствительность к чужеродным аллергенам – пример псевдоаллергии, а в некоторых случаях наблюдается аллергия к «своим» органам, тканям, которая получила название ауто-, или эндоаллергия.
Следовательно, в ответ на контакт с антигенами микробов, вирусов, паразитов у животных может развиться повышенная чувствительность различных типов. Повышенная чувствительность замедленного типа характерна для инфекций при которых возбудитель находится внутриклеточно.
Вследствие все еще недостаточности знаний о структуре аллергизирующих соединений – точная стандартизация аллергенов затруднена. В иммунном ответе главную роль играют лимфоциты, которые с помощью рецепторов распознают антигены, точнее антигенные дерминанты (эпитопы).
У белков замена даже одной единственной аминокислоты может изменить специфичность аллергена. Для аллергенной и антигенной специфичности белков имеет значение их конформация.
В связи с этим достаточно незначительных структурных вариаций в аллергенной детерминанте, чтобы изменить его специфичность. Специфичность аллергенной детерминанты проверяется по реакции взаимодействия с гомологичным антителом.
Изменение последовательности молекул и конформационных детерминант аллергена существенно влияет на его специфичность. Например, денатурация белков приводит к потере некоторых конформационных тереминант. В то же время проявляются новые детерминанты, которые были ранее скрыты внутри молекулы. Денатурированные белковые молекулы аллергена полностью или частично теряют свою аллергенную специфичность и приобретают новую, которая отражается на аллергической реакции. Специфичность выражается в том, насколько точно аллергенная детерминанта «признана» к аллергенсвязывающему центру антитела или рецепторам лимфоцитов. Комплементарность антидерминанты у специфического (гомологичного) аллергена выше, чем у перекрестно реагирующего. В основе взаимодействия перекрестно реагирующих аллергенов лежит структурное подобие или полное сходство с детерминантами специфического аллергена. Отсутствие теоретического освещния и знаний о молекулярной структуре аллергизирующего комплекса микобактерий, а многократное применение концентрации и очистки туберкулиновых аллергенов, с помощью трихлорукусной и уксусной кислот, сернокислого аммония, аммиака, нарушающие химический состав и конфигурацию детерминант аллергена нуждается в необходимости использование щадящих средств воздействия на аллерген при его изготовлении.
Гиперчувствительность (синоним – аллергия) замедленного типа считается проявлением клеточного иммунитета, поэтому она переносится не сывороткой, а лимфоцитами.
В целом разделение аллергии на гиперчувствительность замедленного и немедленного типов имеет лишь историческое значение. В связи с разнообразием изотипов иммуноглобулинов (антител) широкое применение реакций четырех типов, разработанные английскими иммунологами Джел и Кумбс. В реакции первого типа, именуемой анафилактической, участвуют антитела (реагины), связанные с тучными клетками, в реакции второго типа (цитоксической) взаимодействуют антитела и комплемент. В реакциях третьего типа участвуют преципитирующие локальную реакцию – феномен Артюса или васкулит. Патологические реакции четвертого типа обусловлены функциональной активностью Т-лимфоцитов, макрофагов, базофилов и т.д.
В настоящее время известно свыше 15 тысяч веществ, обладающих аллергизирующими свойствами в отношении организма людей, животных и птиц с различной степенью выраженности и длительности.
В то же время при туберкулёзе у животных развивается стойкая длительная аллергия, которая может утрачиваться под воздействием различных физиологических состояний и внешних стрессовых воздействий и вновь появляется.
Как правило, состояние пара- и псевдоаллергии со временем пропадают и не обнаруживаются при повторных исследованиях. На ответную реакцию кожи на туберкулин может оказывать значительное влияние общее состояние животных, температура окружающей среды, вакцинации, инфицированность вирусами, грибами, медикаментозное лечение, микроклимат. Установление истинной этиологии сенсибилизации организма возможно путем одномоментного применения набора видовых туберкулинов и других аллергенов и использование методов серодиагностики и аллергодиагностики вне организма.
Все вышеуказанное свидетельствует, что разные виды аллергии создают трудности в распознавании истинной этиологии аллергического состояния организма приемами моноаллергодиагностики, ввиду того, что в эпизоотической ситуации туберкулёзный процесс нельзя рассматривать как инфекцию, вызываемую только однокачественными видовыми возбудителями. Инфицированность, а следовательно, и сенсибилизация людей, животных, птиц происходит различными микобактериями и другими возбудителями. Об этом свидетельствуют перекрестные реакции на туберкулин. Достоверность аллергической диагностики туберкулёза животных зависит не только от формы течения инфекции, специфических свойств и активности аллергена, но и от той эпизоотической обстановки, в которой происходит взаимодействие организма с возбудителем, формируется инфекционный процесс, а также от физиологического состояния организма.
Применяемые туберкулиновые аллергены по содержанию туберкулиновых единиц различны и использование таких препаратов в симультанной пробе может вызывать недостоверные показатели в дифференциальной диагностике.
При аллергических исследованиях часто выявляются реагирующие животные на туберкулин, но туберкулёз у них не подтверждается. Такие реакции называют неспецифическими. Природа ложных аллергических реакций на туберкулин, внешне сходных с истинными, остается невыясненной. В то же время имеются сообщения о недовыявлении больных туберкулёзом животных при туберкулинизациях, в связи с чем возникают трудности в достоверности туберкулиновой пробы.
В исследованиях под электронным микроскопом установлено, что после выброса гранул сенсибилизированные тучные клетки полностью сохраняют жизнеспособность и об их повреждении говорить не приходится. Таким образом, одна и та же сенсибилизированная тучная клетка может по много раз вовлекаться в аллергические реакции. Рядом авторов были проведены повторные аллергические исследования не через 30 дней, как предусмотрено в наставлении по применению туберкулинов, а через 5-7 дней и получены адекватные реакции на аллерген у коров и у морских свинок после 4-х туберкулинизаций. Полученные результаты дают возможность проводить повторные туберкулинизации и в том числе симультанные в сокращенные сроки. Подтверждением вышеизложенному является проведение двойной туберкулинизации через 72 часа.
Следовательно, фасциолез, некробактериоз и мастит у коров, а у свиней лептоспироз, пастереллез и синдром гипогликемии не являются причиной неспецифических реакций на туберкулин, а формолвакцины и ряд антигельминтных препаратов подавляют чувствительность кожи к туберкулину свыше 30 дней.
Представленные результаты экспериментов необходимо иметь в виду при планировании и разработке регламентации сроков и действия противопоказаний к проведению аллергической диагностики туберкулёза у животных.
В связи с вышеизложенным при проведении аллергической диагностики туберкулёза крупного рогатого скота на практике надо рассматривать реагирующих на видовые туберкулины как подозреваемых в заражении их туберкулёзом. В этих случаях подтверждают диагноз данными паткартины и бактериологическим исследованием с биопробой. Только весь комплекс исследований поможет поставить правильный диагноз на туберкулёз у крупного рогатого скота.
Микобактерии туберкулёза, поглощенные макрофагами, попадают в лизосомы, в которых, происходит их полное или частичное расщепление. При полном распаде антиген теряет способность образования антител и к нему развивается иммунологическое толерантность, а при не полном антиген из лизосом вновь появляется на поверхности макрофагов с помощью информационной РНК. Такой видоизмененный аллерген вступает в контакт с рецепторами, находящимися на поверхности определенных клонов В-лимфоцитов и запускает синтез специфических антител.
Сенсибилизирующие антитела или иммуноглобулины типа «Е-реагины» (иногда называют кожносенсибилизирующими), бивалентны: одним концом они соединяются с клетками кожи, макрофагов или внутренних органов, а другим способны присоединять соответствующий аллерген.
Простой контакт аллергена с реагином на поверхности макрофага вызывает через систему циклических нуклеотидов усиление его секреторной функции и выделение гистамина, серотонина, брадикинина, гранул в тканевую среду.
Другие непрямые методы диагностики туберкулеза
По данным отечественных и зарубежных ученых аллергический метод диагностики со временем теряет значение в оценке наличия инфекции у разных видов животных [8; 29]. В настоящее время наиболее активно развивается направление, связанное с применением для диагностики туберкулеза серологических методов, в первую очередь иммуноферментного анализа (ИФА) для широкого внедрения в ветеринарную практику [42; 53] и иммунохроматографии [38]. Показано [47] что применение ИФА с использованием высокоиммуногенных пептидов из микобактериальных антигенов позволяет выявлять туберкулезную инфекцию до появления позитивной реакции в кожной пробе. Одним из новых подходов в диагностике инфекционных заболеваний животных, в том числе и туберкулеза, является анализ статистического распределения в стаде уровней антител, определяемых с помощью ИФА. Кроме того, как указывают Т.А. Редчук и соавт. (2010), [38] такой подход к оценке эпизоотологического статуса стада позволяет избежать методологической проблемы выбора контролей в связи с тем, что статус отдельного животного не играет определяющей роли. Исследователи питают большую надежду на повышение специфичности иммуноферментного анализа, в том числе с использованием рекомбинантных белков [38; 54]. Авторами были получены рекомбинантные аналоги антигенов МРВ63 и МРВ83 M.bovis, которые являются высокоиммуногенными и могут оказаться перспективными при разработке средств диагностики туберкулеза.
При проведении скрининга рекомбинантных белков ESAT-6, Mb0143, MPB83, PE5, PE13, TB10.4, TB15.3 и химеры ESAT-6/MPB70/MPB83 (слитый белок) в непрямом варианте ИФА наивысшую степень совпадений с внутрикожной аллергической пробой продемонстрировал последний антиген, при этом чувствительность теста составляла 83,2%, а специфичность –85,6% [58].
Для подтверждения или исключения наличия туберкулезного процесса у людей и животных могут использоваться также верифицирующие методы. Наибольшее значение придается так называемому провокационному тесту. О.Т. Титаренко и соавт. (2006)[4] утверждают, что в последние 20 лет к числу наиболее перспективных маркеров туберкулезного процесса стали относить показатель активности фермента аденозиндезаминазы (АДА), повышение уровня которого по диагностической ценности превосходит большинство биохимических показателей, использующихся во фтизиатрии. Это связывается с ролью АДА в пролиферации и дифференциации лимфоцитов и созревании моноцитов, формировании клеточного иммунного ответа, в пользу чего свидетельствует ряд факторов: антигенная стимуляция сопровождается повышением активности АДА, увеличение ее активности в сыворотке крови свойственно заболеваниям, характеризующимся напряженностью клеточного иммунитета.
Заслуживает внимания используемая в медицинской практике градуированная накожная туберкулиновая проба Гринчар–Карпиловского, котрая проводится с различными разведениями цельного туберкулина [6]. Сущность этого метода состоит в том, что детям с положительными пробами Манту проводилась индивидуальная туберкулинодиагностика – накожная градуированная проба Гринчар–Карпиловского, с 100%, 25%,5% и 1% растворами туберкулина. Для этого проводили скарификацию кожи оспенным пером, а также прик-ланцетом, который имел ограничитель глубины укола, с последующим нанесением капель разных разведений туберкулина. В результате проведенных исследований был сделан вывод, индивидуальная туберкулиновая диагностика по накожной градуированной пробе Гринчар–Карпиловского повышает возможность установить инфекционную природу аллергической реакции, а использование прик-теста позволяет получить более объективные результаты.
Кроме этого, для прижизненной диагностики туберкулеза рекомендуют реакцию пролиферации лимфоцитов [27], определения иммуноглобулина Gи интерлейкина-4, разрабатываются и другие методы – микросферных тестов, и спектрофотометрии гемолизатов. Важным условием успешного применения этих методов является использование тех антигенов микобактерий, которые являются наиболее иммуногенными и характерными только для патогенных штаммовM.bovis, что позволяет дифференцировать их от вакцинных и сапрофитных штаммов.
Гамма-интерфероновый тест широко применяется за рубежом в качестве вспомогательного метода для диагностики туберкулеза крупного рогатого скота При инкубации с антигенами M. bovis иммунные клетки, присутствующие в крови сенсибилизированного микобактериями организма, реагируют выбросом химических медиаторов. При этом наиболее интенсивно продуцируется γ- интерферон, который рассматривается как ключевой цитокин при туберкулезном процессе и продуцируется разнообразными типами клеток, но главным образом – Т-лимфоцитами, что приводит к каскаду иммунных реакций, в первую очередь активации макрофагов.
В последнее время активно возвращаются к разработке серологических методов прижизненной диагностики туберкулеза. При сравнительной оценке этих тестов (флюресцентный анализ, мультиантигенный иммуноферментный анализ) с показателями внутрикожной туберкулиновой пробы не получено однозначных ответов о наличии инфекции M. bovis у животных.
Существующие различия в сравниваемых показателях, по мнению ChapinalN, и соaвт. (2012) [47] обусловлены тем, что указанные диагностические тесты определяют различные иммунологические реакции: серологические определяют состояние гуморального иммунитета, а внутрикожный – клеточного. При этом нужно учитывать и влияние на эти показатели состояние иммунного статуса животных на различных стадиях инфекции. В связи с этим исследователи считают необходимым не прекращение, а продолжение дальнейших исследований для создания диагностических тестов, которые в сочетании позволят эффективно контролировать эпизоотическую ситуацию.
В диагностике человека и крупного рогатого скота обещающе показал себя гамма-интерфероновый тест (INF-) Waters WR и соавт. установили, что с помощью этого метода можно устновить состояние инфицирования уже на 29-й день после заражения при высокой кореляции (r=0,87) [51].
Доказано, что этот диагностический тест у свиней экспериментально зараженных M.bovis, по утверждению Pesciaroli M. (2012) [56] имеет специфичность 100%, а чувствительность oт 78.9-84.6%, что позволяет эффективно оценивать эпизоотическую ситуацию и управлять эпизоотическим процессом.
В наших исследованиях было использован метод радиальной иммунодиффузии для исследования динамики индукции преципитинов при экспериментальном заражении морских свинок.
Антигены для постановки РИД готовили следующим образом. Культуру микобактерий (штамм БЦЖ), выращенную на жидкой синтетической питательной среде для выращивания микобактерий туберкулеза в течении 55–60 суток, отделяли от культурального фильтрата и разрушали на ультразвуковой установке «УЗДН» при мощности 22 кВт в течение 30 минут.
Полученная суспензия разрушенных клеток микобактерий с концентрацией белка 9,8 мг/см3служила в качестве антигена А – «Аг‑а».
В качестве антигенов использовали также нативный фильтрат БЦЖ с концентрацией нуклеотидов 0,02 мг/см3«Аг‑КФн», а также фильтрат БЦЖ после термической обработки при 2·105Па (2 атм.) в течение 2 часов, с концентрацией белка 1,1 мг/см3«Аг‑КФт».
В дальнейшем суспензию «Аг‑а» центрифугировали при 1000 об./мин и получали надосадочную жидкость с концентрацией белка 5,7 мг/см3, которая служила в качестве антигена в – «Аг‑в». Суспензию «Аг‑в» центрифугировали при 2000 об./мин, осадок удаляли, а надосадочная жидкость с концентрацией белка 4,8 мг/см3использовалась в качестве антигена С – «Аг‑с».
Цитозоль антигена Z «Аг‑g» (надосадочная жидкость) получен при центрифугировании суспензии «Аг‑g» в вакуумной центрифуге при 100000 g, с концентрацией белково-нуклеотидных компонентов 1,4 мг/см3.
При постановке РИД с сыворотками, полученными через 15 суток после заражения, линии от зараженных возбудителем туберкулеза бычьего вида (штамм Vallae), полученных через 15 суток после заражения линии преципитации (по одной дуге) с испытуемыми антигенами обнаружены на антигены «Аг‑а», «Аг‑в», «Аг‑z» и «Аг‑КФт» через 48 часов после постановки реакции
Сыворотки, полученные через 30 суток после заражения давали по 2 линии преципитации через 24 часа после постановки РИД с антигенами «Аг‑а», «Аг‑КФт», тогда как через 48 часов – по одной еле заметной дуге с антигенами «Аг‑в», «Аг‑с», «Аг‑g».
Таблица 12. Результаты постановки РИД на изучаемые антигены с сыворотками животных, зараженных возбудителем туберкулеза бычьего вида
|
Испытуемые антигены |
Результаты РИД (сутки после заражения ) | ||
|
15 |
30 |
60 | |
|
Аг-а |
+ |
+ |
— |
|
Аг-в |
— |
+ |
— |
|
Аг-с |
— |
+ |
— |
|
Аг-g |
— |
+ |
— |
|
Аг-z |
— |
+ |
— |
|
Аг-КФт |
+ |
+ |
— |
На 60-е сутки преципитины в сыворотке крови морских свинок небыли выявлены, что, по-видимому, связано с развитием у животных с диффузным туберкулезным поражением, состояния анэргии.
Эти данные могут служить отправной точкой при разработке серологического теста, контролирующего иммунную реактивность и состояние развития туберкулёзной инфекции у больных животных.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
Абрамов Л.П. Материалы по аллергической диагностике туберкулёза у крупного рогатого скота // Автор.дис.канд.вет.наук.-Л.,1957.–16 с.
Авербах М.М Иммунология и иммунопатология туберкулёза. М., Медицина., 1976.–311 с.
Агапова М.Ф. Микобактериальные и немикобактериальные факторы сенсибилизации организма в проявлении неспецифических туберкулиновых реакций. М.Ф. Агапова, М.В. Качкин //Научн. Обеспечение АПК Сибири, Монголии, Казахстана, Беларуси и Башкортостана.–Новосибирск, 2002.– С. 371-373.
Аденозинаминаза в комплексной диагностике различных форм внелегочного туберкулеза/ О.Т. Титаренко [и др.].// Проблемы туберкулеза и болезней легких.– 2006. – № 11. –С. 14-18.
Благодарный Я.А., Блехман Н.М. Вопросы природной очаговости туберкулёза и микобактериозов.- В кн.: Природно-очаговые антропозоонозы, Омск.- 1976.-С.76-78.
Бородулина Е.А. Индивидуальная туберкулиновая проба прик-тестом./ Е.А. Бородулина, Б.Е. Бородулин.// Проблемы туберкулеза и болезней легких.– 2006. – № 3. –С. 33-35.
Бусол В.О. Рушійні сили епізоотичного процесу при туберкульозі великої рогатої худоби./В.О. Бусол, В.А. Ситник, В.М. Шевчук// Вісник Сумського національного аграрного університету. Серія Вет. Медицина. – 2004.– № 8.– С.27-30.;
Визначення природи на туберкуліну великої рогатої худоби шляхом застостосування симультанної алергічної проби / Ю.Кассіч, [и др.] // Ветеринарна медицина України. – 2001 – № 5. – С. 14-15.;
Гутира Ф. Частная патология и терапия домашних животных./ Ф.Гутира, И Марек.//М., 1931.– С.609-755.
Гутман Р.Г. Опыты над туберкулёзными коровами с «кохином».-Уч.записки Казанского вет.института. т.8, 1891, с.12.
Донченко А.С. Диагностика туберкулеза крупного рогатого скота./А.С. Донченко, Н.П. Овдиенко, Н.А. Донченко// Новосибирск, 2004. –309 с.].
Евгевский А.А. Экспериментальное обоснование и практические аспекты диагностики и профилактики инфекцинно-аллергических болезней животных // Дисс.доктора вет. наук.-Л.-1990.-332с.
Евглевский А.А. Диагностика и профилактика антропозоонозного туберкулеза./ А.А. Евглевский , М.В. Коломиец.//- Учебное пособие.–Курск, 2004.– 76 с.].
Евглевский А.А., Коваленко А.М. Специфическая диагностика и профилактика туберкулеза // Аграрный вестник Причорноморья: сб. научн. трудов.- 1999.- N 2(7).- С. 27-28.
Зеленська, М. Особливості внутрішньовенної туберкулінової проби при туберкульозі та мікобактеріальній інфекції великої рогатої худоби./ М. Зеленська, Г. Хільченко, Л. Ковальова та ін. – //Ветеринарна медицина України. – 2003.– № 12.– С. 11-13]
Ильина Т.Б. Современное состояние проблем туберкулёзных микобактерий и микобактериозов // Актуальные вопросы лабораторной диагностики туберкулёза.- Труды Ленинградского НИИ туберкулёза.,Л.-1976.-с.23-31.
Ильясов А.Ф. Пути профилактики и оздоровления хозяйств мясного направления от туберкулёза крупного рогатого скота: Автор. Дисс. ..канд.вет.наук..-Новосибирск.-1981.-с.19.
Каминская Г.О. и соав. // Проблемы туберкулёза.-1991.-№6.- С.55-58.
Кокуричев П.И. Туберкулёз домашних млекопитающих и птиц.- Архив патологии, 1974, т.36, №12, с.83.
Кокуричев П.И. Туберкулёз сельскохозяйственных животных, М.-1954.-с.105.
Кокуричев П.И. Туберкулёз сельскохозяйственных животных, Сельхозгиз.-М.,1954.-с.253.
Кокуричев П.И., Кудрявцев А.И., Юшманов В.В. О применениии туберкулино-симультанной пробы для диагностики птичьего туберкулёза у крупного рогатого скота.-Сб.трудов ЛВИ, Л.,1962,вып.24.-С.20-27.
Колокшанский В.А.,Мандрик Р.М. Моделирование на лабораторных животных псевдоаллергических реакций на туберкулин.-В кн.:Животноводство на промышленную основу, Кишенев,1975.-С.110-112.
Кузин А.И. Латентная туберкулёзная инфекция и ее значение в эпизоотологии туберкулёза крупного рогатого скота.-дисс...докт.вет.наук., М.-1978.-с.271
Кузин А.И., Шлынов Л.А. Парааллергические реакции на туберкулин у крупного рогатого скота // Материалы науч.-произв конф. вет.раб., Вологда,Северозападное кн.изд.,1974.– С.70.
Лебедева, Л.В. Чувствительность к туберкулину и инфицированность микобактериями туберкулеза детей./ Л.В. Лебедева, С.В. Грачева.//Пробл. туберкулеза и болезни легких.– 2007.–№ 1.– С. 5-9.
Макаров, М.В. Идентификация микобактерий методом высокоэффективной жидкостной хроматографии./ М.В. Макаров, М.А Краснова, А.М. Мороз// ЖМЭИ. – 2009. – № 3.– С. 64-66.
Микобактериоз, вызванный Mycobacterium xenopy, у крупного рогатого скота/ А.А.Лозовская [и др.]// Проблемы туберкулеза и болезней легких.– 2006. – № 3. –С. 50-52.
Найманов, А.Х. Актуальные вопросы аллергической диагностики туберкулеза крупного рогатого скота методом внутрикожной туберкулиновой пробы (история применения и современной состояние)/ А.Х. Найманов.// Современное состояние и перспективы исследований по инфекционной и протозойной патологии животных, рыб и пчел. Материалы международной научно-практ. конф. 2008. – М., 2008, – С.173-183.]
Найманов А.Х. Совершенствование аллергической диагностики у крупного рогатого скота // Автор.дисс… канд.вет.наук.-М.,1981.-17 c.
Нуратинов Р.А., Способы применения туберкулина в аллергической диагностике туберкулеза животных: Обзор/ Р.А., Нуратинов //Вестник ветеринарии. – 2000. – № 15 (1).– С. 71-77
Особенности бактериовыделения и лекарственной устойчивости микобактерий при внелегочном туберкулезе/ Б.И. Вишневский [и др.]// Проблемы туберкулеза и болезней легких.– 2006. – № 11. –С. 18-21.
Патент на изобретение № 2455364 « Способ идентификации микобактерий с помощью полимеразной цепной реакции», зарегистрирован 10.07.2012, срок действия до 02.07.2030. . Авторы: Коваленко А. М., Сапегин В.М., Шеховцов А.Ю.
Поддубский И.В. Успехи и перспективы науки и практики в ускорении туберкулёза // Ветеринария.-1967, №10.-С.38-40.
Помыканов В.П. Диагностика туберкулеза крупного рогатого скота индивидуального пользования./ В.П. Помыканов//Ветеринарная патология.–2004.–№ 1-2.– С.153-154.
Применение полимеразной цепной реакции для оценки эффективности химиотерапии туберкулеза легких/ А.А. Александров [и др.]//Проблемы туберкулеза и болезней легких.– 2006. – № 1. –С. 52-55.
Ротов В.И.и соавт. Туберкулёз с/х животных // Киев.-Урожай.-1978.-с.246.
Статистический анализ распределения уровня антител к антигенам Mycobacterium bovis при диагностике крупного рогатого скота./ Т.А. Редчук, [и др.].// Цитология и генетика.– 2010.– № 5.– С. 23–30.
Тузова Р.В.Патогенез туберкулёза птичьего типа у млекопитающих // Проблемы туберкулёза .- 1966, №1.-С.65-66.
Урбан В.П., Мартма О.В. Аллергические реакции у свиней сенсибилизированных атипичными микобактериями // Сб науч.трудов ЛВИ.Л.,1973, вып.34, С.135-143.
Урбан В.П.,Широбокова М.М., Зубков А.П., Калишин Н.М. Аллергические реакции у крупного рогатого скота туберкулёзного изолятора.-Сб.тр.ЛВИ,Л.,1969,вып.30.-С.83-88.
Урбан В.П.,Широбокова М.М., Зубков А.П., Калишин Н.М. О специфичности туберкулиновой пробы при диагностике туберкулёза крупного рогатого скота //Претворение в жизнь Ленинского кооперативного плана строительства сельского хозяйства.-Л.-1971.-вып.5.-С.28-29.
Урбан В.П.,Широбокова М.М., Калишин Н.И. Диагностика туберкулёза с/х животных // Учебное пособие для ветврачей.-Л.,1974.-с.34.
Ускоренная идентификация микобактерий с помощь. Лазерной флюоресценции/ М.А. Иванова [и др.] – ЖМЭИ. – 2009. –№ 3. – С. 81-85.].
Шаров А.Н., Шевырев Н.С. Гринев А.А., Плотников Э.С. Препараты применяемые для диагностики туберкулёза животных // Ветеринария.-1978, №10.-С.43-50
Шишков В.П., Урбан В.П. Туберкулёз с/х животных //-М.-Агропромиздат.-1991.-с.254.
Chapinal N,Elkin BT,Joly DO,Schumaker BA,Stephen C. The primary use in indirect ELISA of secreted proteins Mb1761c and Mb2277 of M. bovis//J Immunoassay Immunochem.– 2012.Vol.33, N 3. –P 269-274.]
Cocle P.J. Fied evaluation of a novel differential diagnostic reagent for detection of Mycobacterium bovis in cattle clinical and vaccine//Immunology.-Vol. 13, N 10.- P. 119-1124
Doda K. Estimation of the sensitivity specificyand predictive valye of the intradermal tuberculin test // Iris ce veter.f., 1978, .325 p.
Downs, S.h., Meta-analysis of diagnostic test performance and modelling of testing strategies for control of bovine tuberculosis. /Downs, S.H. [et. all.]// Proceedings of the Society for Veterinary Epidemiology and Preventive Medicine., 2011. – P. 139-153.
Evaluation of gamma interferon (IFN-γ)-induced protein 10 responses for detection of cattle infected with Mycobacterium bovis: comparisons to IFN-γ responses./ W.R. Waters , [et.all] //Clin Vaccine Immunol.2012. Vol. 19, N 3. – P. 346-351.
Jones G. J. Improved skin test for differential diagnosis of bovine tuberculosis by the addition of Rv3020c-derived peptides./ G. J. Jones A.Whelan, D.Clifford, M.Coad, H.M.Vordermeier//Clin Vaccine Immunol.–2012.– Vol. 19, N 4. P. 620-622.
Lepper A.V. Allergy to tuberculin in beef cattle./ A.V. Lepper, C.W. Pearson, L.A. Corner// Aust.Vet.J.–1977.– Vol. 53, N 5. – P. 214-216.
Liu, S. A novel fusion protein-based indirect ensmelinked immunosorbent assay for the detection of bovine tuberculosis // Tuberculosis. 2007. – Vol. 87, N 3. – P. 212-217.
Mikolajczek K.Krzyzaniak J., Lubenska B. Zastosowanie chromatografii cienkowarswowej do typowania mycobacterii.-Pneumol.Pol., 1980, N 6.-Vol .48, 375-381.
Pesciaroli M. Evaluation of the interferon-gamma (IFN-γ) assay to diagnose Mycobacterium bovis infection in pigs./Pesciaroli MRusso M,Mazzone P//Vet Immunol Immunopathol.– 2012. –Vol. 15. – P. 369-372.]
Plum N. Sur la little cintre la tuberculose // Dull.off.Internat.Epizoot.,1954, 42, 297-303.
Rapid Molecular Detection of Tuberculosis and Rifampin Resistance./ C.C. Boehme [at all.]. – New England Journal of Medicine. – 2010, Vol. 363/ – P. 1005-1015.
Screening of recombinant proteins as antigens in indirect ELISA for diagnosis of bovine tuberculosis../ I.I Souza [at. all.].//Springerplus.– 2012, 1:77 at: http://www.springerplus.com/content/1/1/77.
Strain, S.A. Bovine tuberculosis: A review of diagnostic tests for M. bovis infection in cattle/ S.A. Strain, J. McNair, S. W. J. McDowell// Agri-Food and Biosciences Institute, 2011.– 45 с. http://www.dardni.gov.uk/afbi-literature-review-tb-review-diagnostic-tests-cattle.pdf
Wilkinson D., Smith G.C.et al The effects of bovine tuberculosis (Mycobacterium bovis) on mortality in a badger (Meles meles) population in England // J.Zoology.-2000, 250: 3. – Р. 389-395.
ИММУНИТЕТ И СПЕЦИФИЧЕСКАЯ ПРОФИЛАКТИКА
Механизмы защиты организма при внедрении МБТ
Как известно, неспецифический иммунитет обеспечивается рядом защитных механизмов, эффективных против различных патогенов [31, 68]. Для его развития не требуется первичной индукции и направлен он на поддержание постоянства внутренней среды организма (гомеостаза). Этот вид иммунитета включает в себя ряд физических, физиологических и клеточных барьеров, регуляция и кооперация которых осуществляется значительным пулом медиаторов иммунного ответа (в том числе глобулины, циркулирующие иммунные комплексы, серомукоиды) [85, 106].
При хронических инфекциях решающую роль играют реакции клеточного иммунитета. Макрофаги млекопитающих являются связующим звеном между различными защитными механизмами иммунной системы и осуществляют влияние на пролиферацию иммунокомпетентных клеток. Их роль сводится к процессу подготовки антигена. Установлено, что существует группа монокинов, влияющих на дифференцировку и пролиферацию B-клеток.
Итог встречи макроорганизма с возбудителем туберкулёза в значительной мере определяется функциональным статусом фагоцитирующих и иммунокомпетентных клеток, реализующих реакции защиты.
Основным защитным звеном организма при внедрении в него МБТ является фагоцитоз. Поглотившая микроб клетка реализует свой бактерицидный эффект в первую очередь посредством кислородного взрыва, в процессе которого образуются активированные формы кислорода (АФК), инициирующие в мембранных структурах возбудителя процесс пероксидации липидов (ПОЛ) с последующим разрушением мембран. Избыток АФК способен обусловить повреждение не только микроба, но и самого фагоцита, поэтому фагоцитирующие клетки обладают собственной ферментативной системой антиоксидантной защиты (АОЗ).
Первым продуктом кислородного взрыва является высокотоксичный супероксиданион, который под влиянием супероксиддисмутазы (СОД) трансформируется в менее агрессивную перекись водорода (Н2О2). Однако в присутствии ионов железа и хлора из Н2О2под действием пероксидаз генерируются наиболее токсичные АФК – гидроксил-радикал и гипохлорный анион. Поэтому активность каталазы, разлагающей Н2О2на воду и молекулярный кислород, представляется ключевым фактором в системе внутриклеточной АОЗ. Соотношение между способностью клетки развивать кислородный взрыв при встрече с возбудителем и характером ответа со стороны АОЗ на гиперпродукцию АФК определяет как бактерицидный эффект, так и степень повреждения самого фагоцита в ходе конфликта.
По мере утяжеления процесса снижается способность клеток развивать кислородный взрыв при встрече с МБТ. При введении МБТ в организм животных в течение первых суток в альвеолярных макрофагах (АМ) возникает состояние окислительного стресса в виде резкого роста базального окислительного метаболизма при почти полной утрате клетками способности развивать кислородный взрыв в ответ на дополнительную стимуляцию. К моменту появления первых специфических изменений АМ становятся полностью ареактивными. В терминальный период инфекции в них нарастает концентрация конечного продукта ПОЛ – малонового диальдегида (МДА) и многократно увеличивается активность СОД и каталазы, способных выступать в роли биологических синергистов МБТ. В нефракционированном клеточном осадке (НФКО) бронхоальвеолярного смыва после заражения происходит мобилизация бактерицидного потенциала клеток при устойчивом балансе в системе ПОЛ–АОЗ, однако к моменту появления специфических изменений в органах показатели функционального статуса АМ и НФКО становятся идентичными.
Быстрой функциональной декомпенсации изолированных АМ сопутствует инертный уровень фактора активации тромбоцитов (ФАТ), тогда как в НФКО и циркулирующих лейкоцитах он значительно нарастает.
В литературе имеются данные, раскрывающие механизмы естественной резистентности животных разных видов к МБТ, связанные с различиями в метаболических реакциях фагоцитирующих клеток. Так, у морских свинок на ранних этапах развития инфекции в легочных фагоцитах возникает окислительный стресс с быстрой декомпенсацией клеток, приводящей к их полной ареактивности, а в циркулирующих лейкоцитах значительно снижаются их функциональные резервы. При этом во всех клетках интенсифицируются процессы ПОЛ с нарастанием активности СОД и каталазы. На фоне функциональной декомпенсации легочных и циркулирующих фагоцитов синтез ФАТ в них стабильно растет.
У крыс при аналогичной дозе заражения развитие базального окислительного метаболизма в фагоцититах, приводящее к критическому истощению функциональных резервов клеток, не наблюдается. На протяжении инфекционного процесса легочные фагоциты сохраняют способность адекватно отвечать на дополнительную специфическую стимуляцию развитием кислородного взрыва. Во всех видах фагоцитов через 1,5 месяца после заражения возрастает коэффициент стимуляции при встрече со специфическим возбудителем. Состояние АОЗ во всех видах клеток в течение первых двух недель после введения МБТ характеризовалось снижением активности одного или обоих ключевых её ферментов (СОД и/или каталазы), а в период возрастающей резистентности осуществлялась за счёт роста активности каталазы. Уровень МДА в легочных фагоцитах в ходе развития инфекционного процесса достоверно снижался, а в лейкоцитах крови стабильно сохранялся в пределах физиологической нормы. Уровень ФАТ в легочных фагоцитах возрастал в период инвазии и падал ниже контрольных значений при сформировавшейся резистентности. Наблюдалось повышение уровня ФАТ в циркулирующих лейкоцитах в момент максимального развития неспецифических воспалительных реакций с постепенным их снижением.
Особенности иммунитета при развитии туберкулёзной инфекции
Ряд авторов рассматривает иммунопатогенез различных хронических заболеваний, как иммуномодулирующее действие разных вакцин с позиций современных представлений о гетерогенности механизмов иммунного ответа. В 1986 г. T. Mosmann с соавт. [89] описали две альтернативные субпопуляции Т-хелперов (Th): Th1, продуцирующие ИЛ-2, ɤ-ИФН и лимфотоксин ФНОβ, основная функция которых – активация клеточно-опосредованной формы ответа в виде ГЗТ и цитотоксических Т-лимфоцитов (ЦТЛ), и Th2 – хелперы антителообразования, продуцирующие ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-10 и ИЛ-13. Позднее были выделены дополнительные клоны: Th0, одновременно продуцирующие цитокины Th1 и Th2, а также Th3 – продуценты трансформирующего фактора роста (ТФРβ), которые регенерируются при энтеральном введении антигена в иммунной системе синтез Ig А.
Конкурентные отношения Th1 и Th2 обусловлены взаимным негативным влиянием основных дискриминативных цитокинов этих клонов – ɤ-ИФН и ИЛ-4. Важно, что Th1 и Th2 не только направляют антигенспецифический иммунный ответ по клеточному или гуморальному пути, но и инициируют в месте введения патогена воспалительные реакции двух типов ГЗТ с участием макрофагов, синтезирующих провоспалительные монокины ИЛ-1, ФНО и другие медиаторы воспаления, а также индуцируют гиперчувствительность немедленного типа с вовлечением тучных клеток, базофилов и эозинофилов.
Концепция гетерогенности Th сыграла значительную роль в расшифровке протективных механизмов иммунного ответа при инфекциях, вызванных различными возбудителями. Решающим условием эффективности того или иного типа иммунного ответа считают локализацию возбудителя – внутриклеточную или внеклеточную. Внутриклеточные патогены успешнее элиминируются с помощью клеточных механизмов иммунного ответа – триадой «естественные киллеры–ЦТЛ–макрофаги. Установлено, что CD14-связывающие молекулы грамотрицательных и грамположительных бактерий, а также их эндо- и экзотоксины индуцируют в макрофагах синтез ИЛ-12 – основного медиатора дифференцировки Th1 из нативных Т-лимфоцитов. Именно с индукцией ИЛ-12 и активацией клеточного иммунитета связывают как адъювантное действие M. tuberculosis, так и лечебный эффект вакцины БЦЖ. Уровень отвечаемости Т-лимфоцитов на ИЛ-12 рассматривают как важный фактор генетической предрасположенности к Th1-ответу или Th2-ответу на инфекционный агент.
При изучении иммунного статуса и неспецифической реактивности пораженных туберкулёзом животных установлено, что активный прогрессирующий процесс с распадом и бактериовыделением сопровождается депрессией Т-клеточного иммунитета, сдвигом соотношения субпопуляций Т-хелперов к Т-супрессорам в пользу последних, подавлением клеточного противотуберкулёзного иммунитета и активацией продукции антипротеиновых клеток. При благоприятном течении туберкулёза и абациллировании, закрытии полостей распада, уменьшении инфильтративных явлений активируется специфический клеточный иммунитет, а продукция антипротеиновых антител снижается.
Ключевую роль в формировании иммунитета к туберкулёзной инфекции играют альвеолярные макрофаги и различные популяции Т-клеток. Исход взаимодействия макрофагов и МБТ зависит от баланса антимикробной активности фагоцитирующих клеток и резистентности микобактерий к бактерицидному действию макрофагов [77].
Активация CD4+-клеток иммунной системы также сопровождается генерацией киллерных клеток, цитотоксическая активность которых реализуется исключительно в результате контактного взаимодействия с инфицированными клетками-мишенями и не связана с действием цитокинов. Такими свойствами обладает особая субпопуляция: γ-Δ-CD4-клетки. Цитотоксические Т-клетки не обеспечивают полную защиту от МБТ, однако обладают способностью ограничивать распространение инфекции. Поэтому развитие анергии γ-Δ-Т-клеток рассматривается как один из факторов неблагополучного течения туберкулёза. Развитие туберкулёзной инфекции сопровождается снижением относительного количества CD4-, CD8- и CD72-лимфоцитов, а также моноцитов, экспрессирующих антигены гистосовместимости. У зараженных особей с неблагоприятным течением инфекции наблюдается угнетение пролиферативной активности Т-клеток и продукции ИЛ-2, умеренное снижение продукции ИЛ-1 и повышенный уровень секреции ФНО.
Одним из факторов возникновения и развития туберкулезной инфекциии является снижение неспецифичской резистентности организма. При изучении биохимических показателей крови у крупного рогатого скота разных физиолого-возрастных групп, положительно реагирующего на туберкулин в неблагополучных по туберкулезу хозяйствах нами было установлено снижение концентрации витамина С и каротина в 2,0 и 2,2 раза соответственно, по сравнению с нижней границей физиологических значений, перераспределение белковых фракций в сторону увеличения глобулинов, а также снижение активности лизоцима. Для этих животных также характерным является также снижение показателя фагоцитарной активности нейтрофилов (до 23,2%) и коэффициента завершенности фагоцитоза (до 13,3%) с повышением фагоцитарного числа (до 15%) относительно значений нереагирующих животных.
Необходимо подчеркнуть, что практически во всех странах мира борьба с туберкулезом крупного рогатого скота основывается на своевременном выявлении и убое больных животных [40]. При этом не акцентируется внимание на выявлении и искоренении факторов биотического и абиотического происхождения, которые повышают риск возникновения и развития микобактериальной инфекции и действуют на организм опосредовано через иммунную систему, которая теряет способность предотвращать размножение и локализировать распространение микобактерий туберкулёза. Наиболее активными иммунодепресантами биологической природы являются патогенные ретровирусы, вызывающие такие заболевания как энзоотический лейкоз, артрит-энцефалита коз и ряд других, развивающихся с иммунодефицитным синдромом [43, 47, 50, 53]. В частности лейкоз – медленно, но прогрессивно развивающаяся инфекция, сопровождающаяся неспецифической манифестацией и вызывает в организме животных гормональный, метаболический и иммунологический дисбаланс [5, 30, 46]. При экспериментальном воспроизведении сочетанной с вирусом лейкоза крупного рогатого скота (BLV) туберкулёзной инфекцией показано, что вирус проявляет иммуноингибирующее действие и влияет на проявление аллергических реакций на ППД-туберкулин [10, 34, 43]. В то же время в доступной литературе отсутствуют данные о влиянии лейкозного процесса на развитие туберкулёзной инфекции при заражении условно-патогенными микобактериями M. аvium, в частности на экспрессию маркеров неспецифической природной резистентности организма животных.
В наших исследованиях была изучена динамика некоторых гуморального неспецифического иммунитета при микобактериальной инфекции, вызванной M. avium, у овец, зараженных BLV. Опыт проведен на трех группах овец 4-6 месячного возраста. На первом этапе опыта животным 1-й группы инокулировали по 1 мл крови (19 Г/л лимфоцитов) больной лимфолейкозом коровы. На втором этапе, через 5 месяцев после заражения BLV, овцы первой и второй групп были заражены культурой M. avium Животные 3-й группы оставались интактными (контроль). Через 30 суток после этого была проведены аллергические исследования всех животных путем введения ППД-туберкулинов для млекопитающих и птицы.
О динамическом развитии лейкозного процесса у инфицированных BLV овец на первом этапе опыта свидетельствует накопление в сыворотке крови специфических вирусу антител: к через месяц после заражения их титр составлял 1:4, через 4,5 месяца - 1:4 -1:16, а перед заражением M. аvium (через 4,5 мес. опыта) - 1:4 -1:8..
Необходимо отметить, что при туберкулинизации, проведенной через 4,5 месяцев после заражения BLV, у всех овец внутрикожных положительных реакций не наблюдали, что указывает на отсутствие ложноположительных реакций на туберкулин у инфицированных BLV животных.
Развитие реакций на туберкулины у животных 1-й и 2-й групп через 1 месяц после инфицирования M. аvium дает основание утверждать, что в организме овец начал развиваться микобактериозный инфекционный процесс.
Анализ результатов исследования факторов неспецифического иммунитета у овец, представленных в таблице 13, свидетельствует, что через 14 суток после инфицирования М. аvium у животных первой опытной группы происходит повышение уровня общего белка на 15,4% относительно показателей контроля (р≤0,05). У овец второй группы в этот период опыта установлена тенденция к повышению этого показателя: рост составляет 12,2%. В последующем уровень общего белка статистически вероятно повышается через 4 месяца после заражения микобактериями, когда этот показатель превышает контрольный уровень на 16,5%. В последующем существенных изменений уровня общего белка зафиксировано не было.
Повышение уровня глобулинов в динамике опыта было более выраженным: через 14 суток после заражения микобактериями у животных первой и второй групп этот показатель повысился на 49,8% и 48,3%, через 1 месяц – на 40,8% и 61,8%, через 4 месяца – на 21,5% и 36,0% соответственно. Через 8 месяцев после инфицирования микобактериями повышение концентрации глобулинов у овец первой группы составило 17,3%, второй – 26,5% (р≤0,05). При этом разница между показателями овец 1–й и 2–й групп в этот период составляет 13,3-7,5%.
Через 10 месяцев у овец, инфицированных BLV (1-я группа) уровень глобулинов был ниже контроля 18, 9% при этом у животных 2-1 группы этот показатель был на контрольном уровне.
Установленное повышение уровня глобулинов на начальных этапах развития инфекций можно расценивать как проявление активации белково-образующей функции клеток ретикулоэндотелиальной системы [86].
Важным показателем, характеризующим состояние гомеостаза белкового профиля организма, является альбумин-глобулиновый коэффициент, а его снижение свидетельствует об усиленном синтезе глобулинов.
Было установлено, что развитие как микобактериального, так и сочетанного ретровирусно-микобактериальных инфекционных процессов сопровождается динамичным изменением соотношения классов протеинов: у овец первой и второй групп максимальное снижение коэффициента А/Г, когда разница составляет 38,9% и 61,1%, соответственно через 1 месяц после инфицирования M. аvium. В последующем этот показатель у овец обеих групп увеличивается и через 6 месяцев после инфицирования микобактериями приближается к контрольным значениям. Дальнейшее развитие инфекционного процесса, вызванного M. аvium, приводит к снижению отношения А/Г, и через 10 месяцев не отличался от уровня в контрольной группе. У животных с сочетанным течением инфекционных процессов наблюдается повышение этого показателя на 50% относительно контроля.
Таблица 13. Динамика показателей неспецифического иммунитета у овец при сочетанном течении лейкозной и туберкулезной инфекции (M±m).
|
Группа |
Общий белок, г/л |
Глобу-лины, г/л |
А/Г
|
ЦИК, мг/мл |
Sm, мг/мл |
|
До заражжения BLV | |||||
|
1 (BLV) |
57,5±4,6 |
27,2±-1,3 |
1,1±0,1 |
0,16±0,01 |
0,14±0,01 |
|
К (Контроль) |
58,7±2,5 |
28,3±4,4 |
1,15±0,23 |
0,15±0,01 |
0,16±0,01 |
|
Через 5 месяцев после заражения BLV | |||||
|
1 (BLV) |
72,3±2,90 |
41,3±2,3 |
0,75±0,07 |
0,26±0,01 |
0,16±0,01 |
|
К (Контроль) |
77,3±1,0 |
44,9±2,9 |
0,66±0,12 |
0,20±0,01 |
0,14±0,01 |
|
Через 14 суток после заражения M. аvium | |||||
|
1 (BLV+M. avium) |
83,9±3,5* |
49,6±2,0* |
0,69±0,02* |
0,23±0,01* |
0,12±0,01 |
|
2 (M. avium) |
81,6±2,9 |
49,0±3,3* |
0,67±0,06* |
0,20±0,01 |
0,13±0,01 |
|
К (Контроль) |
72,7±2,3 |
33,1±2,8 |
1,2±0,11 |
0,19±0,01 |
0,14±0,01 |
|
Через 1 месяц после заражения M. Avium | |||||
|
1 (BLV+M. avium) |
78,9±4,60 |
46,9±4,6* |
0,69±0,11* |
0,28±0,01* |
0,23±0,01* |
|
2 (M. avium) |
77,8±2,80 |
53,9±2,2* |
0,44±0,02* |
0,21±0,02 |
0,18±0,01 |
|
К (Контроль) |
71,2±0,93 |
33,3±1,1 |
1,13±0,07 |
0,21±0,02 |
0,16±0,02 |
|
Через 4 месяца после заражения M. аvium | |||||
|
1 (BLV+M. avium) |
77,8+2,6* |
47,9+2,0* |
0,55+0,05* |
0,22±0,01** |
0,23±0,01 |
|
2 (M. avium) |
72,3+6,2 |
53,6+3,3* |
0,48+0,05* |
0,27±0,01* |
0,24±0,01 |
|
К (Контроль) |
67,3+2,0 |
39,4+1,3 |
0,7+0,07 |
0,20±0,01 |
0,18+0,02 |
|
Через 6 месяцев после заражения M. аvium | |||||
|
1 (BLV+M. avium) |
68,6+1,5 |
39,6+1,85 |
0,75+0,05 |
0,19+0,05** |
0,225+0,05* |
|
2 (M. avium) |
71,8+3,2 |
43,4+4,45 |
0,7+0,1 |
0,28+0,01* |
0,20+0,005 |
|
К (Контроль) |
68,1+1,96 |
39,8+1,8 |
0,73+0,05 |
0,20+0,01 |
0,16+0,008 |
|
Через 8 месяцев после заражения M. avium | |||||
|
1 (BLV+M. avium) |
70,6+5,3 |
37,2+1,3* |
0,75+0,13* |
0,15+0,02* |
0,13+0,01* |
|
2 (M. avium) |
69,7+3,7 |
40,1+2,7* |
0,9+0,1 |
0,19+0,01 |
0,15+0,01* |
|
К (Контроль) |
63,3+0,9 |
31,7+0,8 |
1,03+0,07 |
0,23+0,01 |
0,18+0,07 |
|
Через 10 месяцев после заражения M. avium | |||||
|
1 (BLV+M. avium) |
77,8+3,65 |
36,1+2,8* |
1,05+0,25 |
0,15+0,01* |
0,25+0,005* |
|
2 (M. avium) |
71,9+1,6 |
42,5+4,0 |
0,84+0,09 |
0,17+0,05 |
0,12+0,01* |
|
К (Контроль) |
75,8+1,93 |
44,5+1,1 |
0,7+0,09 |
0,18+0,01 |
0,17+0,02 |
Примечание: * - разница статистически достоверна по отношению к контролю при р≤0,05.
Как известно, одним из медиаторов иммунного ответа являются ЦИК средней молекулярной массы (11-19 S), биологическая роль которых заключается в активации системы комплемента, а также эффекторых механизмов иммунитета посредством взаимодействия с клеточными рецепторами нейтрофильных гранулоцитов, что в результате запускает реакцию фагоцитоза [68].
Необходимо отметить, что развитие лейкозной инфекции сопровождается повышением концентрации ЦИК - через 5 месяцев после заражения BLV показатели опытной группы превышают контрольный уровень на 30,0%. Через 14 и 30 суток после инокуляции M. аvium, у овец 1-й группы уровень ЦИК был повышен на 21,0% и 33,3% соответственно. В последующие сроки этот показатель последовательно снижался и к концу исследования был меньше относительно контроля на 16,6%. Микобактериальная инфекция у интактных овец также сопровождалась накоплением этого медиатора иммунного ответа на протяжении 6-ти месяцев после заражения: в этот период их уровень превышает контрольные значения на 40,0% (р≤0,05). Затем происходит снижение интенсивности образования ЦИК: через 8 месяцев превышение составляет лишь 17,4% относительно контроля, а через 10 месяцев показатели 2-й и 3-й групп практически не отличались.
Серомукоиды – мукополисахариды сыворотки крови, которые относятся к белкам острой фазы, по данным литературы, могут блокировать рецепторы В-лимфоцитов, что обуславливает их иммуносупрессирующее действие на гуморальный иммунитет. Как известно, накопление Smв сыворотке крови наблюдается при различных онкологических и инфекционных заболеваниях [6; 42].
При проведении исследований установлено, что введение M. аvium, вызывает существенное накопление Smв сыворотке крови через 4 месяца после инфицирования, когда их уровень был повышен на 33,3% относительно контроля. В последующие сроки опыта их концентрация снижается, причем через 10 месяцев после инфицирования установлено статистически достоверное снижение их концентрации относительно контроля, которое составляет 24,4% (р≤0,05).
Анализ полученных данных свидетельствует, что лейкозный процесс оказывает влияние на синтез Smу животных, инфицированных M. аvium: через 1 месяц их концентрация превышает контрольные показатели на 43,7%, через 4 месяца – на 22,1%, 6 месяцев - 40,6%. 8 месяцев – на 22,7% . а через 10 месяцев - на 47,0 (р≤0,05). Полученные данные изменения уровня Sm могут свидетельствовать о нарушении общего обмена белковых молекул а также указывать на развитие иммунодепрессивного состояния в организме животных [6], особенно выраженного у овец, инфицированных BLV.
Разработка противотуберкулёзных вакцин и их классификация
Вакцинация людей и животных является одним из наиболее эффективных методов специфической профилактики туберкулёза.
Впервые вакцина БЦЖ была использована для противотуберкулёзной иммунизации людей в 1921 г. С тех пор она завоевала признание во многих странах и с начала 90-х гг. вакцинация людей против туберкулёза является обязательной в 64 странах и официально рекомендована в 118 странах и территориях.
Как и в случае с другими убитыми или живыми аттенуированными вакцинами, при введении БЦЖ иммунная система организма сталкивается с исключительно сложным набором антигенов. Цельноклеточные вакцины и сложные по составу смеси (фракции клеточных стенок или цитоплазматическая фракция) иммуногенны и содержат собственные встроенные в мембраны иммуностимулирующие молекулы. Большое количество презентируемых эпитопов обеспечивает эффективность препарата при вакцинации генетически гетерогенной популяции. Многочисленные антигены таких вакцин конкурируют за презентирующие клетки, а иммунодоминирующие антигены не всегда индуцируют максимальную протекцию или их экспрессия транзиторна.
Количество антигенов в вакцине можно свести к ограниченному набору молекул, важных для индукции протективного иммунитета и постоянно экспрессируемых антигенов. Простота строения белковых субъединиц нередко приводит к снижению их иммуногенности, что обуславливает применение в составе вакцин мощных иммуностимуляторов или адъювантов.
Альтернативой субъединичным вакцинам могли бы стать так называемые ДНК-вакцины, в которых вместо микробного антигена используется кодирующая его полинуклеотидная последовательность. К преимуществам этого типа вакцин следует отнести их сравнительную безопасность, дешевизну изготовления и введения, а также и стабильность в организме. Недостатком же является слабая иммуногенность и ограниченное количество антигенных детерминант.
Среди основных направлений поиска новых цельноклеточных вакцин наиболее разработанными представляются следующие:
1. Модифицированные вакцины БЦЖ. Их существенными недостатками являются:
а) отсутствие важных протективных антигенов. В геноме вирулентной M. bovis идентифицированы два кластера генов (RD1, RD2), отсутствующие в БЦЖ;
б) в БЦЖ имеются супрессивные антигены, препятствующие развитию протекции. Так, исследователями Королевского медицинского университета (Лондон) на модели мышиного туберкулёза было показано, что внедрение в геном общего для M. tuberculosis и БЦЖ гена белка с молекулярной массой 19 кД, отсутствующего в быстрорастущих микобактериальных штаммах (M. vaccae и M. smegmatis) приводит к ослаблению вакцинной эффективности данных микобактерий;
в) БЦЖ не способна стимулировать «правильное» сочетание субпопуляций Т-лимфоцитов, необходимое для создания протекции. Известно, что у человека и у мышей защита от туберкулёза опосредована сочетанным действием хелперных и супрессорных Т-клеток, а вакцина БЦЖ стимулирует преимущественно супрессорные Т-клетки, что возможно не является оптимальным для создания протекции.
Данные литературы о применении с лечебной целью другого средства – вакцины БЦЖ ограничены и в известной мере противоречивы. По данным ряда авторов, действие БЦЖ-терапии состоит в её способности стимулировать реактивность организма, активировать репаративные процессы [32, 54].
По данным В. А. Стаханова и соавт. [48] лечение вакциной БЦЖ и туберкулинотерапия методом электрофореза ускоряют исчезновение симптомов интоксикации, способствуют значительному рассасыванию инфильтративных изменений в легочной ткани, сокращают сроки прекращения бактериовыделения и закрытия полостей распада. Лечение вакциной БЦЖ было более эффективным при назначении его пациентам с первоначально низкими титрами противотуберкулёзных антител. Эффективность туберкулинотерапии в зависимости от первоначальных титров противотуберкулёзных антител была иной. Лечение этим методом было более эффективным при первоначально высоких величинах титров и при большом числе высоких и средних титров противотуберкулёзных антител. Неэффективному лечению соответствовали первоначально более низкие значения титров противотуберкулёзных антител, при этом их динамика не коррелировала с её эффективностью.
Как указывает Л. И. Мыколышин [35] на 19-й сессии Международного союза борьбы с туберкулёзом отмечалось, что вакцина БЦЖ позволяет предупредить развитие туберкулёзного менингита, милиарного туберкулёза и ряда других тяжелых его форм, однако остается не до конца установленной продолжительность иммунитета, а также механизмы его развития. Что касается направлений для поиска новой вакцины и совершенствования БЦЖ, ведутся работы по созданию ДНК вакцины с использованием «защитного» гена, фильтратных протеинов, протеин-цитокинов, рекомбинантных и субъединичных вакцин, создаются новые атенуированные вакцины, путем изменения гена вирулентности.
Подсчитано, что создание новой вакцины даже с эффективностью 50 % к 2050 году предотвратит 30 млн. случаев заболевания, а с эффективностью 80 % – 130 млн.
Ведущие ученые Н. П. Овдиенко и А. С. Донченко [38] видят решение проблемы профилактики туберкулёза крупного рогатого скота в разработке нового поколения средств и схем специфической защиты, создании принципиально новых экологически безопасных молекулярных вакцин (протективных антигенов).
В заключение следует сказать, что поиск иммуногенных и протективных антигенов микобактерий с целью конструирования на их основе противотуберкулёзных вакцин ведется беспрерывно во многих направлениях. На сегодняшний день к решению этой проблемы ближе всего стоят работы по усилению иммуногенных свойств вакцины БЦЖ различными иммуномодуляторами, а также по конструированию противотуберкулёзных вакцин, созданных на основе фильтратных протеинов, внутриклеточных протеиновых антигенов [19, 22, 23, 37, 55].
Для приготовления компонентов фильтратных протеинов и фракций низкомолекулярных белков необходимо накопление бактериальной массы культуры микобактерий, и в связи с чем актуальным является разработка новой и не дорогой синтетической питательной среды, которая бы содержала незначительное количество солей.
Стратегия создания новых вакцин
Разрабатываемая стратегия создания новых вакцин на базе БЦЖ включает попытки дополнить геном БЦЖ генами из участков RD1 или RD2, но необходимо учитывать возможность восстановления вирулентности вакцинного штамма.
Существует возможность удалить «супрессивные» последовательности из генома БЦЖ, создавая так называемые штаммы-нокауты по данному гену. Такая возможность в отношении гена белка с молекулярной массой 19 кД была реализована, однако существенного усиления протективных свойств зарегистрировано не было.
Разрабатываются способы преодоления жесткой компартментализации антигенов, доставляемых вакциной БЦЖ, посредством создания рекомбинантной вакцины, экспрессирующей гены белков-цитолизинов. Такие белки способны индуцировать образование пор в мембранах и стимулировать презентацию антигена по механизму, рестриктированному генами главного комплекса гистосовместимости класса 1.
Конструкция на основе экспрессирующей листериолизин БЦЖ была получена Хессом и Кауфманом, показавшими, что она действительно способна усилить активирующее действие БЦЖ в отношении CD8 Т-клеток.
Известно, что дентритные клетки микобактерий способны одинаково эффективно презентировать бактериальные антигены на молекулах классов 1 и 2.
К. Демангель с соавт. использовали нагруженные БЦЖ дентритные клетки для иммунизации мышей против туберкулёза. На используемой модели им удалось показать, что при равной эффективности с обычной схемой БЦЖ-вакцинации схема вакцинации нагруженными живой БЦЖ дентритными клетками занимает на порядок меньше времени.
2. Живые аттенуированные штаммы. Антигенный состав вакцинного штамма должен как можно ближе соответствовать составу патогена. Трудности направленного создания мутантов впервые удалось преодолеть группе исследователей института Пастера (Париж), разработавших методы аллельного обмена транспозонного мутагенеза применительно к медленно растущим микобактериям.
Используя метод аллельного обмена, сумели сконструировать аксотрофный мутант purC (один из генов пути биосинтеза пуринов) M. tuberculosis и продемонстрировать определенную степень защиты, создаваемую данным мутантом в модели аэрозольного заражения морских свинок.
Созданный аналогичным образом под руководством Б. Джекобса мутант M. tuberculosis H37Rv (mc 23026), лишенный гена lys A и, соответственно, не способный расти в отсутствие экзогенного источника лизина, в модели на безмикробных мышах C57BL/6 создает уровень протекции сравнимый с БЦЖ.
3. Живые вакцины немикобактериального происхождения. Исследуется потенциал векторов вирусов Vaccinia sp., aro A – мутанты сальмонеллы и некоторых других микроорганизмов.
4. Микобактерии, аттенуированные естественным путем. В качестве терапевтических и профилактических препаратов предлагаются M. vaccae, М. microti, М. habana. Продемонстрированы слабопротективные свойства M. smegmatis и M. vaccae на модели мышиного туберкулёза.
Применение убитой нагреванием M. vaccae в комплексной терапии впервые выявленного туберкулёза позволило ускорить прекращение бактериовыделения с мокротой и улучшить рентгенологическую картину через 6 месяцев после начала лечения.
5. ДНК-вакцины. Для генетической или полинуклеотидной вакцинации используют кольцевую двунитевую ДНК бактериальной плазмиды, в которой экспрессия нужного (встроенного) гена находится под контролем сильного вирусного промотера.
R. E. Tascon с соавт. [103] продемонстрировали протекцию от внутриперитонеального заражения M. tuberculosis у аутбредных мышей Паркса, вакцинированных белком теплового шока с молекулярной массой 65 кД из M. leprae. Полученный уровень защиты оказался сравним с протекцией, создаваемой вакциной БЦЖ.
Несколько менее эффективными оказались плазмиды, экспрессирующие еще один белок теплового шока hsp70, а также богатый пролином антиген с молекулярной массой 36 кД и ESAT-6. Обнадеживающие результаты получены при изучении ДНК-вакцин на базе комплекса Аг 85 (3 микобактериальных белка с молекулярной массой 30–32 кД).
Так, иммунизация мышей C57BL/6 ДНК Аг 85А не только индуцирует у них специфический иммунный ответ по варианту Т-хелперов 1-го типа, но и защищает их от последующего внутривенного или аэрозольного заражения M. tuberculosis.
А. Т. Камат с соавт., иммунизируя мышей одновременно тремя генами M. tuberculosis – МРТ64 (23 кД), Аг85В (30 кД) и ESAT-6 (6 кД) получили достаточно высокий уровень защиты животных от заражения, несколько уступающий вакцине БЦЖ.
Предпринимаются попытки усиления иммуногенности ДНК-вакцин путем объединения в одну молекулу антигенных последовательностей и генов, модулирующих иммунный ответ факторов. Иммунизация мышей ДНК МРТ 64 Аг85В в комбинации с геном фактора, стимулирующего образование колоний гранулоцитов-макрофагов, усиливает специфический иммунный ответ, но не оказывает влияние на протективность вакцины.
6. Субъединичные вакцины. Наиболее перспективным с точки зрения конструирования новых противотуберкулёзных субъединичных вакцин представляются секретируемые белки микобактерий (так называемые белки культурального фильтрата), что хорошо увязывается с большей эффективностью живых вакцинных препаратов по сравнению с убитыми [28].
Группой ученых из Дании во главе с П. Андерсеном выделено семейство белков раннего культурального фильтрата M. tuberculosis (ESAT-6, TB10.4, TB9), обладающих существенной протективной активностью в экспериментальных моделях. Авторами предложена довольно удачная комбинация бромида диоктадециламмония (DDA) и монофосфориллипида А (MPL).
Изучение иммуногенности 2 препаратов, состоящих из белков культурального фильтрата M. tuberculosis, на приматах продемонстрировало безопасность и эффективность использования адъюванта RIBI. Однако пока не существует разрешенного к применению в клинической практике адъюванта, сочетающего абсолютную безопасность с высокой эффективностью.
В некоторых случаях комбинация белков или отдельных эпитопов, объединенных в единую молекулу, способна генерировать более эффективную протекцию, чем отдельные составляющие.
В. В. Еремееву [24] удалось продемонстрировать, что смесь ESAT-6 и МРТ59 (антиген 85В) либо гибридный белок, состоящий из двух молекул, в сочетании с комбинированным адъювантом MPL/DDA способны защитить мышей от туберкулёза не хуже БЦЖ.
Группе американских исследователей путем скрининга иммунодоминантных эпитопов микобактериальных белков с помощью Т-клеток от здоровых ППД-позитивных доноров удалось выделить ряд протективных антигенов. Объединение этих эпитопов в полипротеин позволило создать весьма перспективную вакцину.
До настоящего времени не выработано единое мнение о целесообразности применения вакцины БЦЖ для профилактики туберкулёза крупного рогатого скота.
Противники вакцинопрофилактики крупного рогатого скота с помощью БЦЖ единственным и основным недостатком считают отсутствие тестов, позволяющих дифференцировать поствакцинальную и инфекционную аллергии.
Хотя вакцинация БЦЖ предупреждает появление значительных туберкулёзных поражений, препятствует распространению возбудителя инфекции, но в недостаточной степени профилактирует развитие туберкулёзного процесса. По данным некоторых авторов, она защищает от 33 до 50 % восприимчивых животных от спонтанного заражения.
Анализируя результаты собственных исследований Д. Д. Новак и М. Базарбаев [36] утверждают, что в организме экспериментальных животных микобактерии штамма БЦЖ персистируют до 12 месяцев и способствуют сдерживанию развития туберкулёзной инфекции.
Использование вакцинопрофилактики в общем комплексе противотуберкулёзных мероприятий дает возможность не только сдерживать развитие туберкулёзной инфекции но и приостанавливать этот процесс. В организме привитых животных вакциной БЦЖ, микобактерии проходят следующие фазы развития:
1 – адаптации, до 15 суток;
2 – максимального вегетирования, до 50 суток;
3 – стационарного развития, до 150 суток;
4 – постепенного угасания.
Авторы предлагают прививать вакциной БЦЖ молодняк крупного рогатого скота, полученный в хозяйствах неблагополучных по туберкулёзу. В таких хозяйствах иммунизации подвергают всех телят как на благополучных, так и неблагополучных фермах. Вакцину БЦЖ вводят телятам в возрасте от 2 недель до 2 месяцев. На неблагополучных фермах, где вакцину применяют впервые, прививают всех телят в возрасте до 12 месяцев.
Вакцинированных телят выращивают изолированно от взрослых животных. В послемолозивный период им выпаивают пастеризованное молоко или заменитель цельного молока. Через 1,5–2 месяца после вакцинации телят исследуют внутрикожной туберкулиновой пробой с помощью ППД-туберкулина для млекопитающих. Проявление чувствительности к туберкулину свидетельствует о выработке в организме животного иммунитета.
В хозяйствах, где применялась вакцина БЦЖ для иммунизации молодняка крупного рогатого скота, после их оздоровления и снятия ограничений, вновь рождающихся телят подвергают в течении года однократной прививке.
О целесообразности вакцинации животных против туберкулёза сообщают А. А. Бойко и Е. П. Сапегина [4]. Они обращают внимание на сложность осуществления эффективного противоэпизоотического комплекса борьбы с туберкулёзом крупного рогатого скота при отсутствии вакцины.
Б. Я. Хайкин и В. А. Зубакин [52], рассматривая профилактическую эффективность вакцины БЦЖ при разных схемах её применения, указывали на эффективность использования вакцины в откормочных хозяйствах, в результате чего снижалась заболеваемость, а при убое не регистрировали поражений паренхиматозных органов и лимфатических узлов.
Авторами проанализированы результаты использования вакцины БЦЖ в хозяйствах с разной эпизоотической ситуацией и при вакцинации животных разных возрастных групп. Перед вакцинацией всех животных старше 2 месяцев подвергали туберкулинизации. Вакцинировали только здоровых животных и телят от здоровых матерей. Телят в возрасте до 1 месяца вакцинировали без исследования на туберкулёз. Исследовано 26 ферм, в т. ч. на 10 фермах иммунизацию проводили строго по инструкции, т. е. вакцинировали телят в возрасте от 10–15 суток и проводили ревакцинацию через 12 месяцев. За этими животными вели наблюдения в течение 3–5 лет. В двух откормочных хозяйствах вакцинировали телят разных возрастных групп от 1 месяца до 1 года. На 6 фермах с разным уровнем эпизоотической ситуации вакцинировали коров. Результаты учитывали по выборочным аллергическим исследованиям и данным ветеринарно-санитарной экспертизы туш и органов после убоя на мясокомбинате. Установлено, что для защиты животных от туберкулёзной инфекции вакцину БЦЖ следует применять на поголовье крупного рогатого скота как можно в более раннем возрасте. В благополучных зонах при ограниченном распространении туберкулёза возможно однократное вакцинирование. После ревакцинации у отдельных телят реакция на туберкулин может сохранятся в течение 2–2,5 лет. Поэтому, хотя ревакцинация телят через 12 месяцев удлиняет сроки иммунитета, она нарушает систему отбора нетелей в возрасте 16–18 месяцев из-за наличия у многих животных реакций на туберкулин. Авторы отмечают, что в зонах длительного неблагополучия по туберкулёзу иммунизация коров вакциной БЦЖ нецелесообразна.
Также приведены результаты наблюдений по 4 хозяйствам Троицкого и Увельского районов Челябинской области, где вакцину начали применять с 1985 г. Все хозяйства были неблагополучными по туберкулёзу более 8 лет. Выявляемость реагирующих на туберкулин в среднем за год составляла от 7 до 15 % от общего поголовья животных, а уровень подтверждения диагноза на туберкулёз на мясокомбинате составлял от 5 до 13 %. В изоляторах каждого хозяйства содержалось до 1000 голов крупного рогатого скота, реагирующего на туберкулин. В колхозе «Южный Урал» вакциной БЦЖ одновременно привили все поголовье крупного рогатого скота. Взрослых животных до иммунизации исследовали внутрикожной туберкулиновой пробой путем двукратного введения туберкулина с 30-суточным интервалом. Реагирующий скот выделяли в отдельные дворы, но оставляли на территории фермы на 2 месяца. Нереагировавшим коровам, нетелям, молодняку всех возрастов вакцину вводили внутрикожно в среднюю треть шеи в дозе 1,0 мг с 0,3 см3 растворителя. В остальных хозяйствах вакцину применяли в той же дозе, только на молодняке. Коров и телят через 45–60 суток после прививки проверяли внутрикожной туберкулиновой пробой. В результате этих исследований установлено, что вакцина БЦЖ предохраняет молодняк крупного рогатого скота от заражения в течении года.
Исследования В. Е. Симбирцева и А. А. Петрова [45], проведенные в Челябинской области, также свидетельствуют о высокой эффективности применения вакцины БЦЖ на телятах. С помощью вакцинопрофилактики повышалась эффективность комплекса противотуберкулёзных мер, снижались затраты и сокращались сроки оздоровления хозяйств.
Головко Н. Д. и соавт. [12]. Выбирали оптимальную схему иммунизации для достижения лучших результатов, а также определяли минимальный возраст телят для получения лучшего иммунного ответа для чего провели сравнительные исследования результатов внутрикожного введения вакцины БЦЖ телятам – до 14 суток; 1 мес.; 3 мес.; 4 мес.; 7 мес. Установлено, что иммунные реакции зависят от возраста; они были меньшими у телят до 14 суток и возрастали соответственно к высшей точке у 7-месячных животных. Кроме того, у телят, привитых до 14 суток, туберкулиновая реакция через 12 месяцев после вакцинации не проявлялась, а у привитых в 2 месяцев отмечалась от 0,5 до 2 % опытных животных. Авторы отмечают, что эффективность иммунизации определяется степенью активации специфической защиты у привитых животных. В частности, она повышается в результате ревакцинации; для молодняка реиммунизация была особенно эффективной.
Н. А. Донченко [20] утверждает, что вакцинация БЦЖ не только обеспечивает надежную иммунологическую защиту животных от заражения, но и способствует выявлению ареактивных к туберкулину особей. Для выявления ареактивного к туберкулиновой пробе молодняка крупного рогатого скота использовали противотуберкулёзную вакцину БЦЖ. Автору удалось ликвидировать скрытые источники возбудителя туберкулёза среди телят и взрослых животных и значительно ускорить сроки оздоровления стад от туберкулёзной инфекции с помощью схемы выявления ареактивного к туберкулиновой пробе крупного рогатого скота, иммунизированного вакциной БЦЖ.
Изучена эффективность вакцины БЦЖ для специфической профилактики туберкулёза у телят. Определены сроки и кратность введения вакцины. Изучена динамика ответной аллергической иммунологической реакции телят на введение вакцины, напряженность и длительность иммунитета. В опытах на телятах в возрасте до 3 месяцев установлена оптимальная доза для вакцинации – 1,0 мг.
Установлено, что микобактерии вакцинного штамма БЦЖ до 6 месяцев вегетируют в организме крупного рогатого скота в виде смеси бактериальных и L-форм, а после 6 месяцев только в L-форме. Аллергические реакции на туберкулин до 6 месяцев сохраняются у 73 % животных, а к 12 месяцам полностью исчезают. Вакцина создает напряженный клеточный иммунитет: уровень бластообразования у вакцинированных животных выше (16 %), чем у контрольных (3 %) и реакция сохраняется до 3 лет.
Организм крупного рогатого скота на введение вакцины БЦЖ отвечает проявлением морфологических реакций и активацией иммуннокомпетентных органов до 6 месяцев после вакцинации, а в отдаленные сроки интенсивность их снижается.
Противоэпизоотическую эффективность специфической профилактики туберкулёза с помощью вакцины БЦЖ и особенности вакцинного процесса у крупного рогатого скота изучались Я. Г. Диких [17].
Специфическую профилактику туберкулёза маралов с помощью вакцины БЦЖ в условиях Сибири проводил С. И. Огнев [39].
Наряду с положительными отзывами о профилактической ценности вакцины БЦЖ рядом исследователей были отмечены и ее недостатки в ряде экспериментов.
B. M. Buddle с соавт. [63] провели испытания протективных свойств вакцины БЦЖ и убитой культуры M. vacce на молодняке крупного рогатого скота. Животных иммунизировали интратрахеально и подкожно, а заражение культурой M. bovis проводили через 54 суток после иммунизации. В результате проведенных исследований установлено, что только у животных, иммунизированных интратрахеальным путем, не обнаружено патологоанатомических изменений в легочной ткани.
При вакцинации путём подкожного введения БЦЖ наблюдали незначительные изменения в лёгких. В группе животных, иммунизированных убитой культурой M. vacce обнаруживали патологоанатомические изменения, не отличающиеся от таковых в контрольной (не вакцинированной) группе, хотя авторами отмечены значительные иммунные реакции после введения препарата. Исследователями также доказано, что защитный эффект вакцины БЦЖ не зависит от дозы препарата полученного животным в защитных целях.
После первой иммунизации вакциной БЦЖ происходит мобилизация Т- и В-систем иммунитета, усиливается фагоцитарная активность макрофагов, происходит сенсибилизация Т-лимфоцитов, что сопровождается развитием гиперчувствительности замедленного типа, а также наработкой противотуберкулёзных антител, которые сдерживают развитие туберкулёзной инфекции.
Ревакцинация БЦЖ стимулирует угасающий после первой вакцинации иммунитет, о чем свидетельствует повышение уровня противотуберкулёзных антител.
В Новозеландском научно-исследовательском ветеринарном центре проведено сравнительное изучение эффективности интрагастральной и интрадуоденальной иммунизации вакциной БЦЖ опоссумов с целью профилактики туберкулёза бычьего вида.
Исследователи B. M. Buddle и F. E Aldwell [64] доказали, что более эффективен интрадуоденальный метод введения вакцины. Он дает возможность защитить от искусственного заражения туберкулёзом значительно большее количество животных, хотя вне зависимости от метода введения вакцинированные животные оказались более устойчивыми при искусственном заражении, чем контрольные (невакцинированные).
Aldwell et al. [57] и Buddle et al. [63; 64] доказали надежность вакцинации БЦЖ опоссумов и высокий уровень их защиты при интратрахеальном заражении M. bovis.
При изучении полевых штаммов M. tuberculosis и M. bovis установлено, что все они могут быть применены для конструирования вакцины против туберкулёза.
Для защиты животных от M. bovis были предложены живые аттенуированные вакцины, химические, с измененным генным аппаратом и искусственные рекомбинантные. А также были выделены из инфицированного и вакцинированного крупного рогатого скота Т-клеточные антигены крови для скрининга космид M. bovis и експресированы в M. smegmatis.
Исследователями из Англии, Ирландии, Новой Зеландии проведено сравнительное изучение экономической эффективности и целесообразности вакцинации БЦЖ популяций барсуков и рогатого скота животноводческих хозяйств. Было установлено, что нецелесообразно проводить иммунизацию популяций барсуков вакциной БЦЖ из-за значительной плотности особей, постоянной миграции особей данной популяции в различные регионы и невозможностью постоянного контроля, хотя иммунизация барсуков экономически более рентабельна, чем вакцинация рогатого скота.
На протяжении последнего десятилетия происходит поиск новых поколений вакцин. Проблема сочетанной патологии туберкулёза и приобретенного иммунодефицита поставила вопрос о целевой разработке иммуностимулирующих препаратов. Всего в мире предлагается для исследований 600 новых веществ в качестве иммуностимуляторов.
Еще в 1988 г. K. Matsuo с соавт. [88] выделили ген экстрацеллюлярного L-антигена. Последний состоит из 323 аминокислот, и содержит сигнальный пептид из 40 аминокислот. В культуральном фильтрате M. tuberculosis и M. bovis найден белок MPB 64, ген которого клонирован с использованием олигонуклеотидных зондов. Секвенирование показало, что структурный ген белка MPB 64 состоит из 618 пар нуклеотидов и кодирует белок с молекулярной массой 22,4 кД.
M. Cohen с соавт. [66] отмечали, что при иммунизации без адъюванта белки микобактерий с молекулярной массой 35 кД в дозе 1,0 мг вызывали лишь выработку антител, а при внутрикожном введении 10 мкг происходила активация гуморального и клеточного иммунного ответа.
В. Н. Лазаренко и соавт. [33] считают перспективными разработки рекомбинантных вакцин на основе вакцинного штамма БЦЖ и других видов микобактерий, и положительно оценивают значение в этих исследованиях данных о плазмидах микобактерий, а также конструирование химерных векторов.
Идея специфической иммуномодуляции возникла еще в 60–70-е гг., когда J. Joumans [77] показали значение рибосомальной фракции, а E. Ribi [95, 94] – клеточных стенок микобактерий туберкулёза в осуществлении защиты против туберкулёза. Л. А. Гореловой с соавт. [13] получен специфический иммуномодулятор из цитоплазмы M. bovis БЦЖ (ЦП), который в экспериментальных условиях давал достаточно высокий (до 60 %) уровень защиты.
В. С. Гуткин, А. Н. Востряков, Б. А. Горбатов [14], И. Ф. Копылова [29], D. Granger, K. Jamamoto, E. Ribi [70], P. Langrange [84] также сообщают о протективных свойствах отдельных фракций и оболочек из микобактерий туберкулёза.
Так, В. С. Гуткин с соавт. [14] изучали иммуногенность клеточных оболочек микобактерий туберкулёза, проводя сравнительное изучение иммуногенных и протективных свойств вакцины БЦЖ и масляно-водной эмульсии оболочек микобактерий туберкулёза на морских свинках и мышах. В результате исследований установлено, что фракция оболочек микобактерий обладает выраженными протективными свойствами, поскольку средняя продолжительность жизни животных иммунизированных вакциной БЦЖ в дозе 1,0 мг, составила 82,4 суток; оболочками БЦЖ в дозе 0,1 мг – 84; оболочками M. bovis в дозе 0,37 мг – 83,5; а контрольные (не иммунизированные) животные жили в среднем 68,9 суток. Напряженность противотуберкулёзного иммунитета, вызванного введением оболочек микобактерий туберкулёза, через 4 месяца в сравнении с 2 месяцами сроком несколько снижалась: после иммунизации оболочками БЦЖ – на 10,8 суток, оболочками M. bovis – на 17,2 суток, но превышала среднюю продолжительность жизни контрольных (не иммунизированных) животных на 21,7 и 16,3 суток, соответственно.
С целью повышения протективных свойств вакцины БЦЖ ряд исследователей использовали различные иммуномодуляторы: соли высокомолекулярной РНК, полирибоната, Т- и В-активины, «ЦП-БЦЖ».
В опытах на морских свинках и кроликах изучено действие иммуномодулятора – высокополимерной РНК, выделенной из дрожжей Saccharomyces cerevisiae в сочетании с вакциной БЦЖ. Исследователями установлено, что вакцина БЦЖ и иммуномодулятор, введенные в организм одновременно, действуют угнетающе на развитие туберкулёзного процесса.
А. С. Донченко с соавт. [18] для повышения резистентности организма животных и иммуногенности вакцины БЦЖ использовали индуктор интерферона – ридостин. В опытах на инфицированных морских свинках установлено, что введение вакцины БЦЖ и ридостина приводит к снижению кожной аллергической реакции. Изучение протеинограммы, полученной в опытах на кроликах, показало, что во всех белковых фракциях происходят изменения. Содержание альбуминов у зараженных животных уменьшается, а повышается у животных, которым перед заражением вводили вакцину БЦЖ и ридостин.
По заключению авторов вакцина БЦЖ полностью не защищает животных от заражения туберкулёзной инфекцией, а вакцинация лабораторных животных БЦЖ вместе с индуктором интерферона –ридостином – повышает клеточный, гуморальный иммунитет и, таким образом, иммуногенность вакцины.
В опытах на морских свинках и телятах, проведенных этими же исследователями, изучено действие поливедрина – иммуномодулятора, представляющего собой высокополимерную РНК. Установлено, что морские свинки, зараженные возбудителем туберкулёза бычьего вида без предварительной иммунизации, погибли в течение 77,03±3,55 суток. Продолжительность жизни животных, привитых вакциной БЦЖ без поливедрина, составила 99,5±3,55 суток, что в 1,5 раза меньше, чем срок жизни животных, иммунизированных БЦЖ с иммуномодулятором. В опыте на телятах установлено, что сочетание поливедрина и вакцины БЦЖ значительно повышает иммунный статус организма животных.
Достоверные изменения отмечены в показателях опсонофагоцитарной активности, протеинограммы и в величине бласттрансформации лимфоцитов. У телят, привитых вакциной БЦЖ совместно с поливердином, в эксперименте достигается полная защита организма от заражения возбудителем туберкулёза. Авторы считают, что сочетанное введение вакцины БЦЖ и поливедрина необходимо использовать с целью профилактики туберкулёза у молодняка крупного рогатого скота, а поливедрин и способ повышения протективных свойств вакцины БЦЖ с указанным препаратом рекомендован для применения в ветеринарии Департаментом ветеринарии Минсельхозпрода РФ.
Теми же авторами изучалось влияние иммуномодуляторов поливедрина и ридостина на течение туберкулёзного процесса у морских свинок, вакцинированных БЦЖ и зараженных возбудителем туберкулёза бычьего вида. Прослеживали динамику развития туберкулёзного процесса под влиянием поливедрина и ридостина отдельно и вместе с вакциной БЦЖ, проводя забой морских свинок через кажде 10 суток. Установлено, что вакцина БЦЖ с иммуномодуляторами защищает морских свинок от заражения возбудителем туберкулёза. При использовании поливедрина эффективность составила 20 %, а ридостина – 40 %. У морских свинок, привитых вакциной БЦЖ с иммуномодуляторами, исчезает гиперчувствительность замедленного типа на внутрикожное введение ППД-туберкулина для млекопитающих на 180 сутки после введения данной композиции препаратов.
Л. В. Галатова с соавт. [11] для усиления действия вакцины БЦЖ применяли иммуномодуляторы – Т-активин, эракондом, витамин С и нуклеинат натрия. Было изучено влияние вакцинации в сочетании с иммуномодуляторами на концентрацию нейраминовой кислоты в сыворотке крови телят и получены положительные результаты.
Учитывая высокую эффективность Т и В-активинов для повышения протективных свойств противобруцеллезной вакцины, И. Д. Александров, И. П. Хабузов и Н. С. Ладан [3] испытали эти природные иммуномодуляторы для увеличения протективной активности вакцины БЦЖ при адъювантном и реиммуномодулирующем использовании. Молодняк крупного рогатого скота 6–7-суточного возраста иммунизировали вакциной БЦЖ Ставропольского НИИ вакцин и сывороток и Т- и В-активинами Покровского биозавода. Эффективность комбинированного использования иммуномодуляторов сравнивали с применением на фоне вакцины БЦЖ только Т-активина, только Т- и В-активинов без вакцинации, Т-активина без иммунизации, вакцины БЦЖ без иммуномодуляторов.
Установлено, что Т- и В-активины адъювантно вводимые вместе с вакциной БЦЖ в течение первых трех суток и используемые повторно через 30 и 180 суток, повышают иммуномодулирующее влияние последней, обеспечивая стабильный рост иммунобиологических показателей естественной резистентности, клеточного и гуморального иммунитета.
При патологоанатомическом, гистологическом и бактериологическом исследованиях убитых телят развитие туберкулёзного процесса подтверждено у 66 % контрольных (не иммунизированных) животных. В группах, где иммунизированным животным вводили Т- и В-активины, изменений, свойственных туберкулёзной инфекции, не обнаружили, а возбудитель из отобранного патологического материала не выделен.
Авторы отмечают, что иммуномодуляторы природного происхождения, представляющие собой низкомолекулярные пептиды, не только корригируют активность иммунной системы и показатели естественной резистентности, особенно на фоне иммунодефицита у животных в ранний неонатальный период, но и положительно влияют на протективные свойства такой слабоаглютиногенной вакцины, как БЦЖ. Т- и В-активины не только ликвидируют иммунодефицит у новорождённых животных, но и в течение первого года жизни способствуют поддержанию активности иммунной системы и естественной резистентности в пределах показателей здоровых животных. При этом реиммунизация через 30 и 180 суток повышает иммунобиологические показатели, а также специфическое, профилактическое влияние вакцины БЦЖ, пролонгируя продолжительность противотуберкулёзного иммунитета с 10 до 12 месяцев и предотвращая заражения животных в условия спонтанного инфицирования.
Иммуномодулирующее влияние вакцины БЦЖ связывают с адъювантной ролью низкомолекулярного мурамоилдипептида, который является участком полимерной пептидогликановой основы клеточной стенки микобактерий. Низкомолекулярные мурамоилдипептиды, Т- и В-активины, не являясь антагонистами, стимулируют высвобождение и накопление мононуклеарных клеток (макрофагов), участвующих в первой стадии иммунного ответа в качестве антигенпредставляющих клеток, а также выделяемых макрофагами различных классов цитокинов, интерлейкинов.
По мнению авторов, монокины и ИЛ-1 стимулируют Т-хелперы к секреции лимфокина ИЛ-2 – ростового фактора Т-клеток. При совместном действии ИЛ-1 и ИЛ-2 происходит активная выработка Т-хелперов – будущих продуцентов В-клеток, иммуноглобулинов класса G, выполняющих роль антител. Авторы считают, что мишенями для адъювантного действия низкомолекулярных пептидов являются не только макрофаги. Аналогичную роль могут выполнять Т- и В-лимфоциты, уровень которых повышается под влиянием Т- и В-активинов.
Также возможно влияние низкомолекулярных пептидов непосредственно на В-клетки, что делает их способными к ответу и в отсутствие Т-клеток. Подтверждением этого может служить скорость наступления ответной реакции иммунных органов на введение иммуномодуляторов. Так, уже через сутки после введения Т- и В-активинов в крови возрастает содержание Т- и В-лимфоцитов, иммуноглобулинов класса G, в составе которых изменяется соотношение G1и G2в сторону увеличения Ig G1, обеспечивающего антибактериальный иммунитет. Под влиянием Т- и В-активинов происходит относительно быстрая коррекция спонтанного иммунодефицита в условиях соответствия технологии кормления и содержания животных, иммунная система функционирует в пределах физиологической нормы, что является основой пролонгирования иммунной защиты животных на фоне специфической профилактики туберкулёзной инфекции.
Также была проведена иммунизация крупного рогатого скота против туберкулёза с использованием модифицированной вакцины БЦЖ, инкапсулированной липосомами. K. K.Addoet al. [1] удалось таким образом значительно повысить протективные свойства вакцинного препарата по сравнению со стандартной лиофильной формой БЦЖ.
Отечественными и зарубежными авторами, кроме вакцины БЦЖ были предложены вакцины: Vole, «M.P», B-115, H37Ra, RiRa, Франк, «Академия», AIR, VDS, БК-Харьков, К и др. [2, 44].
Создаются новые рекомбинантные вакцины на базе БЦЖ. Для этой цели пытаются использовать микобактерии M. vaccae и M. smegmatis. Изучается возможность изменения и замены аллелей в микобактериях, а также реинтродукция локусов от M. bovis в ДНК БЦЖ.
Были попытки изготовления и применения векторных вакцин, где в качестве носителя служил возбудитель туберкулёза мышиного вида с измененным геном вирулентности.
Исследования D. G. Newell и R. G. Hewinson [91] привели к значительным успехам в разработке микобактериальных вакцин, сконструированных на основе последних достижений в области молекулярной генетики. Авторы говорят о перспективе получения смоделированных эффективных микобактериальных вакцин.
Введение в организм животного большого количества екзоантигенов микобактерий, продуктов, содержащих белковые специфические антигены, фрагментов пептидов, вызывает быструю продукцию Т- и В-клеточных популяций и достигается значительный протективный эффект при экспериментальном туберкулёзе.
По данным других исследователей иммуногенными и протективными свойствами обладают и внутриклеточные протеины M. tuberculosis, их дальнейшее изучение продолжается.
T.Fifiset al. [69] предлагают применять в качестве иммуногенных и протективных средств смеси антигенов, состоящих из микобактерий с измененными аллелями генов патогенности и продуктов их распада.
Для стимуляции активного Т-клеточного иммунного ответа S. H. Kaufmann [80] иS. H. Kaufmann иD. B. Young [81] предлагают применять адъюванты комплекса ISCOMS и липосомы.
Существует другое направление конструирования протективных противотуберкулёзных препаратов, заключающееся в переносе генов патогенности и специфичности в векторные вакцинные штаммы – аденовирусные, сальмонеллёзные и др.
Защитные туберкулёзные антигены были экспрессированы в коды ДНК векторных штаммов сальмонелл и вызывали бурные Т- и В-клеточные ответы, которые сопровождались значительными аллергическими реакциями. В качестве адъюванта были взяты убитые микобактериальные клетки и выделенные из последних гликозиды. Полученные таким образом противотуберкулёзные препараты могут быть применены как парентерально так и оральным способами.
H.Gulleet al. [71] были получены фракции лизатов разбитых культур микобактерий туберкулёза и культуральных фильтратов для изучения Т-клеточного иммунного ответа у иммунизированных и инфицированных животных. Полученные фракции лизатов оказались не только пригодными для использования их с целью дифференциации поствакцинальных реакций, но и были замечены высокие протективные свойства в опытах на морских свинках. Авторы считают, что большинство фракций лизатов пригодны для использования в качестве кандидатов в вакцинные антигены.
M. S. Hughes et al. [75] изучали значение вакцинации барсуков против бычьего туберкулёза в условиях лабораторного и производственного экспериментов. Авторы отмечают необходимость разработки вакцин, не обладающих аллергическими свойствами и позволяющих использовать кожный тест в программе по искоренению туберкулёза.
Существующие данные о том, что основной защитный эффект, вырабатываемый иммунной системой хозяина на введение иммуногенного специфического антигена, включает выработку клеток CD4 Th1 и цитолитических клеток CD8, позволяют выдвигать требования к новым вакцинам, которые бы вызывали в организме значительные изменения в Т-клеточной системе. Исследователи отмечают, что вакцина, вызывающая такие изменения в организме животного, способна препятствовать начальному инфицированию после заражения M. bovis, уменьшать степень инфицирования и устранять из организма антигенное начало.
Необходимость использовать различные антигены микобактерий для профилактики туберкулёза, а также совершенствование применения вакцины БЦЖ – наиважнейшая проблема всей стратегии по искоренению туберкулёза в Европейском Союзе. Новая вакцина должна значительно превосходить по своим иммуногенным и протективным свойствам БЦЖ, быть доступной в цене и в применении.
В качестве альтернативного способа противотуберкулёзной иммунизации была предложена иммунизация неживыми вакцинами. Было показано, что для сохранения иммунологической памяти при туберкулёзе не обязательна персистенция живых микобактерий.
По данным А. А. Авербаха [1] итальянские исследователи Menzetti и Signorini провели клиническое изучение препарата, состоящего из смеси убитых формалином культур M. tuberculosis, M. bovis и M. avium. Указанная вакцина при внутрикожном методе апликации туберкулиноотрицательным лицам вызывала вираж туберкулиновой чувствительности при однократном введении у 50 % и при двукратном – у 70–80 % привитых. Авторы также заявили о защитном эффекте использованного ими препарата. Позже работы в этом направлении сводились главным образом к изучению трех типов вакцин:
1) из внутриклеточных фракций;
2) из полисахаридных фракций;
3) из клеточных оболочек.
Защитный эффект вакцин из клеточных оболочек микобактерий наблюдали в опытах на мышах и обезьянах. Этот тип вакцины является наиболее перспективным в отношении напряженности и стабильности иммунитета.
J. Sarvda [99] провел исследования, направленные на получение синтетической туберкулёзной вакцины. Он синтезировал октапептид Asp-Gly-Gly-Ser-Glu-Ser-Glu-Gly и гексадекапептид Asp-Gly-Gly-Ser-Glu-Ser-Gly-Gly-Lys-Asn-Gly-Ser-Gln-Met-Arg-Leu, которые воспроизводят фрагменты туберкулинактивного внутриклеточного микобактериального белка, но иммуногенные свойства этих пептидов оказались незначительными.
Белки и нуклеопептиды микобактерий – это полные антигены, вызывающие образование у животных специфических антител, являющиеся активными и специфичными в серологических реакциях. Протективные свойства белковых и пептидных компонентов микобактерий изучены в единичных экспериментальных работах. Удалением клеточных оболочек из гомогената микобактерий получают «частичковую» фракцию, содержащую рибосомы, обрывки цитоплазматической мембраны, низкомолекулярные белки и полипептиды, которые обладают иммуногенными и протективными свойствами.
Из гликопептидов клеточных стенок, обладающих адъювантной активностью, наиболее изучены пептидогликаны микобактерий. К ним относятся нерастворимые адъюванты: пептидогликолипид (скелет клеточной оболочки), экстракты клеточных стенок, тригалоза-6,6-димиколат и водорастворимые адъюванты: гликопептид мурамовой кислоты, связанный с арабиногалактаном, и N-ацетилмурамил-L-аланил-D-изоглутамил (т. е. МДП). МДП-компонент водорастворимого адъюванта, обладает выраженными иммуностимулирующими свойствами и представляет собой минимальную адъювантно-активную структуру бактериальных пептидогликанов. Все гликопептиды стимулируют продукцию антител и реакции гиперчувствительности замедленного типа при введении вместе с антигеном в водно-масляных эмульсиях. F.Toulletet al. [103] считают, что МДП и его аналоги представляют собой простейшую структурную единицу бактериальных пептидогликанов и способствуют замещению целых убитых микобактерий или их компонентов.
При введении с белковым антигеном, МДП особенно эффективно усиливает вторичный иммунный ответ с повышением уровня преимущественно Ig G- антител.
Многие исследователи указывают на токсино-аллергизирующее и иммунизирующее действие различных фракций микобактерий.
Большинство внутриплазматических включений, белков (в том числе эндотоксинов), рибосомальных фракций, по данным G. Joumans и A. Joumans [79] не обладают аллергическими свойствами, но достаточно иммуногенны.
Заслуживает внимания работа А. А. Евглевского [21] о возможности редуцирования аллергенной активности и инактивации токсических свойств эндотоксинов микобактерий туберкулёза для получения вакцинных противотуберкулёзных препаратов (анатоксинов) и целенаправленной десенсибилизации животных.
Для специфической профилактики туберкулёза А. А. Евглевским [23] предложен туберкулёзный анатоксин. По данным автора анатоксин предотвращает развитие туберкулёзной инфекции у 100 % морских свинок и кроликов после двукратного заражения возбудителем туберкулёза бычьего вида. Испытание защитных свойств вакцинного препарата проведено и на крупном рогатом скоте при спонтанном инфицировании животных в условиях эпизоотологического эксперимента. При этом было установлено, что двукратное введение туберкулёзного анатоксина 496 коровам и нетелям обеспечивало защиту животных от заражения микобактериями туберкулёза. В тоже время в течение 18 месяцев выделено 220 животных, реагирующих на внутрикожное введение туберкулина с утолщением кожной складки на 3–7 мм при отрицательной внутривенной аллергической пробе. При проведении контрольного диагностического убоя 67 коров и нетелей опытной группы, установлено, что при патологоанатомическом и гистологическом исследованиях не установлено наличия патологоанатомических изменений свойственных туберкулёзной инфекции, при бактериологическом – возбудитель туберкулёза не обнаружен.
С. Ю. Стебловская [49] в основу изготовления нового варианта туберкулёзного анатоксина положила инактивацию экзо- и эндотоксинов культуральной жидкости M. bovis растворами формальдегида 0,3–0,4 % в конечной концентрации. Антигенная активность исходного материала эндо- и экзотоксинов равнялась 90–100 тыс. Т. Е./см3. Полученные аллергены, лишенные аллергических свойств после детоксикации, адсорбировались на гидроокись алюминия с последующим декантированием неактивной надосадочной жидкости. Уровень иммунного ответа определялся интенсивностью антигенного воздействия. Двукратная иммунизация здоровых животных в дозе 500 тыс. и 1 млн. инактивированных формальдегидом туберкулиновых единиц обеспечивала одинаковый по напряженности иммунный ответ на протяжении 4–6 месяцев. Иммунизация животных анатоксином способствовала активации клеточного и гуморального иммунитета, более выраженные показатели наблюдались среди коров, не реагирующих на туберкулин. Достоверно выраженные изменения иммунобиологической реактивности организма иммунизированных животных проявлялись в последовательном накоплении в сыворотке крови общего белка и иммуноглобулинов класса G и M. Изменения в Т-системе клеточного иммунитета наблюдались в сторону увеличения Т-хелперов и уменьшения Т-супрессоров. Автором предложена методика повышения иммуногенных свойств противотуберкулёзного анатоксина с помощью иммуномодулятора – левамизоля. Установлено, что специфическая иммунизация животных противотуберкулёзным анатоксином в сочетании с иммуномодулятором левамизолем вызывает более выраженную начальную иммунологическую реакцию и позволяет повысить резистентность организма к заражению возбудителем туберкулёза.
Вакцинопрофилактика
Для сохранения благополучия по туберкулёзу Европейским союзом принята программа вакцинации природного источника возбудителя инфекции – грызунов (опоссумы, хомяки, крысы). Вакцинацию проводят оральным путём (с кормом) с использованием вакцины БЦЖ.
В нашей стране в 80-е годы были предприняты попытки применения вакцины БЦЖ в борьбе с туберкулёзом животных и пушных зверей. Были достигнуты определённые успехи, но широкого распространения вакцинопрофилактика не нашла. Это было связано с трудностями диференциации поствакцинальных и инфекционных аллергических реакций и низкими протективными свойствами БЦЖ.
Обстоятельными экспериментами, выполненными отечественными и зарубежными учёными, доказано, что на сегодняшний день наиболее перспективными являются субъединичные вакцинные препараты, полученные из секреторных белков микобактерий, цитоплазматических компонентов, антигенов клеточных стенок, которые обладают высокими протективными свойствами и вызывают временную аллергизацию привитых животных. К таким препаратам относятся туберкулёзный анатоксин и молекулярно-субъединичный комплексный препарат “ПКП-3”, предложенные Бусолом В.А. и Коваленко А.М. Согласно результатам предварительных испытаний этих препаратов в условиях эпизоотологического эксперимента, они позволяют надёжно защитить до 80% восприимчивых животных при применении их в общем комплексе противотуберкулёзных мероприятий [27; 25; 26; 41].
Разработка иммуностимуляторов для повышения протективных свойств вакцины БЦЖ.
При введении вакцины БЦЖ в организм животного иммунная система организма сталкивается со сложным набором антигенов.
Цельноклеточные вакцины, сложные по своему составу фракции клеточных стенок и цитоплазматические субстанции иммуногенны и содержат собственные встроенные в мембраны иммуностимулирующие молекулы. Антигены таких вакцин конкурируют за презентирующие клетки, а иммунодоминирующие антигены не всегда индуцируют максимальную протекцию.
Для повышения протективных свойств вакцины БЦЖ нами были разработаны два иммуностимулятора: синтетический (СИС) и биологический (БИС).
СИС содержит продукты жизнедеятельности микобактерий (туберкулопротеины), адсорбированные на гидроокись алюминия.
Технология получения СИС. На жидкой синтетической питательной среде для выращивания микобактерий выращивали в течение 55–60 суток культуру возбудителя туберкулеза бычьего вида (штамм Vallae). После термической обработки в автоклаве при 2·105Па (2 атм.) в течение 2 часов бактериальную массу отделяли от культурального фильтрата и пропускали его через стерилизующие пластины. Затем фильтрат центрифугировали при 100000g в течение 30 минут, отбирали надосадочную жидкость и в ней доводили концентрацию белка до 2,0±0,1 мг/см3. Белок адсорбировали на гидроокиси алюминия с 10 % содержанием последней в конечном продукте. В стерильных условиях готовый препарат расфасовывали по флаконам.
БИС – суспензия сенсибилизированных к микобактериям и законсервированных эритроцитов крови крупного рогатого скота.
Технология получения БИС. В благополучном по туберкулезу хозяйстве клинически здоровой, нереагирующей на ППД-туберкулин корове вводили взвесь микобактерий вакцинного штамма БЦЖ на физиологическом растворе в дозе 10,0 мг/см3, двукратно, с интервалом 14 суток. Через 30 суток после повторного введения вакцинного штамма у животного отбирали кровь и удаляли фибрин и лейкоциты.
Брали 50,0 см3 отмытых эритроцитов, добавляли такой же объём фосфатного буфера с рН=7,2 и 80,0 см316,5 % раствора формальдегида. Смесь ставили на 2 часа на водяную баню при температуре 37°С, взбалтывая сосуд через каждые 15 минут.
Полученную суспензию клеток крови центрифугировали при 1500 об./мин в течение 10 минут. Надосадочную жидкость декантировали, а к осадку добавляли 40,0 см3фосфатного буфера (рН=7,2), взбалтывали жидкость и опять центрифугируя при том же режиме.
После 6-кратного отмывания отбирали 20,0 см3эритроцитов и готовили из них 10,0 % суспензию на фосфатном буфере (рН=7,2), к которой добавляли 200,0 см3раствора таннина, разбавленного фосфатным буфером (рН=7,2) в соотношении 1:20000, и выдерживали при температуре 20°С в течении 10 минут.
Полученный раствор отмывали трехкратно фосфатным буфером (рН=7,2) с помощью центрифуги в вышеописанном режиме.
Готовили 5 % суспензию эритроцитов, добавляя к 400,0 см3 10 % суспензии равный объём культурального фильтрата микобактерий туберкулеза бычьего вида с концентрацией белка 1,1 мг/см3и выдерживали на водяной бане при температуре 370,5°С в течение 2 часов.
Затем этот раствор центрифугировали при 1500 об./мин в течение 10 минут, сливали надосадочную жидкость, а к осадку добавляли раствор фенола с конечной концентрацией его в готовой суспензии 0,25 %. Готовую стерильную суспензию фасовали в стерильные флаконы.
Вакцину БЦЖ готовили из выращенной на синтетической питательной среде Сотона культуры вакцинного штамма БЦЖ. Снимали с питательной среды 50–60-суточную культуру во флаконы с бусами и шутулировали в течение 30–40 минут, добавляя 10 % стерильного глицерина и доводя физиологическим раствором концентрацию бактериальной массы в суспензии до 1,0 мг/см3, фасовали в стерильных условиях во флаконы.
Для изучения безвредности, иммуногенных и протективных свойств приготовленных опытных образцов иммуномодуляторов и вакцины БЦЖ были поставлены опыты на морских свинках.
Опыт по изучению безвредности и аллергенных свойств иммуностимуляторов и вакцины БЦЖ
Изучали безвредность и аллергенные свойства вакцины БЦЖ, синтетического (СИС) и биологичекского (БИС) иммуностимуляторов.
Для проведения опыта было отобрано 6 групп животных по 10 в каждой. Животным вводили:
1 группе – вакцину БЦЖ,
2 группе – иммуностимуляторы СИС и БИС по 0,95 см3,
3 группе – вакцину БЦЖ и иммуностимулятор БИС,
4 группе – вакцину БЦЖ и иммуностимулятор СИС,
5 группе – вакцину БЦЖ и иммуностимуляторы БИС и СИС,
6 группе – стерильный физиологический раствор.
При изучении безвредности вакцины БЦЖ и иммуностимуляторов установлено, что введение препаратов на протяжении опыта не вызывает в организме морских свинок клинических изменений, свойственных туберкулезной инфекции.
При патогоанатомическом вскрытии морских свинок установлено, что характерных для туберкулезной инфекции изменений во внутренних органах не обнаружено.
С помощью бактериологических исследований патологоанатомического материала, полученного от опытных животных, возбудителя туберкулеза не выделено.
Результаты гистологических исследований патологоанатомического материала, полученного от морских свинок, иммунизированных противотуберкулезными препаратами и иммуностимуляторами, свидетельствуют, что в лимфатических узлах, печени селезенке, легких патологические процессы не развивались.
В гистологических образцах из патологоанатомического материала от животных первой группы в региональных лимфатических узлах и селезенке установлено усиление лимфоидо-гиперпластической, макрофагальной и плазмоцитарной реакций, а также наблюдали повышенный распад зрелых лимфоцитов, в отдаленных лимфатических узлах выявляли параспецифические процессы с продуктивной реакцией без характерных для туберкулезной инфекции изменений. Ткани селезенки, печени, легких, межлегочных лимфатических узлов были без свойственных для туберкулеза изменений.
У морских свинок второй группы отмечали гиперплазию мякотных тяжей лимфатических узлов, содержащих в основном малые и средние лимфоциты, третьей – компактные скопления зрелых лимфоцитов в периферической зоне расширенных реактивных центров.
У животных четвертой группы в фолликулах заглоточных, предлопаточных, средостенных, бронхиальных лимфатических узлов наблюдали реактивные центры крупных размеров и значительное количество ретикулярных клеток, бластов, макрофагов, пятой – значительное количество реактивных центров в региональных и бронхиальных лимфатических узлах, содержащих много бластов, единичные лимфоциты и макрофаги. В цитоплазме макрофагов обнаруживали обломки ядер распавшихся клеток, что свидетельствует об активации клеток макрофагального звена иммунной системы.
Полученные данные позволили сделать вывод о том, что изучаемые иммуномодуляторы СИС и БИС, вакцина БЦЖ безвредны для животных.
Результаты аллергических исследований свидетельствовали, что наименьшими аллергенными свойствами обладают СИС и БИС, а наиболее высокими –СИС + БЦЖ и БЦЖ.
Аллергические реакции у животных, иммунизированных вакциной БЦЖ самостоятельно и в кооперации с БИС выявляли у 80 %, а в кооперации с СИС реакции сохранялись лишь у 40 % морских свинок через 2,5 месяца после их применения.
Высокий уровень сохранения клеточных иммунных ответов у 80 и 40 % животных после введения соответственно БЦЖ с БИС и СИС у морских свинок на протяжении 2,5 месяцев свидетельствуют о значительной активации предложенными комбинациями препаратов Т-клеточного звена иммунной системы.
Для изучения протективных свойств изучаемых иммуностимуляторов, используемых самостоятельно и совместно с вакциной БЦЖ были поставлены опыты на морских свинках с заражением их возбудителем туберкулеза бычьего вида.
Изучение иммуногенных и протективных свойств иммуностимуляторов и вакцины БЦЖ
Испытание иммуногенных и протективных свойств вакцины БЦЖ, синтетического (СИС) и биологичекского (БИС) иммуностимуляторов, регенераторного биостимулятора (РБС), производства научно-производственного центра «Эрбис» (г. Киев) проводили как самостоятельно, так и совместно с вакциной БЦЖ.
Для проведения опыта было отобрано 9 групп животных по 10 в каждой. Животным вводили:
1 группе – вакцину БЦЖ,
2 группе – иммуностимуляторы СИС и БИС,
3 группе – вакцину БЦЖ и иммуностимулятор БИС,
4 группе – вакцину БЦЖ и иммуностимулятор СИС,
5 группе – вакцину БЦЖ и иммуностимуляторы БИС и СИС,
6 группе – вакцину БЦЖ и биостимулятор РБС,
7 группе – биостимулятор РБС,
8 группе – биостимулятор РБС и иммуностимуляторы БИС и СИС,
9 группе – стерильный физиологический раствор.
Всем животным опытных групп препараты вводили двукратно с интервалом 14 суток.
Динамика развития аллергических реакций у опытных животных после заражения возбудителем туберкулеза бычьего вида (штамм Vallae) отражена в табл. 14.
Таблица 14. Динамика аллергических реакций у морских свинок
|
Группа животных |
Количество реагирующих животных, % | ||||
|
Сутки после заражения | |||||
|
15 |
30 |
45 |
60 |
75 | |
|
1 |
80 |
90 |
80 |
70 |
50 |
|
2 |
30 |
60 |
80 |
60 |
40 |
|
3 |
40 |
70 |
50 |
60 |
40 |
|
4 |
30 |
60 |
40 |
40 |
30 |
|
5 |
40 |
90 |
80 |
60 |
40 |
|
6 |
50 |
90 |
70 |
60 |
50 |
|
7 |
0 |
50 |
70 |
80 |
30 |
|
8 |
40 |
60 |
40 |
30 |
40 |
|
9 |
0 |
20 |
90 |
30 |
20 |
При проведении патологоанатомических исследований, проведенных через три месяца после заражения, выявлены туберкулезные изменения во внутренних органах морских свинок.
Результаты патологоанатомических исследований подтверждены бактериологическими исследованиями. Из лимфатических узлов, паренхиматозных органов, пораженных туберкулезом, был выделен возбудитель туберкулеза бычьего вида на питательной среде Левенштейна-Иенсена.
При проведении гистологических исследований полученного патологоанатомического материала установлено, что наиболее значительные изменения в органах и тканях животных произошли у животных контрольной (девятой) группы, где наблюдались типичные, очень хорошо выраженные распространяющиеся туберкулезные изменения в легких, а в печени, селезенке и лимфатических узлах обнаруживали очень сильные, тотальные поражения часто с преобладанием некрозов.
В гистологических образцах из патологоанатомического материала от животных обнаружены:
1 группа – тотальные поражения с некрозами в паховых и межлегочных лимфатических узлах, типичные хорошо выраженные распространяющиеся изменения в селезенке, а в легочной ткани параспецифические изменения;
2 и 7 группы – мелкие, характерные для туберкулеза, поражения тканей легких и типичные туберкулезные распространяющиеся изменения в печени, селезенке и лимфатических узлах;
8 группа – слабые, мелкие туберкулезные участки в печени, селезенке, межлегочных и тотальные поражения с некрозами в паховых региональных отдаленных лимфатических узлах, а в легочной ткани параспецифические изменения с продуктивной реакцией без характерных туберкулезных изменений;
4 и 6 группы – мелкие, характерные участки в печени, межлегочных, отдаленных лимфатических узлах и параспецифические изменения в легочной ткани, в региональных лимфатических узлах очень сильные поражения с некрозами;
3 группа – мелкие участки с туберкулезными изменениями в селезенке, межлегочных лимфатических узлах. В отдаленных лимфоузлах выявляли ярко выраженные распространяющиеся туберкулезные изменения, а в паховых – диффузное некротическое поражение. Параспецифические изменения наблюдали в легочной ткани, а в печени изменений не наблюдали;
5 группа – параспецифические процессы с продуктивной реакцией без характерных для туберкулезной инфекции изменений в селезенке и межлегочных лимфатических узлах. Типичные, очень хорошо выраженные, распространяющиеся туберкулезные изменения выявлены в отдаленных и паховых лимфатических узлах. В легких наблюдали параспецифические изменения, а в печени без изменений;
9 (контрольная) группа –диффузное поражение паренхиматозных органов (селезенки, печени, легких) и лимфатических узлов.
Полученные данные позволяют сделать вывод, что высокими протективными свойствами обладает вакцина БЦЖ с иммуномодуляторами БИС и СИС, комбинация которых обеспечивает защиту 80 % восприимчивых животных от заражения и развития туберкулезной инфекции.
Применение в составе вакцин мощных иммуномодуляторов или адьювантов обусловлено низкой иммуногенностью простых по строению белковых субъединиц, а также экспрессией антигенов, индуцирующих максимальную протекцию [3]. Известно, что в иммунорегуляторных процессах активное участие принимают эритроциты. Благодаря наличию на поверхностной мембране рецепторов к С3b-компоненту комплемента эритроциты способствуют фагоцитозу, усиливают элиминацию циркулирующих иммунных комплексов. При индуцировании патологических процессов в циркулирующей крови появляются эритроциты, обладающие свойством антигеннеспецифически модулировать иммунный ответ
Иммуностимулирующая активность эритроцитов связана с адсорбцией на их поверхности разнообразных высокомолекулярных соединений, поступающих в кровоток из пораженных очагов Интенсивное возбуждение иммунокомпетентных клеток с помощью иммуномодуляторов СИС и БИС в процессе формирования кооперативного действия с вакциной БЦЖ позволило повысить защитные свойства организма животных к туберкулезной инфекции. По данной разработке получен патент Украины № 35036А от 15.03.2001 года.
Недостатком предложенной комбинации иммуностимуляторов СИС и БИС с вакциной БЦЖ является высокая степень аллергизации животных, а следовательно невозможность контролирования и дифференциации поствакцинального и постинфекционного процессов, а также технологические трудности в изготовлении иммуностимуляторов и их раздельном применении.
Поэтому дальнейший поиск протективных противотуберкулезных препаратов был направлен на конструирование неживых высокоиммуногенных субстанций, обладающих более высокими протективными свойствами.
Разработка противотуберкулезного комплексного препарата на основе белковых субстанций микобактерий туберкулеза.
Учитывая, что убитые клеточные и внутриклеточные фракции патогенных микобактерий туберкулеза, обладают иммуногенными и протективными свойствами, не уступающими по степени защиты живой вакцине БЦЖ, наличие супрессивных свойств последней, а также учитывая современные требования о том, что антигенный состав вакцинного препарата должен как можно ближе соответствовать составу патогена, при конструировании противотуберкулезного комплексного препарата ПКП‑2 использовали только патогенный штамм возбудителя туберкулеза (штамм Vallae).
При разработке этого препарата использовали схему наработки СИС. Способ приготовления противотуберкулезного комплексного препарата ПКП‑2 включает выращивание на жидкой синтетической питательной среде для культивирования микобактерий культуры возбудителя туберкулеза бычьего вида (штамм Vallae) в течение 55-60 суток.
После её термической обработки в автоклаве при 2·105Па (2 атм.) в течение 2 часов отделяли бактериальную массу от культурального фильтрата, и пропускали последний через стерилизующие пластины. Затем фильтрат центрифугировали при 100000g в течение 30 минут, осадок убирали, а надосадочную жидкость с концентрацией белка 2,0±0,1 мг/см3адсорбировали на гидроокиси алюминия с 10 % содержанием последней в конечном продукте.
Бактериальную массу, после отделения от культурального фильтрата, разбивали в сосудах с бусами на шутель-аппарате в течение 2 часов, а затем центрифугировали полученную суспензию при 2000 об./мин в течение 30 минут. Осадок удаляли, а в надосадочной жидкости доводили концентрацию белка до 1,0±0,1 мг/см3.
Суспензии растворов после обработки фильтратных протеинов и внутриклеточных белковых фракций сливали в равных количествах в один сосуд и подвергали детоксикации и дезаллергизации с помощью добавления формальдегида до 0,4 % в готовом растворе и выдерживали в течение 2 недель в термостате при температуре 38±0,5°С. Затем добавляли 8,0±0,5 % гидроокиси алюминия и выдерживали в термостате при 38±0,5°С в течение 14 суток. Готовый препарат фасовали во флаконы и стерилизовали в автоклаве при 1,0 атм в течение 20 минут.
Определение безвредности и аллергенных свойств препарата ПКП‑2.
Для определения безвредности и аллергенных свойств испытуемого препарата было отобрано 3 группы животных по 10 морских свинок в каждой. Животным вводили:
1 группа – вакцину БЦЖ;
2 группа – противотуберкулезный препарат ПКП‑2;
3 (контрольная) группа – стерильный физиологический раствор.
При изучении безвредности препарата ПКП‑2 и вакцины БЦЖ установлено, что введение изучаемого препарата на протяжении опыта не вызывает в организме морских свинок клинических изменений, свойственных туберкулезной инфекции.
При патологоанатомическом вскрытии морских свинок опытных и контрольной групп характерных для туберкулезной инфекции изменений во внутренних органах не обнаружено. В местах введения препарата ПКП‑2 обнаруживали подкожные уплотнения соединительной ткани.
С помощью бактериологических исследований патологоанатомического материала (включая биологическую пробу), полученного от опытных животных, возбудителя туберкулеза не выделено.
Результаты гистологических исследований патологоанатомического материала, полученного от морских свинок, иммунизированных вакциной БЦЖ и противотуберкулезным препаратом ПКП‑2, свидетельствуют, что в лимфатических узлах, печени селезенке, легких патологические процессы не развивались.
В гистологических образцах из патологоанатомического материала от животных выявлены:
1 группа – в региональных лимфатических узлах и селезенке усиление лимфоидо-гиперпластической, макрофагальной и плазмоцитарной реакций, в отдаленных лимфатических узлах – параспецифические процессы с продуктивной реакцией без характерных для туберкулезной инфекции изменений. Ткани селезенки, печени, легких, межлегочных лимфатических узлов были без свойственных для туберкулеза изменений;
2 группа – гиперплазированные мякотные тяжи в бронхиальных лимфатических узлах, содержащие малые лимфоциты, клетки плазмоцитарного ряда и очень мало бластов, а также обнаруживали эпителиальные клетки посткапилярных венул, которые были пролиферированы, ядра их просветлены.
Полученные данные позволили сделать вывод, что изучаемый противотуберкулезный вакцинный препарат ПКП‑2 безвреден.
Динамика развития аллергических реакций у опытных животных отражена в табл. 15.
Таблица 15. Динамика аллергических реакций у морских свинок
|
Группа животных |
Количество реагирующих животных, % | ||||
|
Сутки после иммунизации | |||||
|
15 |
30 |
45 |
60 |
75 | |
|
1 |
50 |
80 |
80 |
70 |
80 |
|
2 |
90 |
80 |
70 |
40 |
30 |
|
3 |
0 |
0 |
0 |
0 |
0 |
Результаты аллергических исследований свидетельствуют, что противотуберкулезный препарат ПКП‑2 обладает менее выраженными аллергенными свойствами.
Аллергические реакции у животных, иммунизированных препаратом ПКП‑2, сохраняются у 30 % морских свинок через 2,5 месяца после их применения.
Изучение иммуногенных и протективных свойств противотуберкулезного препарата ПКП‑2.
Для изучения иммуногенных и протективных свойств препарата ПКП‑2 было отобрано 3 группы животных по 10 морских свинок в каждой. Животным вводили:
1 группа – вакцину БЦЖ;
2 группа – противотуберкулезный препарат ПКП‑2;
3 группа – противотуберкулезный препарат ПКП‑2 с РБС;
4 (контрольная) группа – стерильный физиологический раствор.
Результаты аллергических исследований представленных в табл. 16.
Таблица 16. Динамика аллергических реакций у морских свинок
|
Группа животных |
Количество реагирующих животных, % | ||||
|
Сутки после заражения | |||||
|
15 |
30 |
45 |
60 |
75 | |
|
1 |
80 |
90 |
80 |
70 |
50 |
|
2 |
30 |
90 |
50 |
40 |
30 |
|
3 |
40 |
50 |
60 |
40 |
20 |
|
4 |
0 |
20 |
90 |
30 |
10 |
К концу опыта аллергические реакции у животных контрольной группы исчезали у 90 % морских свинок, что, по видимому, связано с развитием состояния анергии у животных с диффузным поражением туберкулезом [1], а у животных опытных групп, наоборот, сохранялись у 20–50 % морских свинок, что связано с заражением и заболеванием туберкулёзом и присутствием специфических антител у иммунизированных морских свинок.
Результаты патологоанатомических исследований, проведенных через три месяца после заражения морских свинок, приведены в табл. 17.
Таблица 17. Результаты патологоанатомических исследований внутренних органов морских свинок
|
Группа животных |
Количество животных с различными степенями патологоанатомических изменений внутренних органов, свойственных туберкулезу, по классификации А. И. Тогуновой |
% защиты | ||||
|
Слабая степень |
Средняя степень |
Тяжёлая степень |
Генерализованная форма |
| ||
|
1 |
4 |
1 |
0 |
0 |
50 | |
|
2 |
1 |
1 |
0 |
0 |
80 | |
|
3 |
1 |
1 |
0 |
0 |
80 | |
|
4 |
2 |
0 |
0 |
8 |
0 | |
Результаты патологоанатомических исследований подтверждены бактериологическими исследованиями с постановкой биологической пробы.
При проведении гистологических исследований полученного патологоанатомического материала установлено, что наиболее значительные изменения в органах и тканях животных произошли у животных четвертой (контрольной) группы, где наблюдались типичные, очень хорошо выраженные распространяющиеся туберкулезные изменения в легких, а в печени, селезенке лимфатических узлах обнаруживали очень сильные, тотальные поражения часто с преобладанием некрозов.
В гистологических образцах из патологоанатомического материала от животных выявлены:
1 группа – тотальные поражения с некрозами в паховых и межлегочных лимфатических узлах, типичные хорошо выраженные распространяющиеся изменения в селезенке, а в легочной ткани – параспецифические изменения;
2 группа – мелкие характерные для туберкулеза изменения в селезенке и отдаленных лимфатических узлах. В межлегочных лимфатических узлах были типичные, хорошо выраженные туберкулезные изменения. Обнаружены также параспецифические изменения в легких, а в печени свойственных туберкулезу изменений не выявлено;
3 группа – мелкие характерные для туберкулезной инфекции участки в межлегочных и отдаленных лимфатических узлах, а в паховых – диффузные некротические поражения. В селезенке и легких выявляли параспецифические изменения с продуктивной реакцией без туберкулезных поражений, а в печени не обнаружено отклонений от нормы;
4 (контрольная) группа –генерализованная форма туберкулеза с диффузным поражением селезенки, печени, легких и лимфатических узлов.
Полученные данные позволили сделать вывод о том, что препарат ПКП‑2 значительно превосходит по своим иммуногенным и протективным свойствам вакцину БЦЖ, но в тоже время уровень защитного действия не позволяет эффективно использовать данный препарат для вакцинопрофилактики туберкулёза, что сопровождается поражением паренхиматозных органов и лимфоидных тканей.
Применение вместе с препаратом ПКП‑2 биостимулятора РБС серьезным образом не повлияло на его протективные свойства.
Дальнейший поиск высокоиммуногенного противотуберкулезного препарата для профилактики туберкулеза был направлен в сторону разработки и испытания молекулярно-субъединичных препаратов, содержащих в своем составе как корпускулярные, так и молекулярные субстанции микобактерий туберкулеза.
Разработка противотуберкулезного молекулярно-субъединичного комплексного препарата ПКП‑3
По данным В. В. Еремеева (2001) [24] наиболее перспективными противотуберкулезными вакцинными препаратами являются субъединичные вакцины, которые состоят из секретируемых белков микобактерий туберкулеза (белки культурального фильтрата).
Известна высокая эффективность адъювантного действия низкомолекулярных пептидов, действующих не только на макрофаги, но и на Т- и В-лимфоциты.
Данные J. Joumans (1974) и E. Ribi (1975) [95] об иммуномодулирующих и протективных свойствах цитоплазматических субстанций (рибосомальных и отдельных фракций клеточных оболочек микобактерий) в сочетании с микобактериями вакцинного штамма БЦЖ подтверждены Л. А. Гореловой (1996) [13].
Эфективность иммуногенного действия противотуберкулезных препаратов из культуральных фильтратов микобактерий M. tuberculosis, M. bovis и штамма БЦЖ была продемонстрирована в опытах на мышах и морских свинках [59; 74; 93; 96; 28].
Были изучены антигенные и иммуногенные свойства отдельных белков (антигенов) МРТ 59 [90; 58; 73], ESAT-6 [101], MPT64 [92], MTB12 [104], MTB8.4 [67], CFP29 [98], TB10.4 [100].
Исходя из того, что микробными токсинами можно считать все белки бактерий (простые и сложные), способные в чрезвычайно низких концентрациях оказывать на клетки и ткани макроорганизма действие, приводящее в конечном счете к нарушению его гомеостаза и развитию основного симптомокомплекса заболевания [16; 7], нами были получены белковые субстанции микобактерий туберкулеза для разработки высокоиммуногенных протективных комплексных препаратов.
С целью получения противотуберкулезного препарата, который обладал бы широким набором антигенов, находящихся как на поверхности клеточной мембраны, так и в продуктах распада микобактерий, нами был разработан молекулярно-субъединичный комплексный препарат, названный ПКП‑3, включающий в себя широкий спектр презентабельных антигенов, которые встречает иммунная система макроорганизма при развитии инфекционного процесса.
Технология получения молекулярно-субъединичного комплексного препарата ПКП‑3, состоящего из двух компонентов: № 1 – молекулярной и № 2 – субъединичной субстанций включает следующие этапы:
Получение компонента № 1 (молекулярной субстанции). Выращенную на жидкой синтетической питательной среде культуру микобактерий туберкулеза бычьего вида (штамм Vallae) подвергали автоклавированию при 1,2±0,2·105Па (1,2 атм.) в течение 2–3 часов до содержания 2,8 мг/см3(вариант № 1), 2,0 мг/см3(вариант № 2), 1,5±0,1 мг/см3(вариант № 3) и 1,0±0,1 мг/см3(вариант № 4) растворимого туберкулопротеина. Отделение культурального фильтрата от инактивированной бактериальной массы проводили с помощью фильтрации через стерилизующие пластины, в результате чего получали фильтратные протеины.
Белковые фракции из микобактериальной массы, полученные при разрушении их на ультразвуковой установке «УЗДН» при частоте 22,0 кГц и продолжительности действия 30 минут, после пропускания их через стерилизующие пластины, подвергали центрифугированию при 100000 g для получения очищенных белково-нуклеотидных фракций и удаления высокотоксичных липидно-восковых фракций до достижения концентрации белков в готовом растворе 2,8 мг/см3(вариант № 1), 2,0 мг/см3(вариант № 2), 1,5±0,1 мг/см3(вариант № 3) и 1,0±0,1 мг/см3(вариант № 4) (субстанция дезинтеграта) (таблица 18).
Затем полученные субстанции фильтратных протеинов и белковых фракций дезинтегратов соединяли по номерам вариантов и подвергали детоксикации и дезаллергизации с помощью добавления формальдегида в три этапа в следующей последовательности 0,3 %, 0,1 %, 0,1 % с интервалом 7 ± 2 суток. При этом температурный режим детоксикации увеличивают с 40±3°С на первом этапе до 44±3°С на заключительном процессе полимеризации.
Таблица 18. Содержание компонентов препарата в вариантах ПКП‑3
|
Вариант ПКП‑3 |
Компонент № 1 |
Компонент № 2 | ||
|
Концентрация фильтратных протеинов, мг/см3 |
Концентрация белково-нуклеотидных фракций, мг/см3 |
Концентрация корпускулярных частиц, мг/см3 | ||
|
1 |
2,8 |
2,8 2,0 1,8 1,0 |
2,0 | |
|
2 |
2,0 |
1,0 | ||
|
3 |
1,5 |
0,1 | ||
|
4 |
1,0 |
0,05 | ||
Затем добавляли гидроокиси алюминия до 5–6 % и опять ставили в термостат при температуре 37–38°С на три недели. Расфасовывали во флаконы и стерилизовали в автоклаве при 1,0±0,2·105Па (1,0 атм.) в течение 20 минут.
Таким образом было приготовлено четыре варианта компонента № 1 (молекулярной субстанции) с содержанием фильтратных протеинов и субстанции дезинтеграта в варианте № 1 – по 2,8 мг/см3, в варианте № 2 – по 2,0 мг/см3 обеих субстанций, а в вариантах № 3 4 – по 1,5 мг/см3и 1,0 мг/см3фильтратных и внутриклеточных протеинов (дезинтегратов) соответственно.
Получение компонента № 2 (субъединичной субстанции). Бактериальную массу БЦЖ, полученную из жидкой питательной среды для выращивания микобактерий, разрушали на «УЗДН» при частоте 22 кГц на протяжении 30–40 минут. Полученную суспензию из дезинтегрированных разрушенных микобактериальных клеток цитоплазматического содержимого (рибосомальных и белковых фракций), а также обрывков клеточных оболочек центрифугировали в течении часа при 100000 g.
Осадок удаляли, а надосадочную жидкость сливали в 4 сосуда и доводили концентрацию белка в варианте № 1 – 2,8 мг/см3, № 2 – 2,0 мг/см3, № 3 – 1,8 мг/см3и № 4 – 1,0 мг/см3.
Затем к ним добавляли разрушенную на шутель-аппарате бактериальную массу БЦЖ, доводя концентрацию корпускулярных частиц в варианте № 1 до 2,0 мг/см3, № 2 – 1,0 мг/см3, № 3 – 0,1 мг/см3и № 4 – 0,05 мг/см3) (табл. 18).
Добавляли адьюванта КЭ-10-01 (производства Запорожского химического завода) к каждому из вариантов компонента № 2 до 10 % концентрации.
Расфасовывали во флаконы и стерилизовали в автоклаве при 1,0±0,2·105Па (1,0 атм.) в течение 20 минут.
Изучение безвредности и аллергенных свойств препарата ПКП‑3
Для изучения безвредности и аллергенных свойств четырех вариантов противотуберкулезного комплексного препарата ПКП‑3 и вакцины БЦЖ было отобрано 6 групп морских свинок по 10 животных в каждой, которым вводили:
1 группе – вакцину БЦЖ,
2 группе – вариант № 1 препарата ПКП‑3,
3 группе – вариант № 2 препарата ПКП‑3,
4 группе – вариант № 3 препарата ПКП‑3,
5 группе – вариант № 4 препарата ПКП‑3,
6 (контрольной) группе – стерильный физиологический раствор.
При изучении безвредности четырех вариантов противотуберкулезного препарата ПКП‑3 установлено, что введение препаратов на протяжении опыта не вызывает в организме морских свинок клинических изменений свойственных туберкулезной инфекции.
При патологоанатомическом вскрытии морских свинок установлено, что характерных для туберкулезной инфекции изменений во внутренних органах не обнаружено. В местах введения варианта № 1 образовывались большие подкожные инфильтраты, которые не рассасывались на протяжении периода исследований, а в местах введения вариантов № 2, 3 и 4 препарата ПКП‑3 обнаруживали подкожные уплотнения соединительной ткани величиной 2–3 мм.
С помощью бактериологических исследований (с постановкой биологической пробы) патологоанатомического материала, полученного от опытных животных, возбудителя туберкулеза не выделено.
Результаты аллергических исследований свидетельствуют, что все четыре варианта препарата ПКП‑3 обладают незначительными аллергенными свойствами (от 10 до 40 % реагирующих через 2,5 месяца после иммунизации).
Результаты гистологических исследований патологоанатомического материала, полученного от морских свинок, иммунизированных противотуберкулезными препаратами и иммуностимуляторами, свидетельствуют, что в лимфатических узлах, печени селезенке, легких патологические процессы не развивались.
В гистологических образцах из патологоанатомического материала от животных выявлены:
1 группа – в региональных лимфатических узлах и селезенке усиление лимфоидо-гиперпластической, макрофагальной и плазмоцитарной реакций, в отдаленных лимфатических узлах выявляли параспецифические процессы с продуктивной реакцией без характерных для туберкулезной инфекции изменений. Ткани селезенки, печени, легких, межлегочных лимфатических узлов были без свойственных для туберкулеза изменений;
2 группа – гиперплазию мякотных тяжей лимфатических узлов, содержащих в основном малые и средние лимфоциты;
3 группа – в периферической зоне расширенных реактивных центров компактные скопления зрелых лимфоцитов;
4 группа – скопление эозинофилов в лимфоаденоидной ткани мякотных тяжей, умеренное разрежение некоторых синусов лимфоидной ткани паракортикальной области регионального лимфатического узла, а также компактные скопления зрелых лимфоцитов, среди которых некоторые из них были представлены в виде ядер в периферической зоне реактивных центров;
5 группа – в региональных лимфатических узлах значительное количество реактивных центров, содержащих бласты, единичные лимфоциты и макрофаги, а также гиперплазированные мякотные тяжи в бронхиальных лимфатических узлах, содержащие малые лимфоциты, клетки плазмоцитарного ряда и очень мало бластов, а также обнаруживали эпителиальные клетки посткапилярных венул, которые были пролиферированы, ядра их просветлены.
Полученные данные позволили сделать вывод, что изучаемые варианты противотуберкулезного препарата ПКП‑3 безвредны.
Наименьшее количество реагирующих животных (по 10 %) сохранялось в группе животных иммунизированных вариантом №3и №4 препарата ПКП‑3 через 2,5 месяца после их применения.
Для изучения иммуногенных и протективных свойств четырех вариантов противотуберкулезного комплексного препарата ПКП‑3 и вакцины БЦЖ было отобрано 6 групп морских свинок по 10 животных в каждой, которым вводили:
1 группе – вакцину БЦЖ,
2 группе – вариант № 1 препарата ПКП‑3,
3 группе – вариант № 2 препарата ПКП‑3,
4 группе – вариант № 3 препарата ПКП‑3,
5 группе – вариант № 4 препарата ПКП‑3,
6 (контрольной) группе – стерильный физиологический раствор.
Через два месяца после иммунизации все животные были заражены возбудителем туберкулеза бычьего вида.
При проведении аллергических исследований установлено, что через месяц после заражения в опытных группах животных реагировало от 60 до 90 %, а уже через 75 дней – от 20 до 40 % морских свинок.
Динамика развития аллергических реакций у опытных животных отражена в табл. 19.
В контрольной группе морские свинки начали реагировать на ППД-туберкулин через месяц после заражения и к 45 суткам реагировало 100% морских свинок, а к концу опыта реагировало всего 20% морских свинок, что по видимому связано с развитием состояния анергии у животных с тотальным поражением всех паренхиматозных органов [51]. У интактных животных на протяжении опыта аллергических реакций на введение ППД-туберкулина для млекопитающих не наблюдали.
Из пораженных лимфатических узлов и паренхиматозных органов был выделен возбудитель туберкулеза бычьего вида.
При проведении гистологических исследований полученного патологоанатомического материала установлено, что наиболее значительные изменения в органах и тканях животных произошли у животных контрольной группы, где наблюдались типичные, очень хорошо выраженные распространяющиеся туберкулезные изменения в легких, а в печени, селезенке лимфатических узлах обнаруживали очень сильные, тотальные поражения часто с преобладанием некрозов.
В гистологических образцах из патологоанатомического материала от животных выявлены:
1 группа – тотальные поражения с некрозами в паховых, бронхиальных и межлегочных лимфатических узлах, типичные хорошо выраженные распространяющиеся изменения в селезенке и печени, а в легочной ткани параспецифические изменения;
2 группа – мелкие туберкулезные очажки в некоторых участках селезенки и в паховых региональных лимфатических узлах;
3 группа – очень незначительные в начальном этапе развития туберкулезные очажки в отдельных участках селезенки и незначительные поражения в паховых лимфатических узлах;
4 группа – мелкие, очень слабые, но характерные для туберкулеза участки в паховых региональных лимфатических узлах, а в отдаленных лимфатических узлах выявляли параспецифические процессы с продуктивной реакцией без характерных для туберкулезной инфекции изменений. Ткани селезенки, печени, легких, межлегочных лимфатических узлов были без свойственных для туберкулеза изменений;
5 группа – характерные для туберкулеза очаги поражения в селезенке и региональных месту введения возбудителя туберкулеза лимфатических узлах;
6 (контрольная) группа –генерализованная форма туберкулеза с диффузным поражением паренхиматозных органов и лимфатических узлов.
Полученные данные позволяют сделать вывод о том, что перспективным вариантом препарата ПКП‑3 является №3, так как он значительно превосходит по своим иммуногенным и протективным свойствам другие варианты препарата и вакцину БЦЖ. Этот вариант решено было взять за основу при дальнейшем всестороннем изучении свойств препарата.
Его иммуногенные и протективные свойства решено было изучить в комиссионном межлабораторном опыте на морских свинках в остром эксперименте с заражением возбудителем туберкулеза бычьего вида и на крупном рогатом скоте в условия хозяйства при спонтанном заражении.
При изучении безвредности противотуберкулезного комплексного препарата ПКП-3 установлено, что введение препарата на протяжении опыта не вызывает в организме морских свинок клинических изменений свойственных туберкулезной инфекции.
При патологоанатомическом вскрытии морских свинок установлено, что характерных для туберкулезной инфекции изменений во внутренних органах не обнаружено. У 50 % животных в месте введения препарата обнаружены припухлости, которые на разрезе имели утолщенные участки грануляционной ткани.
С помощью бактериологических исследований патологоанатомического материала, полученного от животных этой группы, возбудителя туберкулеза не выделено.
Результаты гистологических исследований патологоанатомического материала, полученного от морских свинок, иммунизированных препаратом ПКП-3, свидетельствуют, что в лимфатических узлах, печени, селезенке, легких патологические процессы не развивались.
В селезенке одной морской свинки выявлены признаки атрофии, а в фолликулах одного из лимфатических узлов обнаружены мелкие полости на месте лизиса макрофагов, которые возникли, возможно, под действием антигена. В легочной ткани другой морской свинки обнаружили участки с утолщением альвеолярных перегородок.
Результаты аллергических исследований свидетельствуют, что препарат ПКП-3 обладает незначительными аллергенными свойствами. Динамика развития аллергических реакций у опытных животных отражена в табл. 19.
Таблица 19. Динамика аллергических реакций у морских свинок
|
Группы животных |
Количество животных в группе |
Количество реагирующих животных, % | |||||||||
|
Сутки после иммунизации |
Сутки после заражения | ||||||||||
|
15 |
30 |
45 |
60 |
15 |
30 |
45 |
60 |
75 | |||
|
1 |
40 |
45 |
87 |
43 |
21 |
21 |
0 |
28 |
28 |
50 | |
|
2 |
20 |
75 |
90 |
35 |
92 |
13 |
13 |
45 |
54 |
33 | |
|
3 |
10 |
0 |
0 |
0 |
0 |
0 |
0 |
83 |
0 |
0 | |
При проведении гематологических и биохимических исследований крови от морских свинок всех групп через месяц после заражения было установлено, что показатели количества эритроцитов и концентрации гемоглобина у животных первой и второй групп были достоверно выше, чем у животных третьей группы.
Перекисная резистентность эритроцитов у неиммунизированных животных была ниже (р≤0,05), чем у морских свинок опытной группы, иммунизированных изучаемым препаратом, и составила 17,6 %.
В плазме крови животных третьей группы концентрация См оказалась выше на 107 %, ЦИК – на 91 %, активность АсАТ – на 108 % по сравнению с соответствующими показателями у животных четвертой группы, а содержание мочевины оказалось ниже на 46 % (р≤0,05). Отмечена также тенденция к снижению концентрации альбумина.
Через три месяца после заражения у животных контрольной группы установлено достоверное снижение в 1,3 раза концентрации гемоглобина в эритроцитах, в 1,4 раза – альбумина и в 1,7 раза – активности аланинаминотрансферазы в плазме крови в сравнении с интактными животными (р≤0,01) (табл. 20).
Таблица 20. Гематологические и биохимические показатели крови морских свинок
|
Показатели |
Группы | |||
|
1 ПКП-3 + заражения n=20 |
2 БЦЖ + заражения n=10 |
3 Контроль + заражения n=9 |
4 Интактные животные n=6 | |
|
Эритроциты, млн/мкл |
7,4±0,25 |
8,23±0,5 |
7,46±0,3 |
8,66±1,1 |
|
Гемоглобин, г/л |
105±6,9* |
112±5,0* |
89,7±5,0 |
121,0±5,5* |
|
Альбумин, г/л |
41,4±2,1* |
44,4±3,9* |
34,3±3,4 |
49,4±8,0* |
|
АлАТ, ммоль/л·ч |
2,3±0,23 |
2,02±0,3 |
1,7±0,6 |
2,9±0,8* |
|
АсАТ, ммоль/л·ч |
1,0±0,12* |
1,3±0,2 |
1,67±0,3 |
1,8±0,4 |
|
Мочевина, мкмоль/л |
1,8±0,16* |
1,8±0,26* |
1,07±0,1 |
1,7±0,09* |
|
ЦИК, г/л |
0,16±0,002* |
0,18±0,02* |
0,1±0,01 |
0,2±0,03* |
|
Серомукоиды, г/л |
0,055±0,008* |
0,048±0,01* |
2,9±0,2 |
0,09±0,015* |
Примечание: «*» – разница достоверна по отношению к контролю (р≤0,05).
Полученные данные указывают на снижение синтезирующей функции печени, что по всей видимости связано с поражением этого органа при развитии туберкулезного процесса при экспериментальном заражении.
У зараженных животных наблюдали также развитие иммуносупресивного состояния: концентрация серомукоидов выросла в 32 раза, а концентрация ЦИК была в 2 раза ниже относительно этих показателей у интактных животных.
Биохимические исследования крови иммунизированных животных дали возможность установить, что препарат ПКП-3 и вакцина БЦЖ сдерживают развитие патобиохимических изменений в организме животных.
Концентрация альбумина и активность АлАТ снижались у животных первой группы только в 1,2 раза, а у животных второй группы – в 1,2 раза и 1,3 раза соответственно, в сравнении с показателями интактных морских свинок.
Введение препаратов способствовало также снижению иммуносупресии в организме зараженных морских свинок: уровень серомукоидов был выше в 1,25–1,1 раза, а концентрация ЦИК даже повышалась в сравнении с показателями у животных четвертой группы.
Другие биохимические показатели крови иммунизированных и в дальнейшем инфицированных животных также существенно не отличались от таковых у интактных животных.
Патологоанатомическими исследованиями морских свинок, иммунизированных противотуберкулезным комплексным препаратом ПКП-3 и в последующем зараженных возбудителем туберкулеза бычьего вида (штамм Vallae), выявлено, что только у трёх животных развивались туберкулезоподобные изменения в лимфатических узлах регионарных месту введения возбудителя туберкулеза, тогда как у иммунизированных вакциной БЦЖ поражения внутренних паренхиматозных органов средней степени по классификации А. И. Тогуновой, туберкулёзом обнаружены у двух животных, слабой – у четырёх особей (табл. 3.5.3).
Гистологическими исследованиями установлено, что в селезенке и лимфатических узлах проявлений иммунной активации не выявлено. Фолликулы в большинстве случаев невелики, без выраженных реактивных центров герменативных зон. В некоторых случаях отмечено усиление трабекулярной стромы, что может быть проявлением ослабления ее функции.
Следует также отметить, что в отдельных лимфатических узлах трех морских свинок, которые имели туберкулезоподобные патологоанатомические изменения при вскрытии, наблюдали мелкие очаги из макрофагов с большим ядром и зоной эозинофильной цитоплазмы (похожих на эпителиальные клетки), которые объединяются в многоядерные симпласты, представляющие собой атипичные многоядерные гигантские клетки. Возможно эти изменения были обусловлены действием микобактериальных антигенов.
Очагов с характерными признаками, свойственных туберкулезным поражениям, не обнаружено.
При изучении гистоморфологического материала паренхиматозных органов у значительной части морских свинок второй группы, которые имели макроскопические поражения паренхиматозных органов и лимфатических узлов, в региональных месту заражения лимфатических узлах выявлены свойственные для туберкулезной инфекции поражения, которые вытесняли полностью ткани органов.
В отдаленных от места введения возбудителя туберкулеза лимфатических узлах трех морских свинок, которые имели туберкулезные макроскопические изменения, найдены зародыши туберкулезных очагов из разрозненных клеток и групп многоядерных клеток без замещения или разрушения ткани органа.
В печени одной морской свинки выявлены характерные продуктивные туберкулезные очаги с вакуолизацией и частично лизированными центрами размером до 1500 мкм, а у других отмечены туберкулезные поражения в виде очагов размером до 1000–1200 мкм в селезенке.
В легких морских свинок этой группы выявлены утолщения межальвеолярных перегородок разной степени, особенно выраженные у трех морских свинок, имеющих макроскопические изменения. В селезенке одной из них найдены очаги из 8 гигантских клеток. Состояние иммунных структур лимфатических узлов у разных морских свинок было неоднотипным. В лимфатических узлах двух морских свинок выявлены большие фолликулы с реактивными центрами, заполненными клетками.
В печени одной морской свинки выявлены характерные продуктивные туберкулезные очаги с вакуолизацией и частично лизированными центрами размером до 1500 мкм, а у других отмечены туберкулезные поражения в виде очагов размером до 1000–1200 мкм в селезенке.
В легких морских свинок этой группы выявлены утолщения межальвеолярных перегородок разной степени, особенно выраженные у трех морских свинок, имеющих макроскопические изменения (рис. 3.5.8). В селезенке одной из них найдены очаги из 8 гигантских клеток (рис. 3.5.9). Состояние иммунных структур лимфатических узлов у разных морских свинок было неоднотипным. В лимфатических узлах двух морских свинок выявлены большие фолликулы с реактивными центрами, заполненными клетками (рис. 3.5.10). Фолликулы с пустотами в местах, где были найдены участки с иммунологической деструкцией макрофагов были выявлены в лимфатических узлах и селезенке морских свинок со значительными макроскопическими туберкулезными поражениями паренхиматозных органов.
У животных контрольной группы наблюдали множественные туберкулезные очаги в лимфатических узлах, печени, селезенке, сливающиеся в скопления отторгнутых клеток.
С помощью бактериологических исследований не выявлено роста культуры возбудителя туберкулеза бычьего вида при высевах с патологоанатомического материала на питательную среду Левенштейна-Иенсена от морских свинок первой группы, которых иммунизировали противотуберкулезным комплексным препаратом ПКП-3, а в последующем заражали возбудителем туберкулеза бычьего вида.
Рост колоний культуры возбудителя туберкулеза проявился через 90 суток при посевах с патологоанатомического материала от двенадцати животных, иммунизированных вакциной БЦЖ, а от всех животных контрольной группы – на тридцатые сутки.
Таким образом, можно сделать вывод о том, что противотуберкулезный комплексный препарат ПКП-3 не вызывает у морских свинок патологоанатомических и гистологических изменений во внутренних органах, характерных для туберкулезной инфекции, т. е. препарат безвреден.
После введения препарата в месте введения образуются незначительные припухлости, которые постепенно рассасываются.
После введения препарата аллергические реакции на ППД-туберкулин сохраняются на протяжении двух месяцев у 21 % животных, что свидетельствует о низких аллергенных свойствах препарата по сравнению с вакциной БЦЖ.
Иммунизация морских свинок предлагаемым препаратом ПКП-3 препятствует развитию патологоанатомических, гистологических и патобиохимических изменений, свойственных инфекционному процессу при экспериментальном туберкулезе.
Введение препарата ПКП-3 восприимчивым животным способствует выработке иммунологической напряженности, которая обеспечивает надежную защиту животных от внедрения и размножения возбудителя туберкулеза бычьего вида (штамм Vallae).
Испытание безвредности, аллергенных и биологических свойств противотуберкулезного препарата ПКП-3 на бычках
Опыт проводили в благополучном по туберкулезу опытном хозяйстве Национального аграрного университета «Великоснитынское» (Киевская область) на 36 бычках 2–6-месячного возраста, не реагирующих на ППД-туберкулин.
Бычков распределяли на 2 группы: опытную – 26 голов и контрольную – 10 голов.
Животным опытной группы вводили препарат ПКП-3 двукратно с интервалом 14 суток, подкожно, компонент № 1 в дозе – 5,0 см3с правой, а компонент № 2 – 1,0 см3с левой стороны ниже средней линии шеи.
Животным контрольной группы вводили стерильный физиологический раствор в дозе 5,0 см3, подкожно в область нижней трети шеи.
На протяжении опыта наблюдали за клиническим состоянием опытных животных.
Для проведения гематологических и биохимических исследований отбирали кровь от опытных и контрольных животных до введения препарата и через 7, 19, 30, 45 и 60 суток после начала опыта.
Аллергические исследования проводили с помощью ППД-туберкулина Курской биологической фабрики серия № 39, контроль № 38, пригодного для использования до 2001 г., через 15, 30, 45, 60, 90 суток после применения препарата. В конце опыта животные опытной и контрольной группы были подвергнуты диагностическому убою с проведением патологоанатомических и бактериологических исследований.
При наблюдении за животными установлено, что через 24 часа после введения препарата в местах инъекций образовались припухлости объемом с куриное яйцо, плотной консистенции, теплые. Температура тела у всех опытных животных повышалась до 40,0±0,2°С и держалась на протяжении 48 часов, у 5 животных – 72 часа, у 4 – 96 часов и ещё у 4 – 120 часов, а затем приходила в норму.
Наличие температурной реакции на введение препарата характерно для всех препаратов, содержащих в своем составе продукты жизнедеятельности микроорганизмов, а наличие припухлости присуще всем гидроокисьалюминиевым вакцинным препаратам [9].
В дальнейшем опухоли в местах введения препарата постепенно рассасывались и через месяц после повторного введения препарата оставались лишь твердые припухлости величиной с горошину.
При проведении аллергических исследований установлено, что реакции на ППД-туберкулин появились через 15 суток после введения препарата во всех животных и сохранялись на протяжении месяца. В дальнейшем реакций на туберкулин не выявляли. Контрольные животные не реагировали на туберкулин и имели температуру тела в пределах физиологической нормы на протяжении опыта.
Наличие кратковременного аллергического воздействия препарата объясняется наличием в его составе корпускулярных микобактериальных частиц [15].
Исследованиями крови установлено, что препарат обладает незначительными антиоксидантными свойствами на что указывают показатели изменения концентрации ДК и МДА. Так, через 7 суток после введения препарата концентрация ДК – промежуточных продуктов ПОЛ, снижалась на 37 %, а МДА – на 66 %, (р≤0,05) (табл. 21 и 22, соответственно). На 19 сутки опыта отмечено незначительное возрастание интенсивности ПОЛ, хотя разница с контрольными показателями статистически достоверна. Снижение интенсивности ПОЛ в сыворотке крови наблюдалось до 45 суток опыта, когда уровень МДА был ниже от контрольных показателей на 37,5 %.
Таблица 21. Динамика изменения содержания диеновых коньюгатов в крови подопытных бычков
|
Группа животных |
Концентрация диеновых конъюгатов, мМоль/дм3 | |||||
|
До введения препарата |
После введения препарата, сутки | |||||
|
7 |
19 |
30 |
45 |
60 | ||
|
Опытная |
6,50,04 |
4,10,01* |
4,40,03* |
5,80,06 |
5,90,07 |
5,40,08 |
|
Контрольная |
5,60,02 |
6,50,8 |
6,20,08 |
5,90,07 |
5,60,09 |
5,30,06 |
Примечание: «*» – р≤0,05, разница достоверна по отношению к контролю.
Таблица 22. Динамика изменения содержания малонового диальдегида в крови подопытных бычков
|
Группа животных |
Малоновый диальдегид, ΔD | |||||
|
До введения препарата |
После введения препарата, сутки | |||||
|
7 |
19 |
30 |
45 |
60 | ||
|
Опытная |
1,10,01 |
0,450,01* |
0,520,05* |
0,560,06* |
0,90,04* |
1,00,08 |
|
Контрольная |
1,40,08 |
1,30,08 |
1,20,07 |
1,00,07 |
1,40,03 |
1,10,05 |
Примечание: «*» – р≤0,05, разница достоверна по отношению к контролю.
Наблюдаемое торможение процессов перекисного окисления липидов является по-видимому одной из причин повышения перекисной резистентности эритроцитов (ПРЭ) – интегрального показателя потенциальной устойчивости мембран клеток к действию перекисей (табл. 23) [50]. Учитывая данные литературы о том, что снижение ПРЭ указывает на уменьшение стойкости мембран этих клеток к действию перекисей, одной из причин этому может быть компенсаторное расходование пула структурных антиоксидантов, которое происходит в ответ на нарушение гомеостаза в организме при введении препарата [50].
Таблица 23. Динамика изменения перекисной резистентности эритроцитов в крови подопытных бычков
|
Группа животных |
Гемолиз, % | |||||
|
До введения препарата |
После введения препарата, суток | |||||
|
7 |
19 |
30 |
45 |
60 | ||
|
Опытная |
22,50,7 |
15,20,4* |
19,20,5* |
26,80,6 |
38,91,4 |
36,31,7 |
|
Контрольная |
24,21,1 |
23,00,8 |
26,80,9 |
24,60,7 |
34,71,1 |
38,11,3 |
Примечание: «*» – р≤0,05, разница достоверна по отношению к контролю.
На 7 и 19 сутки опыта гемолиз у животных опытной группы был достоверно ниже на 33 и 28 % соответственно.
Биологическое действие препарата ПКП-3 проявилось также в статистически достоверном повышении уровня общего белка в сыворотке крови опытных животных, которое продолжалось около 30 суток: с максимальным повышением на 21 % на 7 сутки по отношению к контролю (табл. 24).
Исходя из литературных данных [8] это связано с наработкой специфических антител к антигенам микобактерий, содержащихся в препарате.
Таблица 24. Динамика изменения содержания общего белка в крови подопытных бычков
|
Группа животных |
Общий белок, г/дм3 | |||||
|
До введения препарата |
После введения препарата, суток | |||||
|
7 |
19 |
30 |
45 |
60 | ||
|
Опытная |
78,20,7 |
95,40,6* |
93,20,5* |
87,60,9* |
78,90,8 |
77,10,7* |
|
Контрольная |
76,60,5 |
78,30,7 |
84,50,9 |
74,23,9 |
82,42,7 |
80,10,9 |
С динамикой изменения общего белка коррелируют данные о концентрации ЦИК – комплексов Аг–Ат средних размеров. Известно, что ЦИК принимают участие в регуляции как хемотаксической способности, так и метаболической активации нейтрофилов. Cтатистически достоверное повышение уровня ЦИК у опытных животных проявилось на 7 сутки опыта на 47 % по сравнению с контролем, а максимальным был уровень этого показателя на 30 сутки, когда повышение составило 89 % (табл. 25).
Таблица 25. Динамика изменения содержания ЦИК в крови подопытных бычков
|
Группа животных |
ЦИК, мг/см3 | |||||
|
До введения препарата |
После введения препарата, суток | |||||
|
7 |
19 |
30 |
45 |
60 | ||
|
Опытная |
0,190,008 |
0,280,009* |
0,310,005* |
0,360,006* |
0,320,008* |
0,290,007 |
|
Контрольная |
0,180,008 |
0,190,008 |
0,170,009 |
0,190,004 |
0,180,008 |
0,210,006 |
За период исследования незначительно повышалось содержание лейкоцитов к 30–45 суткам опыта у бычков по сравнению с таковыми показателями у контрольных животных (табл. 26).
Отмечено уменьшение на 11 % концентрации эритроцитов в крови подопытных животных к 19 суткам после введения препарата, а показатели концентрации гемоглобина в крови у опытных и контрольных бычков достоверно не отличались.
Таблица 26. Динамика изменения содержания лейкоцитов в крови подопытных бычков
|
Группа животных |
Лейкоциты, тыс./мкл | |||||
|
До введения препарата |
После введения препарата, суток | |||||
|
7 |
19 |
30 |
45 |
60 | ||
|
Опытная |
4,60,01 |
4,80,02* |
5,20,02* |
5,80,06* |
5,90,04* |
5,30,08* |
|
Контрольная |
5,20,02 |
5,00,08 |
4,80,06 |
4,60,07 |
4,70,02 |
5,10,01 |
Примечание: «*» – р≤0,05, разница достоверна по отношению к контролю.
Повышение концентрации серомукоидов на 44 % к 7 суткам опыта свидетельствует о первоначальном иммуносупресивном действии (табл. 27). препарата, а дальнейшее уменьшение этого показателя до исходных величин и уменьшение в 2,5 раза его концентрации говорит о стабилизации иммунной системы и значительном иммуностимулирующем действии со стороны изучаемого препарата
Таблица 27. Динамика изменения содержания серомукоидов в крови подопытных бычков
|
Группа животных |
Концентрация серомукоидов, мг/см3 | |||||
|
До введения препарата |
После введения препарата, сутки | |||||
|
7 |
19 |
30 |
45 |
60 | ||
|
Опытная |
0,80,03 |
1,20,07* |
0,90,01 |
0,80,02 |
0,90,04* |
0,70,06 |
|
Контрольная |
0,70,02 |
0,60,04 |
0,80,06 |
0,70,04 |
0,70,08 |
0,80,03 |
Примечание: «*» – р≤0,05, разница достоверна по отношению к контролю.
При проведении патологоанатомических исследований в месте введения препарата и во внутренних органах изменений свойственных туберкулезной инфекции не обнаружено. Бактериологическими исследованиями микобактерий возбудителя туберкулеза не выявлено.
На основании полученных данных можно сделать вывод о том, что препарат ПКП-3:
— не вызывает у крупного рогатого скота патологоанатомических изменений характерных для туберкулезной инфекции;
— через 24 часа после введения препарата в местах инъекций образуются припухлости объемом с куриное яйцо, плотной консистенции, теплые. Температура тела у животных повышается до 40,0±0,2°С и держится на протяжении 48–120 часов. Образующиеся припухлости в местах введения препарата рассасываются в течение месяца до размера горошины;
— аллергические реакции на ППД-туберкулин появляются через 15 суток после введения препарата во всех животных и сохраняются на протяжении месяца;
— препарат обладает незначительными антиоксидантными свойствами на что указывают показатели изменения концентрации ДК и МДА;
— торможение процессов перекисного окисления липидов является причиной повышения перекисной резистентности эритроцитов (ПРЭ) – интегрального показателя потенциальной устойчивости мембран клеток к действию перекисей;
— индуцирует повышение уровня общего белка, концентрации ЦИК (комплексов Аг–Ат), содержания лейкоцитов и уменьшение в 2,5 раза концентрации серомукоидов, что свидетельствует о значительном иммуностимулирующем действии со стороны изучаемого препарата.
Изучение иммуногенных и протективных свойств препарата ПКП-3 на крупном рогатом скоте
Разработанный и апробированный на высоковосприимчивой лабораторной модели (морских свинках) противотуберкулезный молекулярно-субъединичный комплексный препарат ПКП-3, был подвергнут испытаниям по изучению его иммуногенных и протективных свойств на крупном рогатом скоте в условиях неблагополучного по туберкулезной инфекции хозяйства.
Для проведения этих исследований были взяты животные ЗАО «Єдність» Магдалиновского района Днепропетровской области, неблагополучного по туберкулезу крупного рогатого скота с 1996 г.
За 1996 г. выделено 17 коров, реагирующих на туберкулин из 926 голов (450 коров) общего поголовья крупного рогатого скота, а при диагностическом убое реагирующих – у 2 коров выявлены туберкулезные поражения лимфатических узлов (средостенных, бронхиальных). На следующий год было выявлено уже 265 (117 коров), из них у шести – выявлены патологоанатомические изменения, присущие туберкулёзной инфекции.
В 1998 г. было выявлено 110 голов (91 корова) при общем поголовье животных в хозяйстве – 568 голов (300 коров). При убое реагирующих у 8 из них обнаружены поражения туберкулёзного характера. Поголовье животных в 1999 г. уменьшилось до 292 голов (156 коров). Аллергическими исследованиями всего поголовья выделено 39 голов (28 коров) крупного рогатого скота, среди которых при диагностическом убое у 18 голов выявлены туберкулезные поражения.
Во время весенней туберкулинизации 2000 г. всего поголовья животных (200 голов), выявлено 12 реагирующих на туберкулин животных, а при их убое – у 9 выявлены классические поражения туберкулёзного характера лёгочных лимфоцитов.
В опыт брали все поголовье крупного рогатого скота, насчитывающее 113 голов из них 76 голов коров, 22 – телки до 6 месяцев возраста, 14 –бычков до 2 лет и 1 бык-производитель. Животные были разбиты на 4 группы. В три из них были отобраны животные, которые до начала опыта не реагировали на туберкулин: 2 опытные (68 и 14 голов) и 1 контрольную (17 голов). Животным этих групп вводили:
1 группа (n=68)– препарат ПКП-3 в дозе компонент № 1 – 5,0 см3и компонент № 2 – 1,0 см3, подкожно, ниже средней линии шеи с левой и правой стороны, двукратно с интервалом 14 суток;
2 группа (n=14) – вакцину БЦЖ Ставропольской биологической фабрики в дозе 1,0 см3, подкожно ниже средней линии шеи, двукратно с интервалом 14 суток.
3 группа (контрольная n=17) – стерильный физиологический раствор, подкожно в дозе 5,0 см3.
В 4 группу были отобраны животные (14 голов), которые до начала опыта реагировали на ППД-туберкулин (больные). Животным этой группы ничего не вводили.
После иммунизации животные всех групп были размещены в одном помещении при беспривязном содержании.
С целью установления выделяемости микобактерий туберкулеза из экскретов больных животных двукратно отбирались пробы молока, бронхиальной слизи и крови для проведения бактериологических исследований.
Пробы крови отбирали до начала опыта и через 1, 1,5, 3, 4, 8, 10 месяца после иммунизации от животных всех групп для проведения гематологических и биохимических исследований.
Аллергические исследования проводили до начала опыта и через 1, 1,5, 3, 3,5, 7 и 8 месяцев после иммунизации с использованием ППД-туберкулина для млекопитающих с последующим диагностическим убоем реагирующего скота из опытных и контрольных групп через 2 (24 головы), 3 (30 голов), 6 и 8 (49 голов), 12 (3 головы) месяцев с проведением патологоанатомических и бактериологических исследований.
В результате проведенных исследований установлено, что из полученных образцов бронхиальной слизи, крови и молока при посеве на среду Левенштейна-Иенсена не получено культуры микобактерий туберкулеза, а при постановке биологической пробы с этими образцами погибли от туберкулеза через 3 месяца после заражения молоком, полученным от 11 (91 %) из 12 больных животных (табл. 28). При введении молока, крови и бронхиальной слизи от нереагирующих животных (условно здоровых) морским свинкам гибели животных и поражений туберкулезного характера при вскрытии не обнаружено.
Таблица 28. Результаты биологической пробы на морских свинках материалом, полученным от больных туберкулезом животных
|
№ п/п |
Инвентарный номер |
Результаты биологической пробы на морских свинках с | ||
|
Бронхиальной слизью |
Кровью |
Молоком | ||
|
|
5359 тощая |
— |
— |
+ |
|
|
5399 |
— |
— |
+ |
|
|
5400 |
— |
— |
+ |
|
|
5366 |
— |
— |
+ |
|
|
5340 |
— |
— |
+ |
|
|
5324 |
— |
— |
+ |
|
|
5341 |
— |
— |
+ |
|
|
5331 |
— |
— |
+ |
|
|
5364 |
— |
— |
+ |
|
|
5334 |
— |
— |
+ |
|
|
5301 |
— |
— |
— |
|
|
5324 |
— |
— |
+ |
|
|
5317 условно здоровая |
контроль — |
— |
— |
|
|
5339 условно здоровая |
контроль — |
— |
— |
|
|
5345 условно здоровая |
контроль — |
— |
— |
Аллергическими исследованиями установлено, что через месяц после иммунизации в обеих опытных группах реагировали все животные, а уже через 45 суток в первой реагировало 51 %, второй – 100 %, контрольной – 55 % животных. Через три месяца после иммунизации в первой группе реагировало 29 % крупного рогатого скота (табл. 29). Через 3,5 месяца после иммунизации реагировало на туберкулин в первой группе 7 %, а через 7 месяцев – 4 % особей.
Таблица 29. Результаты аллергических исследований крупного рогатого скота
|
Группа животных |
Реагировало на ППД-туберкулин, % | ||||||
|
До начала опыта |
После иммунизации, месяцев | ||||||
|
1 |
1,5 |
3 |
3,5 |
7 |
8 | ||
|
1. Опытная «ПКП-3» |
— |
100 |
51 |
29*28 |
7*28 |
4*24 |
— |
|
2. Опытная «БЦЖ» |
— |
100 |
100 |
— |
14 |
— |
— |
|
3. Контроль |
— |
— |
55 |
— |
— |
— |
— |
|
4. Больные животные |
100 |
100 |
100 |
— |
— |
— |
— |
Примечание: «*n» – количество реагировавших на туберкулин животных приведено по отношению к фактическому количеству животных в группе (n).
Выявление аллергических реакций у иммунизированных животных в течении 7 месяцев свидетельствует о существовании антигенной атаки на макроорганизм со стороны возбудителя туберкулёза (больных животных), а дальнейшее исчезновение реакций указывает на элиминацию возбудителя вследствие высокой напряжённости выработанного противотуберкулезного иммунитета.
В дальнейшем положительных аллергических реакций в опытных группах через 5 месяца не наблюдали. В контрольной и группе больных туберкулезом через 3 месяца после начала опыта исчезали реакции на туберкулин, что по всей видимости связано с тяжестью развития инфекционного процесса и патологоанатомических изменений, повлекших за собой состояние анергии у больного крупного рогатого скота.
При проведении гематологических исследований крови больных (5 голов) и контрольных (5 голов) животных через 3 месяца после начала опыта наиболее выраженные изменения установлены в эритропоэтической системе. У больных и контрольных животных наблюдалось достоверное снижение количества эритроцитов на 22 % и повышения уровня гемоглобина на 20 %. Это обусловило повышение среднего количества гемоглобина в эритроците до 14,5±0,25 пг, что превышает контрольные показатели у здоровых животных до начала опыта на 55 %.
Определяемые нами показатели общего белка, циркулирующих иммунных комплексов, серомукоидов, диеновых коньюгатов, малонового диальдегида в плазме крови больных и контрольных животных не отличались существенно от таковых у здоровых животных.
Наблюдали существенный ответ Т клеточной системы иммунитета на введенные антигены, проявляющееся увеличением популяции Т-хелперов (Th) и значительным уменьшением Т-супрессорных клеток. Тенденция увеличения количества В-лимфоцитов в более чем 2 раза была достоверной по сравнению с показателями до введения препарата. Результаты этих исследований отражены в таблице 30.
Необходимо отметить, что рост популяции Т хелперов продолжался до 8 мес., а затем снижался, а увеличение популяции В- клеток длилось до 5 мес. с постепенным снижением этого показателя (10 месячный срок наблюдения).
Эти данные по реактивности и быстроте ответа Т и В систем иммунитета на введение препарата, указывают на достаточно интенсивную иммунную Т клеточную реакцию и быструю наработку антител, что подтверждено данными серологических исследований в РИД с данными антигенами.
В результате проведенных патологоанатомических исследований установлено, что у двух животных, иммунизированных изучаемым препаратом обнаружены увеличение средостенных и бронхиальных лимфатических узлов без видимых туберкулезных поражений с проявлением кровоизлияний и саловидности на разрезах.
Характерные туберкулезные изменения в лимфатических узлах обнаружены у двух животных и значительное увеличения заглоточных и бронхиальных лимфатических узлов у трех бычков, вакцинированных БЦЖ.
Интенсивные поражения внутренней стенки грудной полости в виде жемчужницы обнаружены у коровы, а также значительные поражения заглоточных и средостенных лимфатических узлов обнаружены у 8 больных туберкулезом и 13 контрольных коров (табл. 31).
Все пораженные и не пораженные лимфатические узлы были отобраны для проведения бактериологических исследований и постановки биологической пробы.
В результате проведенных исследований выделен возбудитель туберкулеза бычьего вида из патологоанатомического материала от животных 2 (5 голов), 3 (15 голов) и 4 (14 голов) группы (табл. 30).
Таблица 30. Динамика изменения иммунного статуса крупного рогатого скота под действием препарата ПКП-3
|
Сроки проведения исследований |
Количество лимфоидных клеток в периферической крови (тыс/мл) | |||
|
Т хелперы(Тh) |
Т супрессоры |
В клетки | ||
|
До введения ПКП-3 |
2,7±0,1 |
0,4±0,01 |
1,1±0,001 | |
|
Через 1,5мес. |
4,3±0,1 |
0,35±0,01 |
2,8±0,3 | |
|
Через 4мес. |
4,2±0,1 |
0,3±0,01 |
2,9±0,1 | |
|
Через 8мес. |
4,1±0,1 |
0,4±0,01 |
2,5±0,1 | |
|
Через 10мес. |
4,1±0,1 |
0,4±0,01 |
2,1±0,1 | |
Полученные данные дают основание сделать соответствующие выводы:
— препарат ПКП-3 обладает сенсибилизирующими свойствами, которые выявляются аллергическими реакциями на ППД-туберкулин у иммунизированных животных в течение 1 мес. животные которые продолжают реагировать до 3-4 мес. по видимому подвергались воздействию патогенных микобактерий из внешней среды;
— двукратное с интервалом 14 суток введение препарата ПКП-3 в предлагаемых дозах крупному рогатому скоту обеспечивает надежную защиту до 90 % восприимчивых животных от спонтанного заражения возбудителем туберкулеза бычьего вида в сравнении с БЦЖ обеспечивающего 60 % протекцию.
Постоянное инфицирование иммунизированных животных возбудителями туберкулёза от больных коров лишь индуцировало временное (1–2 месяца), состояние ГЧЗТ на туберкулин. При этом развитие туберкулёзного процесса у иммунизированных животных не наблюдалось (табл. 31).
Таблица 31. Результаты патологоанатомических и бактериологических исследований
|
Группа животных |
Патологоанатомические изменения туберкулезного характера |
Результаты бактериологических исследований |
|
1. Опытная «ПКП-3» |
2 головы – увеличение средостенных и бронхиальных лимфатических узлов |
— |
|
2. Опытная «БЦЖ» |
2 головы – туберкулезные поражения лимфатических узлов, 3 головы – значительное увеличение и поражение заглоточных и бронхиальных лимфатических узлов |
+ 5 |
|
3. Контроль |
13 голов – поражение заглоточных и средостенных лимфатических узлов с казеозным содержимым |
+ 15 |
|
4. Больные животные |
1 голова – жемчужница, 8 голов – диффузное поражение заглоточных, бронхиальных, средостенных лимфатических узлов и плевры |
+ 14 |
Положительные результаты этого эксперимента позволили предложить неблагополучным по туберкулезу хозяйствам Днепропетровской и Харьковской областей, согласно распоряжения Главного управления ветеринарной медицины Украины, проведение широких производственных опытов, при включении вакцинопрофилактики с помощью молекулярно-субъединичного препарата ПКП-3 в комплекс противотуберкулезных оздоровительных мероприятий. Ход и итоги оздоровления детально описаны в разделе «Эпизоотология туберкулеза».
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
Авербах М.М Иммунология и иммунопатология туберкулёза. М., Медицина., 1976., с.311.
Авербах М.М., Литвинов В.И. Иммунологические основы противотуберкулёзной вакцинации// М.,М.,1970.-с.221.
Александров И.Д., Хабузов И.П, Ладан Н.С. Т- и В- активины и протективные свойства вакцины БЦЖ // Ветеринария.-2000.-№1.-с.23-28.
Бойко А.А., Сапегина Е.П. Туберкулёз крупного рогатого скота // Москва.-1991.-с.92.
Бурба, Л.Г. Клиническая оценка иммунологического состояния больного лейкозом крупного рогатого скота [Текст] / Л.Г. Бурба, А.Н. Федорченко // Иммунология и иммунотерапия лейкозов человека и животных. – Ташкент, 1984. – С. 39 - 40.;
Бышевский, А.Ш., Биохимия для врачей / А.Ш. Бышевский, О.А. Герсенов // Екатеринбург: Уральский рабочий, 1994 – 269 с.
Вертиев Ю.В. // Журнал микробиол.,1987.- №3.-С. 86-94.
Воробьев А.А. Микробиология и иммунология // Медицина., М.-1999.-с.463.
Воробьев А.А., Васильев Н.Н., Кравченко А.Т. Анатоксины // Медицина.-М., 1965.-с.487.
Гаврилова Г.А. Эпизоотический процесс туберкулеза и лейкоза крупного рогатого скота на Дальнем Востоке и совершенствование методов діагностики: автореф… дис. докт. вет. наук.:16.00.03 –М.:, 2005 – 24 с.
Галатова Л.В. и соавт. Влияние вакцинации в сочетании с иммуностимуляторами на концентрацию нейраминовой кислоты в сыворотке крови телят [Иммунизация вакциной БЦЖ в сочетании с иммуностимуляторами] // Актуальные проблемы ветеринарной медицины.-Челябинск.-1996.-С.14-16.
Головко И.Д. и соавт. Динамика кожной реакции у телят на введение вакцины БЦЖ // Диагностика и профилактика инф. И инв. заболеваний с/х животных в Зап. Сибири. -Омск.-1989. -С.26-29.
Горелова Л.А., Земскова З.С., Панавсек И.А., Некрасов А.В., Пучкова Н.Г., Мороз А.М., Романова Р.Ю. Изучение иммунобиологических свойств специфических иммуномодуляторов адьювантного типа при экспериментальном туберкулёзе // Проблемы туберкулёза.-1996.-№3.-С.46-47.
Гуткин В.С. и соавт. Иммуногенность клеточных оболочек микобактерий туберкулёза// Бюлл.ВИЭВ.- вып.64. -М., 1987.-С.24-26.
Гуткин В.С., Востряков А.Н., Горбатов Б.А. Иммуногенность клеточных оболочек микобактерий туберкулёза .. Бюлл.ВИЭВ.-1987.-№64.-С.24-28.
Далин М.В. , Фиш Н.Г. Токсины микроорганизмов.-1980.-с.247.
Диких Я.Г. Противоэпизоотическая эффективность специфической профилактики туберкулёза, микробиологические и иммунологические особенности вакцинного процесса (БЦЖ) у крупного рогатого скота// Автор.дисс. …канд.вет.наук.-1998.-с.21.
Донченко А.С., Донченко В.Н., Донченко Н.А. Использование индуктора интерферона –ридостина для повышения резистентности организма животных и иммуногенности вакцины БЦЖ// Эпизоотология, диагностика, профилактика и меры борьбы с болезнями животных.-Новосибирск.-1997.-С.87-92.
Донченко А.С., и соавт. Контроль благополучия крупного рогатого скота по туберкулёзу с параалергическим фоном сенсибилизации к туберкулину // Тез.докл.науч.практ.конф.-Новосибирск.-1995.-С.6-7.
Донченко А.С., Шкиль Н.А. Совершенствование методики оценки эпизоотической ситуации крупного рогатого скота// Зооантропонозные болезни, меры профилактики и борьбы.-Гродно.-1997.-С.76-78.
Евгевский А.А. Экспериментальное обоснование и практические аспекты диагностики и профилактики инфекцинно-аллергических болезней животных // Дисс.доктора вет. наук.-Л.-1990.-332с.
Евглевский А.А., Евглевский Ал.А. Изготовление и испытание противотуберкулёзного анатоксина на крупном рогатом скоте // Курский ЦНТИ, №1, 1991.
Евглевский Ал.А. Оценка эпизоотической эффективности полевых испытаний туберкулёзного анатоксина в стационарно неблагополучных по туберкулёзу стадах // Тез.док.науч.произ.конф., Курск, 1996.- С.109-111.
Еремеев В.В. Новая противотуберкулёзная вакцина: мечта или реальность // Проблеммы туберкулёза.-2001.-№1.-С.53-55.
Изучение безвредности, алергенных и протективных свойств нового противотуберкулезного комплексного препарата ПКП-3 /В.А.Бусол, Г.А.Краснiков, А.М.Коваленко, Л.В.Коваленко// Вет. медицина: Межвед. темат. наук. сб.- 2000.- Ч.I, Вып.78.- С.34-42.
Иммуногенные и протективные свойства ПКП-3 // Бусол В.А., Стегний Б.Т.,Короленко Л.С., Ткаченко А.А., Коваленко Л.В., Коваленко А.М., Евглевский А.А., Сытник В. // Проблемы зооинженерии и ветеринарной медицины. Х.- 2001.-Вып. 9 (33), ч. 1.-С. 147-152.
Коваленко А. Профилактическое действие нового противотуберкулезного вакцинного препарата ПКП-3 при экспериментальном туберкулезе // Вет. медицина Украины 2000.- N 8.- С. 16-17.
Коваленко А.М. Разработка специфических средств вакцинопрофилактики туберкулёза крупного рогатого скота// Дисс. доктора вет. наук, Санкт-Петербург., 2002. С. 267.
Копылова И.Ф. К биохимическим основам противотуберкулёзного иммунитета .. Труды ин-та усов. Врачей им.Ленина.-1968.-т.21., С.182-183.
Коромыслов Г. Ф. . Биоклиническая характеристика патогенеза лейкозов крупного рогатого скота [Текст]: автореф. дисс. д-ра биол. наук: 6.00.03//. Коромыслов Георгий Федорович – М. 1978. – 44 с.
Красочко, П.А. Иммунокоррекция в ветеринарной медицине // П.A. Красочко, [и др.]; под ред. П.А. Красочко// Минск «Техноперспектива», 2008. – 507 с.;
Крылов В А., Гергерт В.Я., Короткова Е.Д. // Проблемы туберкулёза .-1995.-№4.-С.11-14.
Лазаренко В.Н., Махлай А.А., Хоменко А.Г. // Вестник Рос.АМН.-1993.-№2.-С.37-39.
Магер, С.Н. Характеристика иммунного ответа у крупного рогатого скота и овец, экспериментально инфицированных BLV, M. bovis, M. smegmatis и вакцинированых БЦЖ в различных сочетаниях: автореф. дис. канд. веет. наук: 16.00.03/ Магер Сергей Николаевич – Новосибирск, 1992. – 24 с.
Мыколышин Л.И. Причины туберкулёза у эффективно вакцинированных БЦЖ детей раннего и дошкольного возраста // Проблемы туберкулёза .-1999.,№1.-с.20-22.
Новак Д.Д., Базарбаев М. Изготовление сухой противотуберкулёзной вакцины для ветеринарных целей // Сборник научных трудов ИЭВСиб.ДВ. -Новосибирск. -1991.-С.21-28.
Овдиенко Н.П., Горбатов В.А., Гуткин В.С. и соав. Противотуберкулёзная резистентность, индуцированная микобактериями БЦЖ и фракций их оболочек // Труды ВИЭВ.-1984.-т.61.- С.41-44.
Овдиенко Н.П., Донченко А.С. и соавт. Основные направления и достижения в изучении туберкулёза животных // Сборник материалов научной сесии РАСХН (к 100 летию ВИЭВ).-1999.-т.1.-С.111-114.
Огнев С.И. Специфическая профилактика туберкулёза маралов// Автор. Дисс. .. канд.вет.наук.-1997.-с.16.
Оздоровительные мероприятия при туберкулёзе крупного рогатого скота [Текст] /М.И. Гулюкин [и др] // Ветеринария – 2012. №1. – С. 3 – 8.
Протективные свойства противотуберкулезного препарата ПКП-3 и вакцины BCG / В.А.Бусол, Г.А. Краснiков, Л.В. Коваленко, А.А. Евглевский А.М. Коваленко // Вет. медицина: Межвід. темат. наук. зб. Х.- 2001.- Вип.79.- С.48-51.
Ройт, А., Бростофр Дж., Мейл Д. Иммунология/. А Ройт, Дж. Бростофр, Д. Мейл // М.:Мир, 2000. – 241-242 с.
Рудницкий, В.Ф. Краткий аналитический обзор иммунологических аспектов при инфекции BLV и лейкозе крупного рогатого скота [Текст] / В.Ф. Рудницкий // Научные основы профилактики и лечения болезней животных. Екатеринбург. – 2005.– С. 117 -121.
Саюбаева Б.П. Остаточная вирулентность аттенуированного штамма “БК-Харьков” по сравнению со штаммом БЦЖ в эксперименте на животных // Труды Каз.НИВИ., 1979., т.18., С.36-37.
Симбирцев В.Е. и соавт. Применение вакцины БЦЖ в комплексе мероприятий по борьбе с туберкулёзом крупного рогатого скота // Проблемы интенсификации промышленного животноводства в зоне Южного Урала.-1989.-С.51-53.
Смирнов. П. Н. Проблемы адаптации сельскохозяйственных животных в Сибири [Текст] / П.Н. Смирнов, и др. : под ред. П.Н. Смирнова // Новосибирск, 1995– 257 с.
Сотниченко, С.А., Некоторые аспекты у больных ВИЧ-инфекцией в различных стадиях, сочетанной с туберкулёзом [Текст] / С.А. Сотниченко, Л.Ф. Скляр, Е.В. Маркелова // Иммунология. – 2008. – Т. 29. – №1. – С. 4- 6.
Стаханов В.А., Леви Д.Т., Рухамина М.Л. Специфическая иммунокоррекция и некоторые характеристики иммунного статуса у больных активным туберкулёзом лёгких // Иммунология.-Медицина.-2000.-№3.-С.51-53.
Стебловская С.Ю. Особенности иммунного ответа у крупного рогатого скота при иммунизации туберкулёзным анатоксином // Дисс.канд.вет.наук.-Курск.-1998.-162с.
Стрижаков, А.А. Новый патогенный для крупного рогатого скота ретровирус – вирус артрита энцефалита коз [Текст] /А.А. Стрижаков, и др. // Научные основы профилактики и лечения болезней животных. Екатерингбург. 2005, С. 334 - 339.
Урбан В.П. Туберкулез // Краевая эпизоотология Нечерноземной зоны РСФСР/ Под редакцией Урбана В.П, Таршиса М.Г..-М.: Колос,1980.-С.75-84.
Хайкин Б.Я., Зубакин В.Я. Профилактическая эффективность вакцины БЦЖ при разных схемах ее применения // Методы диагностики и профилактики бруцеллеза и туберкулёза животных.-1988.-С.71-78.
Чичикин, А.Ю., Нозогеография артрита-энцефалита коз [Текст] / А.Ю. Чичикин, // Ветеринария. – 2011. – №2. – С. 19 - 22/
Чуканов В.И. Лечение больных легочным туберкулёзом антибиотиками в сочетании с вакциной БЦЖ// Автор. дисс. канд.мед. наук.-Харьков,1968. – 16 с.
Яблокова Т.Б. Противотуберкулёзная вакцинация // В кн.: Иммунология и иммунопатология туберкулёза // М., Медицина.-1976.-С.249-270.
Addo K.K. et al. The experimental immunization of cattle against tuberculosis by liposomizet BCG vaccine // Folia veter.-Kosice/-1998/-42/- N 3.-P.153-157.
Aldwell F.E. et al. Route of BCG administration in possums affects protection against bovine tuberculosis// NZ Vet.J.1995.-43.-356-359.
Andersen P. et al (1995) Recall of long-lived immunity of Mycobacterium tuberculosis infection in mice.J.Immunol.154, 3359-3372.
Andersen P.// Infection and Immunity.-1994, N62.-P.2536-2541.
Böddinghaus, B., Rogall, T., Flohr, T., Blöcker, H., and Böttger, E.C. (1990) Detection and identification of mycobacteria by amplification of rRNA. J.Clin.Microbiol. – Vol. 28.– P.1751-1`759.
Böttger, E. C. (1996) Approaches for identification of microorganisms. ASM News. – Vol. 62.– 247- P.250.
Bottger, E. C., Teske, A., Kirscher, P., Bost, S., Chang, H. R., Beer, V., and Hirschel, B. Disseminated “Mycobacterium genavense” infection in patients with AIDS.// Lancet– 1992.– Vol. 340. – P. 76-80.
Buddle B.M. et al. Intraduodenal vaccination of brushtail possums with bacille Calmette-Guerin enhances immune responses and protection against Mycobacterium bovis infection // Int.J. Tuberc.Lung Dis.-1997.– N 1.– 377-383.
Buddle B.M. et al. Protection of cattle from bovine tuberculosis by vaccinacion with BCG by the respiratory or subcutaneous route, but not by vaccination with killed Mycobacterium vaccae // J.Res.Vet.Science.-1995.– – Vol. 59.– P.10-16.
Buddle B.M.,Aidweii F.E. Intraduodenal vaccination of brushtail possums with baccile Calmette-Guerin enhances immune responses and protection against M.bovis infection // Inter.J.Tuberculosis Lung Disease, Aug. 1997.-Vol.1.-N 4.-P.337-383.
Cohen M.L., Mayer L.W.,Rumschlag H.S. et al. // J. Clin. Vicrobiol..-1987.-Vol.25.-N7.-P. 1176-1180.
Coler R.N. et al. (1998) Molecular cloning and immunologic reactivity of a novel low molecular mass antigen of Mycobacterium tuberculosis. J.Immunol. 161, 2356-2364.
Ezekowiz R.A. Innate immunity/ R.A. Ezekowiz, J.A. Hofmann// Cur.Opim.Immunol. – 1996. – Vol. 8. – P. 82.
Fifis T. Et al // Scand.J.Immunology.-1994,39.-P.267-274.
Granger D., Jamamoto K., Ribi E. Delaved hypersensitivity and granulomatous response after immunisation with protein antigens assiciated with mycobacterial glukolipidet and oil droplets // J.Immunol.-1976.-116.-P.482-485.
Heinz Gulle et al. Responses of bovine T-cell to fractionated lysate and culture filtrate proteins of Mycobacterium bovis BCG // J.Vet.Immun.and Immunopathology.-1995, N48.-P.183-190.
Horsburgh, C. R. (1991) Mycobacterium avium complex infections in the acquired immunodeficiency syndrom. N. Engl. J. Med. 324, 1332-1338.
Horwitz M.A. et al (1995) Protective immunity against tuberculosis induced by vaccination with major extracellular proteins of Mycobacterium tuberculosis. Proc.Natl.Acad.Sci. USA 92, 1530-1534.
Hubbard R.D., Flory C.M., Collins F.M. (1992) Immunization of mice with mycobacterial culture filtrate proteins. Clin.Exp.Immunol. 87,94-98.
Hughes M.S., Neill S.D., Rogers M.S. Vaccination of the badger (Meles meles) against Mycobacterium bovis // J.Vet.Mycrob.-1996, N51.-P.363-379.
Hultman, T., Stahl, S., Hornes, E., and Uhlen, M. (1989) Direct solid phase sequencing of genomic and plasmid DNA using magnetic beads as support. Nucleic Acids Res. 17, 4837-4946.
Identification of Mycobacterium bovisantigens by analysis of bovine T-cell responses after infection with a virulent strain. /A. Alito [at all.].//Braz J Med Biol Res.// 2003.– Vol. 36, N11. – P. 1523-1531.].
Jager F.G.// Nutr. Dieta.–1969,–№ 10., p. 215–223.
Joumans A., Joumans G. // J.Immunol.-1973.-Vol.110.-P.581-586.
Kaufmann S.H. // Current Topics in Mycrobiology and Immunology.-1988, 138.-P.141-156.
Kaufmann S.H., Young D.B. // Immunobiology. -1992, 184.-P.208-219
Kirschner, P., Meier, A., and Böttger, E. C. (1993) Genotypic identification and detection of mycobacteria: facing novel and uncultured patogens, in Diagnostic Molecular Microbiology (Persing, D. H., Smith, T. F., Tenover, F. C., and White, T. J. Eds.), American Society for Microbiology, Washington, DC, pp. 173-190.
Kirschner, P., Springer, B., Vogel, U., Meier, A., Wrede, A., Kiekenbeck, M., Bange, F.-C., and Böttger, E. C. (1993) Genotypic identification of mycobacteria by nucleic acid sequence determination: report of 2-year experience in a clinical laboratory. J. Clin. Microbiol. 31, 2882-2889.
Langrange P. Immunity in tuberculosis // Anv.Microbiol.. -1978., 1.- P.97-98.
Liszeweki, M.K. Complement system and immune complex diseases/ M.K. Liszewek //In. Intern. Med. Boston – 1990. – P. 76.
Madej J.A. Udzial endotelin w procesach fizjologicznych i patologicznych: Med.weter., 2001; R.57,N 9. - S. 630-633.
Maidak, B.L., Olsen, G.J., Larsen, N., Overbeek, R., Mc Caughey, M.J., and Woese, C. R. The ribosomal database project (RDP). Nucleic Acid Res. –1996– – Vol. 24.– P. 82-85.
Matsuo K., Yamaguchi R., Yamazaki A. Et al.-J. Bacteriol.-1988.-Vol.170.-N9.-P. 3847-3854.
Mosmann T., Sad S. // Immunol.Today.-1996. -Vol.17, N3. – P.138-146.
Nagai S. et al (1991) Isolation and partial characterization of major protein antigens in the culture fluid of Mycobacterium tuberculosis. Infect.Immun.59, 372-382.
Newell D.G., Hewinson R.G. Control of bovine tuberculosis by vaccination // J.Vet.Record.-1995, N 136.-P.459-463.
Oettinger T. et al (1995) Mapping of the delayed-type hypersensitivity-inducing epitope of secreted MPT64 from Mycobacterium tuberculosis. Infect.Immun. 63, 4613-4618.
Pal P.G., Horwitz M.A. (1992) Immunization with extracellular proteins of Mycobacterium tuberculosis induces cell-mediated immune responses and substantial protective immunity in an guinea pig model of pulmonary tuberculosis. Infect.Immun.60, 4781-4792.
Ribi E., Larson C., Wicht W., Goode G. // Proc.Soc.exp/Biol.-1965.-Vol.118.-P.926-933.
Ribi E., Meyer T., Azuma J., Parker R. // Cell.Immunol.-1975.-Vol.16.-P.1-10.
Roberts A.D. et.al (1995) Characteristics of protective immunity engendered by vaccination of mice with purified culture filtrate protein antigens of Mycobacterium tuberculosis. Immunology 85, 502-508.
Rogall, T., Flohr, T., and Böttger, E. C. Differentiation of mycobacterium species by direct sequensing of amplified DNA. J. Gen. Microbiol. – 1990. – Vol. 36. – 1915-1920.
Rosenkrands I. et al. (1998) Identification and characterization of a 29-kilodalton protein from Mycobacterium tuberculosisculture filtrate recognizet by mouse memory effector cells. Infect.Immun. 66, 2728-2735.
Savrda J. Synthesis and biological assays of peptides from a tuberculin-active protein // Infect.and Immun. -1983. -Vol. 40. –P. 1163-1169.
Scott P. //Science.-1993.-Vol.260.-P.496-497.
Sorensen A.L. et al (1995) Purification and characrerization of a low-molecular-mass T-cell antigen secreted by Mycobacterium tuberculosis. Infect.Immun. 63, 1710-1717.
Springer, B., Stockman, L., Teschner, K., Roberts, G. D., and Böttger, E. C. Two laboratory collaborative study on identification of mycobacteria: molecular versus phenotypic methods. J. Clin. Microbiol.– 1996. – Vol. 34.– 296-303.
Tascon R.E. et al. // Nature Med.–1996.–Vol.2.-P.888-892.
Webb J.R. et al. (1998) Molecular cloning expression, and immunogenicity of MTB12, a novel low-molecular-weight antigen secreted by Mycobacterium tuberculosis. Infect.Immun. 66, 4208-4214.
Woese, K. H. Bacterial evolution. //Microbiol. Rev. -1987.- 51, 221-271.
Wojcik, R. Effect of brewers' yeast (Saccharomyces cerevisiae) extract on selected parameters of humoral and cellular immunity in Iambs. / Wojcik, R.//Bull.Veter.Inst.in Pulawy. – 2010. – Vol.54. – №2. - P. 181-187.
Контроль эпизоотического процесса при туберкулезе крупного рогатого скота
Туберкулёз является зооантропонозным заболеванием, поэтому борьбу с ним ведут как ветеринарные и медицинские специалисты. Ветеринария в борьбе с туберкулёзом подчиняется биологическим и экономическим законам, а медицина – биологическим и социальным. От умения использовать эти законы зависит эффективность борьбы с туберкулёзом как животных, так и людей. В арсенале ветеринарных специалистов радикальных возможностей профилактики туберкулёза больше, чем у медиков, в частности, только в животноводстве можно профилактировать туберкулёз, выращивая животных в хозяйствах закрытого типа и убивать животных для ликвидации источника инфекции.
Научная разработка мер борьбы с туберкулёзом началась с открытия Р. Кохом в 1892 г. возбудителя туберкулёза. За это время проведено исследований по созданию методов борьбы с туберкулёзом. Также вопросы борьбы с туберкулёзом поднимались на Ветеринарных конгрессах, конференциях Международного Эпизоотического Бюро (МЭБ) и Всемирной Организации Здравоохранения (ВОЗ).
Как указывает Лопунов С.В. (2009) [11] одним из первых основателей научного подхода к разработке системы противотуберкулезных мероприятий в животноводстве является немецкий ученый Отто Банг. В основу оздоровительных мероприятий при туберкулезе крупного рогатого скота, предложенных им в 1882 году, он впервые положил аллергическую диагностическую пробу с использованием туберкулина. По результатам аллергического исследования стадо делили на две изолированные группы животных: реагирующих на туберкулин и условно здоровых. Животных второй группы 2 раза в год исследовали туберкулином (внутрикожная проба) и реагирующих на введение аллергена переводили в первую группу. Животных первой группы с клиническими признаками туберкулеза (кашель, истощение, увеличение поверхностных лимфатических узлов и др.) отправляли на убой. Телят, родившихся от не реагирующих на туберкулин коров, содержали под матерями; от реагирующих, после первой дачи молозива, переводили в отдельную группу и выпаивали молоком от здоровых коров или пастеризованным.
Причина широкого распространения туберкулеза крупного рогатого скота в Германии на рубеже ХIX-XXвеков, описанного нами в главе «Эпизоотология туберкулёза крупного рогатого скота», крылась в запущенности этой болезни, на которую долгое время не обращалось должного внимания, а также в безуспешности достаточно мягких мер борьбы, разработанных Робертом фон Остертагом. В 1912 г. он предложил метод борьбы с туберкулезом, в основу которого была положена клиническая диагностика болезни с проведением бактериологических исследований биологического материала от животных. Применение для диагностики туберкулиновой пробы метод не предусматривал. Из стада изолировали и подвергали убою только животных с открытой формой туберкулеза. Телятам выпаивали молоко от коров, не имеющих видимых клинических признаков болезни, или обеззараженное кипячением. Вынужденность применения таких неполных мер в какой-то мере была обусловлена тяжелым экономическим положением послевоенной Германии.Вполне очевидно, что при таком методе противотуберкулезных мероприятий значительная часть больных, и особенно инфицированных животных, оставалась в стаде и являлась весьма опасным источником распространения возбудителя туберкулеза. Поэтому в большинстве стран мира, взявших на вооружение метод Р. Остертага, не удалось добиться улучшения эпизоотической обстановки по туберкулезу крупного рогатого скота [2; 3].
Метод О. Банга используется достаточно широко, благодаря ему туберкулёз ликвидирован во многих странах. Отечественная система мер борьбы с туберкулёзом животных также изначально была основана на методе Банга и ее применение к 90-м годам ХХ века принесло положительные результаты.
Однако за последние два десятилетия в Российской Федерации и другихстранах СНГ изменились формы собственности в агропромышленном производстве, созданы приватные акционерные общества, фермерские хозяйства, увеличилось поголовье скота в частном секторе. Также реформируется система ветеринарного управления. Совокупность этих факторов, как считаетДобрелин В.Н., (2009), обусловила серьезные затруднения в осуществлении ветеринарно-санитарного контроля, в организации и проведении необходимых профилактических и противоэпизоотических мероприятий. Учитывая важное экономическое и социально-эпидемиологическое значение туберкулеза крупного рогатого скота, меры борьбы и профилактики заболевания, в современных условиях требуют развития и совершенствования [4]. В то же время, нельзя не согласиться с М.И. Гулюкиным и соавт. (2012), [12,13]. которые указывают на недопустимость использованияметодов ликвидации болезни в неблагополучных по туберкулезу хозяйствах крупного рогатого скота, не предусмотренных ветеринарным законодательством и подчеркивают непредсказуемость последствий такого применения.
В настоящее время основополагающим международным документом, регламентирующим мероприятия по контролю туберкулеза КРСявляется «Кодекс здоровья наземных животных» Международного Эпизоотического Бюро, (2010),[10]. но в нем отноcительно туберкулеза животных содержаться основные требования по применению обязательных и дополнительных методов диагностики заболевания (туберкулиновая проба и ɤ-интерфероновый тест соответственно), исследованию на туберкулез самцов рогатого скота–доноров спермы и пробников, карантина приматов.
Поэтому в каждой стране разработаны Национальные нормативные документы относительно контроля туберкулеза животных. В настоящее время мероприятия по профилактике и борьбе с туберкулезом животных в Российской Федерации проводятся в соответствии Санитарных и Ветеринарных правил «Профилактика и борьба с заразными болезнями общими для человека и животных». «Туберкулез», утвержденных Госкомсанэпиднадзором России 31 мая 1996 г. и Департаментом ветеринарии МСХ и продовольствия Российской Федерации 18 июня 1996 г. и «Наставления по диагностике туберкулеза животных», утвержденного Департаментом ветеринарии МСХ Российской Федерации 18 ноября 2002 г.
В соответствии Санитарных и Ветеринарных правил степень неблагополучия по туберкулезу стад крупного рогатого скота определяется с учетом распространенности болезни: ограниченная - при выявлении двукратной туберкулиновой пробой до 15 % животных; значительная —при выявлении более 15% больных животных. Оздоровление неблагополучных стад проводят методами:
-систематических диагностических исследований с выделением и убоем больных животных;
-единовременной полной заменой поголовья неблагополучного стада (фермы) здоровыми животными.
При оздоровлении методом систематических исследований с убоем больных животных - всех животных с 2 месячного возраста, каждые 45-60 дней исследуют двойной внутрикожной туберкулиновой пробой. Реагирующих животных признают больными, таврят буквой «Т», изолируют и в течение 15 дней сдают на убой. Метод единовременной полной замены поголовья животных применяют, когда туберкулез впервые установлен в районе, области, республике или при значительной распространенности туберкулеза (более15%) в стаде.
В соответствии «Наставления по диагностике туберкулеза животных» основным методом прижизненной диагностики туберкулеза крупного рогатого скота является внутрикожная туберкулиновая проба. В качестве дополнительных методов диагностики применяют глазную пробу, пальпебральную пробу, внутривенную пробу, симультанную пробу с ППД -туберкулином для млекопитающих и комплексным аллергеном из атипичных микобактерий (КАМ) и симультанную пробу с ППД – туберкулином для млекопитающих и ППД - туберкулином для птиц [8, 9].
В оздоравливаемых хозяйствах весь крупный рогатый скот исследуют внутрикожной туберкулиновой пробой каждые 45–60 дней до получения подряд двух отрицательных результатов. После этого проводят два контрольных исследования с интервалом в 3 месяца. При отрицательных результатах контрольных исследований хозяйство считают оздоровленным от туберкулёза.
При положительных результатах контрольных исследований животных отправляют на боенскую экспертизу. Если обнаруживают туберкулёзные изменения в органах и тканях убитых животных, то заменяют все поголовье. В случае отсутствия изменений отбирают пробы для культурального и биологического исследований, а животных этого стада через 3 месяца еще раз проверяют туберкулиновой пробой. При отрицательных результатах туберкулиновой пробы и лабораторной диагностики хозяйство считают оздоровленным. Если эти контрольные исследования не исключили заболевания животных туберкулёзом, то продолжают оздоровление стада. Если в течение двух лет этим методом не удалось оздоровить стадо, то все поголовье заменяют здоровыми животными.
Изолированное выращивание молодняка. Использование системы изолированного выращивания молодняка является обязательным условием организационно-хозяйственных и специальных мер по оздоровлению хозяйства от туберкулёза. Ее технологические основы заложил М.К. Юсковцем.
Для изолированного выращивания здоровых телят необходимо соблюдение зоогигиенических норм содержания и кормления. Для этого в хозяйстве должны быть родильное помещение, профилакторий, обособленную ферму и пастеризационную установку. При отсутствии профилактория телят можно выращивать в клетках на открытом воздухе.
Телят от здоровых коров содержат в родильном отделении в течение 6–7 дней. В это время им выпаивают молозиво, полученное от здоровых коров. После этого телят переводят в профилакторий или в индивидуальные домики на открытом воздухе, где их содержат до двухмесячного возраста. Телятам старше недельного возраста можно выпаивать сырое молоко от здоровых коров и пастеризованное от больных.
После достижения телятами двухмесячного возраста их исследуют клиническими методами и внутрикожной туберкулиновой пробой. Больных телят отправляют на убой, а здоровых переводят на специальную ферму, где также исследуют на туберкулёз. Телят на специальной ферме, которые по всей группе дали отрицательные результаты, считают здоровыми и используют для комплектования стада.
Оздоровление хозяйств путем полной замены зараженного скота здоровым. При сложной эпизоотической ситуации в ряде случаев экономически выгодно ликвидировать туберкулёз, заменив всех животных неблагополучного хозяйства заведомо здоровыми. Эффективность данного метода оздоровления зависит от экономического состояния хозяйства, а также от его организации и выполнения.
В зимний период заключают с благополучными по туберкулёзу хозяйствами договора на закупку скота. Весной строят летние лагеря для содержания купленного здорового скота. После наступления устойчивой теплой погоды всех животных неблагополучного хозяйства отправляют на убой.
После освобождения неблагополучных ферм от скота сразу же проводят санацию помещений, где содержались больные животные. Комиссия из специалистов хозяйства и государственной ветеринарной службы осуществляет контроль санации помещения и после приема работ разрешает перевод животных на ферму из летних лагерей. Животных оздоровленной фермы два раза в год исследуют клиническими и аллергическими методами.
Меры борьбы с туберкулёзом в спецхозах и на комплексах. Меры борьбы с туберкулёзом животных различаются в спецхозах и на комплексах по производству молока, говядины и по выращиванию нетелей, что обусловлено технологическим процессом и экономической целесообразностью.
На молочных спецхозах и комплексах при выявлении туберкулёза в большинстве случаев для оздоровления используют метод полной замены. Этот метод позволяет ликвидировать туберкулёз быстро и с наименьшими экономическими потерями.
При появлении туберкулёза в спецхозах и на комплексах по выращиванию нетелей, их переводят в режим работы молочнотоварного или откормочного хозяйства. После этого применяют наиболее эффективные оздоровительные мероприятия в данной эпизоотической ситуации.
На комплексах по производству говядины методы борьбы с туберкулёзом зависят от поголовья. На небольших комплексах всех животных сразу сдают на убой, проводят санацию помещений и территории хозяйства, а затем завозят здоровых животных. На комплексах, где в год выращивают более 10 тыс. голов животных одновременная сдача всех животных является технически очень сложной задачей. В последнем случае осуществляют поэтапную сдачу животных и их замену здоровыми. При достижении животными определенной массы их исследуют клиническими и аллергическими методами на туберкулёз, после чего животных положительно реагирующих на туберкулин сдают на убой, а остальных переводят в санированные помещения следующей технологической группы. Освободившиеся помещения санируют и используют для содержания очередной технологической группы.
Полное поэтапное оздоровление комплексов и спецхозов завершается после сдачи всего неблагополучного поголовья и проведения заключительных мероприятий по оздоровлению хозяйства. При отсутствии заболевания животных во вновь поступившем стаде туберкулёз в хозяйстве считается ликвидированным.
Заключительные мероприятия перед снятием карантина. Начинают заключительные мероприятия по оздоровлению хозяйства ранней весной после перевода животных в летние лагеря.
Перед дезинфекцией помещения проводят его механическую очистку от навоза и остатков кормов. Для этого можно использовать гидросмыв и механические средства – скребки, лопаты, метла. Если полы кирпичные или бетонные на этом подготовку помещения к дезинфекции завершают. В помещения с деревянными полами доски снимают с пола, тщательно очищают, обрабатывают дезрастворами, высушивают и снова дезинфицируют. Снимают поверхностный слой грунта в помещении толщиной 12–15 см, вывозят из помещения и складируют в бурты. Земляной пол засыпают сухой хлорной известью, содержащей не менее 25% активного хлора, из расчета 1 кг/м2 пола. Затем завозят новую землю, перемешивают ее с известью и засыпают.
Для дезинфекции помещений используют 3% смесь едкого натра и формальдегида в равном количестве, 5% осветленный раствор хлорной извести, взвесь свежегашеной извести с содержанием хлора не менее 20% или эстостерил-1. Вышеперечисленными растворами проводят дезинфекцию однократно. Через час после окончания дезинфекции помещение проветривают, а кормушки, поилки и полы промывают водой.
Перед аэрозольной дезинфекцией в помещении закрывают все окна, двери и вентиляционные отверстия. Для эффективной дезинфекции температура в помещении должны не ниже 15°C, относительная влажность не менее 60%. Помещение обрабатывают при помощи аэрозольных установок 40% раствором формальдегида, который готовят из расчета 40 мл/м3. Время экспозиции составляет 48 ч.
Навоз обеззараживают биологическими, физическими и химическими способами.
Биологический метод обеззараживания включает использование биотермического метода, компостирования и длительного выдерживания. Его применяют для навоз влажностью не более 70%. Химическим способом обеззараживают жидкий и полужидкий навоз, для чего в него вводят раствор аммиака из расчета 30 кг/м3 и выдерживают в течение трех суток. Физический способ обеззараживания навоза применяют на свиноводческих комплексах, где его обеззараживают пароструйной установкой при температуре 110–120°C под давлением 2 атм в течение 10 мин.
Контроль качества проведенных заключительных мероприятий проводит комиссия из специалистов хозяйства и государственной ветеринарной службы. По результатам приема выполненных работ комиссия вносит предложения о возможности снятия карантина.
Меры борьбы с туберкулёзом в свиноводческих хозяйствах. В племенных хозяйствах и хозяйствах-репродукторах исследование свиней на туберкулёз проводят один раз в год симультанной туберкулиновой пробой. Ремонтный молодняк дополнительно исследуют туберкулиновой пробой перед отправкой в другое хозяйство. В благополучных товарных хозяйствах свиней на микобактериозы исследуют один раз в год туберкулиновой пробой, а в неблагополучных – два раза в год. Также проводят тщательный осмотр свиных туш. При выявлении туберкулёзоподобных изменений отбирают пробы для лабораторного исследования на туберкулёз.
В благополучных хозяйствах при выявлении до 10 голов, положительно реагирующих на туберкулин, их всех подвергают контрольному убою. В случае выявления положительной туберкулиновой реакции более чем у 10 голов, для диагностического убоя отбирают 3–5 животных. Туши тщательно осматривают на наличие туберкулёзных изменений, особенно в лимфоузлах головы, брыжейки и внутренних органов. От убитых животных отбирают кусочки лимфоузлов и внутренних органов для бактериологического исследования.
При получении отрицательных результатов лабораторных исследований на туберкулёз хозяйство считают здоровым. В случае обнаружения в патматериале микобактерий бычьего и человеческого вида на хозяйство накладывают карантин, который снимают после сдачи всего поголовья на убой и проведения заключительных мероприятий по оздоровлению хозяйства.
В случае выделения от свиней комплекса M.avium–M.intracellulareвыявляют и устраняют источник инфекции. Положительно реагирующих животных сдают на убой, а остальных оставляют в общем стаде.
Оздоровление неблагополучных по туберкулёзу крупного рогатого скота хозяйств
В случае, когда в неблагополучном хозяйстве постоянно выделяется менее 25% реагирующих (больных) на туберкулин животных от общего поголовья и не удаётся оздоровить с помощью удаления их из стада в течении 2-х лет, поступают следующим образом: после проведения очередного аллергического исследования с помощью внутрикожной туберкулиновой пробы и удаления реагирующих животных из стада, проводят внутривенную пробу с помощью ППД туберкулина на нереагирующем по внутрикожной пробе поголовье. Реагирующих по внутривенной пробе также удаляют из стада и подвергают убою.
Улучшают санитарное состояние ферм после очередного аллергического исследования скота и удаления реагирующих на туберкулин животных, проводя механическую очистку, санитарный ремонт, дезинфекцию и дератизацию помещений, выгульных дворов и прилегающей к ним территории, проводят все ветеринарно-санитарные мероприятия и выполняют все ограничения, касающиеся неблагополучных по туберкулёзу хозяйств.
Аллергические исследования с помощью внутрикожой туберкулиновой пробы проводят через каждые 30 дней. Животных, реагирующих двукратно по внутрикожной пробе, подвергают диагностическому убою с обязательным проведением бактериологических исследований и постановкой биопробы.
Если животные реагируют двукратно, но не подряд, а через 3-4 месяца, таких животных не подвергают убою, а проводят аллергические исследования с помощью внутривенной туберкулиновой пробы и реагирующих удаляют из стада.
При получении по всему стаду двукратного подряд отрицательного результата аллергических исследований, животных оставляют под наблюдением в течение 6 месяцев, а за этот период проводят 2 контрольных исследования туберкулиновой пробой с промежутком в 3 месяца. При отрицательных результатах этих исследований хозяйство считают оздоровленным т.е. благополучным по туберкулёзу.
С помощью эпизоотологического эксперимента удается изучить отдельные стороны, детали эпизоотического процесса (пути и продолжительность выделения возбудителя во внешнюю среду, механизм заражения животных, влияние различных условий на их устойчивость и др.), а также проверить эффективность профилактических и лечебных средств [1].
Необходимо отметить, что одной из важнейших мер контроля эпизоотической ситуации по туберкулезу крупного рогатого скота является дезинфекция. В недавно вышедшей работе А. И. Завгороднего и соавт. (2012) [7], указывается, что в настоящее время назрела необходимость в разработке комплексных дезинфицирующиих препаратов с широким спектром антибактериального действия, нетоксичных, не имеющих коррозионных свойств, которые могут применяться как в виде растворов, так и аэрозолей. Кроме того, они должны изготавливаться из доступного недорогого сырья, желательно отечественного, иметь необходимые санитарно-гигиенические и потребительские свойства. Важной проблемой в дезинфектологии также является способность мироорганизмов, в том числе и микобактерий, быстро адаптироваться к антибактериальным средствам.
Анализ литературных данных [7; 13; 16] свидетельствует, что рынок ветеринарных препаратов изобилует различными дезинфектантами, в том числе и импортного производства, но не все они проявляют туберкулоцидные свойства, также требуется коррекция регламента их применения в условиях животноводческих хозяйств с разными системами содержания животных.
В научных лабораториях за последние годы разработаны новые дезинфектанты: ДЗПТ-2 и «ФАГ» [13] на основе альдегидных соединенй для влажной обработки, «Дезконтэн» и «Йодез» в виде бактерицидных пен и влажного способа дезинфекции объектов животноводства и других объектов ветеринарного надзора при туберкулезе [16] и целый ряд других средств.
Над разработкой еще одного направления профилактики туберкулеза животных исследователи в области ветеринарной медицины работают на протяжении столетия – это вакцинация. В основе этих поисков лежит вакцина БЦЖ, и определение ее эффективности в системе противотуберкулезных мер. Под эффективностью вакцины надо понимать способность препарата обуславливать специфический иммунитет у животных в обычных условиях их содержания. Одни и те же препараты (вакцины) в одних условиях вызывают существенное снижение заболеваемости, а в других вновь не предотвращают её подъема. Действенность массовых прививок зависит не только от иммунологической способности вакцинного препарата, но и от комплекса других условий [14; 17].
По данным Н. З. Хазипова, М. А. Сафина, Г. З. Идрисова [15] эффективность применения вакцины БЦЖ зависит от полноты проведения комплекса противотуберкулёзных мероприятий (тщательности отбора животных для вакцинации, своевременности и эффективности ветеринарно-санитарных мероприятий, сроков начала применения этой вакцины) и других факторов. В десяти хозяйствах, оздоровленных с применением вакцины БЦЖ, экономическая эффективность противотуберкулёзных мероприятий была выше, чем в среднем по Татарстану в три раза. Необходимо отметить, что проводимые в таком же объеме оздоровительные мероприятия до вакцинации молодняка не давали положительного эффекта и заболевание носило стационарный характер.
А. С. Донченко и Ю. И. Смолянинов [6] при сравнительном изучении двух методов оздоровления с помощью вакцины БЦЖ и без её применения, сделали вывод, что оздоровление в два раза эффективнее при использовании вакцинопрофилактики в общем комплексе мероприятий.
В наших исследованиях, проведенных в предыдущие годы, также была дана оценка противоэпизоотической эффективности разработанного инактивированного препарата ПКП-3, который включает белково-нуклеотидные фракции культурального фильтрата M.bovisи субъединичные субстанции клеток микобактерий штамма БЦЖ.
Оздоровление неблагополучных по туберкулезу хозяйств при применении препарата ПКП-3
Результаты оздоровления КСП «Заповит Ленина» Зачепиловского района Харьковской области
Опыт проводили на поголовье крупного рогатого скота КСП «Заповит Ленина» Зачепиловского района Харьковской области, неблагополучного по туберкулезной инфекции.
КСП «Заповит Ленина» был неблагополучным по туберкулезной инфекции с 1994 г. МТФ № 2 неблагополучна по туберкулёзу с 1994 г. В 1995 г. среди 1020 голов крупного рогатого скота у 70 коров и одной телки были выявлены реакции на туберкулин, при диагностическом убое которых у 8 – выявлены туберкулезные поражения. На следующий год количество больных животных (реагирующих на туберкулин) увеличилось до 166 голов (в том числе 89 коров). При их убое выявлено уже 11 туш с патоморфологическими изменениями, свойственными туберкулезной инфекции в лимфатических узлах дыхательной системы. В 1997 г. общее количество поголовья крупного рогатого скота выросло до 1100 голов и было выявлено 30 голов (в том числе 22 коровы) реагирующих на туберкулин (больных) животных. Паталогоанатомическими исследованиями выявлены туберкулезные поражения только у одной коровы в феврале месяце.
В 1998 г. до применения вакцинного препарата ПКП-3 выявлено больных за 4 месяца – 36 голов (в том числе 18 коров).
По МТФ № 1 неблагополучие установлено в 1998 г. Когда при исследовании на туберкулез 519 голов (95 коров) крупного рогатого скота у 27 (4 коровы) были выявлены туберкулезные поражения заглоточных, средостенных, бронхиальных лимфатических узлов. А уже через месяц среди 416 голов (95 коров) происследованного скота выявили 34 (8 коров) больных (реагирующих на туберкулин) туберкулезом. При патологоанатомическом вскрытии у трех телок и одной коровы были выявлены туберкулезные поражения
При диагностическом убое в марте 1998 г. 24 реагирующих на ППД-туберкулин животных, в тушах трех нетелей и одной коровы (18 %) обнаружены специфические туберкулезные поражения средостенных и бронхиальных лимфатических узлов.
Оздоровление хозяйства проводили по схеме, которая включает в себя:
1. Проведение внутрикожной аллергической диагностической пробы всего поголовья с 2-месячного возраста.
2. Выделение в отдельное помещение реагирующих животных.
3. Иммунизация молекулярно-субъединичным препаратом ПКП-3 всех нереагирующих и реагирующих животных двукратно с интервалом 14 суток.
4. Аллергические исследования реагирующего скота через 13–15 суток после иммунизации. Реагирующих животных убивают с диагностической целью.
5. Исследования внутрикожной аллергической пробой нереагирующих животных через 30 суток. Двукратно подряд реагирующих животных сдают на убой.
6. Иммунизация всего поголовья через 10–12 месяцев после первичной иммунизации.
7. Проведение аллергических исследований по вышеупомянутой схеме до получения двукратных отрицательных результатов аллергической пробы.
8. Постановка на 6-месячный контроль. Если при трехкратном исследовании на туберкулин в течение этого времени не появились реагирующие животные, то хозяйство считается оздоровленным, т. е. благополучным по туберкулёзу.
Животных старше 2-месячного возраста (1 группа – 1350голов) иммунизировали препаратом ПКП-3 (компонент № 1 – 5,0 см3вводили с правой стороны шеи, а компонент № 2 – 1,0 см3– с левой стороны шеи), подкожно, ниже средней линии шеи, двукратно с интервалом 14 суток. Животным 2 группы (62 головы), нереагирующим на туберкулин, вводили вакцину БЦЖ, производства Ставропольской биологической фабрики, в дозе 1,0 мг/см3подкожно двукратно. Животным 3 группы, реагирующим на туберкулин (15 голов), вводили ПКП-3 однократно в тех же дозах, что и животным первой группы.
Ежемесячно после иммунизации проводили аллергические исследования внутрикожной пробой с помощью ППД-туберкулина для млекопитающих с повторным исследованием всех реагирующих животных через 15 суток. После убоя повторно реагирующих через 15 суток животных, проводили патологоанатомические исследования и отбирали материал для гистологических и бактериологических исследований.
При проведении АДП после первичного введения туберкулина выявлено 235 голов реагирующего скота через 3 месяца после введения препарата, из которых через 15 суток повторно реагировали 16 голов, с утолщением кожной складки 6±2 мм.
Через 4, 5, 6, 7, 8, 9, 10, 11 месяцев после иммунизации выявлено 5, 21, 6, 13, 7, 5, 3, 3 голов крупного рогатого скота, повторно реагирующих через 15 суток после основного исследования. При диагностическом убое этих животных не выявляли туберкулёзных изменений. Результаты бактериологических исследований были отрицательными.
Это объясняется постоянным инфицированием иммунизированных животных возбудителем туберкулёза из окружающей среды и временной сенсибилизацией его в организме, что проявляется состоянием ГЧЗТ на аллерген.
В результате проведенных контрольных диагностических убоев и патологоанатомических исследований туберкулезные изменения выявлены только у 10 животных контрольной (третьей) группы и больных (четвертой группы) животных в виде кровоизлияний, саловидности на разрезах лимфатических узлов с выделением из этих образцов возбудителя туберкулеза бычьего вида и атипичных микобактерий M. kansasi. При проведении гистологических исследований академиком Г. А. Красниковым выявлены участки лимфоидной ткани и гигантские клетки, указывающие на развитие туберкулезного процесса.
У животных 1 опытной группы туберкулезных изменений во внутренних органах не наблюдали, а при проведении бактериологических исследований не выделено патогенных и атипичных микобактерий.
При проведении гистологических исследований наблюдали признаки активации иммунных клеток.
Анализируя данные, полученные при патологоанатомических исследованиях 68 туш и органов от животных первой группы установлено:
— у одной особи поражения селезенки в виде округлых инкапсулированных участков с зеленым некротическим содержимым на разрезе;
— у 15 голов обнаружены поражения легочной ткани эхинококковыми пузырями;
— у 4 голов – кровоизлияния в средостенных лимфатических узлах;
— у 2 голов – кровоизлияния в предлопаточных лимфатических узлах;
— у одного животного – в селезенке гнойно-некротический пузырь с жидкими гнилостными массами величиной с кулак;
— у одного животного – гнойно-некротическое поражение верхней доли легкого и средостенного лимфатического узла;
— у одного животного обнаружен плод на последнем месяце беременности.
У остальных животных патологических изменений не обнаружено.
Через 24 месяца после применения препарата ПКП-3 в общей системе оздоровительных мероприятий хозяйство было оздоровлено и сняты ограничения.
Проведенные исследования и успешное применение в системе оздовительных мероприятий препарата ПКП-3 дают возможность сделать вывод, что иммунизация крупного рогатого скота исследуемым препаратом с проведение диагностических мероприятий по предложенной схеме препятствует развитию и размножению возбудителя туберкулеза и развитию патологоанатомических и гистологических изменений, свойственных туберкулезному процессу, что дает основание предлагать его для применения с профилактической целью в неблагополучных по туберкулезной инфекции хозяйствах при проведении всего комплекса оздоровительных мероприятий.
Этими исследованиями подтверждены протективные (защитные) свойства препарата ПКП-3 при спонтанном заражении эпизоотическим штаммом возбудителя туберкулеза крупного рогатого скота.
Результаты оздоровления ЗАО «Лычкове» Магдалиновского района Днепропетровской области
ЗАО «Лычкове» было неблагополучным по туберкулёзной инфекции с марта 1998 г. За 1998 г., при наличии в хозяйстве 2186 голов крупного рогатого скота (900 коров), было выделено 112 реагирующих животных, из них 25 – коровы. При диагностическом забое выявлено 4 головы с патологоанатомическими изменениями, свойственными для туберкулёзной инфекции, что составило 3,5% от числа реагирующих животных. На следующий год (1999) при наличии 1587 голов крупного рогатого скота (725 коров) было выделено уже 315 реагирующих животных (19,8 %), из них 152 коровы. Патологоанатомическими исследованиями выявлено было уже 12 голов с туберкулёзными поражениями лимфатических узлов.
В 2000 г. при проведении нами аллергических исследований 740 голов (338 коров) выделено 29 голов. Диагностическому убою подвергали всех реагирующих животных и у 8 голов (3 телки) были выявлены патологоанатомические изменения туберкулёзного характера.
Полученные данные свидетельствовали о стационарности неблагополучия данного хозяйства по туберкулёзной инфекции и быстром распространении данного заболевания на всё восприимчивое поголовье.
Оздоровление хозяйства проводили по схеме приведенной ранее с применением молекулярно-субъединичного препарата ПКП‑3.
Всё поголовье старше 2-месячного возраста в количестве 740 голов иммунизировали ПКП‑3. Через 2 месяца после вакцинации на ППД-туберкулин реагировало 67 голов крупного рогатого скота. При повторном исследовании реагировавших животных через 15 суток реагировало 5 животных, при убое которых во внутренних органах не выявлено патологоанатомических изменений, присущих туберкулёзной инфекции, а также не выделен возбудитель туберкулёза бактериологическими методами.
Через 6 месяцев выявлено было 39 голов, реагировавших на туберкулин, а при их повторном исследовании через 15 суток реагировало 3 животных, при убое которых во внутренних органах не выявлено патологоанатомических изменений, присущих туберкулёзной инфекции, а также не выделен возбудитель туберкулёза бактериологическими методами.
Через 8 месяцев после иммунизации животных и в связи с реорганизацией хозяйства (уменьшением поголовья крупного рогатого скота) были убиты все ранее однократно реагировавшие животные. В результате убоя 98 голов выявлены саловидность на разрезе и кровоизлияния средостенных и бронхиальных лимфатических узлах у 2 животных, а также выделен возбудитель туберкулёза M. bovis с помощью бактериологических исследований, что составляет 2 % от всех ранее реагировавших животных.
Остальное иммунизированное поголовье содержалось в хозяйстве на протяжении 1,5 лет и через 14 месяцев появились 42 реагировавшие головы крупного рогатого скота, при повторном исследовании которых через 15 суток положительной реакции на туберкулин не было обнаружено Это объясняется присутствием во внешней среде возбудителя туберкулёзной инфекции M. bovis и его постоянным воздействием на иммунизированных животных. В результате чего у вакцинированных животных проявляется ГЧЗТ непродолжительное время, которая исчезает при последующем аллергическом исследовании через 15 суток, вследствие элиминации возбудителя из иммунизированного организма.
Эти данные позволяют сделать вывод о том, что предложенная схема оздоровления неблагополучных хозяйств с применением ПКП‑3 в общем комплексе противотуберкулёзных мероприятий позволяет надёжно защитить от M. bovis-инфекции всех восприимчивых животных и оздоровить хозяйства в течение 2 лет.
Некоторые данные оздоровления КСП «Славутич» и «Шевченко» Верхнеднепровского района Днепропетровской области
КСП «Славутич» и «Шевченко» Верхнеднепровского района Днепропетровской области были неблагополучны по туберкулезу крупного рогатого скота с 1998 года, в которых насчитывалось по 1400 и 1600 голов крупного рогатого скота соответственно. При диагностических убоях в январе и феврале 1998 года трех и 18 реагирующих животных соответственно выявлено по две головы с патологоанатомическими изменениями туберкулезного характера в обоих хозяйствах.
Оздоровительные мероприятия с использованием вакцинопрофилактики проводили согласно схемы наведенной ранее. Через 3, 6, 8, 9, 10, 11, 12 месяцев после иммунизации проводили аллергические исследования и отбирали по 3-5 голов – реагирующих на туберкулин и убивали их с диагностической целью.
В результате проведенных оздоровительных мероприятий установлено, что в течение 12 месяцев после иммунизации крупного рогатого скота, при проведении диагностических убоев не выявлено патологоанатомических изменений в тушах животных подвергнутых исследованию и не выделено возбудителя туберкулеза с помощью бактериологических исследований.
Аллергическими исследованиями установлено, что в указанные сроки исследований выявляли в КСП «Славутич» 23,5, 16, 9, 8,2, 7,7, 0,6, 0,02 % , а в КСП «Шевченко» 21,3, 12, 6, 6,2, 13,7, 0,2, 0,04 % реагирующих животных от числа общего поголовья крупного рогатого скота.
Через 14 мес. после иммунизации поголовья животных аллергических реакций на ППД туберкулин не выявляли.
Данные результатов аллергических исследований свидетельствуют о присутствии в стадах животных источников возбудителя инфекции которые воздействовали в свою очередь на восприимчивых, иммунизированных животных, что проявлялось ГЧЗТ, а постепенное выпадение аллергических реакций свидетельствует об элиминации из организма животных и высокой напряженности противотуберкулезного иммунитета, приобретенного ими в результате вакцинации ПКП-3.
При гистологическом исследовании образцов лимфоузлов, печени, селезенки полученных от убоя животных, выявлены признаки активации иммунных клеток.
После применения вакцинопрофилактики, через два года были сняты ограничения и хозяйства признаны оздоровленными.
Таким образом, применение вакцинопрофилактики в общем комплексе противотуберкулёзных мероприятий дает возможность обеспечить иммунологическую защиту восприимчивых животных (молодняка крупного рогатого скота) и на определенный период обеспечить разрыв эпизоотической цепи.
Необходимо отметить, что в 2012 году в Великобритании проходила процедуру лицензирования вакцина, предназначенная для использования в животноводстве. В то же время вакцинация против туберкулеза КРС запрещена Директивой 78/52/EEC ввиду отсутствия «DIVA»-критерия дифференциации поствакцинальных и постинфекционных реакций на туберкулин [23].
Донченко, Н.А. (2008) [5].указывает на еще один важный аспект противотуберкулезных мероприятий – экономический эффект от их проведения. По его данным, коэффициент экономического ущерба на одно заболевшее животное в сопоставимых ценах (2005 г.) на продукцию животноводства составляет 14,5 тыс. руб., затраты на противотуберкулезные мероприятия — 4725 руб. на одно заболевшее или 1241 руб. на одно животное неблагополучного стада. Оздоровительные мероприятия в РФ до 1991 г. были экономически малоэффективны (1,3 руб. на 1 руб. затрат). В дальнейшем, в связи с внедрением научно разработанной системы, их экономическая эффективность повысилась до 17-69 руб. В результате внедрения комплекса противотуберкулезных мероприятий предотвращенный экономический ущерб составил 21,5 млрд руб., экономический эффект - 17,7 млрд руб/год.
В последние годы за рубежом стратегия контроля туберкулеза крупного рогатого скота обогатилась мерами мониторинга, профилактики заболевания в популяциях диких животных, а также оптимального снижения их численности с учетом равновесия экосистемы.
В ранней работе D. G. Newell и R. G. Hewinson [20; 21], посвящённой мониторингу эпизоотического состояния по туберкулёзной инфекции с помощью вакцинации отмечено, что необходимо контролировать благополучие регионов, где существуют природные резервуары возбудителя инфекции среди диких животных с помощью вакцинации БЦЖ. Авторы отмечают, что туберкулёз крупного рогатого скота остается важной проблемой в Великобританнии, где существуют стационарные резервуары возбудителя инфекции (барсуки и олени). Профилактические прививки вакциной БЦЖ молодняка рогатого скота не применяются из-за невозможности дифференцировать поствакцинальные от постинфекционных реакций клеточного типа. В то же время вакцинация барсуков нашла применение и стала стратегией контроля туберкулёзной инфекции.
Анализ научной литературы свидетельствует, что и через 20 лет эти вопросы не утратили своей актуальности. Так, в Испании, несмотря на принимаемые обязательные меры оздоровления, бычий туберкулез все еще был распространён в 2011 году [21], aроль резервуаров его возбудителя в дикой природе приобретала все большее признание. При высокой плотности обитания и в конкретных обстоятельствах средиземноморского климата, дикие копытные животные, в основном евразийский дикий кабан и благородный олень, способны поддерживать циркуляциюM.bovisдаже при отсутствии домашнего скота. Инфекция широко распространена среди диких копытных на юге страны – до 52% инфицированных животных у диких свиней и до 27% среди оленей. С целью разработки эффективной стратегии контроля эпизоотической ситуации по туберкулезу КРС испанскими учеными проведен сравнительный анализ профилей экспрессии генов хозяева в живой природе в ответ на инфекцию и вакцинацию. На основании полученных данных были разработаны и применены приманки для перорального применения препаратов вакцины БЦЖ для диких поросят кабана. Об эффективности вакцинации свидетельствует тот факт, что даже при экспериментальном оральном заражении высокими дозами эпизоотического штамма M. bovis возбудитель не удалось выделить из фекалий и внутренних органов опытных поросят [21].
По данным J.M.Schöningи соавт (2013) [22] в дикой природе на территории Швейцарии и Лихенштейна надзор за туберкулезом, вызванным M. bovis целенаправленно осуществляется в рамках Национальных скриниговых программ. В период 2006–2011 гг. с использованием патоморфологического, гистоморфологического, культурального методов и ПЦР было происследовано 520 животных, являющихся потенциальными хозяевами M. bovis и M. caprae (барсук, лисица, косуля, благородный олень, кабан). При этом инфицированных животных выявлено не было. Авторы также указывают на перспективность использования серологических тестов для популяционного скрининга туберкулеза крупного рогатого скота в дикой фауне.
Интересным представляется тот факт, что вопросы контроля численности барсуков в контексте мер предупреждения туберкулеза крупного рогатого скота поднимаются в Европейском парламенте. Политика истребления этих животных на территории Великобритании была подвергнута критике, о чем говориться в записке в комиссию Европарламента членов европейского свободного альянса зеленых (Verts/ALE). Они отмечают, что сцелью предотвращения напрасного убийства многих десятков тысяч барсуков, крайне важно, если правительство Великобритании будет изменять свою политику в этой области и всячески поощрять поиск альтернативных решений проблемы туберкулеза крупного рогатого скота. При этом ожидается поддержка Европарламента, направленная на повышение эффективности и достоверности контроля заболевания, снижения уровня распространения туберкулеза КРС путем повышения стандартов бибезопасности, а также изменения законов с целью ускорения выдачи лицензии на применение вакцины против туберкулеза крупному рогатому скоту. [23].
Также с целью недопущения неконтролированного убоя барсуков, предлагается ввести государственное лицензирование этой деятельности [18; 19].
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
Бакулов И.А. и соавт. Метод эпизоотологического исследования // Труды Всесоюзной конф. по эпизоотологии.-т.74.-М., 1974.-С.41-49.
Вишневский П.П. Туберкулез крупного рогатого скота //М.: «СЕЛЬХОЗГИЗ», 1937.– 245 с.
Гутира Ф. Частная патология и терапия домашних животных./ Ф.Гутира, И Марек.//М., 1931.– С.609-755.
Добрелин, Вадим Иванович Эпизоотологический мониторинг туберкулеза крупного рогатого скота в Ростовской области и совершенствование мероприятий по профилактике туберкулеза тема диссертации и автореферата по ВАК 16.00.03, кандидат ветеринарных наук Новочеркасск, -2009 –16 с.
Донченко, Н.А. Усовершенствование средств и методов диагностики и профилактики туберкулеза крупного рогатого скота./Донченко Н.А. //Автореферат доктора ветеринарных наук,- 2008 – № 36. – с.31.
Донченко А.С., Смолянинов Ю.И. Сравнительная экономическая оценка оздоровительных мероприятий при туберкулёзе крупного рогатого скота// Зооантропонозные болезни, меры профилактики и борьбы.-Гродно.-1997.-С.78-80.
Завгородній А.І. Порівняльне вивчення бактерицидних властивостей вітчизняних та закордонних дезінфектантів щодо мікобактерій/ Завгородній А.І. [таін.]// Ветеринарна медицина України. –2012.– № 4. –C.29-31.
Инструкция о мероприятиях по профилактике и ликвидации туберкулеза животных (утв. Главным управлением ветеринарии с Государственной ветеринарной инспекцией Госагропрома СССР 10 ноября 1988 г., согласована с Министерством здравоохранения СССР 10 ноября 1988 г.) //Москва, 1989, 25 с.
Санитарные и Ветеринарные правила «Профилактика и борьба с заразными болезнями, общими для человека и животных. 10.Туберкулез»(утв.Госкомэпиднадзором России 16 мая 1996 г. и Департаментом ветеринарии и Минсельхозпрода России 18 июня 1996 г.)
Кодекс здоровья наземных животных МЭБ -, 2010 г. 470 с.
Лопунов С. В. Эпизоотологический и экономический мониторинг туберкулеза и лейкоза крупного рогатого скота на территории Центрального федерального округа Российской Федерации : Диссертация ... канд. вет. наук –М., 2009.- 146 с.
Наукові та практичні аспекти дезінфекції у ветеринарній медицині/ А.І. Завгородній., Б.Т. Стегній, А.П. Палій,В.М. Горжеєв, А.М. Смірнов. //Х.:ФОП Бровін О.В., 2013.– 222 с.
Оздоровительные мероприятия при туберкулезе крупного рогатого скота Гулюкин М.И. [и др].–Ветеринария.– 2012.– № 1. – С. 3-8 .
Палій А.П. Порівняльне вивчення бактерицидних властивостей альдегідниж дезінфектантів // Ветеринарна біотехнологія. Бюлетень. –2012.– №20.– С. 112-116.
Таршис М.Г. и соавт. Контролируемые эпизоотологические опыты и оптимизация специфической профилактики// Ветеринария.- №12.-1978.-С.71-74.
Хазипов Н.З.,Сафин М.А.,Идрисов Г.З. Туберкулёз крупного рогатого скота //М., Агропромиздат,1985.-125с.
Чеснокова П.В, Дезинфекция объектов животноводства при туберкулезе препаратами йодез и дезконтэн // Автореф.дисс…канд. вет. наук . –М.–2009.- 23 с.
Эволюция оздоровительных мероприятий при туберкулезе крупного рогатого скота //Современные проблемы диагностики и профилактики хронических зооантропонозных инфекций / Всерос. науч.-исслед. ин-т бруцеллеза и туберкулеза животных Найманов А.Х. [и др.]. - Омск, 2009. - С. 126-133
Bovine TB and Badger Control: Consultation on Guidance to Natural England on the implementation and enforcement of a badger control policy July 2011 -15 р. /www.gov.uk/government/uploads/system/uploads/ attachment_ data/file/82297/bovinetb-guidance-ne-110719.pdf
Bovine tuberculosis - uk: (england), control /2013// http://sanidaderural.blogspot.com/2013/07/bovine-tuberculosis-uk-england-control.html
Newell D.G., Hewinson R.G. Control of bovine tuberculosis by vaccination // J.Vet.Record.-1995, N 136.-P.459-463.
Progress in the control of bovine tuberculosis in Spanish wildlife. Gortazar C [et all.] //Vet Microbiol. 2011.– Vol.151(1-2). P.170-8.
Surveillance of Bovine Tuberculosis and Risk Estimation of a Future Reservoir Formation in Wildlife in Switzerland and Liechtenstein J. M. Schöning [et all.].– Open Access Jornal – 2013.– http://www.plosone.org/article/info:doi/10.1371/journal.pone.0054253
The control of bovine tuberculosis in the United Kingdom 2012 http://www.europarl.europa.eu/sides/getDoc.do?type=WQ&reference=E-2012-010251&language=EN.
ЗАКЛЮЧЕНИЕ
На основании проведенного анализа отечественной и мировой литературы, а также результатов собственных исследований, представленной в данном монографическом издании можно сделать вывод о тенденциях развития ветеринарной фтизиатрии. Будущие исследования, скорее всего, будут направлены на углубленное изучение патогенеза, клеточного и гуморального иммунитета при туберкулезе крупного рогатого скота, разработку и усовершенствование средств диагностики, вакцинопрофилактики и повышения природной резистентности животных в условиях промышленного их использования. Возрастающее значение дикой природы в эпизоотологии туберкулеза крупного рогатого скота требует постоянных и целенаправленных исследований экологии возбудителя, его генетической и фенотипической изменчивости, а также патогенеза инфекции M.bovisу различных видов диких и синантропных животных и птиц.
Обязательные меры борьбы с туберкулёзом включают ряд организационно-хозяйственных и ветеринарно-санитарных мероприятий, которые обеспечивают ликвидацию туберкулёза в неблагополучных хозяйствах. К ним относятся: своевременная и точная диагностика заболевания туберкулёзом, дающая объективное представление об эпизоотической ситуации по этому заболеванию; своевременное выявление и удаление больных животных, что препятствует передачи возбудителя инфекции от больных животных здоровым; уничтожение возбудителя туберкулёза во внешней среде; обеззараживание молока и обрата как наиболее частого источника распространения туберкулёза; изолированное выращивание здорового молодняка.
Наиболее перспективны два направления разработки методов диагностики туберкулёза. Первое направление включает создание более специфичных и чувствительных диагностикумов и методов исследований, которые бы позволило точно отличать сенсибилизацию организма, вызванную патогенными и непатогенными микобактериями. Вторым направлением может стать отказ от массового применения иммунологических методов диагностики в благополучных по туберкулёзу хозяйствах и использования для контроля их благополучия по туберкулёзу результатов ветеринарно-санитарной экспертизы на бойнях.
Для надежного обеззараживания возбудителей туберкулёза в животноводческих объектах необходимо создание более активных дезинфектантов, которые бы позволяли проводить дезинфекцию в присутствии животных. Решение этой проблемы позволит дезинфицировать помещения не только после перевода животных в летние лагеря, но и в зимнестойловый период во время содержания животных в помещении. Также можно будет дезинфицировать и птичники при возникновении необходимости, а не только после их освобождения.
Также важным мероприятием является создание эффективных способов обеззараживания микобактерий в молоке и обрате. Решение этой проблемы также возможно в двух направлениях: разработка экономичных пастеризаторов, надежно обеззараживающих молоко при щадящих режимах, которые сохраняют его технологические качества, и строительство на молочных заводах цехов по изготовлению сухого обезжиренного молока. Любое из этих направлений позволит прекратить распространение туберкулёза, сократить расходы на перевозку молока и повторное обеззараживание. Первое направление более предпочтительно, так как позволяет сохранить большинство свойств молока.
Важным мероприятием в оздоровлении хозяйств является выращивание здорового ремонтного молодняка. Для этого улучшают племенную работу в хозяйстве, в частности применяют систему изолированного выращивания молодняка. Также необходимо соблюдение зоогигиенических условий содержания стельных коров, их отела, норм и режима выпойки молозива и молока новорожденным телятам.
Очень важна также разработка способов специфической профилактики туберкулёза, в частности, применение вакцин и поиск более эффективных схем иммунизации животных. Трудности с их разработкой связаны, прежде всего, с недостаточной изученностью природы и механизма иммунитета при туберкулёзе. Исследований на данную тему проведено много, но пока желаемых результатов они не дали. Для решения этих вопросов необходимо более глубокое исследования клеточного и гуморального иммунитета, раскрытие функций различных классов антител, а также детальное изучение макрофагальной системы организма.
Дальнейшие исследования по перечисленным проблемам даст возможность совершенствовать существующие методы диагностики и профилактики туберкулёза, что, в конечном счете, обеспечит ликвидацию этого заболевания.
