
- •IV часть курса физики Молекулярная физика и термодинамика Введение
- •Лекция 1,2. Молекулярно - кинетическая теория газов
- •1.1. Основные понятия. Уравнение состояния
- •1.2. Вывод основного уравнения мокулярно-кинетической теории
- •1. 3. Молекулярно-кинетическое толкование температуры
- •1.4. Статистические распределения
- •1.5. Барометрическая формула. Классическое распределение Максвелла-Больцмана
- •1.6. Явления переноса
- •Лекция 3. 4. Основы термодинамики
- •3.1. Основные понятия
- •3.2. Работа в термодинамике
- •3.4. Количество теплоты. Первое начало термодинамики
- •Для бесконечно малых процессов
- •3.5. Теплоёмкость
- •3.6. Внутренняя энергия и теплоёмкость идеального газа
- •3.7. Адиабатный процесс
- •3.8 Обратимые и необратимые процессы. Второе начало термодинамики
- •1) (Формулировка Клазиуса) Невозможен процесс, единственным результатом которого является передача теплоты от холодного тела к горячему.
- •3.9. Циклы. Тепловая и холодильная машины
- •3.10. Цикл Карно
- •Энтропия
- •Статистический смысл энтропии и второго начала термодинамики
- •Лекция 5. Фазовые равновесия и фазовые превращения
- •Взаимодействие молекул реальных газов
- •Уравнение состояния Ван-дер-Ваальса
- •Изотермы реальных газов. Фазы. Фазовые переходы.
- •1. Участок ее` соответствует газообразному состоянию вещества. По мере сжатия газа давление растет до точки е.
- •Фазовые диаграммы р - т. Тройная точка
- •Поверхностное натяжение жидкости
- •Элементы физики твердого тела Лекция 6. Элементы квантовой статистики
- •6.1. Особенности квантовых статистик
- •6.2. Фазовое пространство. Ячейка фазового объема.
- •6.3. Принцип неразличимости тождественных частиц. Фермионы и бозоны
- •6.4. Функции распределения Ферми –Дирака и Бозе –Энштейна
- •6.5. Понятие о вырождении.
- •6.6. Вырожденный Ферми-газ в металлах
- •Лекция 7,8. Тепловые свойства кристаллов
- •7.1. Строение кристаллов. Дефекты
- •7.2. Классическая теплоемкость кристаллов по Дюлонгу и Пти
- •7.3. Квантовая теория теплоемкости Дебая
- •7.4. Теплоемкость электронного газа в металлах
- •9.3. Недостатки классической теории Друде-Лоренца
- •9.4. Понятие о квантовой теории электропроводности металлов
- •Элементы зонной теории кристаллов
- •9.6. Собственная проводимость проводников. Электроны проводимости и дырки
- •9.7. Примесная проводимость п/п. Электронный и дырочный п/п.
- •9.8. Р / n переход.
- •9.10. Понятие о сверхпроводимости
- •Лекция 11. Атомное ядро
- •11.1. Строение атомных ядер
- •Свойства ядер
- •11.3 Ядерные силы.
- •Законы радиоактивного распада
- •Ядерные реакции
- •Лекция12. Элементарные частицы и современная физическая картина мира
- •Элементарные частицы
- •Элементарные частицы
- •Свойства элементарных частиц
- •Классы элементарных частиц.
- •Физическая картина мира
- •Основные формулы
- •Вопросы для подготовки к зачету
Лекция 3. 4. Основы термодинамики
3.1. Основные понятия
Термодинамика не интересуется строением тел, а изучает превращение энергии, происходящее в системе (теплообмен, работа над телами и др.)
Термодинамика основывается на трёх опытных законах, началах:
начало - аналог закона сохранения энергии;
2 начало - указывает направление процессов;
3 начало - о том, при температуре абсолютной нуля система переходит в состояние с минимальной потенциальной энергией, а тепловое движение замирает
Изолированная система - система, не взаимодействующая с окружающей средой.
Замкнутая система - механически изолирована, но возможен теплообмен с окружающей средой.
Адиабатически изолированная система – это система, в которой нет теплообмена с окружающей средой, но возможно механическое взаимодействие.
Равновесное состояние - состояние, в которое приходит изолированная система со временем (после этого состояние системы не изменяется во времени).
Для равновесного состояния вводят термодинамические параметры состояния: давления Р, температура Т, объём V.
Опыт показывает, что параметры состояния взаимосвязаны некоторым уравнением, которое называют уравнением состояния:
![]() (3.1)
(3.1)
3.2. Работа в термодинамике
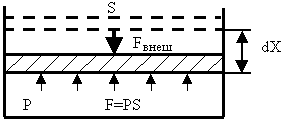
Рассмотрим газ в цилиндре с поршнем, площадь которого равна S. (рис.3.1). Пусть газ сдвигает поршень на расстояние dX.
 При
квазистатическом (квазиравновесном)
расширении газа он совершит работу:
При
квазистатическом (квазиравновесном)
расширении газа он совершит работу:
![]()
Итак, мы получили выражение для элементарной работы газа:
Рис.3.1. При элементарном расширении газ совершает работу А=PdV
![]() (3.2)
(3.2)
П ри
медленном квазистатическом расширении
внешние силы равны силе давления газа,
но противоположно направлены. Поэтому
работа внешних сил:δАвнеш=
- δА
(3.3)
ри
медленном квазистатическом расширении
внешние силы равны силе давления газа,
но противоположно направлены. Поэтому
работа внешних сил:δАвнеш=
- δА
(3.3)
Работа при конечном приращении объёма складывается (интегрируется) из элементарных работ:
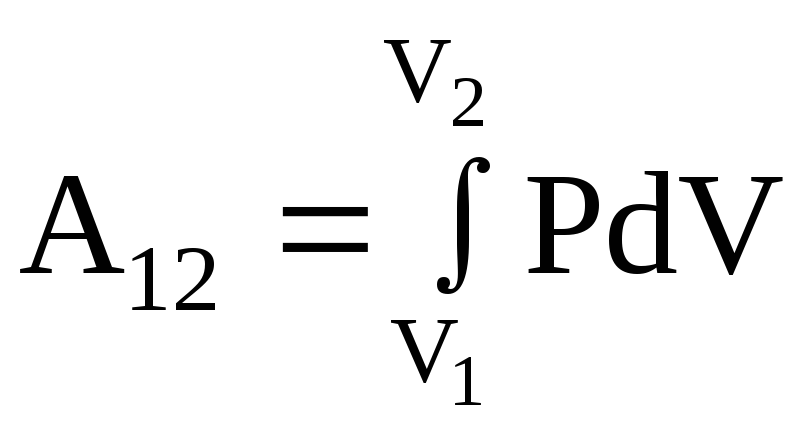 (А12
> 0, А21
< 0) (3.4)
(А12
> 0, А21
< 0) (3.4)
Е
Рис.3.2.
Элементарная
работа δА=РdV
на графике соответствует площади
заштрихованного столбца. Вся работа
газа А12
равна площади под кривой 1-2.
Работа равна площади под кривой перехода в координатах Р,V (см. рис.3.2).
Р А21<0
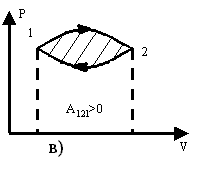
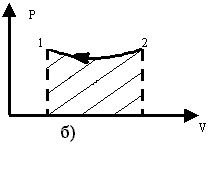
Р ис.3.3а) работа газа
А12>0;
б) работа газа А21<0;
в) работа в замкнутом цикле А121>0
и равна площади внутри замкнутой кривой;
г) в обратном цикле А121<0.
ис.3.3а) работа газа
А12>0;
б) работа газа А21<0;
в) работа в замкнутом цикле А121>0
и равна площади внутри замкнутой кривой;
г) в обратном цикле А121<0.
Н айдем
работу газа в различных изопроцессах:
айдем
работу газа в различных изопроцессах:
а) изохорный процесс V=const. Площадь под изохорой равна нулю, следовательно А12=0
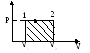

б) изобарное расширение газа: P=const. Работа А12 равна площади заштрихованного прямоугольника А12=Р(V2-V1)
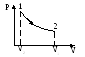
в) изотермическое расширение газа: T=const.
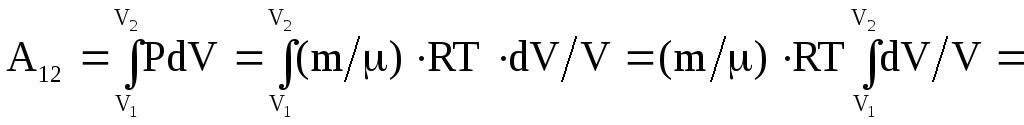
= (m/) RT ln (V2/V1),
где V2 и V1 - объем газа в начальном и конечном состояниях, соответственно.
3.3. Внутренняя энергия
Опыты Джоуля по определению механического эквивалента теплоты позволили ему сформулировать следующий закон:
В адиабатически изолированной системе работа внешних сил не зависит от пути перехода, а зависит только от начального и конечного состояния системы. (Это 1-ое начало термодинамики для адиабатической системы).
Внутренней энергией системы называется функция состояния, приращение которой в адиабатическом процессе равно работе внешних сил над системой
![]()
Внутренняя энергия определена с точностью до постоянного слагаемого, но практически это не важно, т. к. используется либо U, либо dU/dX (производные).
Внутренняя энергия включает энергию всевозможных видов движения и взаимодействия всех частиц термодинамической системы (кинетическая энергия атомов и молекул, потенциальная энергия всех частиц, включая ядра и т. д.).
(Внутренняя энергия не включает кинетическую энергию и потенциальную энергию термодинамической системы как целого).
