
Лекция 2_ФХ
.doc
Лекция 2
-
Термохимия. Закон Гесса и следствия из него. Расчет тепловых эффектов в стандартных условиях
-
Влияние температуры на тепловой эффект химической реакции. Теплоемкость. Уравнение Кирхгофа.
ТЕРМОХИМИЯ
Термохимия – раздел химической термодинамики, изучающий взаимосвязь химических и физико-химических процессов с сопровождающими их тепловыми эффектами.
Тепловой эффект – это количество теплоты, которое система выделяет или поглощает в необратимо протекающем процессе.
В любом акте химического превращения принимает участие некоторая совокупность атомов, характеризующая исходные вещества, а после их перераспределения – и продукты реакции. Перегруппировка атомов вызвана изменением химических связей в молекулах реагирующих веществ. Поскольку внутренняя энергия исходных молекул отличается от внутренней энергии продуктов реакции, то происходит изменение внутренней энергии системы, которое сопровождается тепловым эффектом и совершением работы.
Процессы, при протекании которых теплота выделяется, являются экзотермическими. Процессы, протекающие с поглощением теплоты, – эндотермические.
Закон Гесса и следствия из него. Расчет тепловых эффектов
химических реакций в стандартных условиях
Многие химические реакции протекают при постоянном объеме или постоянном давлении. Из первого закона термодинамики следует, что при этих условиях теплота является функцией состояния:
QV = U,
Qp = H.
Эти равенства в применении к химическим реакциям составляют суть закона Гесса, открытого в 1836 г. русским химиком Г.И. Гессом:
Тепловой эффект химической реакции не зависит от пути проведения реакции, а определяется только н6ачальным и конечным состоянием системы при следующих условиях:
1) процесс осуществляется при V = const или p = const;
2) температура исходного и конечного состояний системы одинакова (однако это не означает, что она должна быть постоянной в течение всего процесса);
3) единственным видом работы является работа расширения (сжатия).
Если не выполняется хотя бы одно из условий, закон Гесса не работает.
Д ействие
закона Гесса удобно представить в виде
схемы. Рассмотрим некоторый обобщенный
химический процесс превращения исходных
веществ в продукты реакции, который
может быть осуществлен различными
путями в одну или несколько стадий (рис.
1).
ействие
закона Гесса удобно представить в виде
схемы. Рассмотрим некоторый обобщенный
химический процесс превращения исходных
веществ в продукты реакции, который
может быть осуществлен различными
путями в одну или несколько стадий (рис.
1).
Согласно закону Гесса, тепловые эффекты всех этих реакций связаны между собой соотношением:
Н1 = Н2 + Н3 + Н4 = Н5 + Н6.
Тепловой эффект изобарного процесса часто называют просто энтальпией.
Уравнение реакции с указанием агрегатного состояния реагентов и теплового эффекта реакции называют термохимическим уравнением. Например, термохимическое уравнение реакции образования бензола в жидком состоянии из простых веществ запишется:
6С (т) + 3Н2 (г) = С6Н6 (ж), Н = 49,03 кДж/моль,
где символы (т), (ж), (г) указывают на агрегатное состояние реагента. Эти символы обычно опускаются, когда агрегатное состояние вещества является очевидным в данных условиях. Верхний индекс «» у теплового эффекта указывает на то, что все реагенты взяты в стандартном состоянии.
Стандартное
состояние
– это состояние чистого вещества при
давлении
1 атм (101325 Па) и заданной
температуре (Т
=const).
При этом вещества должны быть взяты в
том агрегатном состоянии, в котором они
являются термодинамически устойчивыми.
В
справочной литературе приводятся
величины, характеризующие вещество в
стандартном состоянии, определяемом
более узко, а именно
р
= 1 атм и Т
= 298 К.
Стандартную энтальпию реакции, протекающей
при температуре Т,
обозначают
![]() (индекс r
означает «reaction»
– реакция).
(индекс r
означает «reaction»
– реакция).
Практическое значение закона Гесса состоит в том, что он позволяет рассчитывать энтальпии тех химических процессов, для которых непосредственное определение ΔrН связано с большими экспериментальными затруднениями.
Пусть при p = const протекают реакции:
-
С + О2 → СО2 + ΔrН1
-
СО + ½О2 → СО2 + ΔrН2
-
С + ½О2 → СО + ΔrН3
Энтальпии реакций (1) и (2) ΔrН1 и ΔrН2 могут быть определены с высокой точностью экспериментальным путем, в то время как энтальпию реакции (3) ΔrН3 непосредственно измерить невозможно, так как при горении углерода наряду с СО всегда образуется СО2. На основании исходных данных удобно составить схему возможных путей образования СО2 (рис. 2).

Рис. 2. Схема расчета по закону Гесса
В соответствии с законом Гесса энтальпия процесса, протекающего первым (прямым) путем, равна энтальпии процесса, протекающего вторым путем через промежуточное состояние:
ΔrН1 = ΔrН2 + ΔrН3.
Неизвестная энтальпия ΔrН3 равна
ΔrН3 = ΔrН1 – ΔrН2.
Таким образом, определив опытным путем тепловые эффекты некоторых процессов, можно, используя закон Гесса, вычислить тепловые эффекты других процессов, связанных с первыми системой термохимических уравнений.
Из закона Гесса вытекают важные следствия, которые позволяют рассчитывать тепловые эффекты (энтальпии) химических реакций.
1 следствие: тепловой эффект химической реакции, протекающей при температуре Т, равен разности сумм теплот образования продуктов реакции и исходных веществ с учетом стехиометрических коэффициентов:
![]() ,
(1)
,
(1)
где
![]() – стандартная энтальпия (теплота)
образования вещества (индекс f
означает «formation»
– образование);
– стандартная энтальпия (теплота)
образования вещества (индекс f
означает «formation»
– образование);
![]() – стехиометрические коэффициенты
продуктов реакции и исходных веществ.
– стехиометрические коэффициенты
продуктов реакции и исходных веществ.
Стандартной энтальпией (теплотой) образования вещества при заданной температуре называют тепловой эффект реакции образования 1 моль данного вещества из соответствующих количеств простых веществ, находящихся в наиболее устойчивом стандартном состоянии. Согласно решению Международного союза чистой и прикладной химии (IUPAC) стандартные теплоты образования простых веществ принимаются равными 0 при любой температуре.
Стандартную
энтальпию образования при Т
= 298 К рекомендуется обозначать
![]() ,
где i
–
соединение; j
– агрегатное состояние.
,
где i
–
соединение; j
– агрегатное состояние.
Например,
стандартную теплоту образования воды
при Т
= 298 К обозначают
![]() .
Термохимическое уравнение реакции
образования воды при Т
= 298 К запишется
.
Термохимическое уравнение реакции
образования воды при Т
= 298 К запишется
Н2
+ ½О2
= Н2О
(ж) +
![]() .
.
Стандартные энтальпии веществ при Т = 298 К приведены в справочниках.
В качестве примера рассмотрим расчет теплового эффекта химической реакции
СО2 + 4Н2 = СН4 + 2Н2О,
протекающей в газовой фазе при Т = 298 К и р = 1 атм.
Теплота образования водорода по определению равна 0. Следовательно, в соответствии с формулой (1), тепловой эффект данной реакции равен
![]() .
.
2 следствие: тепловой эффект химической реакции равен разности сумм теплот сгорания исходных веществ и продуктов реакции с учетом стехиометрических коэффициентов:
![]() , (2)
, (2)
где
![]() – стандартная энтальпия (теплота)
сгорания вещества (индекс «с»
означает «combustion»
– сгорание).
– стандартная энтальпия (теплота)
сгорания вещества (индекс «с»
означает «combustion»
– сгорание).
Стандартной энтальпией (теплотой) сгорания вещества называют энтальпию реакции полного окисления 1 моль вещества до высших оксидов. Теплоты сгорания высших оксидов принимаются равными 0.
Например, термохимическое уравнение реакции сгорания глюкозы запишется:
С6Н12О6
+ 6О2
= 6СО2
+ 6Н2О
+
![]() .
.
Это следствие обычно используют для расчета тепловых эффектов органических реакций.
Стандартная теплота сгорания относится к проведению процесса при p = 1 атм. В термодинамические таблицы сведены стандартные теплоты сгорания, рассчитанные для температуры 298 К.
Влияние температуры на тепловой эффект химической реакции.
Уравнение Кирхгофа
Зная стандартные теплоты образования (или сгорания) реагентов при Т = 298 К, с помощью закона Гесса можно легко рассчитать стандартную теплоту химической реакции при данной температуре. Часто реальные процессы протекают при температуре, отличной от 298 К. Поэтому необходимо установить, как влияет температура на тепловой эффект химической реакции. Для этого необходимо ввести понятие теплоемкости вещества (системы).
Понятие о теплоемкости веществ
Теплоемкость системы (или тела) – характеризует количество теплоты, которое необходимо сообщить системе, чтобы повысить ее температуру на 1 градус (при отсутствии химической реакции, переходов вещества из одного агрегатного состояния в другое).
Теплоемкость может относиться к 1 моль системы – молярная теплоемкость С (измеряется в Дж/(мольК) или к единице массы системы – удельная теплоемкость Суд (измеряется в Дж/(кгК) или Дж/(гК))
Молярная и удельная теплоемкости связаны соотношением:
![]() ,
,
где М – молярная масса.
Различают среднюю и истинную теплоемкости.
Средняя теплоемкость
![]() определяется отношением сообщенной
системе теплоты к наблюдаемому при этом
повышению температуры:
определяется отношением сообщенной
системе теплоты к наблюдаемому при этом
повышению температуры:
![]() .
.
Истинная теплоемкость С соответствует бесконечно малому изменению температуры:
![]() .
.
В зависимости от условий, при которых производится нагревание, различают теплоемкость при постоянном объеме СV (изохорную теплоемкость) и теплоемкость при постоянном давлении Cp (изобарную теплоемкость):
 (3)
(3)
Для 1 моль идеального газа Cp и СV связаны соотношением:
![]() .
.
Изобарная и изохорная теплоемкости идеального газа отличаются на величину универсальной газовой постоянной R.
Для одноатомного идеального газа
![]()
Для двухатомного идеального газа при средних температурах
![]()
Изобарная и изохорная теплоемкости твердых веществ практически равны.
Теплоемкость твердых, жидких и газообразных тел зависит от температуры. Наиболее часто зависимость теплоемкости индивидуальных веществ от температуры выражают эмпирическим уравнением вида:
![]() , (4)
, (4)
где a, b, c, c’ – эмпирические коэффициенты, вычисленные на основе экспериментальных данных.
Для органических веществ коэффициент c’ = 0, для неорганических – c = 0. Для многих веществ коэффициенты a, b, c, c’ приведены в справочниках.
Уравнение Кирхгофа
Уравнение Кирхгофа позволяет рассчитывать тепловые эффекты химических реакций при любой температуре.
Рассмотрим простейшую химическую реакцию – переход 1 моль вещества А в вещество В при температуре Т2 и постоянном давлении р:
![]() .
.
![]() –
тепловой эффект
реакции.
–
тепловой эффект
реакции.
Эту реакцию можно провести в одну стадию или через ряд последовательных стадий, например:
-
нагреть вещество А до температуры Т1 (тепловой эффект
 ,
где
,
где
 –
средняя изобарная теплоемкость вещества
А);
–
средняя изобарная теплоемкость вещества
А); -
провести реакцию при температуре Т1 (тепловой эффект
 );
); -
охладить продукт реакции – вещество В – до температуры Т2 (тепловой эффект
 ,
где
,
где
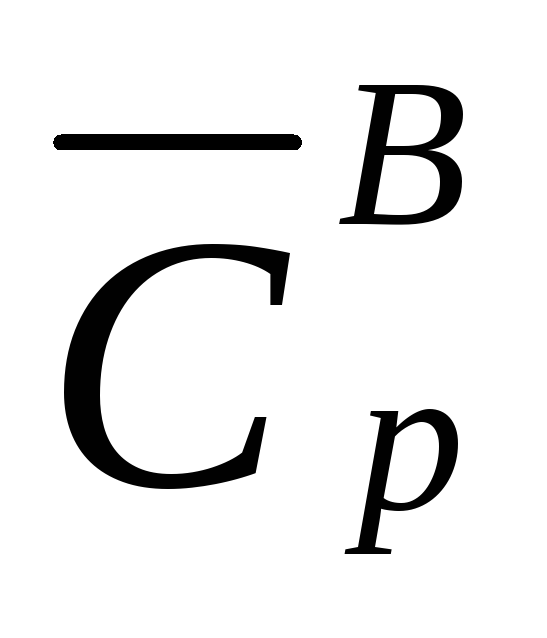 –
средняя изобарная теплоемкость вещества
В).
–
средняя изобарная теплоемкость вещества
В).

Согласно закону Гесса
![]() ,
,
![]() ,
,
где
![]() – разность изобарных теплоемкостей
продуктов реакции и исходных веществ.
– разность изобарных теплоемкостей
продуктов реакции и исходных веществ.
Для химической
реакции
![]() рассчитывают по формуле:
рассчитывают по формуле:
![]() ,
,
где
![]() – стехиометрические коэффициенты
продуктов реакции и исходных веществ.
Средние теплоемкости веществ приведены
в справочной литературе.
– стехиометрические коэффициенты
продуктов реакции и исходных веществ.
Средние теплоемкости веществ приведены
в справочной литературе.
Таким образом,
![]() .
.
За температуру Т1 удобно принять температуру 298 К, поскольку тепловой эффект реакции при 298 К можно легко рассчитать, используя первое или второе следствия из закона Гесса; Т2 – температура реакции Т.
Тогда
![]() . (5)
. (5)
Уравнение (5) – уравнение Кирхгофа – позволяет рассчитать тепловой эффект химической реакции, протекающей при температуре Т (при условии, что в температурном интервале (298 – Т) теплоемкость мало зависит от температуры).
Анализ уравнения Кирхгофа.
– если ΔСр > 0, то с повышением температуры тепловой эффект реакции будет возрастать;
– если ΔСр < 0, с повышением температуры тепловой эффект реакции уменьшается;
– если ΔСр = 0, то тепловой эффект реакции не зависит от температуры.
