
- •Дисциплина: Инженерная химия
- •2. Технологические критерии эффективности химико-технологических процесса (производительность, интенсивность, степень превращения для различных видов реакций, селективность, выход продукта).
- •3. Принципы составления материальных и тепловых балансов химических реакций.
- •4. Эмпирические методы расчета тепловых эффектов.
- •Рассмотрим, например простую обратимую химическую реакцию:
- •7. Исследование кинетики гомогенных химических реакций. Реакторы периодического действия с постоянным и переменным объемом реакционной массы, реакторы идеального вытеснения.
- •8. Особенности исследования кинетики гомогенных каталитических процессов.
- •9. Кинетика гетерогенно - каталитических процессов.
- •10. Основные стадии и кинетические особенности гетерогенно- каталитических процессов.
- •12. Кинетика гетерофазных химических. Процессов в системах газ-жидкость, жидкость-жидкость (несмешивающиеся). Диффузионная, кинетическая и переходная области гетерофазного процесса.
- •14. Общие положения, понятие о химических реакторах, классификация химических реакторов: периодические, непрерывнодействующие и полупериодические реакторы.
- •15. Общие положения, понятие о химических реакторах, классификация химических реакторов: изотермические, адиабатические и политропные реакторы, реакторы смешения и вытеснения.
- •18. Расчет изотермических реакторов для проведения процессов в системах г-ж, ж-ж(н), аппараты колонного типа, система смеситель-сепаратор, модели смещения фаз в реакторах полупериодического действия.
- •20. Основы расчета реакторов с неидеальным потоком движения реакционной среды, использование ячеечной и диффузионной модели для расчета реальных реакторов.
- •Проектные уравнения реакторов, работающих в политропном режиме
- •Проектные уравнения реакторов, работающих в адиабатическом режиме
- •Проектные уравнения реакторов, работающих в изотермическом режиме
- •Оптимальный температурный режим и способы его осуществления в промышленных реакторах
- •1) Простые необратимые реакции
- •2) Обратимые химические реакции
- •Тепловая устойчивость химических реакторов
8. Особенности исследования кинетики гомогенных каталитических процессов.
В гомогенном катализе исходные реагенты и катализатор находится в одной фазе, оразуя гомогенную систему. Примерами гомогенного катализа является реакции этерефикации, гидролиза сложных эфиров и др.
Рассмотрим вывод уравнения скорости гомогенной каталитической реакции на примере реакции:
А+В=С(кат), которая протекает по следующему механизму по стадиям:
К1
А+кат = [A*kat]#
К2 K3
[A*kat]#+B = [ABkat]#
K4
[A*B*kat]#= C(лимитирующая стадия), т.к. 3-я стадия является лимитирующей, то скорость реакции будет определяться кинетическим уравнением этой стадии, т.е.
Vр=К4*С[AВkat]#
В этом уравнении не извесна концентрация промежуточного комплекса [Abkat]#, для определения этой С воспользуемся принципом стационарности, согласно этому принципу:
изменение концентрации любой промежуточной частицы в единицу времени, в установленном режиме равно нулю.


Vр=К3*С[AВkat]#*CB
В последнем уравнении не известна С[AВkat]#, поэтому для ее определения воспользуемся принципом стационарности.
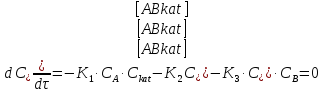
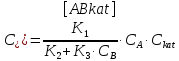
 -
скорость реакции для гомогенного
катализа, протекающей по данному
механизму.
-
скорость реакции для гомогенного
катализа, протекающей по данному
механизму.
9. Кинетика гетерогенно - каталитических процессов.
-
наблюдаемая скорость процесса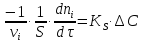 ,
,
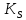 -
наблюдаемая константа скорости,
отнесенная к поверхности катализатора
-
наблюдаемая константа скорости,
отнесенная к поверхности катализатора
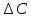 -
движущая сила процесса
-
движущая сила процесса
- Внешнедиффузионная область
Скорость процесса выражается скоростью диффузионного (конвективного) переноса вещества к внешней поверхности катализатора.
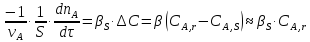
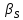 -
коэффициент массопередачи реагента А
из газового потока и внешней поверхности
катализатора;
-
коэффициент массопередачи реагента А
из газового потока и внешней поверхности
катализатора;
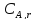 -
концентрация реагента А в газовом
потоке;
-
концентрация реагента А в газовом
потоке;
 -
концентрация реагента А на внешней
поверхности катализатора
-
концентрация реагента А на внешней
поверхности катализатора
Проведение процесса в диффузионной области не желательно, так как в этом случае сильно затрудняются процессы теплообмена в порах катализатора. Реакция протекает в этой области, когда размеры молекул велики, а пор – малы. И когда велика толщина газо-ламинарной пленки. В этом случае для перевода процесса в другую область можно увеличить объемную скорость подачи исходного реагента.
- Внутридиффузионная область.
Является нежелательной областью с теми же недостатками. Протекание ГКП в этой области обусловлено в основном пористой структурой катализатора, а также геометрическими размерами и структурой молекул сырья и продуктов реакции.
 ,
где V
– объем катализатора,
,
где V
– объем катализатора,
 -
константа
скорости, отнесенная к объему катализатора,
-
константа
скорости, отнесенная к объему катализатора,
 -
коэффициент использования внутренней
поверхности катализатора,
-
коэффициент использования внутренней
поверхности катализатора,
 –концентрация
реагенте А на внешней поверхности
катализатора
–концентрация
реагенте А на внешней поверхности
катализатора
n – порядок реакции.
- Стадия адсорбции
Различают физическую адсорбцию и хемосорбцию.
Физическая адсорбция определяется вандервальсовским взаимодействием и имеет электростатическую природу. Сильная зависимость от температуры и расстояния между молекулами. Имеет невысокую температуру адсорбции.
Хемосорбция обусловлена химическим связыванием молекул, энергия очень велика и именно она играет решающую роль в гетерогенно-каталитической реакции. Сила не зависит от температуры.
Для описания процесса адсорбции используют теорию Ленгмюра, согласно которой твердая поверхность однородна, молекулы образуют мономолекулярный слой и отсутствуют какие-либо межмолекулярные взаимодействия. Для практических расчетов используют уравнение изотермы Ленгмюра, устанавливая зависимость степени заполнения поверхности адсорбирующими молекулами от давления при постоянной температуры.
Степень заполнения.
σ
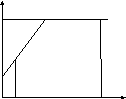
σ=1
p1 p2 p, давление
Адсорбция – это равновесный процесс, состоящий из двух противоположных явлений: 1 – сама адсорбция; 2 – десорбция.
<p1 – минимальная зависимость
P2 – не минимальная зависимость
>p2 – полное заполнение поверхности
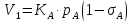 -
скорость адсорбции
-
скорость адсорбции
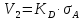 -
скорость
десорбции
-
скорость
десорбции
В состоянии равновесия V1=V2, тогда
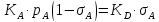
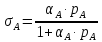 ,
где
,
где
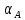 - адсорбционный коэффициент
- адсорбционный коэффициент
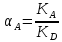
Адсорбционный
коэффициент
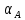 зависит от температуры и теплоты
адсорбции:
зависит от температуры и теплоты
адсорбции:
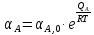
 -
частотный множитель,
-
частотный множитель,
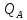 - теплота адсорбции вещества А.
- теплота адсорбции вещества А.
При одновременной адсорбции двух реагентов А и В:
 ,
из этого уравнения следует, что при
низких давлениях
,
из этого уравнения следует, что при
низких давлениях
 .
.
При
высоких давлениях
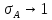 .
.
Для неоднородной поверхности катализатора.
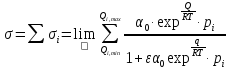
При изменении теплоты адсорбции по мере возрастания степени заполнения:
Q=Q0+ΔQσ
С учетом этого, уравнение изотермы адсорбции имеет вид:
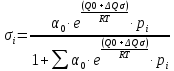
- Кинетическая область
1. Исходное вещество слабо адсорбируется
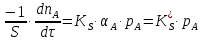 ,
где
,
где
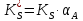
2. Исходное вещество не очень сильно адсорбируется
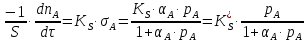
3. Исходное вещество сильно адсорбируется.
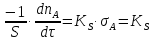 ,
так как
,
так как
Для
реакций типа А+В продукты:
продукты:
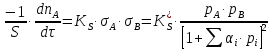
С учетом интерпретации Риделя, согласно которой реакция протекает между молекулой В из газовой среды и молекулой А, адсорбирующейся на катализаторе, кинетическое уравнение примет вид:
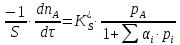
При
этом
 рассчитывают по уравнению
Менделеева-Клаперона:
рассчитывают по уравнению
Менделеева-Клаперона:

