
Химия учеб посрбие
.pdf
Количественно гидролиз может охарактеризовываться величинами: степенью гидролиза и const гидролиза Кãèäð.
Степенью гидролиза называется отношение количества молекул соли, подвергшихся гидролизу, к общему количеству молекул соли в растворе. Степень может изменяться в пределах:
отсутствует гидролиз |
|
полный гидролиз |
||
0 |
≤ |
h |
≤ |
1 |
0 |
≤ |
h |
< |
100 % |
0 |
= |
Ê |
< |
∞ |
|
|
|
[HCO− |
][OH− ] |
|||
Na2CO3 — Kãèäð |
= |
|
|
3 |
|
|
|
|
|
− 2 |
][H2 O] |
||||
|
|
|
[CO3 |
||||
ZnCl2 — Êãèäð = |
[Zn(OH )+ [H+ ] |
||||||
|
[Zn |
+ 2 |
][H2 O] |
|
|||
|
|
|
|||||
Температура и концентрация Н2O влияют на гидролиз. Соль + Н2О ↔ основание + кислота
= [основание] [ кислота]
K [соль][ H2 O]
Увеличение [H2O] увеличивает К, смещает равновесие слева направо.
С увеличением температуры степень гидролиза увеличивается, резко возрастает ионное произведение воды.
Амфотерные гидрооксиды
Амфотерные гидрооксиды являются соединениями типа Ме(ОН)n, которые, будучи практически нерастворимы в воде, взаимодействуют с кислотами и щелочами.
Гидроксиды берилия, цинка, алюминия, хрома, олова, свинца и др. Двойственная природа амфотерных окислов связана с тем, что они электролитически диссоциируют одновременно по типу основания и по типу кислоты:
2H+ + ZnO − 2 |
↔ |
Zn(OH) |
↔ Zn+2 |
+ 2OH |
2 |
|
2 |
|
|
|
|
↓↑ |
|
|
Zn(OH)2 — осадок, равновесие в системе нарушается, растворяется Zn(OH)2.
— 61 —

Если в кислоту добавлять [H+], то увеличивается > [OH], смещение равновесия происходит слева направо, гидроксид цинка будет вести себя как основание:
Zn(OH)2 ↔ Zn+2 + 2OH+OH + H + → H2O
Zn(OH)2 + 2H+ + 2Cl = 2H2O + Zn+2 + 2Cl
или любая другая кислота
Zn(OH)2 + 2H+ = Zn+2 + 2H2O
Растворение амфотерных гидроксидов в щелочах ныне рассматривается как процесс образования комплексных анионов или гидроксокомплексов. Если ион металла, образующего гидроксид, способен с гидроксид-ионами образовать гидроксокомплексы, то данный гидроксид будет растворяться в щелочах и, следовательно, обладает амфотерным характером.
Процесс выражается так:
Zn(OH)2 + K+ + OH → K+ + [Zn(OH)3] — образование гидроксоцинката калия;
èëè Zn(OH)2 + OH = [Zn(OH)3] — гидроксоцинкат-ион. Общая схема:
|
|
|
+2H+ = 2H O + Zn+2 |
|
|
|
2 |
|
|
|
(действие кислот) |
раствор |
|
↔ |
|
Zn(OH) |
2 |
Zn+2 + 2OH |
|
↓↑ |
|
|
|
|
|
|
|
Zn(OH) |
|
|
+OH = [Zn(OH) ] |
2 |
|
3 |
|
осадок |
|
|
(действие щелочей) |
Аналогично ведут себя Al(OH)3, Be(OH)2, Sn(OH)2 c образованием комплексных ионов: [Al(OH)4]; [Be(OH)4]-2; [Sn(OH)6]-2.
Доказано образование коìïëексов, так как они выделяются при кристаллизации из щелочных растворов.
— 62 —

Òåìà 7
ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ. СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ.
При практическом использовании любой химической реакции всегда очень важно, чтобы она происходила с требуемой скоростью. Не только скорость разных реакций, но и скорость какой-либо данной реакции может изменяться в широких пределах в зависимости от условий.
При изучении химических реакций важную роль играет понятие фазы. Фазой называется совокупность всех однородных ча- стей системы, обладающих одинаковым химическим составом и одинаковыми свойствами и отделенных от остальных частей системы поверхностью раздела. Системы, состоящие только из одной фазы, называются гомогенными, системы, содержащие две или более фаз, — гетерогенными. Химические реакции, происходящие в гомогенной системе, называются гомогенными реакциями, а реакции, в которых взаимодействующие вещества содержатся в разных фазах, — гетерогенными реакциями, по механизму эти реакции сильно отличаются друг от друга.
Скорость гомогенных реакций
Необходимым условием, чтобы две молекулы могли вступить между собой в химическое взаимодействие, является их столкновение. В момент столкновения происходит настолько тесное сближение их, что электроны, атомы или ионы, составляющие одну молекулу, попадают в сферу действия электрических полей, возбужденные электронами, атомами или ионами другой молекулы. Лишь в таких условиях могут произойти те переходы электронов и перегруппировки атомов, которыми осуществляется образование новых молекул. В реакции, которые происходят с конечными скоростями, к химическому взаимодействию приводит только какая-то часть столкновений, составляющая небольшую долю их общего числа.
— 63 —
Возможность и вероятность химического взаимодействия между молекулами при столкновении зависит от их состояния в момент столкновения. Молекулы, обладающие большим запасом энергии, более реакционноспособны. И химическое взаимодействие наиболее вероятно при столкновении, в котором участвуют молекулы, более богатые энергией в этот момент. Чем больше в газе относительное содержание таких молекул, тем больше и скорость хими- ческой реакции.
Молекулы, обладающие повышенным запасом энергии называются активными, а разность между минимально необходимой для этого запаса энергией и средней энергией молекулы данного вида в данных условиях называется энергией активации.
Скорость химической реакции принято выражать изменением концентрации реагирующих веществ или продуктов реакции во времени:
|
c |
− |
c |
|
dc |
||
V = ± |
2 |
|
1 |
; V = ± |
|
, |
|
t |
− |
t |
|||||
dt |
|||||||
2 |
|
1 |
|
|
|
||
ãäå V ìîëü/ë/ñ — скорость (всегда положительна);
±ñ — концентрация одного из веществ или же концентрация одного из продуктов реакции.
Закон действия масс
Теоретические и экспериментальные данные показывают, что для реакций, наиболее простых в кинетическом отношении, справедливо следующее соотношение, называемое законом действия масс: при постоянной температуре скорость химической реакции прямо пропорциональна концентрации реагирующих веществ в степени, равной коэффициентам перед формулой данного вещества в уравнении реакции:
2NO + H2 = N2O + H2O
V= Ê Ñ 2NO . ÑH2
Ê— константа скорости реакции. Численно она равна (Ê = V )
âусловиях, когда концентрация каждого из реагирующих веществ равна единице: СNO = CH2= 1.
—64 —

Для газовых реакций этот закон является строгим только в пределах применимости к реагирующим веществам законов идеальных газов, к реакциям в растворах, но только при больших разбавлениях.
С повышением температуры увеличивается энергия всех форм молекулярного движения и соответственно возрастает относительная доля активных молекул. Это естественно влечет за собой и повышение скорости химических реакций. Правило Вант-Гоф- фа, согласно которому повышение температуры на 10 ° увеличи- вает скорость гомогенной химической реакции примерно в 2—4 раза:
K2 |
Vt2 |
|
t |
|
− t |
|
|
= γ n, |
|
= γ |
|
2 |
1 |
K |
V |
|
||||
|
|
10 |
||||
1 |
|
t1 |
|
|
|
|
t1 изменяется до t2 = t1 +10n градусов; γ — температурный коэффициент скорости реакции, равный примерно 2—4.
Цепные реакции
Cl2 + H2 долгое время находятся вместе, но стоит внести пары Na, начинается очень активная реакция:
Na + Cl → |
NaCl + Cl• , Cl• + H → HCl + H• , |
2 |
2 |
начало роста |
|
H• + Cl → HCl + Cl• è ò. ä. Cl• + Cl• = Cl (обрыв цепи) |
||
2 |
|
2 |
Схема цепной реакции: |
||
|
о |
|
о |
о |
|
о |
о о |
о |
о о о о |
о о |
о о |
о о о о о о о о |
о о |
|
Цепная реакция происходит с нарастающей во времени скоростью и часто заканчивается взрывом. Впервые ее открыл Шилов, систематизировал Н.Н. Семенов и создал количественную теорию кинетики цепных реакций.
— 65 —
Катализ
Каталитической называется реакция, в которой скорость изменяется в результате введения в реакционную систему тех или других веществ, состав и количество которых остаются неизменными к концу реакции. Вещества, изменяющие таким образом скорость реакции, получили название катализаторы.
Положительный и отрицательный катализ. Каталитические реакции разделяются на реакции гомогенного и гетерогенного катализа:
À + Â = ÀÂ
Роль катализатора: А + К = АКАК + В = АВ + К Механизм может быть различным, чаще это образование
промежуточного соединения АК. В растворах ионы Н+ вызывают поляризацию молекул и их деформацию, сопровождающуюся изменением их реакционноспособности, и могут значительно изменить скорость реакции.
При гетерогенном катализе важную роль играет состояние поверхности катализатора, его структура и степень развития поверхности.
При реакциях окисления и восстановления в качестве катализатора используются вещества, обладающие полупроводниковыми свойствами. Характерная для катализатора специфичность:
Ñ2Í5ÎÍ = Ñ2Í4+ Í2О — катализатор — оксид алюминия
этилен
Î
//
Ñ2Í5ÎÍ → ÑÍ3—Ñ + Í2,
\
Í
а катализатором этой реакции могут быть оксид магния или олова, металлы Ni, Pt, Pd, которые являются катализаторами дегидрирования и гидрирования.
2Ñ2Í5ÎÍ → Ñ2Í5ÎÑ2Í5 + Í2Î (Í3ÐÎ4 — катализатором является фосфорная кислота).
NH3; SO2 → SO3; CH3OH — синтезы этих веществ осуществляются в присутствии катализаторов.
— 66 —
Фотохимические реакции
Фотохимическими реакциями называются реакции, происходящие под действием лучей света (видимых инфракрасных, ультрафиолетовых). Поглощение света усиливает вращательное движение молекул или колебательные движения в них атомов и атомных групп. Это приводит к возбуждению электронов наружных оболочек атомов, что может привести к образованию ионов за счет отрыва наиболее слабо связанных электронов.
По химическому характеру это реакции синтеза, диссоциации или окисления и др.:
n
Cl2 + H2 → 2HÑl
квант солнечного света
6ÑÎ2 + 6Í2Î → Ñ6Í12Î6 + 6Î2 + 2,8 кДж Поглощение света приводит к зарождению цепи.
Важная фотохимическая реакция — фотосинтез происходит в растениях. Свет поглощается зелеными листьями — хлорофиллом, который способен к интенсивному поглощению электромагнитных колебаний в области красной части спектра.
Скорости гетерогенных процессов
При гетерогенных химических реакциях, когда взаимодействие происходит на поверхности раздела между фазами, общая скорость зависит от скорости отдельных стадий, из которых складывается процесс в целом. Скорость взаимодействия на самой поверхности раздела зависит от природы процесса, от температуры, от величины поверхности соприкосновения фаз и других факторов. Взаимодействие на поверхности раздела приводит к возникновению различия составов поверхностных и внутренних слоев данной фазы. Состав слоев постепенно выравнивается за счет диффузии соответствующих исходных веществ в данной фазе. Диффузия — это медленный процесс, и общая скорость реакции будет определяться в первую очередь скоростью диффузии, которая задерживает весь процесс.
— 67 —
|
|
|
Обратимые |
реакции |
|
|
|
|
|
|
||
Примером обратимой реакции являются реакции образова- |
||||||||||||
íèÿ âîäû: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2Í2 + Î2 ↔ |
2Í2Î; |
|
|
|
|
|
|
||
иодистого водорода: |
|
|
|
|
|
|
|
|
|
|
||
Í + J ↔ |
2HJ |
V = K [H ] . [J ]; |
|
V |
2 |
= K |
[HJ] |
2 |
||||
2 |
2 |
|
1 |
1 |
2 |
2 |
|
|
2 |
|
||
|
Процент |
|
|
|
|
|
|
|
|
|
|
|
|
HJ |
100 |
|
V1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V1 = V2 |
|
|
||||
|
|
|
|
|
|
V2 |
|
химическое |
|
|||
|
|
50 |
|
|
|
|
равновесие |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
20 |
40 |
|
60 |
80 |
|
|
100 |
|
|
|
|
|
|
|
Время |
|
|
|
|
|
|
|
|
|
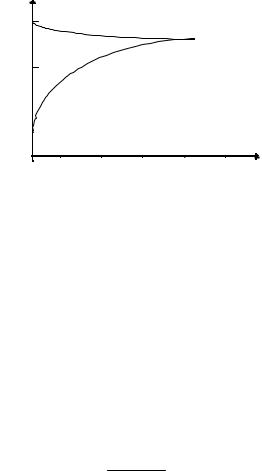
Кривые образования и разложения HJ |
|
|
||||||||
Критерием химического равновесия и необходимым условием его является равенство скоростей прямой и обратной реакции:
V1 = V2, следует K1[H2] . [J2] = K2[HJ]2;
|
|
K |
|
[HJ ]2 |
|
|||
K = |
1 |
|
= |
|
|
, ãäå Ê — константа равновесия; |
||
|
|
[H2 ][J2 ] |
||||||
c |
|
K2 |
|
ñ |
||||
|
|
|
|
|||||
Kc |
= |
[HJ ]2 |
— уравнение, характеризующее пре- |
|||||
|
|
|
|
|
||||
|
|
|
][J2 ] |
|||||
|
[H2 |
|
|
|||||
дел, до которого может измениться состав реакционной системы при самопроизвольном процессе.
Закон действия масс: àÀ + â ↔ ñÑ + dD
[C]c[D]d Kc = [ A]a [B]в
— 68 —
Для газовых реакций через парциальные давления:
Kp = |
Pc |
Pd |
C |
D |
|
Pa |
Pb |
|
|
A |
B |
Фазовые равновесия
При равновесии между чистой жидкостью и ее паром (а также при равновесии между твердым веществом и его паром) скорость процессов испарения и конденсации одинаковы. Давление пара отвечает такому состоянию, называемому давлением насыщенного пара при данной температуре. Для раствора, компоненты которого могут испаряться в условиях равновесия при данной температуре, каждому летучему компоненту отвечает определенное давление его паров — это давление называется парциальным давлением насыщенного пара данного компонента, оно зависит от температуры и от состояния раствора, от концентрации и от вида концентрации других компонентов.
Условием фазового равновесия в системе, состоящей из нескольких конденсированных фаз и нескольких компонентов, является равенство парциального давления насыщенного пара каждого данного компонента над всеми фазами.
Принцип Ле-Шателье:
Если на систему, находящуюся в равновесии, воздействовать извне и тем изменить условия, определяющие положение равновесия, то в системе усилится то из направлений процесса, течение которого ослабляет влияние этого воздействия, в результате чего положительное равновесие сместится в этом же направлении:
N2 + 3H2 ↔ 2NH3 + 92,048 êÄæ
Повышение температуры всегда способствует накоплению веществ, которые образуются в данной реакции с поглощением теплоты, то есть усиливает эндотермическое направление процесса; понижение температуры действует в противоположном направлении.
Повышение давления способствует образованию веществ, занимающих в данных условиях меньший объем, то есть усиливает то из направлений процесса, которое сопровождается уменьшением объема; понижение давления действует в противополож-
— 69 —
ном направлении. Увеличение давления способствует образованию NH3.
Правило фаз
В равновесной системе число фаз Ф, число степеней свободы С и число компонентов К связаны простым соотношением:
Ñ = Ê – Ô + 2.
Число условий (t, давление, концентрация), которые можно менять произвольно в известных пределах, не изменяя этим числа
или вида фаз системы, называется числом степеней свободы. |
|
||||
Система: Лед + вода + пар = С = 0 |
|
|
|
||
вода + пар = 1 степень свободы |
|
|
|
||
вода или пар — моновариантная система. |
|
||||
Åñëè Ê = 1, òî Ñ = 3 – Ô, è åñëè Ô = 1, òî Ñ = 2. |
|
||||
При равновесии между двумя фазами (вода ↔ пар, лед ↔ |
ïàð) |
||||
Ô = 2, Ñ = 3 – 2 = 1. |
|
|
|
|
|
При равновесии между тремя фазами (лед ↔ вода ↔ |
ïàð) |
||||
Ô = 3 Ñ = 0. |
|
|
|
|
|
Для однокомпонетной системы больше трех фаз существо- |
|||||
вать не может. |
|
|
|
|
|
Рн/м2 |
|
|
|
|
|
B Жидкость |
С |
|
|
||
|
Лед |
|
|
||
|
|
|
|
|
|
|
610,5 |
|
|
|
|
|
|
пар |
|
|
|
|
|
|
|
|
|
Д |
0 |
|
|
|
|
|
|
|
|
||
А 0,01
0,01
t C
Диаграмма состояния воды
ОА — лед ↔ пар, ОД — переохлажденная вода ↔ пар,
ÎÑ — âîäà ↔ |
ïàð, |
ÎÂ — ëåä ↔ |
âîäà. |
1)Повышение температуры сдвигает влево, так как экзотермическая реакция.
—70 —
