
- •Лекция №9
- •Регуляция ферментативной активности.
- •Изоферменты или изоинзимы.
- •Классификация ферментов.
- •Лекция №10
- •Биоэнергетика.
- •Энергетика переноса электронов.
- •Механизм энергетического сопряжения в митохондриях.
- •Химеосмотическая, протондвижущая концепция.
- •Моносахариды.
- •Лекция №13
- •Обмен углеводов.
Регуляция ферментативной активности.
В каждой ферментной системе есть хотя бы один фермент, выполняющий роль дирижера, который задает скорость всей последовательности реакции, т.к. катализирует самую медленную стадию.
В большинстве мультиферментых систем дирижер катализирует первую реакцию, а все остальные протекают с очень высокой скоростью.
Эти ферменты-дирижеры, активность которых зависит от разных факторов (молекулярных сигналов) можно разделить на два типа:
-
Аллостерические регуляторы, когда в ферменте-дирижере имеются аллостерические центры, куда могут включаться молекулы, под влиянием молекулярных сигналов этот фермент или увеличивает свою активность или понижает. Эти молекулы, которые включаются в аллостерический центр регуляторного фермента – метаболиты клетки, называют их модуляторы, эффекторы, модификаторы. Примером такого регулирования является синтез аминокислоты изолейцина из аминокислоты треанина.
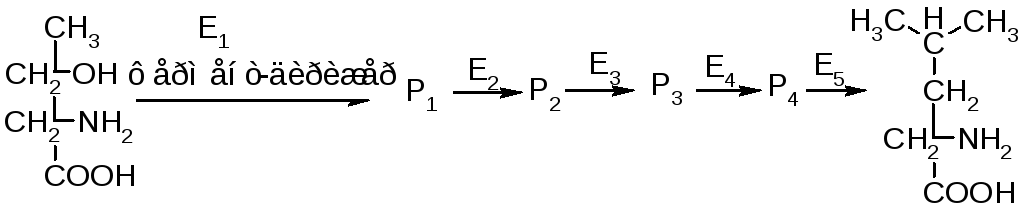
Модулятором регуляторного фермента E1 является конечный продукт – изолейцин. Как только концентрация изолейцина превышает стационарную концентрацию, избыточное количество включается в аллостерический центр E1, фермент становится не активным и цепочка прерывается. Как только концентрация становится стационарной, цепочка опять включается. Принцип такой регуляции очень часто встречается. Такие регуляторные ферменты могут не только понижать активность, но могут и увеличивать активность фермента. В этом случае таким модулятором выступают сами молекулы субстрат. В этом случае субстрат связывается не токльо в активном центре фермента, но еще и в других аллостерических центрах – гомеотропная регуляция, когда 2 или более аллостерических центр участвуют в регуляции. Многие ферменты имеют несколько аллостерических центров, куда могут присоединяться понижающие и повышающие активность молекулы.
-
Ковалентная модификация фермента. Есть ферменты, которые могут существовать в активной или неактивной форме, активация их происходит в результате ковалентной модификации. К такому классу относится фермент гликогенфосфорилаза. Под действием этого фермента идет реакция расщепления гликогена
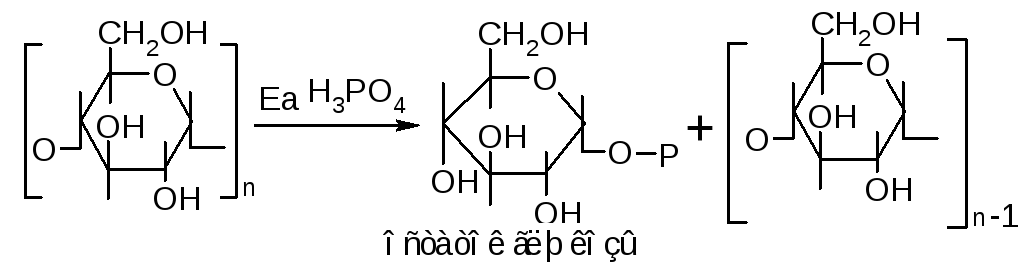
Происходит отщепление от гликогена одного остатка глюкозы, образуется глюкоза-1-монофосфат, а гликоген укоротился на одно углеводное звено. Регуляция происходит в результате перехода фермента гликогенфосфорилазы–а (активный) под действием воды и фермента ферментфосфатазы, в результате получается гликогенфосфорилазы–b (неактивная) и две молекулы фосфорной кислоты.
![]()
![]()
Киназафосфорилаза-b
Изоферменты или изоинзимы.
Многие ферменты могут в нескольких формах, встречающихся у одного и того же организма и даже в одной клетке. В таких случаях все формыкатализирут одну и ту же реакцию, но отличаются по своим каталитическим, кинетическим параметрам, по структуре и аминокислотному составу. Их можно выделить и идентифицировать. Такие множественные формы ферментов называются изоферментами. Один из первых ферментов, который был описан лактатдегидрогиназа. Под действием этого фермента молочная кислота превращается в пировиноградную и образуется.

Лактатдегидрогиназа существует в тканях животных в виде 5 разных ферментов, которые можно разделить методом электрофореза. Каждая из форм состоит из 4 полипептидных цепей, молекулярная масса примерно 3500. все 5 изоформ содержат в разных соотношениях полипептидные цепи двух типов, различающихся по аминокислотному составу и последовательности. Так, например, форма A4 выделена из скелетной мышцы быка, а B4 – из сердечной мышцы, а все остальные формы, которые содержатся в других клетках и тканях имеют состав A3B, A2B2, AB3. Изоформы очень полезны для живого организма, т.к. одни ферменты могут заменять друг друга в цепочке, повреждения на генетическом уровне не происходит.
