
Khimia_Abakumova_08_1-80
.pdf
Решение. Определим молярную массу сахарозы:
М1 = (12 12 + 1 22 + 16 11) г/моль = 342 г/моль.
Определим количество растворенного вещества в растворе:
ν1 |
m1 |
|
4,57 г |
0,0134 моль. |
M1 |
|
342 г/моль |
||
|
|
|
На основании уравнения (6.5) определим массу растворителя (m2) в растворе:
m |
2 |
ν1 |
1000 |
0,0134 моль |
1000 100 г. |
|
0,134 моль/кг |
||||
|
Сm |
|
|||
Определим объем растворителя (воды) в растворе:
V |
m2 |
|
100 г |
100 см3 (мл). |
ΥH2O |
|
|
||
H2O |
1г/см3 |
|
||
6.1.5. Мольная доля вещества (Ni ) в растворе
Мольная доля вещества в растворе определяется отношением количества этого вещества к общему количеству вещества в растворе:
N1 |
|
ν1 |
|
|
|
|
|
|
m1 |
M1 |
|
|
|
|
, |
|
|
ν ν |
2 |
|
|
|
m M m |
M |
2 |
|
|
||||||||
|
1 |
|
|
1 |
1 |
2 |
|
|
|
|
|||||||
N2 |
|
|
ν2 |
|
|
|
|
|
|
m2 |
M2 |
|
|
|
, |
(6.6) |
|
|
ν |
ν |
2 |
|
m M m |
M |
2 |
||||||||||
|
1 |
|
|
1 |
1 |
2 |
|
|
|
|
|||||||
где N1 – мольная доля растворенного вещества; N2 – мольная доля растворителя в растворе.
Приусловии, чторастворсостоитизрастворителяиодногорастворенного вещества, справедливо равенство
N1 + N2 = 1. |
(6.7) |
Пример 5. Рассчитать мольные доли глюкозы С6H12O6 и воды в растворе с массовой долей глюкозы 36 %.
Решение. Пусть масса раствора m = 100 г. Тогда масса глюкозы в растворе m1 = 36 г, масса воды m2 = 64 г. Определим молярные массы глюкозы и воды:
М1 |
МC H |
|
O |
6 |
(6 |
12 1 12 6 16) г/моль 180 г/моль; |
|
|
6 |
12 |
|
|
|
||
|
М2 |
|
МH2O |
(2 1 1 16) г/моль 18 г/моль. |
|||
Определим количество глюкозы и воды в растворе:
ν1 |
νC6H12O6 |
m1 |
|
|
36 г |
0,2 моль; |
||||
М1 |
|
|
180 г/моль |
|||||||
ν2 |
νH2O |
m2 |
|
|
|
64 г |
|
3,56 моль. |
||
M2 |
18 г/моль |
|||||||||
|
|
|
||||||||
Определим мольную долю растворенного вещества – глюкозы:
N1 |
ν1 |
|
0,2 |
0,053. |
|
ν ν |
2 |
|
0,2 3,56 |
||
1 |
|
|
|
||
Определим мольную долю растворителя – воды:
N2 |
ν2 |
|
3,56 |
0,947 или N2 1 – N1 1 – 0,053 0,947. |
|
ν ν |
2 |
|
0,2 3,56 |
||
1 |
|
|
|
||
6.1.6. Титр раствора (Т)
Титр раствора определяет массу растворенного вещества в граммах(г), котораясодержится в1 мл раствора. Титр раствора, г/мл, можно рассчитать по уравнению
Т |
m1 |
|
CМ М1 |
|
Сн Э1 М1 |
. |
(6.8) |
|
V 1000 |
1000 |
1000 |
||||||
|
|
|
||||||
Пример 6. Определить титр раствора KOH, эквивалентная концентрация которого Сн = 0,01 н. (моль/л).
Решение. Относительный эквивалент KOH – Э1 = 1. Определим молярную массу KOH:
М1 = (1 39 + 1 16 + 1 1) г/моль = 56 г/моль.
По уравнению (6.8) рассчитаем титр раствора:
Т |
0,01 56 1 |
0,00056 г/мл. |
|
1000 |
|
||
|
|
|
|
6 0 |
6 1 |
6.1.7. Вычисления, связанные с пересчетом концентраций растворов из одних единиц в другие
Пример 7. Массовая доля CuSO4 в водном растворе составляет 10 %. Плотностьраствора 1,107 г/см3. Вычислитьмолярную, эквивалентную, моляльную концентрацию и мольную долю сульфата меди.
Решение. Молярная масса растворителя (воды) М2 = 18 г/моль. Относительный эквивалент CuSO4 – Э1 = 1/2. Рассчитаем молярную и эквивалентную массу сульфата меди:
М1 = (64 + 32 + 4 16) г/моль = 160 г/моль; mэ(1) = 1/2 160 г/моль = 80 г/моль.
Пусть объем раствора V = 1 л, рассчитаем массу раствора: m = VΥ = 1000 мл 1,107 г/мл = 1107 г.
Определим массу CuSO4 в одном литре раствора:
m |
1107 г |
10 % 110,7 г. |
|
|
|
||
1 |
|
|
|
|
100 % |
|
|
Определим массу растворителя (воды) в растворе:
m2 = m – m1 = 1107 г – 110,7 г = 996,3 г.
Определим количество растворенного вещества (CuSO4) и растворителя (H2O) в растворе:
ν |
110,7 г |
0,69 моль, ν |
2 |
|
996,3 г |
55,35 моль. |
|
|
|
||||
1 |
160 г/моль |
|
18 г/моль |
|
||
|
|
|
|
|||
Рассчитаем молярную, эквивалентную, моляльную концентрации и мольную долю растворенного вещества:
|
|
CМ |
|
0,69 моль |
|
0,69 моль/л, |
||||
|
|
|
1 л |
|||||||
|
|
|
|
|
|
|
||||
|
|
Cн |
0,69моль/л |
1,38 моль/л, |
||||||
|
|
1/2 |
|
|
||||||
|
|
|
|
|
|
|
|
|||
Cm |
0,69 моль |
1000 0,69 моль/кг растворителя, |
||||||||
996,3 г |
||||||||||
|
|
|
|
|
|
|
||||
|
N1 |
|
|
|
0,69 моль |
|
0,012. |
|||
|
|
|
|
|
|
|
|
|||
|
|
0,69 моль 55,35 моль |
||||||||
|
|
|
|
|||||||
6.1.8. Приготовление разбавленных растворов из концентрированных
Разбавлением называется уменьшение концентрации раствора
врезультатедобавлениярастворителя. Разбавлениесопровождаетсяувеличениемобъема раствора иобщеймассы раствора. Количествои масса растворенного вещества не изменяются при разбавлении.
Введем обозначения: mx – масса растворителя, добавленного
висходныйраствор, г; Vx – объемрастворителя, добавленноговисходный раствор, дм3; Θx – количество растворителя, добавленного в исходный раствор, моль.
Тогда концентрации разбавленного раствора: С*, С*М, С*н, С*m, N* (1) можно рассчитать на основании следующих уравнений:
|
m C m C m m |
, |
C |
|
|
|
C m |
|
|
|
|
|
|
|||||||
|
|
|
m mx ; |
(6.9) |
||||||||||||||||
|
1 |
|
|
|
|
x |
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
СМ V |
|
|
|
|
|
|
|
1 СМ V |
СМ V Vx , |
|
СМ |
|
|
|
|
|
; |
|
|
(6.10) |
||||||||
|
|
V Vx |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cн V |
|
|
|
|
|
|
nэ 1 |
Сн V |
Cн V Vx |
, |
Сн |
|
|
|
|
|
; |
(6.11) |
|||||||||
|
|
|
V Vx |
|
||||||||||||||||
|
|
|
* |
|
|
|
|
|
|
* |
|
|
Cm m2 |
|
|
|
|
|
||
Θ1 Cm m2 Cm m2 |
mx , |
|
|
Сm |
|
|
|
; |
(6.12) |
|||||||||||
|
|
m m |
x |
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
||||
N* 1 |
|
|
Θ1 |
|
|
|
|
|
|
m1 М1 |
|
|
, |
(6.13) |
||||||
|
|
Θ1 |
Θ2 Θx |
|
m1 М1 m2 mx М2 |
|
||||||||||||||
где С, СМ, Сн, Сm – процентная, молярная, эквивалентная, моляльная концентрации в исходном растворе.
Пример 8. Какой объем раствора ортофосфорной кислоты с массовой долей H3PO4 36 % (Υ = 1,219 г/см3) требуется для приготовления 13 л 0,15 н. раствора H3PO4?
6 2 |
6 3 |

Решение. Проведем анализ условия задачи и введем обозначения: раствор № 2 получен в результате разбавления раствора № 1. Объем ра- ñòâî ðà ¹ 2 V* = 13 л, эквивалентная концентрация этого раствора С*н = 0,15 н. Определим количество эквивалентов растворенного вещества и учтем, что при разбавлении количество растворенного вещества в растворе не изменяется. Тогда в соответствии с уравнением (6.11)
n 1 |
C V C* V *; |
|
C* V * |
||
V |
н |
, |
|||
|
|||||
э |
н |
н |
|
Cн |
|
|
|
|
|
|
|
где Сн и V – соответственно эквивалентная концентрация и объем раствора № 1. Однако по условию задачи дана массовая доля (С) раствора № 1, поэтомунеобходимоперейтиотмассовойдолиисходного раствора к его эквивалентной концентрации (см. пример 7): в 100 г исходного раствора содержится 36 г H3PO4 и 64 г H2O; молярная масса и относительныйэквивалент H3PO4 соответственно М1 = 98 г/моль; Э1 = 1/3. Рассчитаемэквивалентнуюконцентрациюисходногорастворапоуравнению(6.3):
|
m Υ |
|
36 г 1,219 г/см3 |
||
Сн |
|
1 |
|
|
1000 13,4 моль/л (13,4 н.). |
М Э m |
|
98 г/моль 1/3 100 г |
|||
1 |
1 |
|
|
|
|
Определим объем раствора №1, который использовали для приготовления 13 л раствора №2:
V |
0,15 моль/л 13 л |
0,146 л. |
|
13,4 моль/л |
|||
|
|
6.1.9.Приготовление растворов заданной концентрации
исмешиванием двух растворов известной концентрации
Если для приготовления раствора с заданной концентрацией используютдва раствора сизвестнымиконцентрациями, то обычнозадача сводится к расчету объема или массы одного раствора, которую необходимо добавить к известной массе или известному объему второго раствора, чтобы получить раствор заданной концентрации.
Пример 9. Какую массу раствора с массовой долей KOH 20 % (раствор 1) надо прибавить к 250 г раствора с массовой долей KOH 90 % (раствор 2), чтобы получить раствор 3 с С = 50 %?
Решение. I способ. Обозначим массу раствора 1 за X и представим количественные характеристики растворов в табличном виде:
Растворы |
m1, г |
m, г |
|
(масса вещества) |
(масса раствора) |
||
|
|||
|
|
|
|
Раствор 1 |
0,2 X |
X |
|
|
|
|
|
Раствор 2 |
0,9 250 |
250 |
|
|
|
|
|
Раствор 3 |
0,2 X 0,9 250 |
X 250 |
|
|
|
|
Составим уравнение с одним неизвестным:
|
|
|
С 3 |
m1 |
3 |
|
0,2 |
X 0,9 250 |
100 |
50 %. |
|||||||
|
|
|
|
|
|
100 |
|
|
|
|
|
|
|
||||
|
|
m 3 |
|
|
X 250 |
|
|||||||||||
Решим его относительно X: |
|
|
|
|
|
|
|||||||||||
|
X |
|
0,9 – 0,5 |
|
|
90 – 50 |
|
|
40 |
|
4 |
; 3X |
1000; |
X 333,3 г. |
|||
250 |
|
0,5 – 0,2 |
|
50 – 20 |
30 |
3 |
|||||||||||
|
|
|
|
|
|
||||||||||||
II способ. Задачитакоготипаможнорешитьспомощьюдиагональной схемы или «правила креста». В точке пересечения двух условных отрезков располагают концентрацию смеси двух растворов, слева располагают концентрации исходных растворов, справа – концентрации исходных растворов за вычетом концентрации полученной смеси:
(X г) 20 |
40 |
|
50 |
(250 г) 90 |
30 |
Далее составляют уравнение с одним неизвестным и решают его:
X |
|
40 |
; |
X |
1000 |
333,3 г. |
||
250 |
|
30 |
|
3 |
||||
|
|
|
||||||
6.1.10. Закон химических эквивалентов в химическом анализе
Закон химических эквивалентов лежит в основе объемного химическогоанализаводныхиневодныхрастворовразличныхвеществ. Если химическая реакция протекает в растворе, то независимо от вида реакции(ионообменная, гидролизилиокислительно-восстановительная) взаимодействие между веществами осуществляется в эквивалентных соотношениях:
nэ1 nэ2 , |
(6.14) |
6 4 |
6 5 |
V С |
н1 |
V C |
н2 |
или |
|
V1 |
|
Сн2 |
, |
(6.15) |
|
V |
|
С |
|
||||||||
1 |
2 |
|
|
н1 |
|||||||
|
|
|
|
|
2 |
|
|
|
|
||
где nэ1, nэ2 – количество эквивалентов анализируемого вещества (1) и реагента (2), с помощью которого осуществляется анализ; V1 и V2 – объемы растворов вещества (1) и вещества (2); Сн1 и Сн2 – эквивалентные (нормальные) концентрации реагирующих веществ. Из уравнения (6.15) следует, что объемы растворов реагирующих веществ обратно пропорциональны их эквивалентным концентрациям.
Пример 10. Для нейтрализации раствора, содержащего 2,25 г кислоты, потребовалось 25 мл 2 н. раствора щелочи. Определить эквивалентную массу кислоты.
Решение. Определим количество эквивалентов щелочи и кислоты, вступивших в реакцию нейтрализации:
nэ к nэ щ Сн щ V щ 2 моль/л 0,025 л 0,05 моль.
Определим эквивалентную массу кислоты:
mэ к |
m(к) |
|
2,25 г |
45 г/моль. |
nэ(к) |
|
0,05 моль |
||
|
|
|
||
|
|
ЗАДАЧИ |
|
|
6.1.Сколько граммовAlCl3 содержится в 0,5 л; 3 л, 5 л, 10 л 2 %-го раствора, если плотность раствора Υ = 1,016 г/см3.
Ответ: 10,16 г; 60,96 г; 101,6 г; 203,2 г.
6.2.Определить количество вещества и массу CuSO4, которые содержатся в 100 мл, 500 мл, 4 л, 6 л раствора с молярной концентрацией
0,2 моль/л.
Ответ: 0,02 моль (3,2 г); 0,1 моль (16 г); 0,8 моль (128 г); 1,2 моль (192 г).
6.3.Определить количество вещества и массу H3PO4, которые содержатся в 200 мл, 600 мл, 2 л, 8 л раствора с эквивалентной концентрацией 0,03 моль/л.
Ответ: 0,002 моль (0,196 г); 0,006 моль (0,588 г); 0,02 (1,96 г); 0,08 (7,84 г).
6.4.Вкакомобъемеводынужнорастворить5,85 гNaCl, чтобыприготовить растворы с моляльной концентрацией 1 моль/кг; 0,2 моль/кг; 0,8 моль/кг; 0,5 моль/кг. Плотность воды принять равной 1 г/см3.
Ответ: в 100 мл; 500 мл; 125 мл; 200 мл.
6.5.Сколько граммов этилового спирта C2H5OH потребуется добавить к 360 мл воды, чтобы мольная доля спирта в растворе составила 0,0005; 0,002; 0,01; 0,4. Плотность воды принять равной 1 г/см3.
Ответ: 0,46 г; 1,84 г; 9,29 г; 613 г.
6.6.При20 °Ссмешали0,7 лбензолаC6H6 и0,8 лтолуолаC6H5CH3. Вычислить мольные доли каждого из веществ в полученном растворе. Плотности бензола и толуола соответственно равны 0,879 г/см3
и0,867 г/см3.
Ответ: 0,511; 0,489.
6.7.Найтимассы водыи медногокупороса CuSO4 5H2O, необходимые для приготовления одного литра раствора, содержащего 8 % мас. безводной соли. Плотность приготовленного раствора равна
1,084 г/см3.
Ответ: 948,4 г, 135,6 г.
6.8.Какой объем 0,1 н. HNO3 можно приготовить из 0,7 л раствора HNO3 с массовой долей 30 % (Υ = 1,180 г/см3)?
Ответ: 39,3 л.
6.9.Какойобъемраствора сернойкислотыс массовойдолейH2SO4 30 % (Υ = 1,219 г/см3) можно приготовить из 12 кг раствора серной кислоты с массовой долей 60 %?
Ответ: 19,7 л.
6.10.Из 5 л раствора гидроксида калия с массовой долей KOH 50 % и плотностью 1,538 г/см3 надо приготовить раствор с массовой долей KOH 18 %. Какой объем воды необходимо добавить к исходному раствору?
Ответ: 13,67 л.
6.11.Какой объем 5 н. раствора NaOH можно приготовить из 4 л растворагидроксида натрияс массовойдолейNaOH 50 % (Υ = 1,525 г/см3)?
Ответ: 15,25 л.
6.12.Какой объем раствора гидроксида калия с массовой долей
KOH 24 % иплотностью 1,218 г/см3 можноприготовитьиз125 лраствора едкого кали с массовой долей KOH 48 % (Υ = 1,510 г/см3)?
Ответ: 310 л.
6.13.КакойобъемрастворасернойкислотысмассовойдолейH2SO4 96 % (Υ= 1,835 г/см3) нужно взять для приготовления 5 л 0,5 н. раствора
H2SO4?
Ответ: 69,5 мл.
6 6 |
6 7 |
6.14.К 0,5 л раствора серной кислоты с массовой долей 98 %
иплотностьюΥ = 1,837 г/см3 прибавлено 3 лводы. Какова массоваядоля
H2SO4 в полученном растворе?
Ответ: 23 %.
6.15.Какойобъемводынужноприбавитьк1 лрастворагидроксида калия с массовой долей 40 % и плотностью Υ = 1,411 г/см3, чтобы получить раствор с массовой долей KOH 18 %?
Ответ: 1,724 л.
6.16.Смешаны 0,8 л 1,5 н. раствора NaOH и 0,4 л 0,6 н. раствора NaOH. Какова молярная концентрация эквивалента полученного раствора? Изменениемобъемовприсмешивании растворовпренебречь.
Ответ: 1,2 н.
6.17.КакойобъемрастворасолянойкислотысмассовойдолейHCl в растворе 30 % (Υ = 1,149 г/см3) следует добавить к 5 л 0,5 н. раствора HCl дляполучения1 н. раствора? Изменениемобъемовприсмешивании растворов пренебречь.
Ответ: 0,296 л.
6.18.В каких массовых соотношениях надо смешать растворы
сернойкислотысмассовойдолейH2SO4 соответственно90 и6 %, чтобы приготовить раствор с массовой долей 30 %?
Ответ: 1:2,5.
6.19.В каких объемных соотношениях надо смешать соляную кислотусплотностьюΥ = 1,189 г/см3 иводудляприготовленияраствора, имеющего плотность Υ = 1,098 г/см3? Изменением объемов при смешивании растворов пренебречь.
Ответ: 1,08:1,00.
6.20.К0,8 лраствора гидроксида натрияс массовойдолейС= 30 %
иплотностью Υ = 1,328 г/см3 прибавлено 0,4 л раствора едкого натра с массовой долей 14 % и плотностью Υ = 1,153 г/см3. Определить плотность полученного раствора и массовую долю NaOH в нем. Изменением объемов при смешивании растворов пренебречь.
Ответ: 1,27 г/см3; 25 %.
6.21.Определить, в каких объемных соотношениях необходимо смешатьрастворыKOH плотностью1,100 и1,411 г/см3 дляприготовления раствора KOH плотностью 1,240 г/см3. Изменением объемов при смешивании растворов пренебречь.
Ответ: 1,2:1,0.
6.22.Какой объем воды и концентрированной серной кислоты
с плотностью Υ = 1,814 г/см3 надо смешать, чтобы приготовить 18 л
раствора H2SO4 с плотностьюΥ = 1,219 г/см3? Изменениемобъемовпри смешивании растворов пренебречь.
Ответ: 13,2 л; 4,8 л.
6.23.Какой объем 0,25 н. раствора H2SO4 можно нейтрализовать прибавлением 0,6 л 0,15 н. раствора Ca(OH)2?
Ответ: 0,36 л.
6.24.Какойобъемрастворасолянойкислоты, смассовойдолейHCl 4 % (Υ = 1,018 г/см3) необходимо прибавить к 0,5 л 0,02 н. раствора
AgNO3 для полного осажденияAg+ в видеAgCl?
Ответ: 9 мл.
6.25.Плотность раствора Na2CO3 равна 1,102 г/см3. Из 4 л этого раствора при действии соляной кислоты получено 66,6 л CO2 (н. у.). Вычислить массовую долю Na2CO3 в растворе.
Ответ: 7,15 %.
6.26.Какой объем 0,5 М Al2(SO4)3 требуется для реакции с 0,3 л 0,15 М Ba(NO3)2?
Ответ: 0,03 л.
6.27.Какой объем 0,20 н. раствора KOH требуется, чтобы осадить
ввидеFe(OH)3 всежелезо, содержащеесяв0,028 л1,4 н. раствораFeCl3?
Ответ: 0,196 л.
6.28.Какимобъемом4 н. раствораH2SO4 можнополностьюразложить 0,65 лрастворакарбонатакалия, плотностькоторого1,189 г/см3 смассовой
долей K2CO3 20 %? Какой объем займет выделившийся газ (н. у.)?
Ответ: 0,56 л; 25,1 л.
6.29.Какова была масса Al(OH)3, если для его растворения потребовалось 0,2 л раствора азотной кислоты с массовой долей 30 % и плотностью 1,180 г/см3? Какой минимальный объем 2,5 н. раствора KOH необходимозатратитьдлярастворенияэтогоколичествагидроксида алюминия?
Ответ: 29,12 г; 149 мл.
6.30.Рассчитать объем SO2 (н. у.), который можно получить при действии 0,05 л 0,85 н. раствора H2SO4 на раствор K2SO3.
Ответ: 0,476 л.
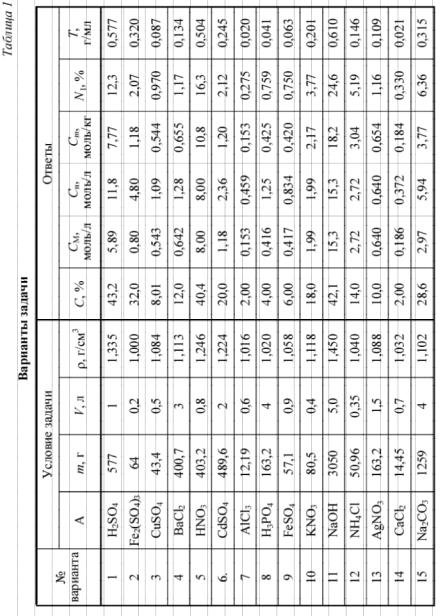
6.31.Водный раствор содержит m г вещества А в объеме V. ПлотностьраствораΥ. Вычислитьмассовуюдолю(%) веществаАврастворе, атакжемолярнуюконцентрацию, эквивалентнуюконцентрацию, моляльность раствора, мольную долю вещества А и титр раствора. (Варианты задачи представлены в табл. 1.)
6 8 |
6 9 |
6.2. Растворимость
Растворимостьювеществаназываютегоспособностьрастворяться
втом или ином растворителе. Растворимость определяется различием
вэнергии взаимодействия между молекулами в чистом растворяемом веществе и молекулами в чистом растворителе. При малых различиях
вэнергии межмолекулярного взаимодействия вещество обладает неограниченнойрастворимостью, вслучаезначительныхрасхожденийэтих величин наблюдается ограниченная растворимость вещества.
Следовательно, для любого растворяемого вещества в любом растворителе выполняется правило, установленное еще древними алхимиками: подобное растворяется в подобном.
Ограниченная растворимость вещества в выбранном растворителе зависит от температуры и давления. Увеличение концентрации растворяемого вещества при постоянной температуре и давлении приводит к состоянию «насыщения».
Насыщенным раствором называется раствор, в котором скорость растворения равна скорости кристаллизации (конденсации) растворенного вещества. Насыщенный раствор всегда находится в равновесии с чистым растворяемым веществом.
Мерой растворимости вещества при заданных температуре и давлении служит концентрация его насыщенного раствора.
6.2.1. Растворимость газов в жидкостях
Растворимость газов в жидкостях с повышением температуры уменьшается, так как увеличение кинетической энергии частиц приводитк тому, чтомолекулыгазалегче покидаютраствор, чемвозвращаются в него.
Зависимость растворимости газов от давления выражается закономГенри: призаданнойтемпературеконцентрациярастворенногогаза прямо пропорциональна его парциальному давлению:
Сi Кi Рi , |
(6.16) |
где Сi – концентрация газа в растворе; Рi – парциальное давление газа, т. е. давление, которое оказывал бы газ на стенки сосуда, если бы один
7 0 |
7 1 |

занимал весь объем; Кi – константа Генри, которая зависит от природы газаирастворителя, аеечисленноезначениеопределяетсявыборомединицизмерениядавленияиконцентрации. Представимконцентрациюгаза врастворе(Ci) отношениемколичествавеществавжидкомрастворе(niж) кобъемурастворителя(V), апарциальноедавлениегазавыразимизуравненияКлапейрона– Менделеевачерезегообъем(Vг) иколичествовещества в газовой фазе (niг):
|
|
|
|
С |
|
Θiж |
; |
Р |
|
Θiг R T |
. |
(6.17) |
||||
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
i |
V |
|
|
i |
|
|
Vг |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Тогда из уравнения (6.16) следует: |
|
|
|
|
|
|
|
|||||||||
iж |
Кi |
iг R T |
|
|
или |
Vг |
|
iг |
Кi R T |
(6.18) |
||||||
|
V |
|
|
Vг |
|
|
|
V |
|
|||||||
|
|
|
|
|
|
|
|
iж |
|
|||||||
Припостояннойтемпературе(T = const) идавлениимеждужидким раствором и газовой фазой устанавливается равновесие, т. е.
Θiг сonst,
Θiж
и, следовательно, отношение объема газа к объему жидкости, в которой газ растворен, является постоянной величиной.
Растворимость газов обычно выражают коэффициентом абсорбции, т. е. отношением объема газа к объему растворителя, в котором газ растворен:
Vг |
сonst приT сonst. |
|
V |
||
|
Пример 1. Определение массы газа в растворе по его растворимости. Сколько хлороводорода растворится в 100 л воды при 40 °С (313 К) и давлении 98625 Па, если растворимость HCl приэтойтемпературе составляет 386 м3 на 1 м3 воды?
Решение. Определим объем хлороводорода в 100 л воды:
x |
100 386 |
38,6 м3. |
||
|
1000 |
|||
|
|
|||
Молярная масса хлороводорода МHCl = 36,5 г/моль. По уравнению Клапейрона – Менделеева
|
|
|
|
P V |
М |
R T |
|
||
|
|
|
|
|
|
|
|||
|
|
|
|
|
m |
|
|
||
рассчитаем массу хлороводорода в 100 л воды: |
|
||||||||
m |
P V М |
|
98625 Па 38,6 м3 36,5 |
г/моль |
53422 г 53,4 кг. |
||||
R T |
8,31 |
Дж |
|
313 |
К |
||||
|
|
|
|||||||
|
|
моль К |
|
||||||
Пример2. Определениемассовойдолигазообразноговещества по коэффициенту абсорбции. Коэффициент абсорбции аммиака при 0 °С и Р= 1,01333 105 Паравен1300. ВычислитьмассовуюдолюNH3 врастворе.
Решение. Молярная масса аммиака равна 17 г/моль. Определим массу1300 м3 (1,3 106 л) аммиака, содержащегосяв1 м3 воды, учитывая, что объем одного моля любого газа при указанных в задаче условиях, составляет 22,4 л/моль:
mNH |
|
1,3 106 л 17 г/ моль |
986607 г 986,6 кг. |
|
3 |
|
22,4 л/моль |
||
|
|
|
||
Определим массу раствора, принимая массу 1 м3 воды за 1000 кг: mNH3 mH2O 986,6 кг 1000 кг 1986,6 кг.
Определим массовую долю аммиака в растворе:
986,6 кг |
|
СNH3 1986,6 кг |
100 % 49,7 %. |
Пример 3. Определение растворимости газовой смеси по коэффициентам абсорбции компонентов смеси. Газовая смесь содержит 21 % об. O2 и 79 % об. N2; коэффициенты абсорбции кислорода – 0,049 м3, азота– 0,0236 м3 на1 м3 водыпри0°С идавлении1,0133 105 Па. Определить коэффициент абсорбциигазовой смесив воде при указанных условиях и объемные доли газовой смеси, растворенной в воде.
Решение. Определим парциальное давление газов. Общее давление газовой смеси Р = 1,01333 105 Па = 1 атм. С учетом состава газовой смеси P(O2) = 0,21 атм, P(N2) = 0,79 атм.
Определим растворимость кислорода и азота в воде с учетом парциального давления, так как согласно закону Генри растворимость газа в жидкости прямо пропорциональна парциальному давлению:
7 2 |
7 3 |
V |
0,049 м3 0,21атм |
|
0,0103 м3 |
, |
|
1атм |
|||||
O2 |
|
|
|||
V |
0,0236 м3 0,79 атм |
0,0186 м3. |
|||
1атм |
|||||
N 2 |
|
|
|||
Определим растворимость газовой смеси в воде (коэффициент абсорбции):
V |
V |
V |
N2 |
0,0103 м3 |
0,0186 м3 |
0,029 м3. |
г |
O2 |
|
|
|
|
Определим объемные доли кислорода и азота в газовой смеси, растворенной в воде:
ΖобO2 |
VO2 |
|
0,0103 м3 |
100 % |
36 %, |
||
Vг |
|
0,029 м |
3 |
||||
|
|
|
|
|
|
||
ΖобN2 |
VN2 |
|
0,0186 м3 |
|
100 % |
64 %. |
|
Vг |
|
0,029 м |
3 |
|
|||
|
|
|
|
|
|
||
6.2.2. Растворимость жидкостей и твердых тел в жидкостях
Растворимостьтвердых тел вжидкостяхчащевсего с повышением температуры увеличивается. Это объясняется затратой значительного количества энергии на разрушение кристаллической решетки твердого тела.
Растворимость жидкостейв жидкостяхтакже увеличиваетсяс ростом температуры и выше некоторой температуры, которая называется критической температурой растворения, становится неограниченной.
Однако, еслиэнергиягидратации(сольватации) великаиобразование раствора сопровождается выделениемэнергии, растворимость с ростом температурыпонижается. Этонаблюдается, например, при растворении в воде щелочей, некоторых солей лития, магния, алюминия согласно схеме
Кристалл + Растворитель λ Насыщенный раствор ± Q.
Растворение жидкостей и твердых тел в жидкостях обычно не сопровождаетсязначительнымизменениемобъема, поэтомурастворимость
веществ, находящихся в жидком и твердом состоянии, практически не зависит от давления.
Растворимость твердых тел выражают коэффициентом растворимости – массой вещества в граммах, которую нужно растворить в 100 г растворителя при данной температуре для получения насыщенного раствора.
Пример 4. Определение растворимости вещества. Вычислить растворимость BaCl2 при 0 °С, если в 13,1 г раствора содержится 3,1 г безводной соли.
Решение. Определим массу растворителя в растворе: mH2O (13,1 3,1) г 10 г.
Рассчитаем коэффициент растворимости BaCl2 при 0 °С:
mBaCl |
2 |
100 г |
3,1г |
100 г 31г. |
m |
|
10 г |
||
|
|
|
||
H2O |
|
|
|
|
Пример 5. Определение массы растворенного вещества, кристаллизующегосяиз насыщенного раствора при его охлаждении. Какая масса соли выпадет в осадок из 540 г водного раствора AlCl3 при понижении температуры от 80 до 0 °С? Растворимость AlCl3 при 0 °С равна
44,9 г, а при 80 °С – 48,6 г.
Решение. Определиммассураствора(m), содержащую100 грастворителя, при указанных температурах:
при t = 0 °C m1 = (100 + 44,9) г = 144,9 г, при t = 80 °C m2 = (100 + 48,6) г = 148,6 г.
Определиммассусоли, котораявыпадаетвосадокприохлаждении 148,6 г раствора:
m = m2 – m1 = (148,6 – 144,9) г = 3,7 г.
Составим пропорцию и определим массу AlCl3, которая кристаллизуется при охлаждении 540 г раствора:
x |
m |
540 г |
3,7 г |
540 г 13,4 г. |
|
m |
148,9 г |
||||
|
|
|
|||
|
2 |
|
|
|
ЗАДАЧИ
6.32. Какой объем воды необходимо взять, чтобы полностью растворить 250 г хлора при 10 θС и давлении 1,5 105 Па? Коэффициент
7 4 |
7 5 |
абсорбциихлора составляет при10 θСидавлении1,0133 105 Па 3,148 м3 |
6.41. Коэффициент растворимости CaCl в воде при 100 °С равен |
||
на 1 м3 воды. |
|
2 |
|
159 г на 100 г H O. Какая масса хлорида кальция при этой температуре |
|||
|
Ответ: 17,5 л. |
2 |
|
|
содержится в 2 кг раствора? |
|
|
|
6.33. Растворимость сероводорода при20 °Сидавлении 1,0133 105 |
Ответ: 1228 г. |
|
Па равна 2,91 л на 1 л воды. Вычислить массовую долю H2S в растворе. |
6.42. Вычислить массовую долю K2SO4 и его коэффициент раство- |
||
|
Ответ: 0,41 %. |
римости, если при 0 °С 50 г раствора содержат 3,44 г сульфата калия. |
|
|
6.34. КоэффициентабсорбцииCO2 при20 °Сравен0,878. Подкаким |
Ответ: 6,9 %; 7,4 г в 100 г воды. |
|
давлениемдолженнаходитьсядиоксидуглерода, чтобыприрастворении |
6.43. Определить массовую долю CoCl2 и растворимость хлорида |
||
его в воде получить раствор с массовой долей CO2 1 %? |
кобальта, если 500 г раствора при 20 °С содержат 173 г соли. |
||
|
Ответ: 6,3 105 Па. |
Ответ: 34,6 %; 52,9 г в 100 г воды. |
|
|
6.35. В 0,05 л воды растворено 4,9 л хлороводорода при 18 °С |
6.44. Растворимость CuSO |
при 20 и 100 °С равна соответственно |
и1,0 105 Па. Определитьмассовуюдолю(%) HCl вполученномрастворе. |
20,2 и 77 г. Какая масса сульфата4 |
меди выпадет в осадок, если охладить |
|
|
Ответ: 13 %. |
825 г раствора от 100 до 20 °С? |
|
|
6.36. Коэффициентабсорбцииводородавводепри30 °Ссоставляет |
Ответ: 264,7 г. |
|
0,017. Каковамассоваядоля(%) водородаврастворепри30 °Сидавлении |
6.45. Определить массу карбоната калия, выпавшего в осадок из |
||
96500 Па? |
770 г насыщенного при 100 °С раствора, если его охладить до 0 °С. |
||
|
Ответ: 0,13 %. |
Коэффициент растворимости K2CO3 при 100 °С составляет 155 г, а при |
|
|
6.37. Газовую смесь, состоящую из 40 % об. водорода и 60 % об. |
0 °С – 111 г. |
|
диоксидауглерода, раствориливводепри10 °Сидавлении1,0133 105 Па. |
Ответ: 132,9 г. |
|
|
Определить коэффициент абсорбции газовой смеси и объемные доли |
6.46. При охлаждении насыщенного при 90 °С раствора до 25 °С |
||
H2 |
и CO2 в смеси, растворенной в воде. Коэффициенты абсорбции |
выкристаллизовалось 200 г соли. Определить массу воды и соли в |
|
H2 |
и CO2 соответственно равны 0,0199 и 1,194. |
исходномрастворе, есликоэффициентырастворимостиравны42,7 и6,9 г |
|
|
Ответ: 0,724; H2 – 1 %, CO2 – 99 %. |
при температурах 90 и 25 °С соответственно. |
|
|
6.38. Температураповерхностногослояводоемаизменяетсявдневное |
Ответ: 556,8 г; 237,8 г. |
|
время суток от 10 до 20 °С. Какой объем кислорода выделится из поверхностного слоя толщиной 10 см, если площадь водоема 500 м2? Коэффициентыабсорбциикислородапри10 и20 °Ссоответственноравны 0,038 и 0,031. Содержание кислорода в воздухе принять равным 22 % об.
Ответ: 0,077 м3.
6.39.Растворимость диоксида углерода в воде при 0 °С и давлении
1,0133 105 Па равна 1,713 м3 на 1 м3 воды. Какова масса CO2, содержащегосяв25 лH2O, приэтойтемпературеидавлении0,745 105 Па?
Ответ: 61,84 г.
6.40.Вычислить растворимость Ba(NO3)2 в воде при 20 °С, если
в545 г раствора этого вещества в воде при указанной температуре содержится 45 г нитрата бария.
Ответ: 9 г в 100 г воды.
7 6 |
7 7 |

Раздел 7. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ. СВОЙСТВА РАСТВОРОВ ЭЛЕКТРОЛИТОВ
Электролитами называются вещества, которые в расплавленном или в растворенном состоянии проводят электрический ток. К электролитам относятся вещества, в которых атомы связаны сильной полярной или ионной химической связью (кислоты, основания, соли). Молекулы электролита в воде или в другой полярной среде, характеризующейся большой диэлектрическойпроницаемостью, распадаются на ионы – положительные (катионы) К+ и отрицательные (анионы) А–. Именно ионы переносят электрический ток в растворах. Электролитическая диссоциация в растворе происходит в результате сложного физико-химического взаимодействия молекул электролита с полярными молекулами растворителя. В итоге за счет суммарной тепловой энергии диполей воды (Е | kT) происходит разрыв ионной связи в электролите.
Электролитическая диссоциация полярных молекул (К+А–)
в растворе происходит вследствие ослабления ионной связи, вызванного действием полярных молекул растворителя:
К+А– + n H |
O l К+ (H O) |
+ А– (H O) |
a |
(7.1) |
2 |
2 k |
2 |
|
NaClкр + n H2Oж l NaClр-р l Na+ (H2O)k + Cl– (H2O)a,
где k и а – число молекул растворителя в гидратной оболочке.
Числа k и а называются числами гидратации. Число гидратации зависит от заряда иона, его размера и температуры раствора.
Например, в табл. 2 приведены для катионов щелочных металлов числа гидратации.
Таблица2
Числагидратациидлящелочныхметаллов
Ион |
Li |
Na |
K |
Rb |
Cs |
Число гидратации |
120 |
66 |
16 |
14 |
13 |
На процесс диссоциации влияет диэлектрическая проницаемость растворителя H, что видно из формулы Кулона:
F |
e |
1 |
e |
2 |
, |
(7.2) |
|
H r2 |
|||||||
|
|
|
|||||
гдеF – силавзаимодействиямеждузарядами ē1, ē2 ; r – расстояниемежду центрами ионов; H – диэлектрическая проницаемость растворителя. Например, для воды (табл. 3) H = 80 при 20 °С, тогда сила притяжения ионов по закону Кулона в водных растворах ослабляется в 80 раз и поэтому ионы эффективно распределяются в системе.
|
Таблица3 |
Диэлектрическаяпроницаемостьнекоторыхрастворителей |
|
|
|
Наименование вещества |
Диэлектрическая проницаемость Η при 20 θС |
Бензол |
2,28 |
Циклогексан |
2,05 |
Нитробензол |
36,1 |
Хлорбензол |
5,94 |
о-Крезол |
5,8 |
Этиловый спирт |
26,8 |
Метиловый спирт |
33,1 |
Глицерин |
43,0 |
Вода |
80,0 |
Лед |
75,0 ( 20 θС) |
Воздух |
1,0 |
7.1. Энергетика процесса гидратации
Гидратацию можно условно разделить на два составляющих процесса, которые протекают одновременно: разрыв связи в растворенном веществе (эндотермический процесс) и образование гидратов (экзотермический процесс).
Процесс гидратации ионов сопровождается выделением теплоты, которая называется теплотой гидратации соответственно соединения 'HKA, катиона 'HK и аниона 'HA:
'HKA = 'HK + 'HA. |
(7.3) |
Пример 1. Определить теплоту гидратации моля NaCl.
Решение.
'HNaCl |
'H |
'H |
422,6 351,5 774,1 кДж/моль. |
|
Na |
Cl |
|
7 8 |
7 9 |
