вариан 1
.doc
Реакция Коновалова. Алканы вступают в реакцию с азотной кислотой при нагревании (нитрование):
CH3—CH2—CH2 │
CH2—CH3 t CH3—CH2—CH—NO2 │
CH2—CH3
+
HNO3 +
Н2О

пентан 3-нитропентан
Из галогенпроизводных (Реакция Мейера).
t CH3—CH2—CH—
Br │
CH2—CH3 CH3—CH2—CH—NO2 │
CH2—CH3
+
AgNO2 +
AgBr↓

3-бромпентан 3-нитропентан
Свойства 3-нитропентана:
а) Первичные и вторичные нитросоединения растворимы в щелочах с образованием солей. Благодаря наличию нитрогруппы атомы водорода в нитрометане подвижны, могут отщепляться в растворе при действии оснований (pKa = 10,2). Взаимодействие 3-нитропентана с NаОН:
CH3—CH2—CH—NO2 │
CH2—CH3
ОNа
│ CH3—CH2—CH—N=О
│
CH2—CH3
t
+
NаОН

3-нитропентан
б) Вторичные нитросоединения реагируют с азотистой кислотой с образованием нитрозонитросоединений (псевдонитролов). Взаимодействие 3-нитропентана с НNO2:
C2H5—CH—NO2 │
CH2—CH3
N=O │ C2H5—C—NO2 │
CH2—CH3 t
+
НNO2

в) Первичные и вторичные нитросоединения конденсируются с альдегидами, образуя нитроспирты.
CH3—CН—ОН
│ (CH3)2—CН—CН2—C—NO2
│
CH2—CH3
C2H5—CH—NO2 │
CH2—CH3 t
CH3 │ CH3—CH—CH=О
+

3-нитропентан 5-метил-3-этил-3-нитрогексанол
№4
C2H5—CH—NH2 │
CH2—CH3
3-аминопентан
Получение.
Восстановление железом:
C2H5—CH—NO2 │
CH2—CH3 t
C2H5—CH—NH2 │
CH2—CH3
+
9Fe + 4H2O
4
+
3Fe3O4
4

3-нитропентан 3-аминопентан
Восстановление водородом в присутствии катализатора и при высокой температуре:
C2H5—CH—NO2 │
CH2—CH3 t
C2H5—CH—NH2 │
CH2—CH3
+
3H2
+
2H2O

3-нитропентан 3-аминопентан
Основной способ получения аминов — алкилирование аммиака, которое происходит при нагревании алкилгалогенидов с аммиаком под давлением.
C2H5—CH—Сl │
CH2—CH3 +
2NН3 +
NH4Cl
C2H5—CH—NH2 │
CH2—CH3 t,
р

3-хлорпентан 3-аминопентан
При избытке алкилгалогенида полученный первичный амин также может вступать в реакцию алкилирования, превращаясь во вторичный или третичный амин, например:
CH3—CH—Сl │ CH3
C2H5—CH—NH2 │
CH2—CH3
C2H5—CH—NH—CH—(CH3)2 │
CH2—CH3 t,
р
+
-
HCl

3-аминопентан 2-хлорпропан вторпентилизопропиламин
Практически в таких реакциях получается смесь солей первичного, вторичного и третичного аминов, из которой амины выделяют под действием щелочи и разделяют путем перегонки.
Свойства 3-аминопентана
Амины, являясь производными аммиака, имеют сходное с ним строение и проявляют подобные ему свойства. Для них также характерно образование донорно-акцепторной связи. Азот предоставляет неподеленную электронную пару, исполняя роль донора. В качестве акцептора электоронов может выступать, например, протон Н+, образуя ион R3NH+. Возникшая ковалентная связь N-H полностью эквивалентна остальным связям N-H в амине.
а) Амины присоединяют галогеналканы RCl, с образованием донорно-акцепторной связи N-R, которая также эквивалентна уже имеющимся.
t
C2H5—CH—NH2 │
CH2—CH3
C2H5—CH—NH—CH3 │
CH2—CH3
+
CH3Сl
-
HCl
3-аминопентан метилилизопропиламин
б) Первичные и вторичные амины взаимодействуют с азотистой кислотой различным образом. При помощи азотистой кислоты первичные, вторичные и третичные амины отличают друг от друга. Из первичных аминов образуются первичные спирты. Вторичные амины с азотистой кислотой дают N-нитрозамины — маслянистые жидкости с характерным запахом.
t
C2H5—CH—NH2 │
CH2—CH3
C2H5—CH—ОН │
CH2—CH3
+
НNO2
+
N2
+ Н2О
3-аминопентан пентан-3-ол
в) Взаимодействуя с кислотами, амины образуют алкиламмониевые соли, в большинстве случаев растворимые в воде. Например, амины присоединяют галогеноводороды:
t
C2H5—CH—NH2 │
CH2—CH3
+
НCl
[(C2H5)2—CH—NH3]Cl

г) Ацилирование. При нагревании с карбоновыми кислотами, их ангидридами, хлорангидридами или сложными эфирами первичные и вторичные амины ацилируются с образованием N-замещенных амидов, соединений с фрагментом —С(О)N<:
Реакция с ангидридами протекает в мягких условиях. Ещё легче реагируют хлорангидриды, реакция проводится в присутствии основания, чтобы связать образующийся HCl.
t
C2H5—CH—NH2 │
CH2—CH3
C2H5—CH—NН—CH=O │
│ CH3—
CH2
CH3
CH3—C=O +
│ Cl
+
НCl

№5
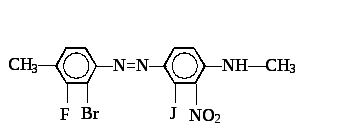
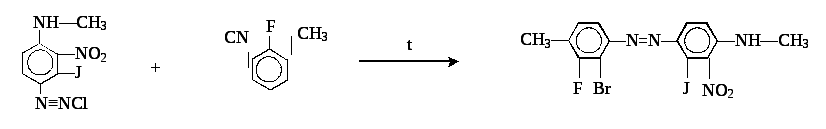
Для получения данного соединения разделим его пока на две составные части:

▲ Получение
1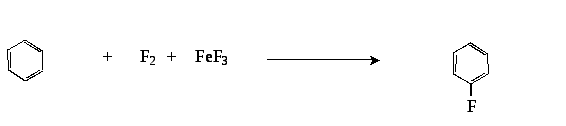 .
При взаимодействии бензола со фтором
(в присутствии катализатора FеF3)
атом водорода замещается атомом фтора:
.
При взаимодействии бензола со фтором
(в присутствии катализатора FеF3)
атом водорода замещается атомом фтора:
фторбензол
2. При взаимодействии фторбензола с хлорцианом в присутствии хлорида алюминия образуется о-фторбензонитрил:
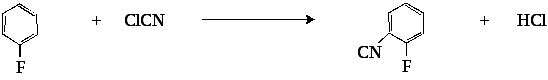
о-фторбензонитрил
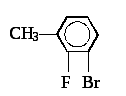
3. В молекуле о-фторбензонитрила оба заместителя замедляют реакцию электрофильного замещения алкильной группой. Фтор ориентирует алкильную группу в орто- и пара- положения относительно себя, тогда как нитрильная группа в мета- положение. Реакция Фриделя-Крафтся-Густавсона - в молекуле фторбензонитрила можно заместить атом водорода на алкильный радикал действием галогенопроизводных углеводородов в присутствии хлорида алюминия (замещение идет преимущественно в орто- положение):
СН3Cl + AlCl3 → СН\s\up 11(+ + [AICl4]−
СН\s\up 11(+ + C6H6 → C6H5–СН3 + H+
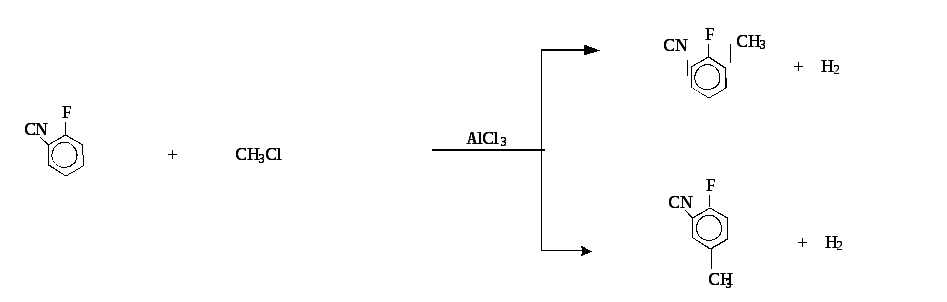
2-метил-6-цианофторбензол и 4-метил-6-цианофторбензол
▲ Получение
Получение
1. Нитрование ароматических систем азотной кислотой в присутствии серной кислоты с получением нитросоединений:
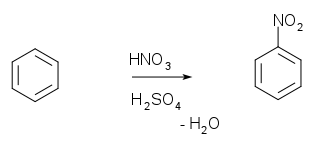
нитробензол
2. Реакция Зинина — удобный способ получения ароматических аминов при восстановлении ароматических нитросоединений. В качестве восстановителей используются: H2 (на катализаторе). Иногда водород генерируют непосредственно в момент реакции, для чего обрабатывают металлы (цинк, железо) разбавленной кислотой.
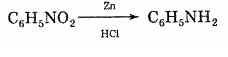
3. Присоединение алкилгалогенидов Амины присоединяют галогеналканы с образованием соли:
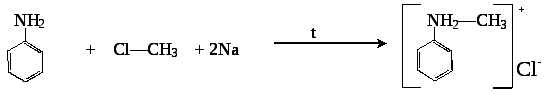
хлорид метилфениламина
Обрабатывая получившуюся соль щелочью, можно получить свободный амин:
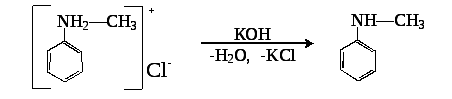
метилфениламин
4. Нитрование ароматических систем азотной кислотой в присутствии серной кислоты с получением нитросоединений (H2SO4 используется как водоотнимающий агент):
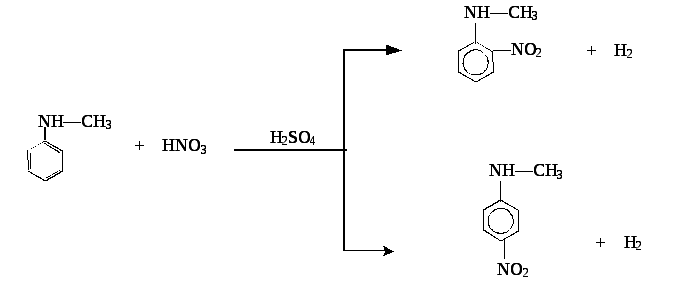
о-нитрометилфениламин и п-нитрометилфениламин
5. В молекуле о-нитрометилфениламина можно заменить атом водорода на алкильный радикал действием галогенопроизводных углеводородов в присутствии хлорида алюминия, в данном случае алкильная группировка может также пойти как в орто так и в пара-положение относительно амино-группы так как нитро- и амино- группы действуют синхронно:
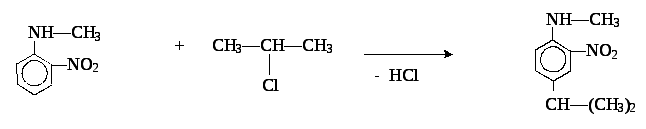
4-изопропил-2-нитрометилфениламин
4. При каталитическом окислении 4-изопропил-2-нитрометилфениламина кислородом воздуха образуются 2-гидрокси-3-карбокси-4-фтортолуол и ацетон:
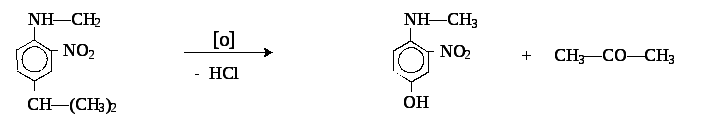
4-гидрокси-2-нитрометилфениламин
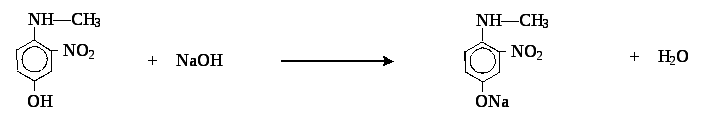
5. Если через 4-гидрокси-2-нитрометилфениламин пропустить щелочь, то образуется:
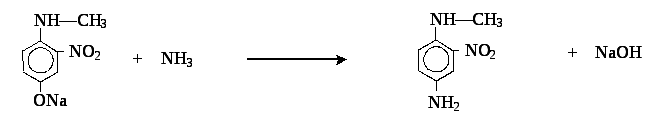
6. Далее, простой эфир фенола легко реагирует с аммиаком:
7. Образование ароматического диазосоединения. Обычно при диазотировании пользуются NaNO2 в присутствии избытка неорганической кислоты:
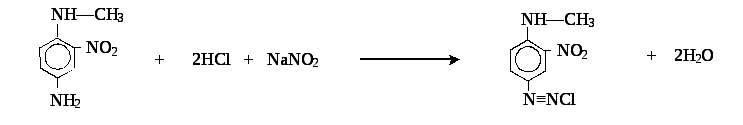
На самом деле в реакции используют не стехиометрические количества HCl, а трехкратный избыток на моль амина - один моль кислоты идет на образование нитрозоацидий катиона ON-OH\s\up 10(+ , один моль - на образование диазотирующей частицы NOCl, третий моль HCl - на получение хлористой соли диазония R—N≡NCl.
8. При взаимодействии с йодом и йодноватой кислотой при 2000С атом водорода может замещаться атомом йода в трех местах в виду разнонаправленной ориентации предыдущих заместителей:

▲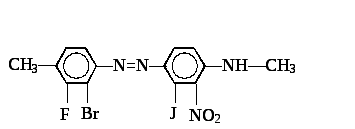 Получение
Получение
Реакции сочетания с ароматическими соединениями, содержащими подвижный атом водорода. При этом отщепляется хлористый водород и образуется устойчивое окрашенное азосоединение: