
- •Тема : скорость химических реакций и химическое равновесие
- •Тема : растворы
- •Тема: окислительно-восстановительные
- •Получение кислорода и сжигание в нём веществ
- •Влияние среды на протекание окислительно - восстановительных процессов
- •Определение электродных потенциалов. Направление окислительно-восстановительных процессов
- •Электролиз водных растворов
- •Галогены
- •Опыт 7. Восстановительные свойства галогеноводородов и галид- ионов.
- •Соединение азота. Свойства
- •Фосфор и его свойства
- •Опыт 2. Соли фосфорной ортокислоты
- •Сера и ее свойства Опыт1. Аллотропия серы
- •Опыт 2. Получение диоксида серы и сернистой кислоты
- •Опыт 6 Теосерная кислота и теосульфаты
- •Приложение
Электролиз водных растворов
Описанные ниже опыты проводят в приборе, представленным на рисунке.
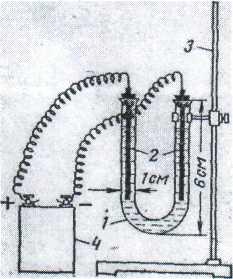
Рисунок - Прибор для электролиза
Электролизером является U-образная трубка 1; ее закрепляют в штативе 3. Электроды 2 представляют собой графит, вынутый из карандаша (графитовые электроды), или проволочки из соответствующих металлов (металлические электроды), вставленные в каучуковые пробочки. Пробки в электролизер вставляются неплотно. Источником тока служит батарейка 4 карманного электрического фонаря. Во всех опытах электролизер заполняют электролитом на Vg его объема. Электроды перед каждым опытом тщательно промывают дистиллированной водой.
а) Электролиз раствора хлорида олова (II)
Выполнение работы. Заполнить электролизер раствором хлорида олова (II). В оба колена электролизера опустить графитовые электроды и соединить их медными проволоками с электрической батарейкой. Наблюдать на катоде появление блестящих кристалликов металлического олова. Окисление или восстановление олова происходит на катоде? Написать уравнение катодного процесса. Доказать образование свободного хлора на аноде, для чего через 4—5 мин, пропускания электрического тока вынуть анод из электролизера, прибавить в анодное пространство по 3—4 капли растворов иодида калия и крахмала и наблюдать появление синего окрашивания. Написать уравнение анодного процесса.
б) Электролиз раствора иодида калия
Выполнение работы. В коническую пробирку налить на 3/4 ее объема раствор иодида калия и добавить по 5-6 капель фенолфталеина и крахмала. Раствор перемешать и вылить в электролизер. Опустить в него графитовые электроды и присоединить их к батарейке.
Отметить изменение цвета раствора около катода и анода. Написать уравнение катодного и анодного процессов. Почему окрасились растворы в катодном и анодном пространствах? Окисление или восстановление иода произошло на аноде?
в) Электролиз раствора сульфата натрия
Выполнение работы. В стакане, объемом 100 мл смешать раствор сульфата натрия с нейтральным раствором лакмуса и вылить полученный раствор в электролизер. Пропустить через раствор электрический ток и отметить изменение окраски в обоих коленах электролизера. Написать уравнения катодного и анодного процессов, протекающих при электролизе сульфата натрия. Какие вещества выделяются на катоде и на аноде? Объяснить изменение окраски лакмуса в катодном и анодном пространствах.
г) Электролиз водных растворов солей с растворимыми анодами
Выполнение работы. Налить в электролизер 0,5 н. раствор сульфата меди, опустить в него графитовые электроды и пропустить через раствор электрический ток. Через несколько минут прекратить электролиз и отметить на катоде красный налет меди. Написать уравнения катодного и анодного процессов. Какой газ в небольших количествах выделяется на аноде?
Не отключая электролизер от батарейки, поменять местами электроды в коленах электролизера, вследствие чего электрод, покрывшийся вначале медью, окажется анодом. Снова пропустить электрический ток. Что происходит с медью на аноде? Какое вещество выделяется на катоде? Написать уравнения катодного и анодного процессов, протекающих при электролизе сульфата меди с медным анодом.
Провести аналогичный опыт с 0,5 н. раствором сульфата никеля (II). Что выделяется на катоде? Написать уравнение катодного восстановления никеля. Какое вещество окисляется на аноде при электролизе сульфата никеля с угольным анодом? С никелевым анодом? Написать уравнения соответствующих анодных процессов.
ТЕМА: КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Опыт 1. Получение и свойства некоторых аммиакатов
Выполнение работы. Налить в коническую пробирку 10-12 капель раствора медного купороса, после чего добавлять по каплям концентрированный раствор аммиака, встряхивая каждый раз пробирку для лучшего перемешивания её содержимого. В ходе опыта обратить внимание на первоначальное образование осадка основной соли – сульфата гидроксомеди (׀׀), отметив его цвет, а также на последующее растворение полученного осадка в избытке аммиака и окрашенного (в какой цвет?) раствора. Какой состав образующегося при этом иона?
Разбавить раствор приблизительно равным объёмом спирта и отцентрифуговать образовавшиеся при этом кристаллы [Сu(NH3)4]SO4 ·H2O – комплексного соединения, растворимость которого в спиртоводной смеси значительно меньше, чем в воде. Слить раствор с осадка и испытать отношение осадка к раствору любой кислоты – серной, азотной, соляной и др. Как и почему изменяется при этом окраска раствора?
Написать уравнения всех реакций, проведённых в этом опыте.
Опыт 2. Исследование тетрааминкупро(׀׀) сульфата
Выполнение работы. Часть вещества растворить в пробирке в небольшом количестве воды, добавить к раствору несколько капель концентрированного раствора аммиака. Сравнить полученный раствор с раствором исходного вещества – медного купороса, есть ли между ними разница?
В четыре пронумерованные пробирки внести пипеткой по 10 капель исследуемого раствора комплексной соли.
а) Проба на ион Cu2+ действием щёлочи. В пробирку №1 добавить несколько капель 0,1 н раствора щёлочи. Наблюдается ли выпадение осадка?
б) Проба на ион Cu2+ действием сульфида натрия. В пробирку №2 добавить несколько капель раствора Na2S. Наблюдается ли выпадение осадка?
в) Проба на ион SO42- . В пробирку №3 добавить несколько капель раствора BaCl2 и дать отстояться.
г) В Пробирку №4 по каплям добавить раствор 2н серной кислоты, наблюдать изменение окраски. После этого, добавляя по каплям раствор 30% щелочи, попытаться осадить ион меди в виде гидроксида.
ТЕМА: ХИМИЯ ЭЛЕМЕНТОВ
