
- •Раздел 1 основные классы неорганических соединений Теоретическая часть
- •1. Основные понятия химии
- •Состав атома
- •3. Основные классы неорганических соединений
- •Основания
- •Различия в определении кислот и оснований
- •Амфотерные гидроксиды
- •Кислоты
- •Наименование важнейших кислот и их солей
- •4. Генетическая связь основных классов неорганических соединений
- •Лабораторная работа
- •Вопросы для самоконтроля
- •Упражнения
- •Определение молярной массы эквивалента металла
- •Теоретическая часть
Определение молярной массы эквивалента металла
Цель работы: усвоить понятия химического эквивалента, молярной массы эквивалента, закона эквивалентов; ознакомиться с экспериментальным определением молярной массы эквивалента металла методом вытеснения водорода из кислоты.
Теоретическая часть
Известно, что количество вещества определяется числом структурных единиц (атомов, молекул, ионов) этого вещества и выражается в молях.
Моль ()– это единица количества вещества, содержащая столько же структурных единиц данного вещества, сколько атомов содержится в 0,012 кг углерода, состоящего только из изотопа12С.
Молярная масса (М) вещества представляет собой отношение массы вещества (m) к его количеству (), а значение молярной массы численно совпадает с относительной молекулярной массой вещества или относительной атомной массой элемента, но измеряется в г/моль.
Эквивалентом вещества (э), вступающего в какую-либо реакцию, называют такое его количество, которое приходится на единицу валентности соответствующего элемента при образовании им соединения.
Химический эквивалент и молярная масса эквивалента представляют собой важнейшие характеристики элементов, простых и сложных веществ, учитывая то, что согласно закону эквивалентов все вещества взаимодействуют между собой в эквивалентных количествах.
Единицей химического эквивалента (э), так же как и количества вещества является моль, а молярная масса эквивалента (Мэ), соответственно измеряется в г/моль.
Так, водород в своих соединениях, как правило, одновалентен, и его эквивалент равен 1 моль Н или 1/2 моль Н2, а молярная масса его эквивалента Мэ(Н) = 1 г/моль.
Кислород в своих соединениях двухвалентен, тогда его эквивалент равен 1/2 моль О или 1/4 моль О2, а молярная масса его эквивалента Мэ(О) = 8 г/моль.
Железо в своих соединениях может быть и двух-, и трехвалентным, тогда его эквивалент в первом случае будет равен 1/2 моль Fe, а молярная масса эквивалента Мэ(Fe) = 28 г/моль. Эквивалент железа во втором случае будет равен 1/3 моль Fe, а молярная масса эквивалента Мэ(Fe) = 18,6 г/моль. Следовательно, молярную массу эквивалента простого вещества можно рассчитать по формуле:
![]() , (1)
, (1)
где М(эл-та) – молярная масса элемента; В(эл-та) – валентность элемента.
Молярные массы эквивалентов сложных веществ (оксидов, кислот, оснований, солей) рассчитываются несколько иначе.
Молярная масса эквивалента оксида рассчитывается отношением молярной массы оксида к произведению числа атомов элемента на его валентность.
![]() ,
,
где М(оксида) – молярная масса оксида; n(эл-та) – число атомов элемента; В(эл-та) – валентность элемента.
Для оксида железа (Ш), например, молярная масса его будет равна:
![]()
Молярная масса эквивалента кислотырассчитывается отношением молярной массы кислоты к числу атомов водорода в кислоте, способных замещаться в химических реакциях.
![]() ,
,
где М (кислоты) – молярная масса кислоты; n (H) – число замещающихся в химической реакции атомов водорода.
Для серной кислоты (H2SO4), например, молярная масса эквивалента будет равна:
![]()
Молярная масса эквивалента основания рассчитывается отношением молярной массы основания к числу гидроксогрупп.
![]() ,
,
где М (основания) – молярная масса основания; n (OH) – число гидроксогрупп.
Для гидроксида кальция (Ca(OH)2), например, молярная масса эквивалента будет равна:
![]()
Молярная масса эквивалента соли рассчитывается отношением молярной массы соли к произведению числа атомов металла на их валентность.
![]() ,
,
где М (соли) – молярная масса соли; n (Ме) – число атомов металла; В (Ме) – валентность металла.
Для сульфата натрия (Na2SO4), например, молярная масса эквивалента будет равна:
![]()
Из закона эквивалентов следует, что массы вступающих и образующихся в результате реакции веществ прямопропорциональны молярным массам их эквивалентов:
![]() , (2)
, (2)
где m(1) и Мэ(1) – масса и молярная масса эквивалента первого вещества; m(2) и Мэ(2) – масса и молярная масса эквивалента второго вещества.
Из следствия из закона Авогадро вытекает понятие молярный объем - объем, который занимает 1 моль любого газа при нормальных условиях, т.е. при р = 105 Па (1 атм или 760 мм рт. ст.) и Т = 273 К ( 0о С). Значение этого объема равно 22,4 л/моль (22400 мл/моль). Отсюда можно вывести понятие и молярного объема эквивалента газа (или эквивалентного объема) – объема, занимаемого при нормальных условиях одним эквивалентом (одной молярной массой эквивалента) газа.
Известно, что эквивалент водорода равен 1/2 моль Н2, тогда молярный объем эквивалента водорода Vэ(Н2) = 11,2 л/моль; соответственно Vэ(О2) = 5,6 л/моль, т.к. эквивалент кислорода равен 1/4 моль О2.
Если же в реакции участвуют газы и известны их объемы, то соотношение (2) можно представить следующим образом:
![]() (3)
(3)
где m(1) и Мэ(1) – масса и молярная масса эквивалента первого вещества; V(2) и Vэ(2) – объем и молярный объем эквивалента второго вещества.
Следует иметь ввиду, что объемы, входящие в соотношение (3), нужно приводить к нормальным условиям по формуле объединенного закона Гей-Люссака – Бойля –Мариотта:
![]() ,
откуда
,
откуда![]() (4)
(4)
где р, V, Т – давление, объем и температура газа при условиях опыта; ро, Vо, То – давление, объем и температура газа при нормальных условиях.
Известны методы экспериментального определения молярных масс эквивалентов: 1) метод прямого определения – молярную массу эквивалента определяют по данным прямого синтеза кислородного или водородного соединения данного элемента; 2) аналитический метод – производится точный анализ соединения данного элемента с любым другим, молярная масса эквивалента которого известна; 3) метод вытеснения водорода - используется для определения молярной массы эквивалента тех металлов, которые способны вытеснить водород из разбавленных кислот и щелочей; 4) электрохимический метод – определяется масса металла, осаждающегося на электроде при электролизе раствора соли этого металла. Молярная масса эквивалента рассчитывается по закону Фарадея: при прохождении через раствор или расплав электролита 965000 Кулонов электричества на электродах выделяется по одному эквиваленту вещества.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Сущность экспериментального определения молярной массы эквивалента металла заключается в определении объема водорода (приведенного к нормальным условиям), вытесняемого из кислоты навеской металла, взятой на аналитических весах.
Произведением молярной массы эквивалента металла на его валентность определяют молярную массу атома металла.
По молярной массе атома металла и его валентности находят местоположение металла в периодической системе элементов Д.И.Менделеева, т.е. его название.
По указанию преподавателя студент взвешивает на аналитических весах навеску металла известной валентности.
Прибор для определения молярной массы эквивалента изображен на рисунке.
П
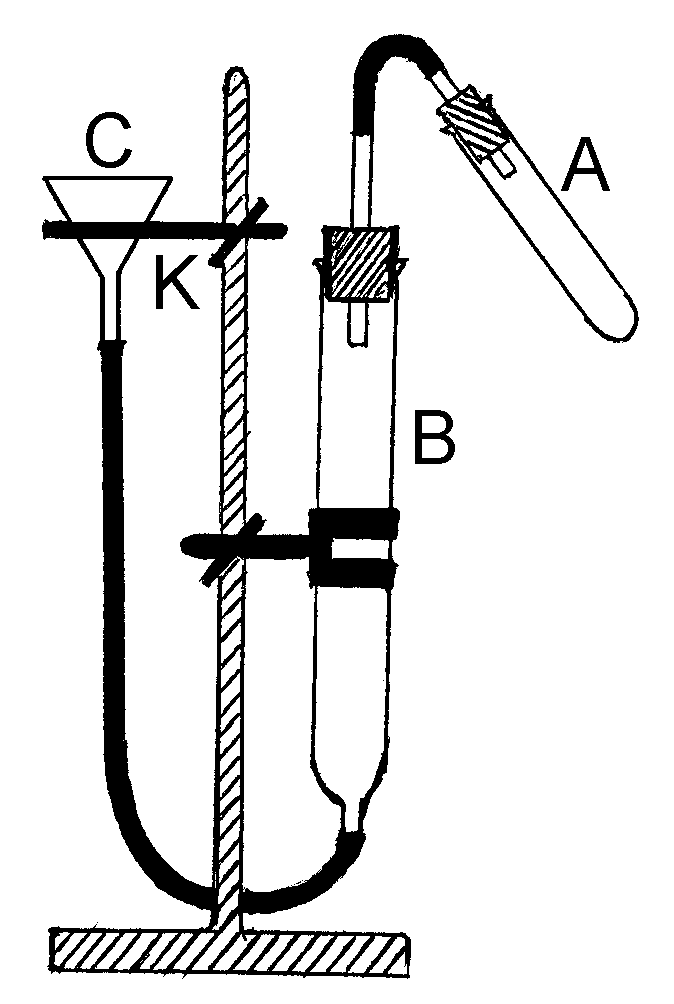
Убедившись в герметичности прибора, отсоединяют пробирку А от прибора и, записав начальный уровень воды в бюретке В, наливают в пробирку А 1/4 ее объема соляной кислоты, приготовленной для определения молярной массы эквивалента металла соответствующей валентности.
Держа пробирку А в положении, близком к горизонтальному, помещают на сухое место у отверстия пробирки взвешенный металл и в таком положении соединяют пробирку А с бюреткой В, следя за тем, чтобы металл не упал в кислоту.
Убедившись вторично в герметичности прибора путем поднятия воронки С вверх, стряхивают металл в кислоту и наблюдают за ходом реакции.
По окончании реакции (прекращение выделения пузырьков водорода), устанавливают уровень воды в бюретке В и воронке С на одной высоте, перемещая кольцо К с воронкой С вниз по штативу, и записывают уровень воды в бюретке В после окончания опыта. Шкала бюретки В проградуирована в миллилитрах (мл).
С помощью барометра определяют величину атмосферного давления ( ратм ), термометра – температуру ( t ) воздуха в помещении (соответственно и температуру воды в приборе) в момент проведения опыта.
С помощью таблицы 1 определяют давление водяного пара ( рН2Опар ), соответствующего измеренной температуре опыта, в мм рт.ст.
Таблица 1
Зависимость давления водяного пара от температуры
|
t , оС |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
|
рН2Опар |
12,8 |
13,6 |
14,5 |
15,5 |
16,5 |
17,5 |
18,7 |
19,8 |
21,1 |
22,4 |
23,8 |
Порядок расчета
Определите объем выделившегося водорода в результате опыта. Для этого от значения уровня воды в бюретке В после окончания опыта ( V2 ) следует вычесть значение уровня воды в бюретке В в начале опыта ( V1 ).
V(Н2) = V2 – V1.
Переведите значение объема выделившегося в результате опыта водорода в кубические дециметры, учитывая, что 1 см3 = 10 –3 дм3.
Приведите экспериментальный объем выделившегося водорода к нормальным условиям, воспользовавшись формулой 4. Следует учесть, что давление внутри бюретки В складывается из давления водорода и давления водяного пара внутри объема бюретки при данной температуре:
ратм = рН2 + рН2Опар , тогда
![]()
![]()
где ратм – измеренное атмосферное давление во время проведения опыта; рН2Опар – давление водяного пара при температуре опыта; V (Н2) – экспериментальный объем водорода; Т – температура проведения опыта (К), равная (273+t); ро, То – давление и температура при нормальных условиях.
Вычислите молярную массу эквивалента металла, с точностью до 0,1 г/моль, воспользовавшись формулой 3:
![]()
4. Воспользовавшись формулой 1, рассчитайте молярную массу металла и укажите какой это металл.
![]()
Результаты эксперимента представьте в виде таблицы 2.
Таблица 2
|
масса металла, г и (В) |
pатм, мм рт.ст. |
t, 0C |
V1,, мл |
V2, мл |
V(H2), л |
pH2Oпар, мм рт.ст. |
V0(H2), л |
Мэ (Ме), г/моль |
М (Ме), г/моль |
|
|
|
|
|
|
|
|
|
|
|
5. Вычислите величины абсолютной и относительной ошибок (Х).
Абсолютная ошибка:
Хабс. = М (Ме) табличное – М (Ме) экпериментальное
Относительная ошибка:
![]()
Вопросы для самоконтроля
1. Что называется эквивалентом вещества?
Что является единицей эквивалента вещества?
Какую размерность имеет молярная масса эквивалента вещества?
Какие значения имеют молярные массы эквивалентов водорода и кислорода?
Как можно рассчитать молярную массу эквивалента элемента?
Что такое молярный объем и молярный объем эквивалента?
Какие значения имеют молярные объемы эквивалентов водорода и кислорода?
Как формулируется закон эквивалентов?
Почему при выполнении расчетов в экспериментальной части работы нужно знать давление водяного пара?
Какие Вы знаете методы экспериментального определения молярной массы эквивалента металлов?
Задачи
Медь с кислородом образует два соединения, в которых содержится 79,9 % меди и 20,1 % кислорода, и 88,8 % меди и 11,2 % кислорода. Определите молярные массы эквивалентов меди в этих соединениях и составьте формулы этих соединений.
При сгорании 3 г магния образовалось 5 г оксида магния. Рассчитайте молярную массу эквивалента магния.
При взаимодействии 2,4 г углерода с кислородом образовалось 5,6 г оксида. Определите молярную массу эквивалента углерода в этом соединении и напишите уравнение реакции.
При взаимодействии 4 г двухвалентного металла с кислородом образовалось 5,6 г оксида. Определите, какой это металл и напишите уравнение реакции.
При растворении в соляной кислоте 5,4 г трехвалентного металла выделилось 6,72 л водорода, измеренного при н.у. Определите, какой это металл и напишите уравнение реакции.
При взаимодействии одновалентного металла с 0,2 г водорода образовалось 4,8 г гидрида металла. Определите, какой это металл и напишите уравнение этой реакции.
При окислении 8 г металла, проявляющего валентность, равную I, получено 9 г оксида. Определите, какой это металл и напишите уравнение данной реакции.
Рассчитайте объем водорода, выделившегося при растворении в соляной кислоте 18 г металла, молярная масса эквивалента которого равна 9 г/моль.
При взаимодействии 0,9 г трехвалентного металла с серой образовалось 2,5 г сульфида металла. Определите, какой это металл, учитывая, что молярная масса эквивалента серы в этом соединении 16 г/моль. Напишите уравнение соответствующей реакции.
При окислении 6,4 г серы образовалось 16 г оксида. Определите молярную массу эквивалента серы в этом соединении и напишите уравнение соответствующей реакции.
