инженерия
.doc|
1.предмет.основные этапы. Генетическая инженерия как новое направление возникла на стыке результатов исследований в области нескольких биологических наук -Молекулярной генетики -Биохимии (химии нуклеиновых кислот и энзимологии) -Молекулярной биологии
|
|
|
|||||||||||||||||||||||||||||||||
|
2. Теоретические предпосылки генетической инженерии
1972 г. - дата рождения генетической инженерии Создана первая искусственная (рекомбинантная) ДНК, содержащая несколько фрагментов ДНК, а именно : -вируса SV40 -бактериофага Р dvgal -галактозного оперона Escherichia col Рекомбинантная ДНК – это молекула ДНК, сконструированная in vitro Генетическая инженерия позволяет преодолеть установленные природой видовые барьеры и осуществить неограниченное межвидовое скрещивание, т.к. инструменты генетической инженерии лишены видовой специфичности Аксиломарская конференция (1975) по биобезопасности работ с рекомбинантными ДНК in vitro
|
3. Общие принципы и методы генетической инженерии Генетическая инженерия – конструирование in vitro функционально активных генетических структур (рекомбинантных ДНК) или иначе – создание искусственных генетических систем, в которых гены или их части объединяются в заданной последовательности (А.А. Баев) Генетическая инженерия – это раздел экспериментальной молекулярной биологии (С.Н. Щелкунов) Генетическая инженерия @ генная инженерия
Схема типичного эксперимента по получению и молекулярному клонированию рекомбинантных ДНК Молекулярное клонирование – получение копий созданной рекомбинантной ДНК
|
||||||||||||||||||||||||||||||||||
|
4. Ферменты генетической инженерии Рестрикционные эндонуклеазы, Лигазы , ДНК-полимеразы, РНК-полимеразы, Поли (А)-полимеразы, Дезоксирибонуклеазы, Рибонуклеазы Рестрикционные эндонуклеазы (рестриктазы) -Рестрикционные эндонуклеазы – это ферменты, осуществляющие образование разрывов в молекулах ДНК -Первая рестриктаза была выделена в 1968 г. Мезельсоном и Юанем -Одна из наиболее распространенных рестриктаз - EcoRI Номенклатура рестриктаз (Х. Смит и Д. Натанс, 1973г.) Название фермента является производным от родо-видового обозначения микроорганизма, оно составляется по правилу: к первой прописной букве названия рода добавляют две первые строчные буквы вида (Escherichia coli – Eco). За родо-видовым названием следует в случае необходимости обозначение штамма или серотипа (Escherichia coli R – EcoR). Различные рестриктазы, одной и той же бактериальной клетки, обозначаются римскими цифрами (Escherichia coli R – EcoR I, EcoR V) Действие рестриктаз класса I на молекулу ДНК ЕсоR K TGA (N) 8 TGTC , ЕсоR B AAC(N) 6 GTGC Фермент имеет несколько активностей : расщепление ДНК,метилирование ДНК, узнавание специфической последовательности Расщепление ДНК совмещено с гидролизом АТФ, требуется Mg2+. Расщепление проходит на расстоянии 400-700 пн от участка узнавания, при этом образуются гетерогенные продукты, что объясняется неодновременным случайным взаимодействием молекул фермента с разными участками узнавания ДНК и неодновременным началом транслокации цепей. Нарушение специфичности действия рестриктаз происходит в случае:-внесения большого избытка рестриктаз при этом происходит расщепление ДНК по дополнительным участкам, -снижения ионной силы и повышение рН растворов, -введения в раствор органических растворителей, -введения в раствор ионов Mn2+ Рестриктазы класса II являются основными инструментами генетической инженерии. -Прототип - рестриктаза, сайт рестрикции которой выявлен впервые. -Новой считается любая рестриктаза, найденная в неизученном ранее штамме. -Ферменты, имеющие одинаковые узнаваемые последовательности и одинаково их расщепляющие называются изошизомерами Например, рестриктазы HapII, HpaII и MnoI
|
4. действие рестриктаз класса II на молекулу ДНК Образование фрагментов ДНК с тупыми концами (Alu I)
Образование фрагментов ДНК с липкими концами (EcoR I)
Сайт рестриктазы Alu I
Большинство рестриктаз узнают тетра- и гекса- нуклеотидные последовательности -тетра-нуклеотидные последовательности встречаются в среднем через 256 пар оснований ,рестриктазы узнающие такие последовательности называются мелкощепящими -гекса-нуклеотидные последовательности встречаются в среднем через 4096 пар оснований -рестриктазы, узнающие такие последовательности называются крупнощепящими Особенности действия рестриктаз BamHI, BglII и Sau3AI-Ферменты обладают разной специфичность, но дают одинаковые липкие концы.Лигирование приводит к образованию последовательности, которая узнается другим ферментом BamHI, BclI, BglII, XhoII-GATC,, SalGI XhoI, AvaI - NCGA Свойства рестриктаз класса III -Узнают несимметричные последовательности длиной 5-6 пн и расщепляют ДНК в стороне от участков узнавания на расстоянии 24-27 пн, образуя одноцепочечные 5‘-концы длиной 2-3 нуклеотида -Требуют: АТФ и ионы Mg2+
|
|
11. Векторные молекулы ДНК Вектор – это фрагмент, обеспечивающий репликацию гибридной молекулы ДНК в клетке) Основные свойства вектора: -присутствие ограниченного количества сайтов рестрикции (предпочтительно один) -наличие генетических маркеров для отбора рекомбинантных ДНК -сохранение репликативных функций после встраивания фрагмента чужеродной ДНК -стабильное поддержание копий в клетках-реципиентах Векторами могут быть плазмиды, фрагменты хромосом, фаги, вирусы 12. Экспрессирующий вектор – это вектор, который наряду с амплификацией обеспечивает правильную и эффективную экспрессию чужеродных генов в клетках- реципиентах (плазмиды) Интегративный вектор – это вектор, который может обеспечивать интеграцию чужеродной ДНК в геном хозяина (фрагменты хромосом, фагов, вирусов) Особенности контроля репликации векторов Количество копий молекул вектора на клетку- -Менее 10 Особенности контроля репликации векторов -Строгий контроль -10-200 - Ослабленный контроль Векторы клонирования в бактериях
|
5. ДНК-лигаза ДНК-лигаза – это фермент, катализирующий образование фосфодиэфирной связи в двухцепочечной молекуле ДНК, Т.Е. ПРОЦЕСС ЛИГИРОВАНИЯ (СШИВАНИЯ) ДНК-лигаза фага Т4 – мономерный полипептид (молекулярная масса 68 кДа) – катализирует образование фосфодиэфирной связи между ‘-фосфатным (5‘-р) и 3 гидроксильным (3‘-ОН) концами ДНК Лигирование тупых концов фрагментов ДНК
Лигирование липких концов фрагментов ДНК
ДНК-лигаза фагаТ4 обеспечивает объединение любых двуцепочечных фрагментов ДНК , поэтому данный фермент является одним из важнейших ферментов создания рекомбинантных молекул ДНК
|
|
6. ДНК-полимераза I E. coli (Pol I) Обнаружена А. Корнбергом в 1958 г. Мономерный полипептид с молекулярной массой 103 кДа, имеет трехдоменную структуру. Каждый домен обладает отдельной ферментативной активностью: N-концевой домен - 5‘-3 ‘-экзонуклеазной; С-концевой - 5‘-3 ‘- полимеразной; средний домен - 3‘-5‘ - экзонуклеазной Связывается с одноцепочечными участками двойной спирали ДНК в местах одноцепочечных разрывов, а также с концами двухцепочечных молекул ДНК 5‘-3‘- полимеразная активность Pol I Фермент осуществляет реакцию синтеза комплементарной цепи ДНК Необходимы: -одноцепочечная ДНК-матрица -комплементарный фрагмент – праймер (затравка) с 3‘-ОН концом 3‘-5‘- экзонуклеазная активность Pol I Фермент осуществляет реакцию расщепления фосфодиэфирных связей в неспаренных участках ДНК (гидролиз ДНК с 3‘-ОН конца) В ходе реакции убирается ошибочный нуклеотид на место которого присоединяется правильный, что обеспечивает точность полимеризации, направляемой матрицей Необходима -одно- или двухцепочечная ДНК-матрица 5‘-3‘- экзонуклеазная активность Pol I -Фермент осуществляет реакцию расщепления фосфодиэфирной связи одной цепи двухцепочечной ДНК, начиная со свободного 5‘-конца -Нуклеаза может вырезать с 5‘-конца до 10 нуклеотидов -Реакция играет важную роль в репарации повреждений ДНК in vivo Использование ДНК полимеразы Iи ее фрагментов -Pol I используется для ведения меченых дезоксирибонуклеотидов в синтезируемые цепи ДНК путем перемещения одноцепочечного разрыва вдоль двухцепочечной ДНК, в котором 3‘-ОН-конец используется в качестве затравки (ник-трансляция), при этом Pol I прокладывает себе путь с помощью 5‘-3 ‘- экзонуклеазной активности -Термостабильная Taq-ДНК-полимераза широко используется для проведения ПЦР
|
7. Фрагмент Кленова ДНК-полимеразы I E. coli (Pol I)
|
|
8. РНК-зависимая ДНК-полимераза (обратная транскриптаза, РНК-полимераза, ревертаза)
|
9. Поли(А)-полимераза E. coli -Поли(А)-полимераза открыта А Сиппелом в 1973 г. -Катализирует присоединение к свободному 3‘-ОН-концу одноцепочечных молекул РНК поли(А)-последовательностей
Нуклеаза Bal31 Обнаружен в 1975 г. Х. Грей с соавторами Фермент обладает активностями -Экзонуклеазы, катализирующей удаление олигонуклеотидов или мононуклеотидов одновременно с 5‘- и 3‘-концов двухцепочечной ДНК, при этом обе цепи деградируют одновременно с одинаковой скоростью -Эндонуклеазы, специфичной к одноцепочечной ДНК Используется для образования тупых концов в экспериментах когда необходимо сблизить какие-либо функционально значимые генетические элементы
Концевая дезоксирибонуклеотидилтрансфераза (терминальная трансфераза)
|
|
10. Дезоксирибонуклеазы -Экзонуклеаза III E.coli-Катализирует последовательное отщепление нуклеотидов из двухцепочечных ДНК в направлении 3'→5' Фермент обладает эндонуклеазной активностью РНК-азы Н, осуществляющей гидролиз РНК в РНК-ДНК-гибридах -Экзонуклеаза фага λ Катализирует последовательное отщепление мононуклеотидов в двухцепочечных ДНК при наличии в них 5' –концевых фосфатных групп. Используют для получения одноцепочечных молекул ДНК с целью их последующего секвенирования -Нуклеаза S1 -Специфически расщепляет одноцепочечные молекулы ДНК с образованием 5'-фосфорилированных моно- и олигонуклеотидов Эти же свойства присущи нуклеазе SI золотистой фасоли -Панкреатическая дезоксирибонуклеаза I (ДНКаза I ) -Гидролизует одно и двухцепочечные ДНК с образованием сложной смеси моно- и олигонуклеотидов, содержащих 5'-фосфатные группы Рибонуклеаза (РНКаза А) -Обладает активностью эндорибонуклеазы, специфически расщепляющей фофодиэфирные связи, образованные пиримидиновыми нуклеотидами -Продуктами гидролиза являются 3'-фосфорилированные пиримидиновые мононуклеотиды и олигонуклеотиды, содержащие концевые пиримидин-3'-монофосфаты
-Ферменты, способные использовать в качестве субстрата катализируемых ими реакций нуклеиновые кислоты являются инструментами экспериментов по конструированию и анализу гибридных молекул НК -Все используемые в ГИ ферменты должны быть высокоочищенными, т.к. посторонние активности могут привести к побочным реакциям и резко снизить эффективность получения целевых генетических конструкций
|
13. Векторная система Escherichia coli -Плазмиды и клетки E. coli – первые объекты генетической инженерии -Escherichia coli – самая изученная клетка из всех существующих -Именно в E. coli был впервые обнаружен половой фактор и доказано, что он является внехромосомной двухцепочечной кольцевой молекулой ДНК (плазмидой) Криптические плазмиды -Плазмиды, выявляемые фенотипически несут детерминанты устойчивости к антибиотикам (R) , гены катаболизма органических соединений, не являющихся обычными источниками углерода и энергии (D) , могут обуславливать синтез токсинов бактериоцинов, антибиотиков -Плазмиды, не выявляемые фенотипически, называются криптическими Плазмидные векторы E. coli - pSC101, ColE1, pMB9, pBR313, pBR322, pBR325 pBR328
14. Вектор pSC101 -получен в 1973 г. в лаборатории С. Коэна как -первая векторная плазмида -(размер 9,1 тпн) -имеет маркерный ген (tet) устойчивости к тетрациклину с сайтами рестрикции HindIII, BamHI SalI -имеет строгий контроль репликации (6 копий на клетку) -вектор pSC101 и его производные используются для клонирования в тех случаях, когда повышение количества кодируемого вставкой белка может привести к гибели бактериальной клетки
15. Вектор ColE1
|
|
16. Вектор pMB9 Создан на основе делеционного варианта ColE1, обозначенного pMB8 -обладает геном иммунности к колицину, имеет один сайт EcoRI, в который перенесен ген устойчивости к тетрациклину плазмиды pSC101 -размер pMB9 - 5,3 тпн -маркеры:-устойчивость к тетрациклину,-иммунитет к колицину -недостаток - тест на колицин ненадежен
17. Вектор pBR313 Входит в серию плазмид pBR созданных в лаборатории Х. Бойера в 1977-1980 гг.содержит единичные сайты рестрикции: -EcoRI, HindIII, BamHI, SalI, XmaI, SmaI, HpaI -фенотипическая детекция осуществляется при клонировании по -HindIII, BamHI, SalI, PstI – сайтам, при этом рекомбинантные клоны могут быть отобраны по фенотипу устойчивость / чувствительность к антибиотикам - ампицилину и тетрациклину
|
18. Вектор pBR322 был получен случайно, длина 4,36 тпн, имеет два селективных маркера устойчивости к ампицилину и тетрациклину, используется в подавляющем большинстве генно-инженерных работ, на основе pBR322 были сконструированы векторы pBR325 и pBR328, в составе которых появился маркер устойчивости к хлорамфениколу
Плазмида pBR 325 При создании использовали ДНК фага PI, содержащего гены устойчивости к хлорамфениколу ( ген хлорамфениколацетил- трансферазы -cat )
|
|
29. Плазмиды серии pUC
|
19. Векторные системы бактерий, не относящихся к роду Escherichia -Реализация генетической информации имеет особенности, характерные для каждой таксономической группы -Несовместимость плазмид – это неспособность плазмид стабильно сосуществовать в одной клетке -По этому признаку плазмиды распределены на группы несовместимости или Inc-группы (от англ. incompatibility) -Плазмиды, относящиеся к одной Inc-группе, обладают сходными признаками и обнаруживают значительную гомологию Группы несовместимости E. coli - N,P,Q и W , P,Q – наиболее изученные группы несовместимости -Плазмиды с широким кругом хозяев способны реплицироваться в бактериях различных видов (это многие плазмиды грамположительных бактерий) Плазмиды широкого круга хозяев - Плазмиды, способные к экспрессии в клетках бактерий разных родов 20. 21. Плазмиды способные к конъюгации – процессу переноса от клетки –донора к клетке-реципиенту при непосредственном контакте клеток между собой называют конъюгативными или трансмиссивными Перенос плазмид обеспечивает большой набор генов, объединенных в tra-оперон.Этапы конъюгации -образование скрещивающихся пар с помощью пилей - половых ворсинок -перенос и репликация ДНК (переносится только одна цепь плазмидной ДНК, после переноса формируется кольцевая двухцепочечная молекула) Трансмиссивность плазмид Нетрансмиссивные плазмиды могут быть перенесены в рецепиентные клетки с помощью конъюгативных плазмид. Этот процесс называется мобилизацией Механизмы мобилизации -Перенос за счет белковых продуктов генов tra-оперона, он начинается с участка oriT мобилизируемой плазмиды и для его осуществления необходимо наличие на плазмиде генов mob. Col EI и RSF 1010 -Перенос в составе коинтегратов с конъюгативными плазмидами. Коинтеграт - кольцевая молекула ДНК,в которой объединены два и более репликона, способных к независмой репликации.Коинтеграты способны диссоциировать на дискретные плазмидные репликоны. Несовметимость плазмид – не способность стабильно сосуществовать в клетке. Группы несовместимости Inc (от incompatibility- несовместимость) E. coli N,P,Q и W. P,Q – наиболее изученные группы несовместимости -Плазмиды RK2 и RSF1010 -Наиболее изученные плазмиды групп IncP (RK2) и IncQ (RSF1010) -Важным свойством плазмид является то, что их гены имеют промоторы широкого круга хозяев, отличающиеся по структуре консервативных районов от районов промоторов E. coli
|
|
22. Челночные векторыБифункциональные (бирепликонные плазмиды) Свойства челночных векторов: -наличие репликона, обеспечивающего размножение рекомбинантных ДНК автономно от бактериальной хромосомы -возможность экспрессии фенотипических маркеров Первый челночный вектор pDP1 (19 тпн) сконструирован в 1984 г. Д. Гинеем из двух репликонов, один из которых функционирует в E. coli, а второй - в Bacteroides fragilis В 1985-1988 г. на основе pDP1 создана серия плазмид, наиболее удачная из них pUC19 (К. Смит) pUC303 челночный вектор для цианобактерии Anacystis nidulans и E. coli E. coli используется в качестве промежуточного хозяина для селекции, анализа и амплификации послечего рекДНК вводят в бактерии других таксономических групп.
|
23. Векторы на основе бактериофага λ Векторы на основе фага λ появились в 1974 г.. ДНК фага λ двухцепочечная, линейная, размер 48 502 пн. На концах имеются одноцепочечные ГЦ- концы длиной 12 н (обозначаются cosR и cosL). В клетках фаговая ДНК циклизуется по cos-концам и функционирует в кольцевой форме. Ковалентно-связанные cosR и cosL называются cos-сайтом Фаг развивается в клетке по литическому или лизогенному пути -При литическом развитии происходит лизис клеток и образуются фаговые частицы -В лизогенном пути ДНК фага интегрируется в хромосому (между генами gal и bio) и находится в форме профага. Геном фага состоит из трех частей: первая – гены от Nu1 до J, белковые продукты которых необходимы для образования капсидов и упаковки в них ДНК, вторая – центральная, расположена между генами J и N, она содержит гены - -redα и redβ , участвующие в рекомбинации - int , необходимые для сайт-специфической интеграции ДНК в бактериальную хромосому (которая происходит по особым участкам (att) -xis, контролирующие исключение профага из хромосомы -Третья - содержит элементы контролирующие репликацию (О и Р) лизис клеток (S и R) -Получение векторных молекул сводится к введению мутаций по участкам действия рестриктаз в несущественной для размножения фага области генома -Жизнеспособность фага сохраняется при изменении генома в пределах 22% -Гибридные фаги должны иметь размер в интервале 38-51 тпн
34. Особенности конструирования геномных библиотек
|
|
24. Структура векторов внедрения фага λ -имеют на ДНК одиночные сайты рестрикции, - селекция рекомбинантных клонов осуществляется как выявление фаговых мутантов
Векторы замещения фага λ -Имеют два или больше сайтов рестрикции -Заключенные между этими участками фрагменты ДНК вектора замещаются чужеродными фрагментами ДНК -Детекция рекомбинантных ДНК происходит как выявление делеции генов фага λ Векторы фага λ, предназначенные для клонирования крупных фрагментов -Можно клонировать фрагменты размером до 23 тпн (библиотека генов) -При создании библиотеки каждый сегмент изучаемого генома должен быть представлен среди рекомбинантных ДНК -Можно создать энциклопедию (клонотеку) генов -При создании энциклопедии рекомбинантные ДНК последовательно перекрывают весь геном
|
25. Космиды Созданы в 1978 г. Дж. Коллинз и Б. Хон для клонирования крупных фрагментов ДНК (35-51 тпн), имеют размер 4,6 тпн. Компоненты космид: -участок плазмиды с областью начала репликации и геном устойчивости к антибиотику, -единичные сайты рестрикции, -фрагмент ДНК, содержащий cos-сайт. Этапы клонирования -чужеродная ДНК помещается между cos-сайтами космиды , -рекомбинантная ДНК упаковывается в фаговые капсиды , -инфекция клеток E. coli, -репликация рекомбинантной ДНК в форме плазмиды внутри клеток
Схема клонирования в космидах по Д. Иш-Горовиц и Дж. Бюрк
|
|
26. Фазмиды векторы, состоящие из фрагментов фага и плазмиды Обеспечивают возможность регулируемого переключения развития гибридных ДНК на фаговый или плазмидный путь -после встройки чужеродной ДНК могут развиваться как фаги или как плазмиды -фазмида λpMYF131 - 33 277 пн, поддерживается в клетках E. coli в форме плазмиды, увеличение размера при встраивании чужеродной ДНК придает ей свойства фага -таким образом, фазмиды являются векторами, обеспечивающими возможность смены фаз, т.е. экспериментально регулируемого переключения развития гибридных ДНК на фаговый или плазмидный путь
28. Фагмиды Состоят из фрагментов плазмид и нитевидных фагов Созданы в 1981 г. Г. Долго на основе плазмиды pBR322 и фага f1 Л. Денте с соав. создали серию плазмид pEMBL, состоящих из фрагментов плазмид серии pUC и генома фага f1 Векторы с разной ориентацией фрагмента фаговой ДНК обозначают знаком «+» или «-» Наиболее известный вектор Bluescript II KS(+/-) 2961 пн , создан на основе pEMBL19(+/-) Обеспечивает
бело-синюю селекцию рек кл
|
27. Векторы на основе нитевидных фагов используются в случаях, когда необходимо манипулировать одной цепью ДНК нитевидные фаги E. coli (M13, fd, f1) представляют собой - кольцевую одноцепочечную ДНК длиной 6 407 (М13) и 6 408 (fd и f1), -упакованную в трубочку, состоящую из 2700 копий оболочечного белка PvIII и закрытую на концах 4-5 молекулами минорных оболочечных белков pIII, pVI, pVII и pIX -нитевидные фаги инфицируют только мужские бактериальные клетки -геном фага в клетках одновременно присутствует в виде копий двухцепочечной кольцевой плазмиды и одноцепочечной ДНК в составе вирионов -в геноме фагов существует межгенная область IR (500 н), во многие места которой могут быть внесены изменения без нарушения жизнеспособности фага -при инфекции фаговые частицы постоянно экскретируются без лизиса Векторы фага М13 -Векторы используются при гетеродуплексном анализе -выделении комплементарной ДНК -направленном мутагенезе -секвенировании -Использование
векторных систем нитевидных фагов
получило название – фаговый дисплей
|
|
30. Искусственные бактериальные хромосомы -Предназначены для клонирования очень больших фрагментов ДНК (125-300 тпн), используются для создания библиотек фрагментов сложных геномов, в частности человека -ВАС (от анг. bacterial artificial chromosome) созданы на основе F- плазмиды pMBO131 E. coli, в которую встроили фрагмент ДНК с cos-участками фага Х, уникальными сайтами BamHI и HindIII и промоторами фагов Т7 и Sp6 -Клонирование возможно по loxP- и cos-сайтам YAC (от англ. yeast artificial chromosome ) созданы на основе плазмид дрожжей-сахаромицетов
31. Векторные системы на основе вирусов животных вирус SV40, вирус папилломы, аденовирусы, вирус герпеса, ретровирусы Векторы на основе вируса SV40 Особенности строения вируса SV40 -гены SV40 в значительной степени перекрываются -представляют собой кольцевую ДНК длиной 5 243 пн -область начала репликации (ori) перекрывается с промоторными последовательностями ранней и поздней транскрипции -белок Т-антигена является единственно необходимым для эффективной репликации вируса в инфицированных клетках -Внедрение вируса в хромосомную ДНК не является сайт-специфическим -при получении рекДНК важно сохранить неповрежденным участок начала репликации -вставки или делеции без потери жизнеспособности SV40 могут происходить ограниченно: большинство векторов на основе SV40 получено замещением участка ДНК области поздних генов вируса по сайтам HpaII, EcoRI, BamHI, HaeII, AccI, KpnI -Впервые экспрессия эукариотического гена β-глобина кролика была достигнута в лаборатории П. Берга в 1979 г
|
32. Векторные системы растений
Векторы на основе Ti плазмиды -Ti плазмида (от англ. tumor inducing) грамотрицательных почвенных бактерий Agrobacterium tumefaciens, вызывает заболевание «корончатый галл» -Размер 200-250 тпн, содержит Т-область (transferred DNA) 10-30 тпн, 35 генов вирулентности (vir), способна передаваться в растительную клетку. -Перенос плазмиды происходит через пили бактерий, а затем через канал в клеточной мембране растения -ДНК проникает в ядро растительной клетки и встраивается в геном, сайты инсерции случайны, однако имеется преимущественное внедрение в транскрипционно активные области генома -Т-ДНК кодирует ферменты синтеза фитогормонов, индуцирующих разрастание трансформированных клеток, а также ферменты синтеза аминокислот и сахаров -Гены ферментов биосинтеза гормонов и необычных аминокислот эволюционно адаптированы для экспрессии только в растительных клетках, поэтому агробактерии являются «природными генными инженерами
|
|
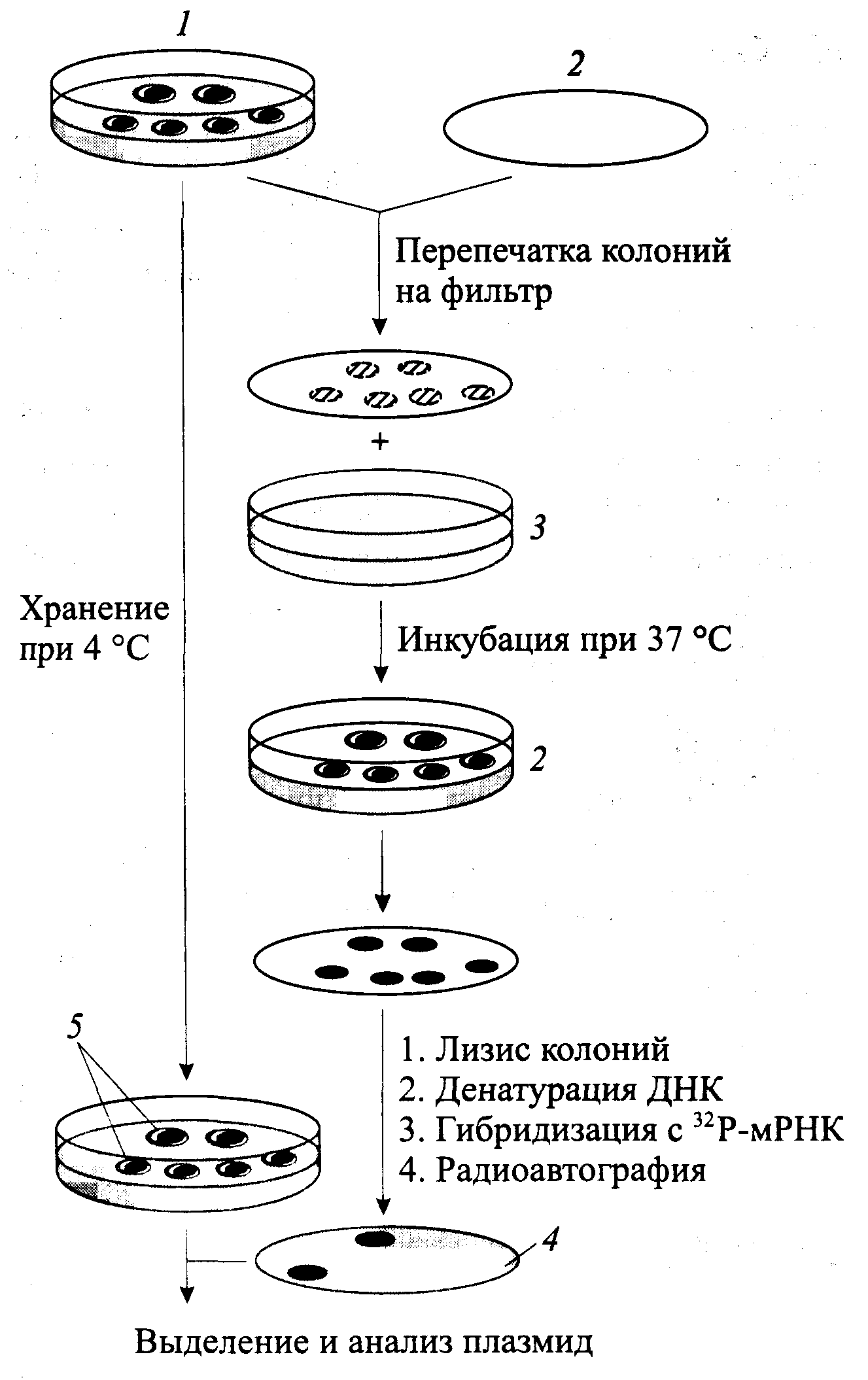
33. Методы отбора и анализа рекомбинантных молекул ДНК -фенотипическая селекция - применяется при тестировании векторных плазмид, детерминирующих устойчивость трансформированных клеток к антибиотикам (тетрациклин, ампициллин), -прямая селекция сразу после высева трансформантов на селективную среду возможна для векторов имеющих летальные для клеток-реципиентов гены -гибридизация нуклеиновых кислот in situ-применяется в случае необходимости отбора рекДНК, содержащих специфические последовательности, которые используются в качестве зонда
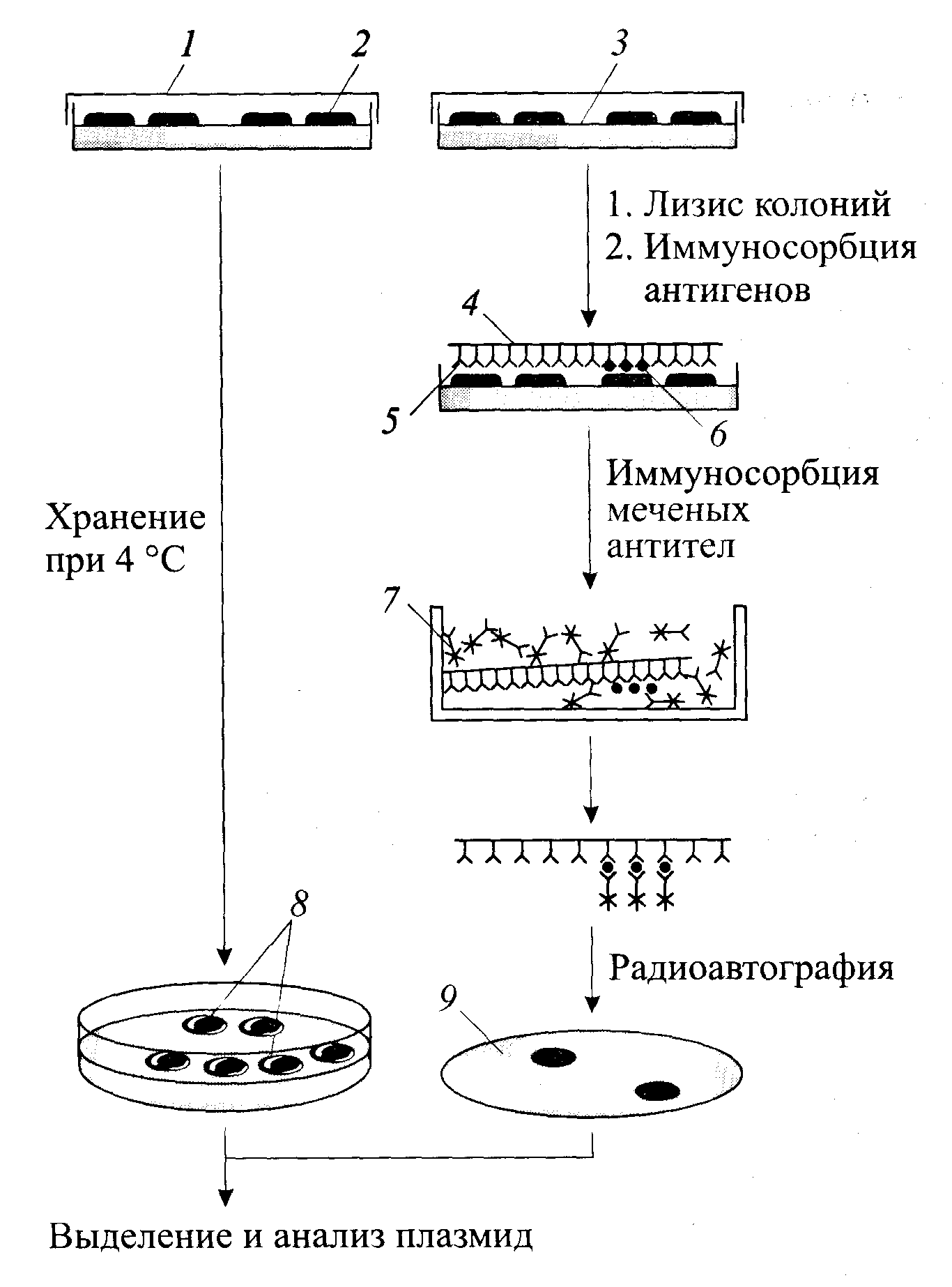
-функциональная комплементация предложен Р. Дэвисом в 1976 г. заключается в эффекте комплементации рекДНК мутации клетки-реципиента, -рекДНК с фрагментом хромосомной ДНК дрожжей-сахаромицетов, лигированная с ДНК вектора фага λ, после трансформации, способна комплементировать мутацию hisB E. coli , поэтому рекомбинантные клетки можно отобрать на питательной среде без гистидина . радиоиммуноанализ белков in situ В основе метода – способность иммуноглобулинов связываться с полистиролом или поливинилом На поверхности этих материалов происходит иммуносорбция антигена После взаимодействия с меченными антителами комплексы антиген-антитело выявляются радиоавтографически
|
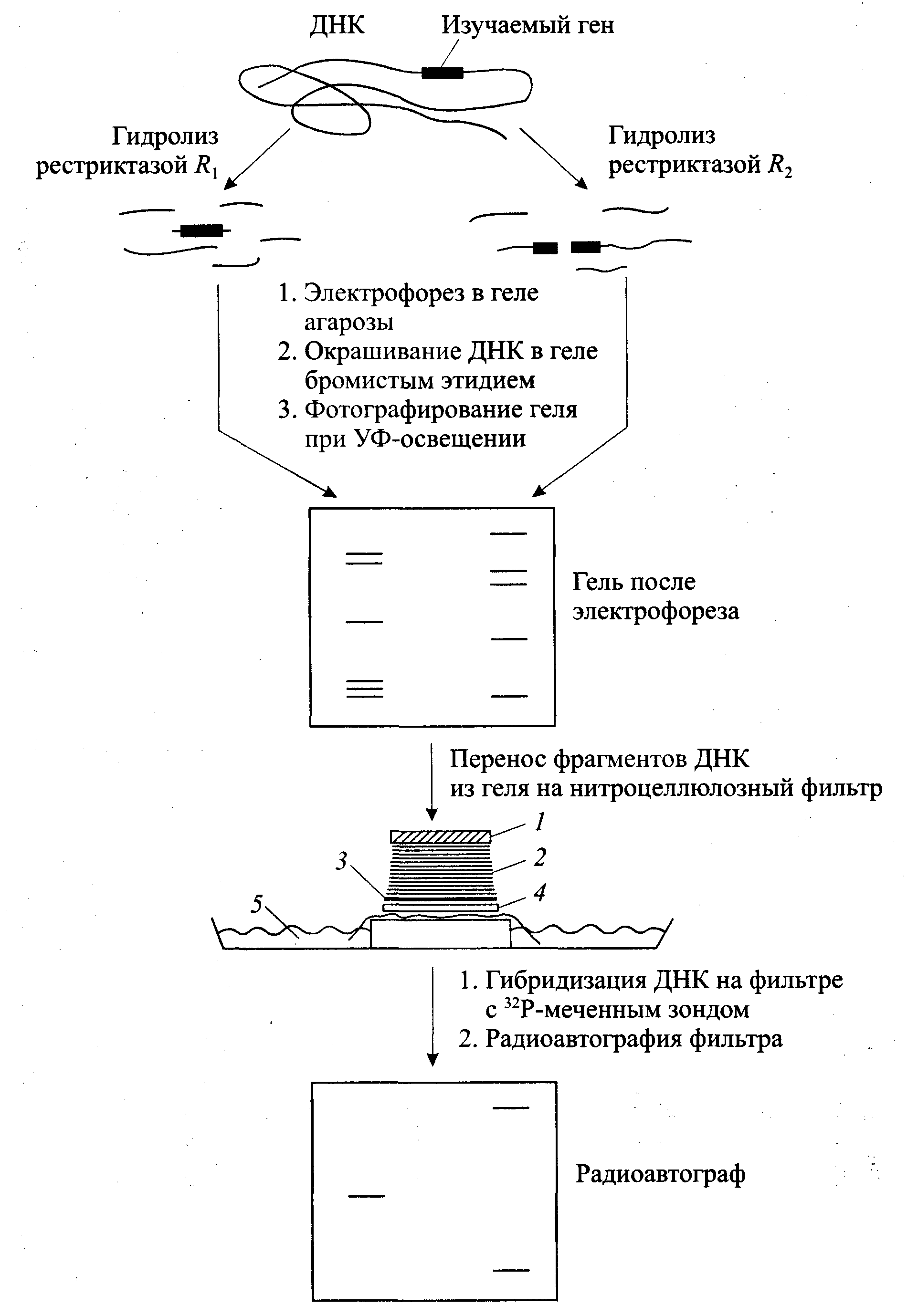
33 -блоттинг по СаузернуBlotting (промокание) предложен Е. Саузерном в 1975 г. для ДНК , по аналогии разработаны -Northern blotting для РНК ,- Western blotting для белков. -иммуноблотинг Иммуноблотинг
- это анализ смеси белков на твердой
подложке-мембране методом иммунодетекции.
Дот-блот анализ (от англ. dot
- пятно) - это анализ смеси биополимеров
(белков или нуклеиновых кислот) без
предварительного фракционирования
секвенирование |


















 онов
онов