
СОЕДИНЕНИЯ АЗОТА
.pdf
СОЕДИНЕНИЯ АЗОТА Органических азотистых соединений в нефтях в среднем не более 2–
3% и максимально (в высокосмолистых нефтях) до 10%. Большая часть азота концентрируется в тяжелых фракциях и в остаточных продуктах. Азотистые соединения нефти принято делить на основные и нейтральные.
Вещества основного характера могут быть отделены от нефти обработкой слабой серной кислотой. Количество азотистых оснований составляет в среднем 30% от суммы всех соединений азота. При перегонке они попадают в дистилляты. Азотистые основания нефти представляют собой гетероциклические соединения с атомом азота в одном из колец, с общим числом колец от одного до трех. В основном они являются гомологами пиридина, хинолина, изохинолина, а также в меньшей степени акридина:
5 |
4 |
3 |
6 |
5 |
4 |
3 |
6 |
5 |
4 |
3 |
7 |
6 |
5 |
4 |
3 |
|
|
|
|
|
|
|
|
||||||||
6 |
1 2 |
7 |
8 |
1 |
2 |
7 |
8 |
1 |
2N |
8 |
9 |
10 |
1 |
2 |
|
|
N |
|
|
|
|
|
|
N |
|
||||||
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
||
Пиридин |
|
Хинолин |
|
Изохинолин |
|
|
Акридин |
|
|
||||||
В настоящее время установлено строение многих выделенных из нефти ближайших гомологов азотистых оснований этих классов. Пиридин и его гомологи – жидкости с резким запахом. Пиридин кипит при 115,26°С, является хорошим растворителем. Хинолин и изохинолин кипят при ~240°С. Изохинолин плавится при 25°С, а акридин – при 107°C.
Нейтральные вещества составляют большую часть (до 80%) азотистых соединений нефти и концентрируются в высокомолекулярной части нефтей. Строение и свойства их изучены мало. Можно считать доказанным наличие в некоторых нефтях гомологов пиррола, индола, карбазола:
N |
N |
N |
H |
H |
H |
Пиррол |
Индол |
Карбазол |
Азотистые соединения – как основные, так и нейтральные – достаточно термически стабильны, особенно в отсутствие кислорода, и не оказывают заметного влияния на эксплуатационные качества нефтепродуктов. Однако отмечено, что при хранении дизельных топлив и мазутов некоторые азотистые соединения вызывают усиленное смолообразование.
В 1934 г. Трейбс открыл наличие в нефтях порфиринов. В дальнейшем они были обнаружены во многих нефтях. Строение их показывает, что они близки к гемину (красящее вещество крови) и хлорофиллу.
CH =CH |
CH3 |
CH2=CH |
|
CH |
|
2 |
|
|
3 |
||
|
CH |
|
CH |
|
|
|
|
|
CH=CH2 |
||
H3C |
CH=CH2 |
H3C |
|
||
|
|
|
|||
NH |
N |
N |
|
N |
|
|
|
CH |
|||
HC |
CH |
HC |
Fe |
||
|
|||||
N |
HN |
N |
|
N |
|
|
|
||||
|
|
|
CH3 |
||
H3C |
CH3 |
H3C |
|
||
|
|
||||
|
CH |
|
CH |
|
|
|
|
|
CH2 |
||
CH2 |
CH2 |
CH2 |
|
||
|
|
||||
HCOO-CH |
CH -COOH |
HCOO-CH2 |
|
CH2-COOH |
|
2 |
|
|
|
||
|
2 |
|
|
|
|
Прото-порфирин |
Гем гемоглобина |
||||
В составе их молекулы имеется четыре пиррольных кольца. Порфирины весьма склонны к образованию комплексных соединений с металлами. В нефтях они находятся как в свободном состоянии, так и в виде комплексов с ванадием, никелем и железом.
Химические свойства азотсодержащих соединений а) Основные (щелочные) соединения
Пиридин можно рассматривать как бензол, в котором группа –СН= замещена атомом азота. И пиридин, и бензол имеют молекулы, представляющие собой практически правильный шестиугольник.
Наличие у атома азота неподеленной пары электронов приводит к тому, что пиридин (как и другие азотистые основания – хинолин, изохинолин, акридин) проявляют свойства третичных аминов. Прежде всего это свойства слабых оснований. В растворах они взаимодействуют с водой по основному

типу:
+ H-OH |
+ OH |
N |
N |
H
Гидроксид хинолиния
Концентрации гидроксильных ионов оказывается достаточно для образования гидроксидов целого ряда металлов: Fe3+, Co2+, Sn2+ и других.
Соединения легко образуют соли с кислотами, такими как соляная, бромоводородная, серная и другие:
+ HBr |
Br |
|
N |
N |
|
H Бромид пиридиния |
+ HBr |
Br |
N |
N |
|
H |
|
Бромид хинолиния |
Соли хорошо кристаллизуются и используются для выделения и идентификации соединений азота. Интересно, что соли акридина в водных растворах имеют зеленую флуоресценцию, а при разбавлении вследствие гидролиза флуоресценция переходит в синюю, характерную для свободного акридина.
Как третичные амины, азотистые основания реагируют с галогеналкилами, образуя соответствующие соли, которые при нагревании изомеризуются в результате перехода заместителя от атома азота к атому углерода в положение 2 или 4 (но не 3):
+ С2H5I |
I |
to |
I |
|
|||
N |
N |
N |
С2H5 |
|
|
||
|
C2H5 |
H |
|
|
Йодид 1-этилпиридиния |
Йодид 2-этилпиридиния |
|
При обработке пероксидом водорода или пербензойной кислотой в уксуснокислой среде образуются оксиды азотистых соединений:
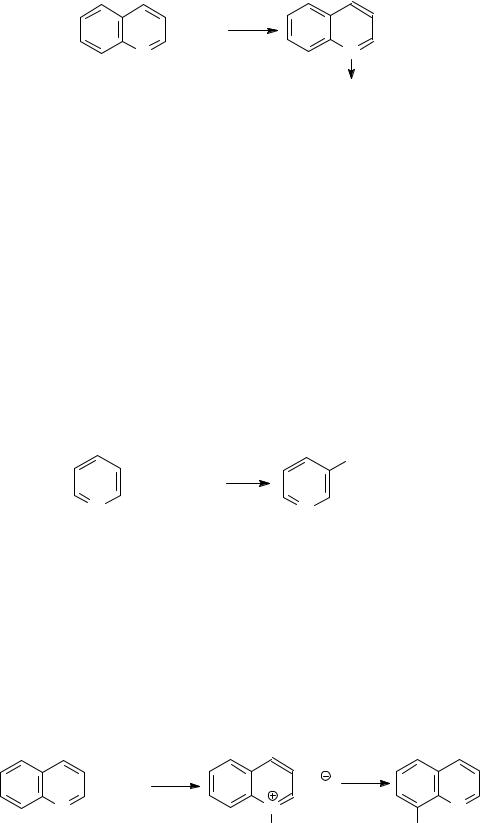
+ H2O2 |
+ H2O |
N |
N |
O
N-оксид хинолина
Пиридиновое ядро, присутствующее в молекулах всех указанных азотистых оснований, подвергается замещению электрофильными, нуклеофильными, радикальными реагентами. При этом нужно учитывать, что присутствие атома азота обедняет кольцо электронной плотностью вследствие его сильного положительного индукционного эффекта, причем особенно обедняются положения 2,4,6. Присутствие алкильных или других донорных заместителей облегчает реакции электрофильного замещения.
При нагревании пиридина в течение 24 часов с дымящей серной кислотой до 220-230°С в присутствии сульфата ртути образуется пиридин-3-
сульфокислота:
o |
SO3H |
t |
|
+ HOSO3H |
+ H O |
|
2 |
N |
N |
Вхинолиновых или акридиновых циклах, помимо пиридинового, присутствуют бензольные кольца, более активные в реакциях замещения. Поэтому реакции замещения протекают у этих соединений гораздо легче.
Вслучае хинолина индукционное влияние атома азота приводит к обеднению электронной плотностью положений 2,4 пиридинового и 5,7 – бензольного кольца. Поэтому электрофильные агенты атакуют прежде всего положения 8,6:
|
H2SO4 |
NO3 |
|
|
+ HNO3 |
- H2O |
|
N |
N |
|
N |
|
H |
|
NO2 |
|
Нитрат хинолиния |
8-Нитрохинолин |
|
|
|
|
|
Общей реакцией азотистых соединений является их способность восстанавливаться водородом:
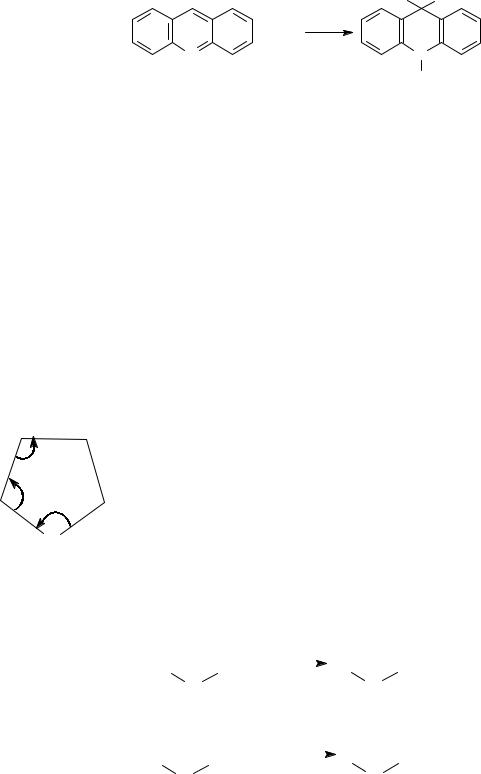
H |
H |
+ 2[H] |
|
Zn+HCl |
N |
N |
|
|
H |
Акридан |
|
б) Нейтральные азотистые соединения
В этих соединениях присутствует пятичленное кольцо с атомом азота, находящимся в состоянии sp3-гибридизации, имеющим атом водорода. В
образовании ароматической электронной системы участвуют как 4 π-
электрона двух связей С=С, так и неподеленная пара электронов атома азота,
что приводит к формированию единого шестиэлектронного π-облака – ароматической структуры, подобной бензолу. В результате кольцо пиррола становится плоским, простые связи укорачиваются. Строение пиррольного кольца представлено на схеме (длина связи указана в ангстремах).
|
1,44 |
|
|
|
|
|
|
Пиррол является |
|
настолько слабой |
кислотой, |
что |
||||||||||||||||
|
o |
|
|
1 |
часто |
рассматривается |
как нейтральное соединение |
(Кд= |
||||||||||||||||||||
109 |
|
|
|
3 |
||||||||||||||||||||||||
|
|
|
, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
o |
|
|
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
o |
|
|
5,4×10 |
-15 |
). |
|
Соли пиррола |
образуются |
лишь |
при |
||||||||||||||||||
110 |
|
|
|
|
|
|
|
|||||||||||||||||||||
|
100 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
2 |
взаимодействии с активными восстановителями, например, |
||||||||||||||||||||||
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
металлическим калием или реактивом Гриньяра. |
|
|||||||||||||||||||||
|
H |
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
При сплавлении пиррола с сухим гидроксидом калия также |
||||||||||||||||||||||
осуществляется замещение водорода и образование пирролкалия: |
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
+ K |
|
|
2 |
|
|
|
|
+ H2 ; |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
K |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ KOH |
|
|
|
|
|
|
|
+ H2O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
K |
|
|
|
||||
Пирролкалий (но не сам пиррол!) реагирует с алкилгалогенидами, например, йодистым этилом, с образованием замещенных пирролов:

|
|
|
|
+ C2H5I |
|
|
|
|
|
|
|
нагре- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
вание |
|
|
|
|
|
|
|
|
|
|
|
|
- KI |
|
|
|
|
|
|
|
|
N |
С2Н5 |
|||
|
N |
|
|
|
N |
|
|
|||||||||||
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
K |
|
|
|
|
C2H5 |
|
|
H |
|
||||||||
|
|
|
|
|
|
1-этилпиррол |
2-этилпиррол |
|||||||||||
Основные свойства пиррола, являющегося формально вторичным амином, маскируются быстрой полимеризацией под действием кислот.
Интересной качественной реакцией пиррола является покраснение сосновой лучины, смоченной соляной кислотой, в присутствии паров пиррола. Предполагается, что это происходит вследствие полимеризации пиррола в кислой среде.
Пиррол легко восстанавливается водородом:
|
|
|
|
|
|
[H] |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Zn + CH3COOH |
|
|
|
2,5-дигидропиррол |
|
|
|
|
|
|
|
N |
|||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
H2 (Pt) |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
тетрагидропиррол, |
|||||
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
N |
||
|
|
|
|
|
|
|
|
пирролидин |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
