
- •Введение Общие рекомендации для подготовки к лабораторным занятиям
- •Лабораторная работа №_____ Тема:________________________________________________
- •Неметалл
- •Классификация бинарных соединений
- •Классификация оксидов по составу
- •1.2.2. Трехэлементные соединения с кислородом и водородом (гидроксисоединения)
- •Классификация гидроксисоединений и их производных – солей
- •Список традиционных названий оксокислот и солей Таблица 4
- •2.Классификация веществ по типу химической связи и физическим свойствам
- •Классификация кристаллов по типу химической связи
- •5. Классификация неорганических веществ по кислотно-основным свойствам
- •5.1. По кислотно-основным свойствам неорганические соединения подразделяют:
- •Основание
- •Кислота
- •Амфотерное соединение
- •Кислота Основание Основание Кислота
- •5.2. Взаимодействие оксидов и гидроксисоединений с водой
- •5.3. Реакция нейтрализации
- •Например:
- •5.3.4. Закономерности изменения кислотно-основных свойств оксидов
- •Сравнительная характеристика свойств оксидов металлов и неметаллов
- •Генетическая связь между классами неорганических соединений
- •5.4. Гидролиз солей
- •Факторы, влияющие на гидролиз соли
- •6.Основные способы получения оксидов и гидроксидов
- •6.1. Способы получения оксидов
- •6.2. Способы получения гидроксидов
- •7. Лабораторные работы по теме:
- •7.1. Лабораторная работа № 1.
- •Задание 1.4.23 Сумма коэффициентов в молекулярном уравнении реакции
- •7.2. Лабораторная работа № 2.
- •7.3. Лабораторная работа № 3
- •7.4. Лабораторная работа № 4
- •8. Окислительно-восстановительные процессы
- •8.3. Химические свойства металлов
- •8.3.1. Ряд стандартных окислительно-восстановительных потенциалов металлов
- •8.3.2. Взаимодействие металлов с водой
- •8.3.3. Взаимодействие металлов с водными растворами щелочей
- •8.3.4. Взаимодействие металлов с растворами кислот, окисляющими
- •8.3.5. Взаимодействие металлов с концентрированной серной кислотой
- •8.3.6. Взаимодействие металлов с азотной кислотой
- •8.4. Лабораторная работа № 5
- •9.1. Основные понятия
- •Сравнение процессов в гальванических элементах и электролиза
- •9.2. Гальванический элемент
- •I процесс (коррозия с водородной деполяризацией)
- •II процесс (коррозия с кислородной деполяризацией)
- •9.4. Электролиз
- •Электролиз растворов солей
- •Электролиз водного раствора сульфата меди (II) с инертным анодом
- •Ряд разряжаемости катионов на катоде
- •Ряд разряжаемости анионов на аноде
- •9.5. Лабораторная работа № 6
- •Приложение
- •Константы диссоциации некоторых кислот и оснований при 25оС
- •Произведение растворимости некоторых малорастворимых электролитов при 25оС
- •Стандартные окислительно-восстановительные потенциалы в водных растворах при 25оС
- •Библиографический список
- •Содержание
9.1. Основные понятия
Электрохимический процесс – окислительно-восстановительный процесс, протекающий на электродах с участием электрического тока.
Особенности электрохимических процессов
1) - пространственное разделение процессов окисления и восстановления;
2) - наличие внешней цепи (металлический проводник) и внутренней цепи (электролит) (рис. 6);
3) - первичные реакции идут на «электродах» – поверхности контакта металлического проводника и электролита;
катод – электрод, на котором идет процесс восстановления;
анод – электрод, на котором идет процесс окисления.


 внешняя цепь
(металлический проводник)
внешняя цепь
(металлический проводник)



электро-
лит

 внутренняя
цепь
внутренняя
цепь
электроды
Рис. 6. Схема электролитической ячейки
Электрохимические процессыподразделяются на две группы
а) процессы, происходящие в гальванических элементах и сопровождающиеся возникновением электрической энергии за счет химических процессов;
б) процессы, протекающие в элетролизерах под действием электрической энергии от внешнего источника тока, вызывающей химические реакции на электродах.
Сравнение процессов в гальванических элементах и электролиза
|
Электрохимический процесс |
с получением электрической энергии |
с потреблением электрической энергии |
|
Преобразование энергии |
Преобразование химической энергии в электрическую |
Преобразование электрической энергии в химическую энергию продуктов электролиза
|
|
Протекание процесса |
Самопроизвольное |
Принудительное |
|
Устройство |
Гальванический элемент |
Электролизер |
|
Знак заряда катода анода |
+ – |
– + |
|
Воздействие перенапряжения |
Напряжение снижается |
Напряжение повышается |
|
Наименование процессов |
|
|
9.2. Гальванический элемент
Гальванический элемент – устройство, в котором химическая энергия самопроизвольно протекающей окислительно-восстановительной реакции превращается в электрическую энергию. Гальванический элемент содержит два полуэлемента, между электродами которых возникает разность потенциалов.
Принцип работы гальванического элемента иллюстрирует гальванический элемент Даниэля-Якоби, состоящий из цинкового и медного полуэлементов (рис. 7).
В цинковом полуэлементе металлическая цинковая пластина погружена в водный раствор соли цинка, с концентрацией [Zn2+]=1 моль/л. В медном полуэлементе – металлическая медная пластина погружена в водный раствор соли меди (II) с концентрацией [Cu2+]=1 моль/л. Цинковая и медная пластины соединены металлическим проводником, растворы солей – «солевым мостиком» («электролитический ключ»).
Вольтметр Cu-катод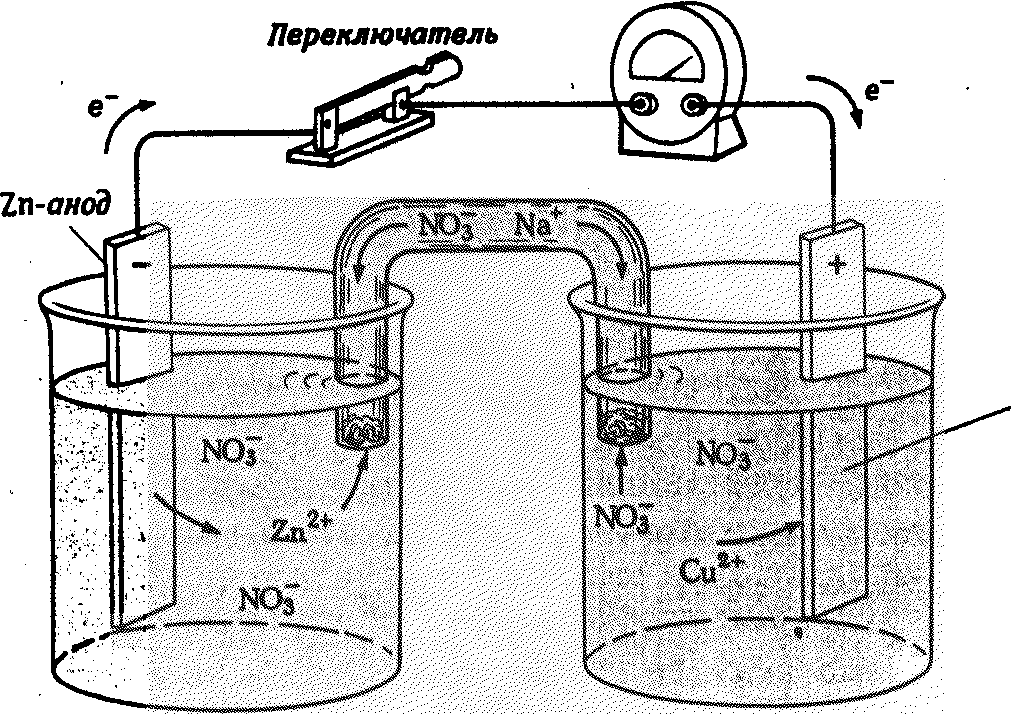
Рис. 7. Гальванический элемент Даниэля-Якоби
До замыкания цепи на каждой из металлических пластин на границе с
раствором устанавливаются равновесия:
Cuo(тв.)![]() Сu2+(р-р)+
2e(на мет.);
Сu2+(р-р)+
2e(на мет.);![]()
Zno(тв.)![]() Zn2+(р-р)+ 2e(на
мет.);
Zn2+(р-р)+ 2e(на
мет.);![]()
Цинковая пластина
заряжена более отрицательно, чем медная.
Между ними возникает разность потенциалов.
При замыкании системы в цепь равновесия
на границе металл–раствор нарушаются.
По внешней цепи – металлическому
проводнику – избыток электронов с
Zn–пластины переходит
наCu–пластину, где их
концентрация меньше, так как![]() <
<![]() .
.
В результате, равновесие на Zn-пластине смещается вправо, идет окисление металлического цинка.
На Cu-пластине равновесие смещается влево, протекает восстановление ионов меди (II).
Анод Zn(тв.) – 2e→Zn2+(р-р)(процесс окисления)
Катод Cu2+(р-р)+ 2e→ Сuo(тв.)(процесс восстановления)

Ионное
уравнение Zn(тв.) +Cu2+(р-р)→Zn2+(р-р)+Cuo(тв.)
суммарной реакции
Молекулярное Zn + Cu(NO3)2 → Zn(NO3)2 + Cu
уравнение суммарной реакции
Между растворами электролитов также возникает разность потенциалов. В цинковом полуэлементе в результате растворения цинка увеличивается концентрация ионов Zn2+, в растворе создается избыток положительно заряженных ионов. В медном полуэлементе в результате осаждения меди концентрация ионовCu2+уменьшается и в растворе создается избыток отрицательно заряженных ионов. По внутренней цепи – «солевому мостику» – катионы и анионы перемещаются навстречу друг другу. Таким образом, в системе возникает направленное перемещение заряженных частиц, т.е. возникает электрический ток.
Электродвижущая сила – ЭДС – гальванического элемента определяется разностью потенциалов катода и анода
![]() > 0
> 0
По мере работы гальванического элемента значения потенциалов катода и анода изменяются.
Поскольку молярная концентрация ионов Cu2+– уменьшается, в соответствии с уравнением Нернста уменьшается потенциал катода
![]() .
.
Молярная концентрация ионов Zn2+– [Zn2+] – увеличивается, следовательно, увеличивается потенциал анода
![]() .
.
Таким образом, по мере работы гальванического элемента ЭДС уменьшается, так как происходящие на электродах процессы приводят к выравниванию потенциалов. Система приходит в равновесие и гальванический элемент прекращает работу при условии
![]()
Схема записи гальванического элемента
Для обозначения гальванического элемента используют символическую запись, упрощающую их описание.
Например, элемент Даниэля-Якоби, может быть описан следующей краткой схемой
ө
 Zn|ZnSO4| |CuSO4|Cu
Zn|ZnSO4| |CuSO4|Cu![]()
 C1C2
C1C2
полуэлемент полуэлемент
анод катод
граница раздела обозначение «солевого мостика»,
металл-раствор т.е. полуэлементы пространственно
(реакция идет разделены, электролиты соединяются
на электроде) «солевым мостиком»
Электрохимическая коррозия
Коррозия металлов – это их самопроизвольное разрушение под воздействием окружающей среды. Причиной его является термодинамическая неустойчивость металла-восстановителя по отношению к окислителям, присутствующим в среде.
Коррозию по механизму взаимодействия металла со средой подразделяют:
а) на химическую;
б) электрохимическую;
в) биологическую;
г) радиационную.
Электрохимическая коррозия – это разрушение металла в среде электролита с возникновением внутри системы электрического тока.
По механизму электрохимической коррозии протекает атмосферная, почвенная коррозии, коррозия природными речными, морскими водами, электрокоррозия блуждающими токами.
Электрохимическая коррозия протекает, если между двумя участками металлической конструкции возникает «разность потенциалов».
Причины возникновения разности потенциалов между разными участками металлической конструкции
Контакт двух разных металлов.
Неоднородность сплава, из которого изготовлена конструкция.
Присутствие примесей, продуктов окисления металлов на поверхности.
Неоднородность состава коррозионной среды.
Различные механические напряжения.
Разница температур.
«Блуждающие токи».
Участки с меньшим значением окислительно-восстановительного потенциала называют анодными, с большим окислительно-восстановительным потенциалом – катодными участками.
Рассмотрим механизм электрохимической коррозии на примере контакта двух разных металлов:
 Среда электролита:H2O,O2
Среда электролита:H2O,O2
активный
неактивный металл
(1) металл (2)
Zn
2e
Sn ө
![]()


![]() Zn2+
OH-H2
Zn2+
OH-H2
![]() ө
ө
Zn2+ OH–, H2↑


φ1 = –0,76 <φ2 = –0,14
анодный участок катодный участок
Более активный металл характеризуется меньшим значением окислительно-восстановительного потенциала (φ1<φ2). Избыток электронов от активного металла –Zn(анодного участка) – переходит к неактивному металлу –Sn(катодному участку). Следовательно, на анодном участке с меньшим значением окислительно-восстановительного потенциала протекает реакция окисления активного металла.
Анодная реакция(на участке с меньшим окислительно-восстановительным потенциалом)
1) Ме(1) – ne– → Men+(1) (p-p)
активный
металл
Zn– 2e→Zn2+(p-p)
Катионы активного металла – Меn+(1)илиZn2+переходят в среду электролита, накапливаются у поверхности и раствор у анодного участка приобретает избыточный положительный заряд.
Неактивный металл на катодном участке – Sn– выполняет роль металлического проводника. Электроны перемещаются к поверхности катодного участка металла, где протекает реакция восстановления окислителей, присутствующих в среде электролита. Наибольшее значение имеют окислители кислород – О2и вода –Н2О (Н+).
Катодные реакции (на участке с большим окислительно-восстановительным потенциалом)
2) восстановление H2O(H+)
2H2O+ 2e–→H2+ 2OH–; (pH≥7) или 2H+ + 2e→H2; (pH<7)
3) восстановление О2
О2+ 2Н2О + 4е– → 4ОН–; (рН≥7) или О2+ 4Н+ + 4е → 2Н2О; (рН<7)
Анодные и катодные реакции протекают одновременно. Суммарные уравнения процессов коррозии можно составить, суммируя уравнения 1) и 2) или 1) и 3) с учетом коэффициентов электронного баланса.
