
КИНЕТИКА РЕАКЦИЙ В РАСТВОРАХ
.docКИНЕТИКА РЕАКЦИЙ В РАСТВОРАХ
Теория абсолютных скоростей реакций, строго говоря, применима только для рассмотрения реакций в идеальных газах, когда исходные частицы и активированный комплекс можно рассматривать изолированно от окружающей среды.
В растворе образование активированного комплекса из исходных частиц сопровождается теми или иными изменениями молекулярных взаимодействий реагирующих частиц с молекулами растворителя.
Жидкое состояние вещества является промежуточным между твердым и газообразным. Отличаясь от газа и твердого тела, жидкость имеет черты сходства с каждым из этих состояний.
Применение теории активированного комплекса к кинетике реакций в растворах
Для применения этой теории к жидкости необходимо учесть межмолекулярные взаимодействия исходных частиц и активированного комплекса с молекулами окружающей среды.
Рассмотрим уравнение переходного состояния:
![]() .
.
Раствор нельзя считать идеальным, так как имеется межмолекулярное взаимодействие, поэтому необходимо вместо Kc ввести Ka:
![]() ;
;
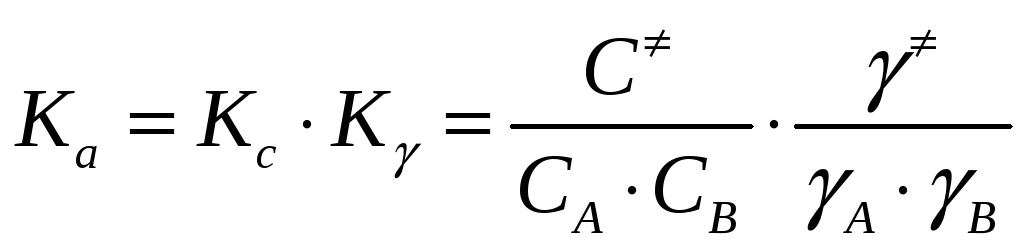 ,
,
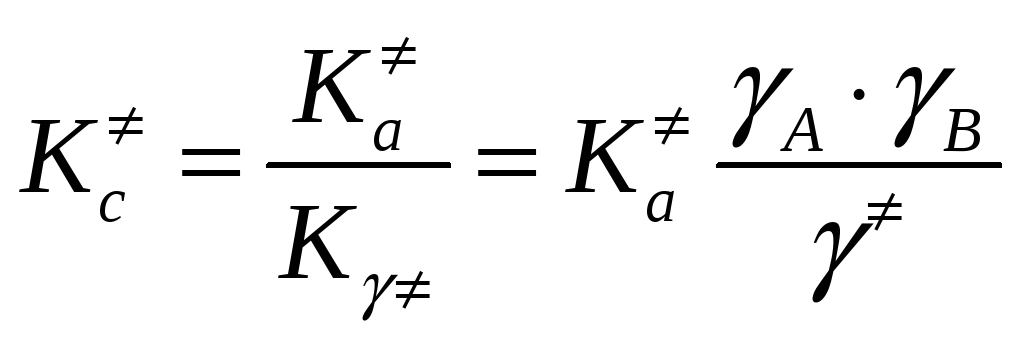 ,
,
![]() .
.
При = 1 система идеальная.
Если перейти к изобарному потенциалу, то
![]() ,
,
где
![]() – изобарный потенциал при активности,
равной единице.
– изобарный потенциал при активности,
равной единице.
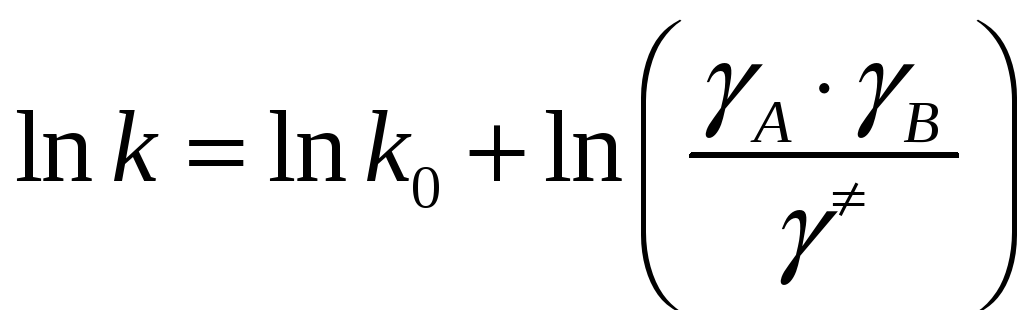 ,
,
k0 – константа скорости в среде, для которой коэффициенты активности исходных частиц и активированного комплекса приняты равными единице.
Это соотношение называется уравнением Бренстеда-Бьеррума. Данное уравнение в принципе решает вопрос о влиянии среды на скорость элементарной химической реакции, сводя задачу к определению коэффициента активности исходных веществ и активированного комплекса. Однако в то время как существует ряд методов, позволяющих измерить коэффициент активности исходных веществ, величину не удается экспериментально измерить из независимых данных. Поэтому уравнение Бренстеда-Бьеррума имеет лишь теоретическое значение.
Влияние среды на скорость гомолитических реакций
В гомолитических реакциях образование активированного комплекса не сопряжено с существенным перераспределением электрических зарядов между реагирующими атомами. Поэтому оно не должно сопровождаться сильным изменением межмолекулярных взаимодействий. В связи с этим можно ожидать, что переход от газовой фазы к жидкой не должен сильно сказываться на величине константы скорости гомолитической реакции. Как правило, изменение k лежит в пределах одного порядка.
Наиболее заметно влияние среды в гомолитических процессах реализуется при наличии клеточного эффекта. В общем случае, явление клеточного эффекта состоит в том, что две частицы растворенного вещества, оказавшись вблизи друг друга, как бы попадают в клетку из молекул растворителя и не могут сразу разойтись на значительное расстояние. Пока частицы находятся в клетке, существует повышенная вероятность их столкновения, и, следовательно, взаимодействия между ними. Особенно это проявляется в том случае, если частицы образуются в одной клетке.
Наиболее яркий пример – реакции гомолитического распада:

Вероятность выхода радикалов в объем (e) равна:
![]() ;
;
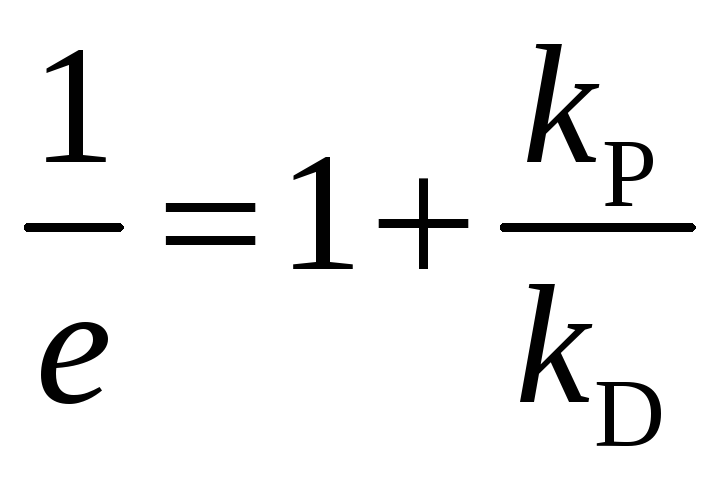 .
.
Влияние среды на скорость гетеролитических реакций
В разбавленных растворах зависимость коэффициента активности иона от ионной силы описывается уравнением Дебая-Гюккеля:
![]() ,
,
где zi – заряд иона.
Если реагируют zA и zB, то z = zA + zB.
![]() ,
,
![]() ,
,
![]() ,
,
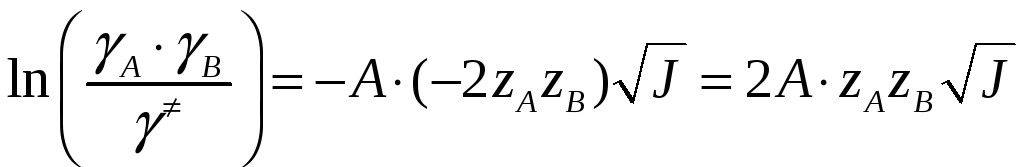 .
.
Это влияние ионной силы называют первичным солевым эффектом.
![]()
Уравнение Дебая-Гюккеля является приближением и верно лишь для разбавленных растворов. Изменение ионной силы приводит к изменению степени диссоциации слабого электролита.
![]() ,
,
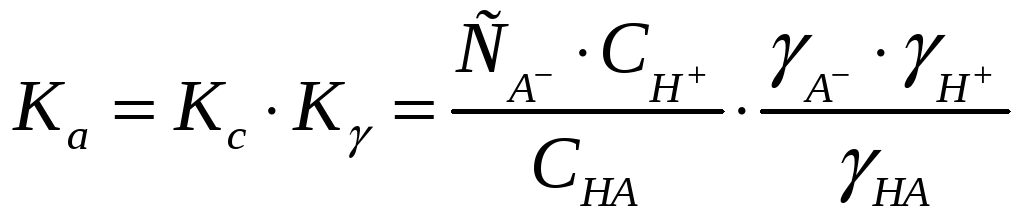 .
.
С ростом ионной силы величины A и H убывают, так как K падает, Ka = Const. В результате Kc растет и константа скорости реакции увеличивается. Это явление называют вторичным солевым эффектом
