
5 курс / Пульмонология и фтизиатрия / РОЛЬ_НЕЙРОНОВ_ИНТРАМУРАЛЬНЫХ_ГАНГЛИЕВ
.pdf2013; Knight et al., 1990); это может быть связано с потерей метаболизирующего фермента. Кроме того, экспериментальные вирусные инфекции привели к уменьшению эпителиальной активности HMT в сочетании с увеличением чувствительности к ингаляционному гистамину (Nakazawa et al., 1994).
1.4.3. ВЛИЯНИЕ ГИСТАМИНА НА ФУНКЦИОНАЛЬНУЮ АКТИВНОСТЬ
ГЛАДКОЙ МЫШЦЫ НИЖНИХ ДЫХАТЕЛЬНЫХ ПУТЕЙ
Внастоящее время известно о роли метасимпатических интрамуральных ганглиев в регуляции функциональной активности гладкомышечной стенки дыхательного тракта. Воздействие гистамина на гладкую мускулатуру респираторных путей также происходит
сучастием интрамуральных ганглиев, включающих как парасимпатические, так и метасимпатические нейроны (Федин, 1997, 2001). Гистаминергические реакции гладкой мускулатуры опосредуются через трахеобронхиальные быстро и медленно адаптирующиеся рецепторы растяжения, которые расположены в эпителиальном и мышечном слое (Matsumoto et al., 1992; Matsumoto et al., 1993). Рецепторы растяжения локализуются в эпителиальном слое, и их раздражение вызывает сократительную активность гладкомышечных клеток. Возбуждение трахеобронхиальных рецепторов растяжения способствует рефлекторной констрикции гладкой мышцы респираторных путей и кашлевому рефлексу (Cardell, Edvinsson, 1994).
Вверхних отделах дыхательных путей Н1-рецепторов гистамина больше, чем в нижних, что имеет существенное значение в степени выраженности бронхоспазма в бронхиолах (Bayat et al., 2009).
При исследованиях реакций гладкой мускулатуры трахеи и бронхов, которые были вызваны стимуляцией электрическим полем, установлено, что высокие концентрации гистамина вызывают сократительные ответы, оказывая влияние непосредственно на гладкомышечные клетки. Действие низких концентраций носит более сложный характер. В диапазоне самых низких концентраций гистамин уменьшает амплитуду ответов гладкой мускулатуры, а при использовании более высоких доз вещества наблюдается увеличение амплитуды сокращения. Применение новокаина снижало действие низких и высоких доз гистамина на гладкую мускулатуру респираторных путей при данном виде стимуляции (Федин, 2003). При этом гистамин взаимодействует
40
https://t.me/medicina_free
с трахеобронхиальными рецепторами, которые вызывают усиление или снижение реакций гладкой мускулатуры на стимуляцию электрическим полем. Кроме того, в осуществлении потенцирующих и дилатационных влияний могут участвовать разные группы нейронов метасимпатического функционального модуля (Федин, 1997).
Влияние гистамина на эпителиальные клетки стимулирует в них производство простогландидов Е1, Е2 и F2, которые являются релаксантами для гладкой мускулатуры трахеи и бронхов и расслабляют гладкую мускулатуру респираторных путей. Эти эффекты гистамина опосредуются Н1-рецепторами (Кукес, 2009).
Также известно, что Н3-рецепторы могут снижать сокращения, вызванные активацией парасимпатических нервов, модулируя как активность холинергических нейронов, так и эфферентных нервных окончаний (Godlewski et al., 1997).
Гистаминовые рецепторы трансдуцируют внеклеточные сигналы через различные G-белки: Gq/11 для H1Rs, G s-α для H2Rs, Gi/o для H3Rs и H4Rs (Metcalfe et al., 1997). Активация или ингибирование HRs значительно увеличили влияние гистамина в патологических болезненных состояниях (Metcalfe et al., 1997; Thurmond et al., 2008).
Tripathi T. и др. продемонстрировали кратковременные эффекты гистамина на образование антител, на которые влияла концентрация гистамина (Tripathi et al., 2009; Tripathi et al., 2010).
Гистамин H1R играет основную роль в модуляции полных иммуноглобулинов и продемонстрировал сильные эффекты в гене IgG, тогда как H2R играет доминирующую роль в генерации IgM и продемонстрировал свою основную роль в дифференцировке и пролиферации B-клеток, как положительно, так и отрицательно регулируя продукцию антител (Tripathi et al., 2010). Более того, недавнее иммунотоксическое исследование HR-агониста показало, что HTMT, амтэмин и клобенпропит (H1-, H2- и H4-агонист соответственно) играют важную роль в модуляции уровня генерации антител, среди которых HTMT играет доминирующую роль по сравнению с другими. Напротив, R-[-]-альфа- метилгистамин (H3-агонист) имеет доминирующую ингибирующую роль в продуцировании антител (Tripathi et al., 2010). H1R расположен на гладких мышцах, эндотелии и центральной нервной системе; H2R на теменных клетках; H3R в основном на центральной и, в меньшей степени, на ткани периферической нервной системы; в то время как H4R обнаружен первичным в базофилах и костном мозге (Shahid et al.,
41
https://t.me/medicina_free
2009; Yamashita et al., 1991; Gantz et al., 1991; Lovenderg et al., 1999; Nguyen et al., 2001). Гистамин-индуцированное бронхиолярное сужение вовлечено в первую фазу бронхиальной астмы (Rang et al., 1995). Учеными обнаружено, что у особей с астмой гистамин увеличивает тонус гладкой мускулатуры дыхательных путей и вызывают отек слизистой оболочки, а также железистую секрецию, что приводит к сужению дыхательных путей и ограниченному потоку воздуха. У здоровых особей бронхиальная активность на гистамин была ограничена, скорее всего, из-за меньшего количества H1Rs в гладких мышцах дыхательных путей (Goldie, 1990). Гистамин и его рецепторыагонисты имеют обширное влияние на многие анатомические структуры живого организма (Naushad et al., 2010).
Различные экспериментальные исследования (in vivo и in vitro, как нормальные, так и патологические состояния) с гистамином выявили различные влияния его на различные типы тканей и в разных условиях. Гистамин и его агонисты-рецепторы в целом оказывают дифференциальное стимулирующее действие на эпителий как крупных (трахея и бронхи), так и мелких (бронхиолы) дыхательных путей. Эти наблюдения могут быть подтверждены многими исследованиями, которые предполагают, что гистамин индуцируется эндотелиальными клетками для синтеза релаксантов сосудов гладких мышц, включая простациклин и оксид азота, что вызывает вазодилатацию (Abbas et al., 1994), увеличение концентрации эпидермального фактора роста (EGF) (Tunio, Hobsley, 1995). Однако было показано, что наряду с индукцией гепатоцеллюлярной дегенерации различной интенсивности гистамин и его агонист-рецепторы также индуцируют многоядерность в гепатоцитах. Агонисты гистамина оказывают дифференциальное воздействие на респираторный эпителий (Naushad et al., 2010).
Из представленных выше фактов, становится понятно, что влияние гистамина на гладкую мускулатуру респираторной системы, исследовалось учеными неоднократно. Имеется конкретная информация о воздействии высоких доз гистамина на респираторный тракт, которые приводят к бронхоконстрикции. Но в своих работах исследователи рассматривают дилатирующее влияние гистамина при исходно повышенном тонусе гладкой мускулатуры, искусственно вызванном фармакологическими веществами или применением специфических констрикторных факторов. Следует отметить, что вышеописанные
42
https://t.me/medicina_free
реакции гладкой мускулатуры носят уже измененный патологический характер. Также остаются открытыми вопросы о роли нейронов интрамуральных ганглиев при воздействии гистамина на гладкую мускулатуру трахеи и бронхов. Между тем именно деятельность нейронов функционального модуля обеспечивает автоматизм работы гладкой мускулатуры нижних респираторных путей. Непонятной остается также взаимосвязь между разными нервными структурами, которые влияют на реактивность гладкой мускулатуры трахеи и бронхов, и гистаминовыми рецепторами, определяющими реакцию мышцы на предъявление гистамина.
43
https://t.me/medicina_free
ГЛАВА 2. СОВРЕМЕННОЕ ПРЕДСТАВЛЕНИЕ
ОРОЛИ НЕЙРОНОВ ИНТРАМУРАЛЬНЫХ ГАНГЛИЕВ
ВФИЗИОЛОГИЧЕСКИХ РЕАКЦИЯХ ГЛАДКОЙ МЫШЦЫ ТРАХЕИ И БРОНХОВ
Концентрация, длительность и формы предъявления гистамина влияют на эффективность воздействие медиатора на гладкие мышцы. Влияние гистамина на нервные и рецепторные структуры дистальных отделов трахеи и бронхов разнообразно. В данной главе авторы представляют свои исследования, проведенные в рамках научно-исследо- вательской деятельности кафедры безопасности жизнедеятельности и здоровьесберегающих технологий Петрозаводского государственного университета, при поддержке и участии лаборатории сравнительной физиологии дыхания Института эволюционной физиологии и биохимии им. И. М. Сеченова Российской академии наук.
Эксперименты проводились по электрофизиологическим методикам, которые представлены в трудах А. Д. Ноздрачева, А. Н. Федина, Е. В. Алиевой (1997), J. A. Hey, M. del Prado, R. W. Egan. W. Kreuther and R. W. Chapman (1992), J. L. Burgaud, N. Oudart (1993), G. Godlewski,
В.Malinovska, W. Buczko, Е. Schlicker (1997), B. J. Canning, S. M. Reynolds and S. B. Mazzone (2001), Yu Shaoyong, М. Kollarik, А. Ouyang, А. С. Myers,
В.Undem (2007). Эксперименты проводились на изолированных препаратах трахеи и бронхов, на 68 крысах линии Вистар. Исследовались самки и самцы, их масса тела составляла 220—350 г., возраст 2—3 месяца. Эвтаназию животных производили путем помещения в камеру с хлороформом. Изучались сокращения гладкой мускулатуры, которые вызвались электрической стимуляцией и воздействием фармакологических веществ. На каждом препарате проводили 3—4 серии экспериментов. Каждая серия предполагала исследование нового фармакологического вещества. После каждой серии производили отмывание препаратов физиологическим раствором в течение 30 мин.
Эксперименты были разбиты на 4 этапа. Во время первого этапа изучалось влияние 0,01—100 мкг гистамина на тонические сокращения гладкой мускулатуры трахеи и бронхов и констрикция, вызванная стимуляцией мышцы. Рассматривались действия гистамина на фоне блокаторов гистаминовых рецепторов 100 мкг супрастина, 100 мкг/мл циметидина, 100 мкг бетагистина. На втором этапе исследовалась активность гладкой мышцы при воздействии 0,1—10 мкг гистамина
44
https://t.me/medicina_free
при стимуляции постганглионарных нервов. Применялась блокада гистаминовых рецепторов (в тех же концентрациях) и блокада нервномышечной передачи (1 мкг/мл атропина). Третий этап эксперимента был посвящен рассмотрению ответов гладкой мышцы на 0,1—10 мкг гистамина при стимуляции преганглионарных нервов. Определялось участие быстро и медленно адаптирующихся рецепторов растяжения и С-волокон в реакциях гладкой мускулатуры, для чего применялись анестетик новокаин 1 мкг/мл и капсаицин 1 мкг/мл и антагонисты гистаминовых рецепторов в указанных выше концентрациях. Исследовались ответы гладкой мускулатуры на фоне блокады межнейронной передачи 10 мкг гексаметония. На четвертом этапе эксперимента выяснялась роль тормозной НАНХ-системы в реакциях гладкой мускулатуры трахеи и бронхов на действие 0,1—10 мкг гистамина, для чего применялись ингибитор синтеза оксида азота L-NAME 10 мкг и ингибитор циклической гуанилат циклазы метиленовый синий 20 мкг.
2.1. ЭФФЕКТЫ ГИСТАМИНА ПРИ РАЗНЫХ ВИДАХ ЭЛЕКТРОСТИМУЛЯЦИИ
Гистаминовые Н1-рецепторы сосредоточены на гладкомышечных клетках и в рецепторах растяжения. В результате проведенных нами экспериментов было установлено, что Н1-рецепторы локализованы также на постганглионарных холинергических волокнах. Достаточно актуально выяснить роль всех этих групп рецепторов в реакции гладкой мышцы на низкие дозы гистамина.
Результат сокращения гладкой мышцы является итоговой суммой всех возбуждающих и тормозящих влияний на гладкую мышцу (Jolly, Desmecht, 2003). В связи с существованием различных подтипов гистаминовых рецепторов гистамин вызывает различные варианты ответов (Müller et al., 2006). В наших опытах гистамин в низких (0,01— 10 мкг) концентрациях в зависимости от вида электрической стимуляции вызывал различные ответы (рис. 35).
Гистамин в низкой концентрации уменьшал мышечные ответы при электрической стимуляции самих миоцитов; увеличивал ответы при возбуждении электрическим током постганглионарных волокон; вызывал двухфазный ответ при стимуляции преганглионарных нервов — низкие концентрации снижали ответы мышцы, а повышенные — приводили к констрикторному эффекту.
45
https://t.me/medicina_free
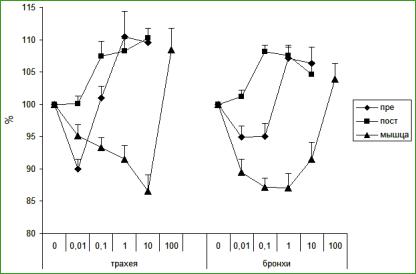
Рис. 35. Ответы трахеи и бронхов при стимуляции
пре- и постганглионарных нервов и мышцы
По оси абсцисс — доза гистамина в мкг, по оси ординат — изменение ответов в процентах, за 100 % приняты ответы препаратов трахеи и бронхов в физиологическом растворе. Условные обозначения: «пре», «пост» и «мышца» — стимуляция пре- и постганглионарных нервов и мышечных клеток соответственно
2.2. ВЛИЯНИЕ Н1-РЕЦЕПТОРОВ, РАСПОЛОЖЕННЫХ НА АФФЕРЕНТНЫХ
ИЭФФЕРЕНТНЫХ НЕЙРОНАХ, НА АКТИВНОСТЬ ГЛАДКОЙ МЫШЦЫ
Внаших экспериментах мы провели оценку сократительной активности мышцы трахеи и бронхов на фоне заблокированных Н1
иН2-рецепторов. Для блокады гистаминовых рецепторов I типа применялся супрастин. Н2-рецепторы блокировали циметидином. При стимуляции гладкой мышцы электрическим полем устранение физиологического эффекта Н1-рецепторов приводило к понижению ответов до 92,4 % на препаратах трахеи и до 83 % — на бронхах (рис. 36.). В бронхах реакция на блокаду Н1-рецепторов была более выражена (ответы понижались сильнее, чем в трахее). Подобные результаты экспериментов могут свидетельствовать не только о констрикторной
46
https://t.me/medicina_free

%
100
90
трахея
бронхи
80
70
60
50
40
мышца |
пост |
пре |
пост + атр |
Рис. 36. Ответы гладкой мышцы трахеи и бронхов на гистамин
при блокаде Н1-рецепторов
По оси абсцисс — вид стимуляции, по оси ординат изменение ответов в процентах, за 100 % приняты ответы препаратов трахеи и бронхов в физиологическом растворе. Условные обозначения: «пре», «пост» и «мышца» — стимуляция пре- и постганглионарных нервов и мышечных клеток соответственно
роли Н1-рецепторов, но и о большей плотности этих рецепторов
вбронхах по сравнению с трахеей.
Вслучае одновременной блокады Н1 и Н2-рецепторов сократительной реакции в ответ на гистамин не наблюдалось.
Вопытах, где применялась только блокада Н2-рецепторов, регистрировалось увеличение сократительной реакции гладкой мышцы до 109,9 % на препаратах трахеи и до 115,3 % — на бронхах. Аналогичные результаты были получены как отечественными физиологами — А. Н. Фединым, Е. Н. Крюковой, так и зарубежными специалистами — Matsumoto, Costello (Matsumoto, 1992; Федин и др., 1997; Costello et al., 1999; Федин, Крюкова, 2001). В препаратах трахеи и бронхов крупного рогатого скота реакция на блокаду Н1-рецепторов отличалась от реакции респираторного тракта крысы. Гладкая мышца
47
https://t.me/medicina_free
трахеи крупного рогатого скота характеризовалась большим снижением ответов, чем мышца бронхов при блокаде Н1-рецепторов (Jolly, Desmecht, 2003).
Стимулирование электрическим полем постганглионарных волокон (блокада Н1-рецепторов) понижало ответы трахеи и бронхов до 84—87 % соответственно. Достоверной разницы между ответами трахеи и бронхов не было. Введение в ванночки с препаратами небольших концентраций гистамина (10 мкг) приводило к снижению сократительного ответа мышцы трахеи до 74 % и бронхов до 92 %.
Блокада нервно-мышечной передачи атропином практически не изменяла разницы в эффекте гистамина на трахею и бронхи; эффект на трахее примерно на 13 % был выражен сильнее, чем на бронхах.
При стимуляции преганглионарных нервов 10 мкг гистамина приводили к увеличению ответов трахеи и бронхов. В условиях этой же стимуляции блокада Н1-рецепторов или блокада рецепторов растяжения новокаином устраняли эту реакцию на гистамин. Вероятно, гистамин влияет на нервные окончания рецепторов растяжения. По данным японского исследователя Matsumoto, в респираторном тракте кролика при ингаляции гистамином наблюдалась появление потенциалов действия на рецепторы растяжения (Matsumoto et al., 1993). Аналогичные результаты были получены в опытах на респираторном тракте морской свинки (Canning et al., 2001).
Таким образом, можно заключить, что в сократительной активности гладкой мышцы трахеи и бронхов ведущую роль играют Н1-рецепторы, располагающиеся на постганглионарных холинергических нервах и контролирующие высвобождение ацетилхолина в нейромышечных синапсах.
В условиях патологии ведущее значение может переходить к Н1-ре- цепторам, локализованным непосредственно на миоцитах, что приводит к увеличению бронхоспазма (Canning et al., 2006).
2.3. СРАВНЕНИЕ ФУНКЦИИ ГИСТАМИНОВЫХ МЫШЕЧНЫХ Н2-РЕЦЕПТОРОВ И НЕЙРОНАЛЬНЫХ Н3-РЕЦЕПТОРОВ
Согласно данным научной литературы, Н2-рецепторы сосредоточены в большом количестве на мышце. Н2-рецепторы локализованы на гладкомышечной ткани, а локализацию Н3-рецепторов связывают с тормозной НАНХ-системой (Burgaud et al., 1992). В наших предыду-
48
https://t.me/medicina_free

щих исследованиях было показано, что Н3-рецепторы сосредоточены на чувствительных нервных окончаниях С-волокон и на постганглионарных тормозных нервах. Большой интерес представляют эксперименты по изучению роли тормозных Н2- и Н3-рецепторов в сокращении гладкой мышцы респираторного тракта. Ниже приведены результаты опытов, демонстрирующие влияние этих рецепторов на эффекты гистамина при различных видах электрической стимуляции.
На фоне стимуляции мышцы устранение эффектов Н2-рецепторов циметидином вызывало увеличение сократительной реакции. На препаратах бронхов этот эффект был более выражен относительно фоновой реакции.
Антагонисты Н2-рецепторов увеличивали опосредованный гистамином тонус мышцы трахеи морской свинки (Koga et al., 1987). На фоне блокады Н3-рецепторов гистамин не изменял тонуса трахеи (рис. 37).
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
130 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
120 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
110 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
100 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
% |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
трахея |
|
90 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
бронхи |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
80 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
70 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
60 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
50 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
мыш |
|
пост |
|
пре |
|
|
|
мыш |
|
пост |
|
пре |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
цим |
|
|
|
|
|
|
|
бета |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 37. Влияние гистамина на сокращения трахеи и бронхов
при блокаде Н2- и Н3-рецепторов
По оси абсцисс — вид стимуляции, по оси ординат изменение ответов в процентах, за 100 % приняты ответы препаратов трахеи и бронхов в физиологическом растворе. Условные обозначения: «пре», «пост» и «мыш» — стимуляция пре- и постганглионарных нервов и мышечных клеток соответственно, «цим» — блокатор Н2-рецепторов циметидин, «бета» — блокатор Н3-рецепторов бетагистин
49
https://t.me/medicina_free
