
6 курс / Клинические и лабораторные анализы / ткаченко, кровь
.pdf
ГЛАВА 9. ФУНКЦИИ СИСТЕМЫ КРОВИ
Цельная кровь человека состоит из жидкой части (плазмы) и форменных элементов,которыми являются эритроциты, лейкоциты и кровяные пластинки - тромбоциты .
Функции крови:
1)транспортная - перенос газов (О2 и СО2), пластических (аминокислот, нуклеозидов, витаминов, минеральных веществ), энергетических (глюкоза, жиры) ресурсов к тканям, а конечных продуктов обмена - к органам выделения (желудочнокишечный тракт, легкие, почки, потовые железы, кожа);
2)гомеостатическая - поддержание температуры тела, кислотно-щелочного состояния организма, водно-солевого обмена, показателей газового обмена (O2 и CO2);
3)защитная - обеспечение иммунных реакций, кровяного и тканевого барьеров против инфекции, регенерации тканей;
4)регуляторная - обеспечение гуморальной и гормональной регуляции функций систем и тканей организма;
5)секреторная - образование клетками крови биологически активных веществ.
9.1.ФУНКЦИИ ПЛАЗМЫ КРОВИ
Плазма является для клеток крови жидкой средой, обеспечивающей их нормальное функционирование. Плазма крови состоит из воды (около 90 % массы), солей или электролитов (0,9 %), углеводов, липидов (1,1 %), органических кислот и оснований, промежуточных продуктов обмена, витаминов и белков (8 % массы плазмы). Объем циркулирующей крови, включающий форменные элементы и плазму крови, у взрослого человека составляет 6-8 % массы тела (4-6 л), или 62,4±7,8 мл/кг массы тела. Из них на долю циркулирующей плазмы крови - 28,2±4,0 мл/кг. Процентная часть объема, занимаемая клетками, от общего объема крови называется гематокритом. Гематокрит в норме при нормоцитемии (т. е. при нормальном содержании форменных элементов в крови) у мужчин равен 44-48 %, у женщин - 41-45 %.
Электролитный состав плазмы представлен катионами Na+, K+, Ca2+, Mg2+, Fe3+, Zn2+ и Cu2+., анионами Cl-, HCO3-, HPO4-, HSO4-, органическими кислотами и анион-
протеинатами. Суммарная величина анионов и катионов в плазме крови, выраженная в мэкв/л, примерно одинакова и составляет около 154 мэкв/л каждая. Электролиты формируют осмотическое давление плазмы.
Осмолярность, создаваемая концентрацией ионов Na+ и Cl-, в плазме крови составляет около 250 мОсм/л. Суммарная осмолярность плазмы крови складывается из осмолярности растворенных в ней как электролитов, так и неэлектролитов (глюкозы, мочевины, белков) и достигает 301,8 мОсм/л. Однако так называемое скорректированное значение осмолярности плазмы, связанное с введением поправок на взаимодействия между молекулами и ионами, составляет 282 мОсм/л. Концентрация ионов в 1 мОсм/л раствора при температуре 37 °С, создает осмотическое давление, равное 19,3 мм рт. ст. Отсюда осмотическое давление плазмы крови человека составляет 5443 мм рт. ст. Ионный состав плазмы крови и межклеточной жидкости почти одинаков. Однако осмотическое давление последней ниже, чем в плазме, и равно 5423 мм рт. ст. Объясняется эта разница меньшим содержанием белка в интерстициальной жидкости, чем в плазме крови. Концентрация белков в плазме крови достигает 0,8 ммоль/л, а формируемое ими осмотическое давление - 0,8 мОсм/л, или 14 мм рт. ст. Однако плазма крови с указанной концентрацией белков создает осмотическое давление, равное 28 мм рт. ст. Объясняется это тем, что белки, будучи отрицательно заряженными ионами, удерживают вблизи их молекул большое число положительно заряженных ионов (катионов, в основном ионов
натрия). Эти добавочные катионы увеличивают величину осмотически активных веществ в плазме крови и делают ее осмотическое давление на 50 % больше, чем создаваемое только белками (эффект равновесия Даннона). Осмотическое давление, создаваемое белками плазмы, получило название коллоидно-осмотического, или онкотического давления (Ронк) плазмы и составляет 28 мм рт. ст. На 80 % Ронк плазмы создается альбуминами, на 15-18 % - глобулинами. Ронкплазмы крови делает возможным постоянное поступление воды в кровеносные капилляры из тканей, так как интерстициальная жидкость имеет более низкое Ронк (8 мм рт. ст.), чем плазма крови. Связано это с тем, что в растворе с меньшим осмотическим давлением, т. е. с меньшей осмолярностью, присутствует больше осмотически свободной воды, чем в растворе с большей осмолярностью. В результате давление большей концентрации свободных молекул воды на стенку капилляра, являющуюся полупроницаемой мембраной, создает диффузию молекул воды во внутрисосудистый сектор, имеющий большее осмотическое давление и, следовательно, меньшую концентрацию свободных молекул воды. Выход воды из плазмы крови в интерстициальную жидкость возможен благодаря тому, что в артериальном конце капилляра гидростатическое давление крови (сила, выталкивающая воду из сосуда - Ркапил) равна 30 мм рт. ст. и превосходит Ронк плазмы (т. е. силу, удерживающую воду в сосуде, равную 28 мм рт. ст.). Выходу жидкости из капилляра в интерстиций способствуют также отрицательное по отношению к атмосферному давлению давление интерстициальной жидкости, равное 3 мм рт. ст., и Ронк этой жидкости, притягивающее воду в интерстиций, равное 8 мм рт. ст. Таким образом, общее давление сил, вытесняющих жидкость из сосуда в интерстициальное пространство, составляет 41 мм рт. ст. и преодолевает силу, удерживающую жидкость в сосуде, равную 28 мм рт. ст. Следовательно, фильтрационное давление, перемещающее жидкость из капилляра в ткань, составляет:
Рис. 9.1. Обмен воды между плазмой крови в капиллярах и интерстициальной жидкостью.
204 |
205 |
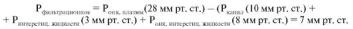
В результате, в артериальной части капилляров имеет место выход воды, составляющий 0,5 % плазмы крови, в интерстициальное пространство. Напротив, в венозной части капилляров, где Ркапил крови снижается до 10 мм рт. ст. и становится меньше Ронк, т. е. силы, возвращающей жидкость в сосуд (28 мм рт. ст.), вода интерстициальной жидкости диффундирует в капилляр (рис. 9.1).
где Ркапил = 30 мм рт. ст.; Ринтерстиц. жидкости =3 мм рт. ст.; Ронк. интерстиц. жидкости =8 мм рт.
ст.; Ронк. плазмы = 28 мм рт. ст.
Возврат воды из интерстиция в капилляры составляет 90 % от объема жидкости, профильтровавшейся в артериальной части капилляров. Остальное количество жидкости возвращается из интерстиция в кровоток по лимфатическим сосудам.
Белки плазмы крови Белки плазмы крови обеспечивают:
1)коллоидно-осмотический, кислотно-щелочной и водный гомеостазис;
2)агрегатное состояние крови и ее реологические свойства (вязкость, свертываемость, суспензионные свойства);
3)перенос органических веществ - липидов, аминокислот, гормонов, витаминов, неорганических - Fe, Mg, Ca и др. к тканям, продуктов обмена (билирубина и др.) - к органам выделения;
4)питательную функцию крови, как резерва аминокислот;
5)детоксикационную функцию; иммунные реакции.
Общее количество белков в плазме крови в норме составляет 70-80 г/л, в том числе фибриногена - 2-4 г/л. С помощью электрофореза белки сыворотки крови у человека разделяются на следующие фракции: преальбумин, альбумин, α1-, α2-, β-и γ- глобулины.Отношение фракции альбумины/глобулины в сыворотке крови у взрослого человека составляет от 1,3 до 2,3. Преальбумины выполняют в основном транспортную функцию, перенося гормон тироксин, ретинол (производное витамина А). В норме количество преальбуминов составляет 0,18-0,37 г/л сыворотки. Недостаток белка или цинка в рационе человека нарушает синтез и уменьшает концентрацию преальбумина в сыворотке крови. Альбумины - это низкомолекулярные белки с молекулярной массой, равной 69 000. Образуются в печени, поэтому при ее заболевании (цирроз печени) их количество в крови уменьшается. Одна треть общего количества альбуминов (200-300 г) в организме взрослого человека находится в крови (37-55 г/л сыворотки крови), а две трети - вне сосудистого русла, во внеклеточной жидкости. Между кровью и внеклеточной жидкостью происходит непрерывный обмен молекулами альбумина. Функции альбумина:
1)в крови и тканях участвует в формировании коллоидно-осмотического (онкотического) давления, поддерживая транскапиллярный обмен жидкости, тургор тканей и объем жидкости во внутрисосудистом и внеклеточном пространствах;
2)легко соединяясь с органическими (билирубин, свободные жирные кислоты) и неорганическими (ионы Mg, Ca и др.) веществами, стероидными гормонами (с прогестероном и др.), лекарственными средствами (антибиотики, сердечные гликозиды), транспортирует их с током крови в ткани и, напротив, многие продукты метаболизма - от тканей к районам их выведения из организма (например, билирубин, образовавшийся в ходе разрушения гемоглобина) - к печени, почкам, легким, желудочно-кишечному тракту, способствуя детоксикационной функции организма;
3)является компонентом белковой буферной системы плазмы крови, регулирующей кислотно-щелочное равновесие;
4)легко расщепляется в тканях до аминокислот, используемых клетками в качестве пластических и энергетических ресурсов.
Глобулины имеют высокую молекулярную массу (105 000-900000). Их концентрация составляет около 30 % от общей массы белков в сыворотке крови. α-
глобулины - это гликопротеины, связанные с углеводами (2/3 всей глюкозы плазмы циркулирует в составе гликопротеинов); они являются транспортными белками для гормонов, витаминов и микроэлементов, а также липидов, участвуя в образовании липопротеидных комплексов, в составе которых переносятся триглицериды, фосфолипиды, холестерин и сфингомиелины. β-глобулины - богатая липидами фракция белка, которая содержит 3/4 всех липидов плазмы крови, в том числе фосфолипиды,
холестерин и сфингомиелины. β-глобулины выполняют функцию белков-переносчиков различных соединений (например, α- и β- глобулины - так называемые транскобаламины) - участвуют в переносе витамина В12 с кровью от кишечника к тканям;β1-глобулин-трансферрин - связывает и переносит железо. α- и β- глобулины участвуют в формировании «острофазных белков крови» (название связано с выявлением этих белков в крови при остром начале заболевания) (α1-глобулины содержат α1-антитрипсин и α1-кислый гликопротеин; α2-глобулины - содержат гаптоглобин, α2- макроглобулин, церуллоплазмин, β1-глобулин - гемопексин, белок гепцидин). В организме человека острофазные белки крови создают наряду с иммунной системой и гранулоцитарно-моноцитарной линиями кроветворной ткани надежный барьер против инфекций, поступления (или образования) в организме токсических веществ. Так, С- реактивный белок преципитирует соматический пневмококковый полисахарид, активирует комплементзависимую цитотоксичность, фагоцитарную активность нейтрофилов и макрофагов, тормозит агрегацию тромбоцитов. Фибронектин обладает опсонизирующей функцией (от греческогоopsoneim - делать съедобным), способствует фагоцитозу бактерий нейтрофилами и моноцитами/макрофагами. Амилоид А очищает плазму от токсических субстанций; α1-антитрипсин тормозит протеолиз, угнетая активность протеаз, высвобождающихся при разрушении лейкоцитов и клеток тканей. α1-кислый гликопротеин модулирует функции Т- и В-лимфоцитов (синтез антител, активность Т-киллеров, антителзависимую цитотоксичность). Церулоплазмин является антиоксидантом и антиагрегантом. Значительная часть β-глобулинов сыворотки крови представлена белками свертывающей, антисвертывающей и фибринолитической системы крови. Главной функцией γ-глобулинов является обеспечение гуморального иммунитета (глава 10). Продукты белкового обмена, углеводы и липиды плазмы крови
Остаточный или белковый азот крови - это азотосодержащие продукты белкового катаболизма (мочевина, мочевая кислота, креатин, свободные аминокислоты, индикан). Величина остаточного азота (в норме 14,3-28,6 ммоль/л) отражает эффективность выделения продуктов белкового обмена через почки. Повышение остаточного азота и его компонентов в крови является важным диагностическим показателем нарушения их экскреторной функции. Концентрация мочевины в плазме крови в норме составляет 300+75 мг/л, т. е. около 50 % небелкового азота плазмы. Мочевина - это конечный продукт деградации белков, который подлежит выведению из организма. Увеличение ее концентрации в крови, так же как и креатинина (в норме 9-11 мг/л плазмы), отмечается при почечной недостаточности. Мочевая кислота - это конечный продукт метаболизма пуринов.В норме ее концентрация составляет 50 мг/л плазмы. Увеличение в крови мочевой кислоты характерно для подагры. Содержание свободных аминокислот достигает 500 мг/л плазмы. Уменьшенное их содержание в сыворотке или плазме крови наблюдается у больных с анемиями и объясняется усиленным использованием аминокислот в костном мозге для синтеза гемоглобина.
Углеводы крови - более 90 % приходится на глюкозу - главный источник энергии для клеток, образуемой при аэробном или анаэробном гликолизе. У человека содержание глюкозы, определенное натощак в цельной крови, в норме составляет 0,8-1,2 г/л крови.
Общее содержание липидов в плазме крови достигает 5-8 г/л. Разделенные с помощью электрофореза (или ультрацентрифугированием), они обнаруживают на липидограмме гетерогенный состав и включают холестерин, фосфолипиды, триглицериды, жирные кислоты. Взаимодействие этих липидов с белками-апопротеинами
206 |
207 |
формируетлипопротеины высокой плотности (ЛПВП), состоящие на 50-60 % из белков; липопротеины низкой плотности (ЛПНП), очень богатые жирами и лишь на 20-25 % состоящие из белков, и, наконец, липопротеины очень низкой плотности (ЛПОНП), на 90 % состоящие из липидов. ЛПНП и ЛПОНП переносят от печени к другим тканям липиды, а ЛПВП транспортируют избыточный холестерин из тканей в печень, где он и его эфиры превращаются в желчные кислоты и выводятся с желчью в кишечник, а затем - из организма.
Среди органических кислот в плазме крови в наибольших количествах представлены молочная кислота (80-100 мг/л), пировиноградная (3-8 мг/л) и лимонная (9-13 мг/л). Рост уровня молочной кислоты в крови, например, свидетельствует об усилении анаэробного гликолиза, что имеет место в организме после интенсивной физической работы.
Факторы, обеспечивающие жидкое состояние крови Жизнедеятельность клеток организма, транспорт питательных веществ, продуктов
обмена и газов кровью, протекающие в ней биохимические и иммунные реакции могут осуществляться только при сохранении жидкого состояния крови. Поэтому они нарушаются при агрегации (склеивании друг с другом) клеток крови. Поддержание крови в жидком состоянии обеспечивается системой гемостаза (сбалансированным соотношением компонентов свертывающей, антисвертывающей и фибринолитической систем крови), электрохимическими свойствами клеток и белков крови. Электрохимические заряды расположены на поверхности или вокруг этих структур крови и сохраняют эритроциты, а также другие клетки крови во взвешенном состоянии в кровеносном русле, обеспечивают устойчивость дисперсии белков в плазме крови. Поэтому поток крови в сосудах представляет собой движение заряженных отрицательно частиц (клеток крови, белков плазмы), что приводит к формированию электростатического распора, обеспечивающего расстояние между клетками и коллоидными элементами крови, препятствующее их агрегации. Препятствуют агрегации клеток в потоке крови также силы поверхностного натяжения мембран клеток, гидродинамические (механические) силы, перемещающие клетки в направлении тока крови. Солидизации (соединению клеток крови в агрегаты различной величины) способствуют снижение энергии движущейся по сосудам крови, например, в результате ухудшения работы сердца, нарушения межмолекулярных отношений в мембранах эритроцитов, силы гравитации. При непродолжительном замедлении кровотока агрегация эритроцитов обратима: при восстановлении кровотока образовавшиеся агрегаты эритроцитов - «монетные столбики» распадаются на функционально полноценные клетки.
Коллоидная стабильность плазмы крови обусловлена гидратацией белковых молекул и наличием поверхностного электрокинетического дзета-потенциала, т. е. потенциала поверхности скольжения частицы в коллоидном растворе, который создает одноименные заряды и силы электростатического отталкивания белковых молекул и клеток крови. Величина дзета-потенциала выше у альбуминов, чем у других белков плазмы крови.Поэтому альбумины, которые адсорбируются на поверхности эритроцитов, поддерживают клетки в плазме крови во взвешенном состоянии (т. е. поддерживают суспензионныесвойства крови). Крупнодисперсные белки (фибриноген, глобулины) снижают суспензионные свойства эритроцитов, уменьшают их отрицательный заряд. Снижение последнего приводит к формированию агломератов эритроцитов, которые оседают более быстро, чем отдельные клетки крови. Эти свойства крови оценивают по скорости оседания эритроцитов (СОЭ) в ее неподвижном объеме, которая у мужчин равна 4-10 мм/ч, у женщин - 5-12 мм/ч. СОЭ возрастает при увеличении в крови уровней фибриногена, при гиперфибриногенемии, α2-, β-и γ-глобулинов - при воспалительных заболеваниях. Альбумины плазмы крови, сорбируясь на поверхности эритроцитов, замедляют СОЭ.
Вязкость - это сопротивление течению жидкости при взаимном перемещении частиц за счет внутреннего трения. Вязкость цельной крови создается взаимодействием воды с
макромолекулярными коллоидами и плазмы с форменными элементами. Вязкость плазмы в 1,8-2,5 раза, а цельной крови - в 4-5 раз выше, чем воды. Повышению вязкости крови способствуют: увеличение в ней содержания фибриногена, липопротеинов; рост гематокрита (при его повышении до 60-70 вязкость крови возрастает в 10-20 раз по сравнению с вязкостью воды); агрегация эритроцитов. Удельный вес крови - в норме варьирует от 1052 до 1064, зависит от количества эритроцитов, содержания в них гемоглобина и состава плазмы. Удельный вес эритроцитов (1094-1107) выше, чем у плазмы (1024-1030). Повышение гематокрита увеличивает удельный вес крови.
9.2. ФУНКЦИИ И СВОЙСТВА ЭРИТРОЦИТОВ
Основная функция эритроцитов - перенос О2 содержащимся в них гемоглобином от легких к тканям и СО2 - от тканей к альвеолам легких. Эритроциты участвуют также в обеспечении кислотно-щелочного гомеостазиса. Данные функции эритроцитов обусловлены высоким содержанием гемоглобина (95 % массы эритроцита), деформируемостью их цитоскелета, благодаря чему эритроциты легко проникают через капилляры с диаметром около 3 мкм, хотя имеют диаметр от 7 до 8 мкм. Глюкоза является основным источником энергии в эритроците. Восстановление формы деформированного в капилляре эритроцита, активный мембранный транспорт катионов (Na+, Ca2+) через мембрану эритроцита, синтез глютатиона обеспечиваются за счет энергии анаэробного гликолиза в цикле Эмбдена-Мейергофа. В ходе метаболизма глюкозы, протекающего в эритроците по побочному пути гликолиза, контролируемого ферментом дифосфоглицератмутазой, в эритроците образуется 2,3-дифосфоглицерат (2,3-ДФГ). Основная функция 2,3-ДФГ - уменьшение сродства гемоглобина к кислороду, что облегчает высвобождение О2 из связей с гемоглобином. Энергия глюкозы в эритроците используется также в реакциях восстановления окисленных компонентов эритроцита, что сохраняет их функцию. Так, благодаря реакциям восстановления атомы железа гемоглобина поддерживаются в восстановленной, т. е. двухвалентной форме, что препятствует превращению гемоглобина в метгемоглобин, в котором железо окислено до трехвалентного, вследствие чего метгемоглобин не способен к транспорту кислорода. Восстановление окисленного железа метгемоглобина до двухвалентного обеспечивается ферментом - метгемоглобинредуктазой. В восстановленном состоянии поддерживаются и серусодержащие группы, входящие в состав белков мембраны эритроцита, гемоглобина, ферментов, что сохраняет их функциональные свойства. Постоянно образующийся в эритроците в ходе пентозофосфатного цикла НАДФН активирует фермент глютатионредуктазу, которая катализирует превращение окисленного глютатиона в восстановленный. Восстановленный глютатион, а также фермент супероксиддисмутаза, витамин Е (α-токоферол) защищают фосфолипиды мембраны эритроцита от повреждения спонтанно образующейся в эритроците перекиси водорода.
Эритроциты имеют дисковидную, двояковогнутую форму, их поверхность - около 145 мкм2, а объем достигает 85-90 мкм3. Такое соотношение площади к объему способствует деформабильности - способности эритроцитов к обратимым изменениям размеров и формы при их прохождении через капилляры. Форма и деформабильность эритроцитов поддерживается липидами мембран - фосфолипидами (глицерофосфолипидами, сфинголипидами, фосфатидилэтаноламином, фосфатидилсирином и др.), гликолипидами и холестерином, а также белками их цитоскелета. В состав цитоскелета мембраны эритроцита входят белки - спектрин (основной белок цитоскелета), актин, белки полосы 4.1, 4.2, 4.3 и др. (их название связано с обозначением фракции белков цитоскелета, разделяемых при электрофорезе). Основой мембраны эритроцита является липидный бислой, пронизанный интегральными белками - гликопротеинами и белком полосы 3. Последние связаны с частью белковой сети цитоскелета - комплексом спектрин-актин-белок полосы 4.1, локализованным на
208 |
209 |

цитоплазматической поверхности липидного бислоя (рис. 9.2). Благодаря нековалентным межмолекулярным взаимодействиям данных белков цитоскелета и легкому смещению молекул спектрина обеспечивается быстрое изменение формы эритроцитов - их деформация, позволяющая проходить этим клеткам через микроциркуляторное русло, ретикулоцитам - выходить из костного мозга в кровь. Деформируемость эритроцита может снижаться, если увеличивается вязкость, уменьшается текучесть и эластичность его мембраны, что наблюдается при увеличении соотношения холестерин/фосфолипиды в мембране эритроцита (например, у пожилых людей). До 52 % массы мембраны эритроцитов составляют белки гликопротеины, которые с олигосахаридами образуют антигены групп крови. Гликопротеины мембраны содержат сиаловую кислоту, которая придает отрицательный заряд эритроцитам, отталкивающий их друг от друга, препятствующий их агрегации (т. е. склеиванию друг с другом) в крови.
Рис. 9.2. Схема модели изменений цитоскелета мембраны эритроцита во время его обратимой деформации. Обратимая деформация эритроцита изменяет лишь пространственную конфигурацию (стереометрию) эритроцита, следующую за изменением пространственного расположения молекул цитоскелета. При этих изменениях формы эритроцита площадь поверхности эритроцита остается неизменной: а - положение молекул цитоскелета мембраны эритроцита при отсутствии его деформации. Молекулы спектрина находятся в свернутом состоянии; б - деформация эритроцита, вызванная изменением положения молекул его цитоскелета. Молекулы спектрина раскручены и растянуты, но площадь мембраны эритроцита остается прежней. Данные изменения цитоскелета эритроцита возникают после фосфорилирования белка полосы 4.1 переносом на него остатка фосфорной кислоты от молекулы АТФ. Активированный белок полосы 4.1 уменьшает сродство между молекулами актина и спектрина. Молекулы спектрина раскручиваются и растягиваются, вызывая изменение формы эритроцита, но площадь его мембраны остается прежней
Энзимы мембраны - Na+/K+-зависимая АТФаза обеспечивает активный транспорт Na+ из эритроцита и K+ в его цитоплазму. Са2+-зависимая АТФаза выводит Са2+ из эритроцита. Фермент эритроцита карбоангидраза катализирует реакцию: СО2+Н2О Н2СО3 H++НСО3-; поэтому эритроцит транспортирует часть углекислого газа от тканей к легким в виде бикарбоната, до 30 % СО2 переносится гемоглобином эритроцитов в форме карбаминового соединения с радикалом NH2 глобина. В мембране эритроцита представлены белки - переносчики глюкозы, белки, формирующие водные каналы - аквапорины.
Гемоглобин Гемоглобин - это гемопротеин с молекулярной массой около 60000, окрашивающий
эритроцит в красный цвет после связывания молекулы О2 с ионом железа (Fe2+). У мужчин в 1 л крови содержится 157 (140-175) г гемоглобина, у женщин - 138 (123-153) г. Молекула гемоглобина состоит из четырех субъединиц гема, связанных с белковой частью молекулы - глобином, сформированной из полипептидных цепей. Синтез гема протекает в митохондриях эритробластов. Синтез цепей глобина осуществляется на
полирибосомах и контролируется генами 11-й и 16-й хромосом (рис. 9.3). Гемоглобин, содержащий две α- и две β-цепи, относят к α-типу (от англ. adult - взрослый).
Рис. 9.3. Схема синтеза гемоглобина у человека в эритроидной клетке. Указаны ферменты, контролирующие этапы синтеза молекулы гема в молекуле митохондрий, а также хромосомы, ответственные за синтез цепей глобина А (α- и β-цепи) и гемоглобинов плода (у- и 5-цепи)
1 г гемоглобина А типа связывает 1,34 мл О2. У плода формируется гемоглобин F (от faetus- плод). Его глобин представлен двумя цепями α и двумя γ. Гемоглобин F обладает на 20-30 % большим сродством к О2, чем гемоглобин А, что способствует лучшему снабжению плода кислородом. При рождении ребенка до 50-80 % гемоглобина у него представлены гемоглобином F и 15-40 % - типом А, а к трем годам уровень гемоглобина F снижается до 2 %.
210 |
211 |
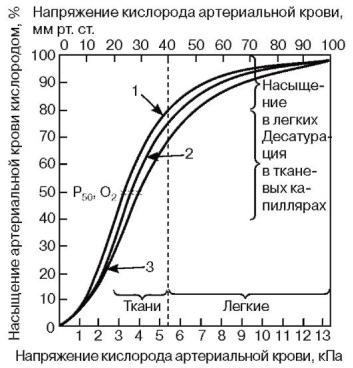
Рис. 9.4. Кривая диссоциации оксигемоглобина. Сродство гемоглобина к кислороду увеличивается: 1 - при уменьшении рСО2 в крови, при увеличении рН плазмы крови, при уменьшении температуры ткани или уменьшении содержания 2,3-дифосфоглицерата в эритроцитах (3); 2 - нормальная кривая при рН 7,4 и 37 °С. Сродство гемоглобина к кислороду уменьшается: при увеличении рСО2, при уменьшении рН плазмы крови, увеличении температуры крови и увеличении содержания в эритроцитах 2,3- дифосфоглицерата
Соединение гемоглобина с молекулой О2 называется оксигемоглобином. Сродство гемоглобина к кислороду и диссоциация оксигемоглобина (отсоединения молекул кислорода от оксигемоглобина) зависят от напряжения кислорода (рО2), углекислого газа (рСО2) в крови, рН крови, ее температуры и концентрации 2,3ДФГ в эритроцитах. Так, это сродство повышают: увеличение рО2 или снижение рСО2 в крови, нарушение образования 2,3-ДФГ в эритроцитах. Напротив, повышение концентрации 2,3-ДФГ, снижение рО2 крови, сдвиг рН в кислую сторону, повышение рСО2 и температуры крови - уменьшают сродство гемоглобина к кислороду, тем самым облегчая ее отдачу тканям. 2,3- ДФГ связывается с β-цепями гемоглобина, облегчая отсоединение О2 от молекулы гемоглобина (рис. 9.4). Увеличение концентрации 2,3-ДФГ наблюдается у людей, тренированных к длительной физической работе, адаптированных к длительному пребыванию в горах. Оксигемоглобин, отдавший кислород, называется восстановленным, или дезоксигемоглобином . В состоянии физиологического покоя у человека гемоглобин в артериальной крови на 97 % насыщен кислородом, в венозной - на 70 %. Чем выраженней потребление кислорода тканями, тем ниже насыщение венозной крови кислородом. При
интенсивной физической работе насыщение кислородом оттекающей от мышц венозной крови снижается до 15 %. Содержание гемоглобина в отдельном эритроците составляет 27,5-33,2 пикограмма. Снижение этой величины свидетельствует о гипохромном (т. е. пониженном), увеличение - о гиперхромном (т. е. повышенном) содержании гемоглобина
вэритроцитах. Этот показатель имеет диагностическое значение. Например, гиперхромия эритроцитов характерна для В12-дефицитной анемии, гипохромия - для железодефицитной анемии.
Старение и разрушение эритроцитов в организме Эритроциты у человека функционируют в крови максимум 120 дней, в среднем 60-
90 дней. Установлено несколько механизмов гибели стареющего эритроцита. Старение эритроцита сопровождается уменьшением содержания в нем ферментов, поддерживающих гликолиз - глюкозо-6-фосфатдегидрогеназы и др., что снижает образование АТФ в ходе метаболизма глюкозы. Дефицит энергии нарушает процессы восстановления формы эритроцитов, удаления ионов Ca2+, Na+ из эритроцита, защиту липопротеинов мембраны от окисления свободными радикалами кислорода, в мембране эритроцита уменьшается содержание сиаловых кислот. Увеличение концентрации Са2+ в цитоплазме эритроцита активирует Са2+-чувствительную транслоказу, усиливающую перенос молекул фосфатидилсерина, из бислоя мембраны эритроцита на ее внешнюю поверхность. Молекулы фосфатидилсерина, в нормальных условиях «экранируемые» сиаловыми кислотами, которые теряются стареющими эритроцитами, уже не защищают последних от контактов с макрофагами селезенки, костного мозга, печени. Макрофаги, имеющие рецепторы к молекулам фосфатидилсерина, опознают такие эритроциты как поврежденные и фагоцитируют их. Стареющие эритроциты разрушаются внутри сосудов(внутрисосудистый гемолиз) или же захватываются и разрушаются макрофагами
вселезенке, купферовских клетках печени и в костном мозге (внутриклеточный гемолиз).Внутриклеточным гемолизом в сутки разрушается 80-90 % старых эритроцитов. В макрофагах после отщепления от молекулы гемоглобина гема, из последнего освобождается железо, а под влиянием биливердинредуктазы из молекулы гема образуется билирубин. Билирубин из мест разрушения гемоглобина транспортируется альбуминами, а также α- и β-глобулинами крови к печени с последующим выведением его через желчный проток в двенадцатиперстную кишку. Освободившееся железо депонируется в макрофагах, пополняя резерв Fe в организме. Молекулы глобина расщепляются в макрофагах до аминокислот, пополняя аминокислотный резерв организма.
Внутрисосудистым гемолизом разрушается 10-20 % эритроцитов. Из них молекулы гемоглобина и гема поступают в плазму. Гемоглобин связывается с гликопротеином плазмы гаптоглобином и доставляется им для утилизации паренхиматозными клетками печени, что предупреждает поступление свободного гемоглобина в почки и тромбирование им их нефронов. Молекулы гема связываются белком плазмы - гемопексином, транспортируются им в печень, где подвергаются ферментному разрушению в паренхиматозных клетках до билирубина и железа.
Обмен железа в организме В организме человека содержится 4-5 г железа в виде резервного (1/4)
и функционально активного железа (3/4). 62-70 % функционально активного железа находится в гемоглобине эритроцитов, 5-10 % - в миоглобине, остальное - в тканях, где оно в составе металсодержащих энзимов-цитохромов обеспечивает транспорт электронов по электронно-транспортной цепи митохондрий, синтез ДНК и деление клеток, входит в состав цитохромов Р450 мультиэнзимных комплексов в тканях печени, плаценты, легких, снижающих активность токсических веществ, поступающих из крови в эти ткани.
Резервное железо в организме человека постоянно переходит в функциональное и обратно. Так, за счет повторного использования костный мозг получает ежесуточно 20-25 мг железа. Ионы железа (Fe2+) ежедневно всасываются в кишечнике из пищи. В
212 |
213 |
кишечнике более эффективна абсорбция Fе2+, чем Fe3+. Поэтому аскорбиновая кислота, фруктоза, аминокислоты (цистеин, метионин), поддерживая двухвалентную форму железа, ускоряют его абсорбцию. В кишечнике лучше абсорбируется биодоступное железо, входящее в состав гема (мясные продукты, кровяная колбаса), чем железо из пищи растительного происхождения. Абсорбция Fe2+ в желудочно-кишечном тракте зависит от возраста человека, функционального состояния его организма и составляет: у женщин детородного периода - 2,8 мг/день, молодых мужчин - 1 мг/день, стариков - 0,9 мг/день, беременных женщин - 3-3,5 мг/день. Дефицит железа в организме человека приводит к развитию гипохромной анемии.
Всасывание Fe2+ осуществляется в апикальной мембране энтероцитов тонкого кишечника. Из энтероцита Fe2+ поступает в капиллярную сеть кишечника, в кровотоке окисляется до трехвалентного Fe белком плазмы крови церулоплазмином и специализированными транспортными белками - трансферрином и трансферриновым рецептором («плавающий» в крови фрагмент рецептора трансферрина) и доставляется к костному мозгу, печени, где используется в митохондриях эритробластов для синтеза гема, депонируется в молекулах ферритина - в эритробластах, макрофагах, клетках печени, скелетных мышцах. Внутри лизосом молекулы ферритина образуют большие аморфные нерастворимые агрегаты -гемосидерин . Таким образом, ферритин и гемосидерин - это формы резервного железа в клетках. Молекулы ферритина могут секретироваться из депонирующих железо клеток в плазму крови - в количествах, пропорциональных накоплению в клетках Fe. Поэтому уменьшение концентрации ферритина в сыворотке крови ниже 12 мкг/кг (в норме от 15 до 300 мкг/кг) является важнейшим признаком железодефицитного состояния у человека. В норме лишь 1/3
трансферрина плазмы насыщена Fe3+. Количество Fe3+, которое может быть связано трансферрином, называется общей железосвязывающей способностью крови и в норме составляет 45-72 мкмоль/л. Концентрация Fe в сыворотке крови у взрослых людей обоего пола составляет 9-29 мкмоль/л. С мочой выводится за сутки 60-100 мкг Fe.
Из клеточного резерва железо освобождается в двухвалентном состоянии (благодаря восстановлению энзимом ксантиноксидазой, аскорбиновой кислотой и др.). Высвобождение Fe2+ из макрофагов в плазму крови осуществляется их мембранным белком ферропортином - экспортером Fe2+ из депонирующей его клетки. Данная функция ферропортина в свою очередь регулируется гепцидином, белком плазмы крови, синтезируемым в печени. Гепцидин, связываясь с молекулами ферропортина на мембранах макрофагов или энтероцитов, индуцирует их интернализацию и деградацию, препятствуя тем самым выходу Fe2+ из макрофага и энтероцитов в кровь. Гепцидин при увеличении содержания железа в крови и тканях тормозит высвобождение депонированного железа из тканей, а также абсорбцию Fe2+ в кишечнике. Анемия и гипоксия подавляют синтез гепцидина, уменьшая его угнетающее действие на поглощение Fe в кишечнике и высвобождение в кровь Fe, депонированного в тканях, поскольку функция ферропортина не тормозится гепцидином.
Эритропоэз Эритропоэз - процесс образования эритроцитов в костном мозге и включает
следующие этапы: колониеобразующая клетка эритроцитарная (КОК-Э) → 1 проэритробласт (удвоение) → два базофильных эритробласта I порядка → 4 базофильных эритробласта II порядка → 8 полихроматофильных эритробластов I порядка → 16 полихроматофильных эритробластов II порядка → 32 полихроматофильных нормобласта → 32 оксифильных нормобласта → денуклеация нормобластов → 32 ретикулоцита → 32 эритроцита. Эритропоэз до формирования ретикулоцита занимает 5 дней. Эритропоэз у человека протекает в эритробластических островках костного мозга, представляющих собой ассоциацию макрофагов и эритроидных клеток, благодаря способности макрофагов адгезировать эритроидные клетки (от проэритробласта до ретикулоцита) (рис. 9.5). Макрофаги островков фагоцитируют вытолкнутые из нормобластов ядра, обеспечивают
эритробласты ферритином и пластическими веществами, секретируют эритропоэтин и глюкозаминогликаны, последние повышают концентрацию ростковых факторов в островках. Из костного мозга ретикулоциты выходят в кровь и в течение суток созревают в эритроциты. По количеству ретикулоцитов в крови судят об интенсивности эритропоэза. У человека их количество составляет 5-10?. В 1 л крови у мужчин содержится 5,21 x
1012(4,52-5,9 x 1012), а у женщин - 4,6 x 1012 (4,1-5,1 x 1012) эритроцитов. Уменьшение количества эритроцитов в единице объема крови называется анемией, увеличение - эритроцитозом. Последний может носить физиологический, приспособительный для организма человека характер (например, при подъеме в горы на высоту более 3000 метров над уровнем моря).
Рис. 9.5. Эритробластический островок костного мозга человека: 1 - эритробласт; 2 - цитоплазма макрофага
Регуляция эритропоэза Эритропоэтин, секретируемый тубулярными и перитубулярными клетками почек
(85-90 %), макрофагами костного мозга, купферовскими клетками и гепатоцитами (10-15 %), является основным гуморальным активатором эритропоэза. При прекращении образования эритропоэтина в организме эритропоэз прерывается. Синтез и секреция эритропоэтина производящими его клетками определяются уровнем обеспечения их кислородом. Нормальный уровень содержания О2 в клетках почек, гепатоцитов и макрофагов препятствует формированию в их цитоплазме индуцируемого гипоксией фактора-1α(ИГФ-1α), стимулирующего транскрипцию эритропоэтиновой иРНК и синтез эритропоэтина. При снижении кислородного обеспечения клеток почек (при снижении рО2до 20-40 мм рт. ст. в почечной артерии) нарастает содержание ИГФ1α в цитозоле и его перемещение в ядро клетки, где ИГФ-1α специфически связывается с ДНК, вызывая экспрессию гена эритропоэтина. При гипоксии почечной ткани (например, после острой кровопотери) количество эритропоэтина возрастает в 100 раз и более - до 1-8 МЕ (международных единиц)/мл при норме - 0,01-0,08 МЕ/мл плазмы. Эритропоэтин тормозит апоптоз, активирует пролиферацию и дифференциацию КОК-Э, про- и эритробластов, синтез гемоглобина, энзимов, участвующих в формировании цитоскелета эритроцитов, увеличивает выход в кровь ретикулоцитов. Эритропоэз угнетают ингибиторы эритропоэза, образующиеся в организме, если обеспечение кислородом тканей превышает их потребность в нем. Половые гормоны - андрогены, а точнее, их 5-β-Н-метаболиты, увеличивают чувствительность клеток-предшественниц эритроидного ряда к эритропоэтину, что делает эритропоэз более интенсивным. Поэтому
214 |
215 |

после полового созревания у мужчин больше эритроцитов и гемоглобина, чем у женщин. Для поддержания эритропоэза, пролиферации и созревания эритроидных клеток, синтеза гемоглобина - в организм человека с пищей необходимо поступление должного количества витаминов и микроэлементов (глава 14).
9.3. ЛЕЙКОЦИТЫ
Эти клетки формируют мощный кровяной и тканевой барьеры против микробной, вирусной и паразитарной (гельминтной) инфекции, стимулируют регенерацию тканей. У взрослого человека в крови содержится 4-10 x 109/л лейкоцитов. Увеличение их количества называется лейкоцитозом, уменьшение - лейкопенией. Различают физиологический и реактивный лейкоцитоз. К физиологическому лейкоцитозу относят:
■пищевой - возникает после приема пищи, носит перераспределительный характер;
■миогенный - наблюдается после тяжелой физической нагрузки;
■эмоциональный - связан с выбросом в кровь катехоламинов и кортикостероидов . При физиологическом лейкоцитозе происходит небольшое и кратковременное
увеличение числа лейкоцитов, отсутствуют изменения в лейкоцитарной формуле. Реактивный лейкоцитоз развивается при воспалительных процессах, инфекционных заболеваниях и вызван усиленным образованием лейкоцитов в костном мозге. Лейкопения имеет место только при заболеваниях, угнетающих гранулоцитопоэз, например, при лучевой болезни. Количественные изменения лейкоцитов обычно сопровождаются повышением или снижением их функциональной активности, которая во многом определяет устойчивость организма к инфекции. Лейкоциты, имеющие в цитоплазме зернистость, называютсягранулоцитами, а не содержащие зернистости - агранулоцитами. Процентное отношение в крови лейкоцитов, происшедших из разных линий кроветворения, называется лейкоцитарной формулой (табл. 9.1).
Функции нейтрофильных гранулоцитов Функции нейтрофильных гранулоцитов состоят в следующем:
■уничтожение проникшей в организм микробной инфекции;
■удаление (фагоцитоз) поврежденных клеток;
■секреция бактериоцидных и стимулирующих регенерацию тканей веществ. Осуществляют они их, тесно взаимодействуя с макрофагами, Т- и В-лимфоцитами.
На важность функционального вклада нейтрофилов в защиту организма от инфекции указывает, например, тяжесть течения вызванных микробной инфекцией заболеваний у больных, страдающих сниженной продукцией или качественными нарушениями этих клеток. Зрелый нейтрофил содержит сегментированное на 2-5 долей ядро, уплотненный хроматин, а в цитоплазме - многочисленные мелкие секреторные гранулы трех типов.
Таблица 9.1. Лейкоцитарная формула
Количество и процентное содержание лейкоцитов в 1 мкл крови
|
Общ |
|
|
Гранулоциты |
|
|
Агранулоцит |
||
|
|
|
|
|
ы |
|
|||
ее |
число |
|
|
|
|
|
|
|
|
Пок |
|
|
нейтрофильные |
|
|
||||
лейкоцит |
|
|
|
|
|||||
азатели |
|
|
|
|
|
||||
|
баз |
эози |
|
|
лим |
мо |
|||
ов |
в 1 л |
|
палочко |
сегменто |
|||||
|
|
офилы |
нофилы |
фоциты |
ноциты |
||||
крови |
|
|
|||||||
|
|
|
|
ядерные |
ядерные |
|
|
||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1- |
100- |
|
3065- |
1200 |
200 |
|
4-10 |
В |
1 |
75 |
180-400 |
-2800 |
|||
|
250 |
5600 |
-700 |
||||||
x 109 |
мкл в % |
|
0,2 |
1-5 |
25- |
||||
|
|
|
|
5-0,75 |
1-4 |
|
55-68 |
39 |
1-9 |
|
|
|
|
|
|
|
|
||
|
Часть гранул, дающих положительную окраску на фермент миелопероксидазу, |
||||||||
представлена лизосомами, которые содержат лизоцим (повреждает |
стенку бактерий), |
||||||||
низкомолекулярные катионные белки - серпроцидины, дефенсины и кателицидины,нарушающие дыхание и рост микроорганизмов и грибков, дефенсины повышают также проницаемость сосудов микроциркуляционного русла; протеазы и кислые гидролазы - позволяют нейтрофилам легко переваривать фагоцитированные объекты. Гранулы 2-го типа содержат лактоферрин, обладающий бактериостатическим действием,траскобаламины I и III - переносчики витамина В12 в крови и лизоцим. Вещества гранул 3-го типа содержат нейтрофилокины и кислые глюкозаминогликаны, поддерживающие процессы регенерации тканей. Гранулы 2-го и 3- го типов нейтрофилов даже вне фагоцитоза постоянно секретируют биологически активные вещества - цитокины:опухольнекротизирующий фактор-α, интерлейкин-1,
интерлейкин-6, интерлейкин-11. Вместе с такими же цитокинами, секретируемыми макрофагами в острой фазе заболевания, вызванного инфекцией, травмой (например, ожоговой), они стимулируют синтез и секрецию в кровь из печени белков острой фазы.
Нейтрофилы способны быстро мигрировать из крови и накапливаться в инфицированных или поврежденных участках организма благодаря образующимся в этих тканяхвазоактивным и хемотаксическим факторам (хемоатрактантам), а затем фагоцитировать, т. е. захватывать и разрушать в фагоцитарных вакуолях поглощенные бактерии и поврежденные клетки. Вазоактивные факторы (дефенсины, гистамин, секретируемый под влиянием дефенсинов тучными клетками тканей) повышают
проницаемость капилляров, что способствует |
миграции |
нейтрофилов в |
ткань. Хемотатрактанты взаимодействуют с их |
рецепторами |
на поверхности |
нейтрофилов и направляют их движение из крови к воспаленному участку. Мощными
хемоатрактантами |
являются N-формилпептидыбактериального |
||
происхождения, лейкотриены и эндотоксины, секретируемые |
Т-лимфоцитами |
и |
|
макрофагами, активированными бактериями и продуктами их жизнедеятельности. Недостаточность хемотаксической активности нейтрофилов препятствует их накоплению
вочаге воспаления, что способствует распространению инфекции в организме.
Ктаким последствиям приводит, например, нарушение хемотаксиса нейтрофилов у больных при ожоговой болезни, диабете, при низком содержании белка в рационе человека. Перед выходом в ткани нейтрофилы приклеиваются к эндотелию сосудов в районе воспаления с помощью адгезивных молекул - интегринов (CD18β-2) и L- селектиновна мембране лейкоцитов и селектинов Е и Р на эндотелиальных клетках, экспрессируемых под влиянием хемоатрактантов. При нарушении функций адгезивных молекул нейтрофилы не способны прикрепляться к эндотелию капилляра, а затем мигрировать из сосуда в инфицированную микроорганизмами ткань, что способствует распространению инфекции.
Через 30-60 секунд после контакта мембраны нейтрофила с бактерией в нем
возникает «вспышка метаболизма» с образованием перекиси водорода, суперокисных ионов и гидроксильных радикалов. Последние окисляют галогены (Cl-, J-) мембран бактерий с образованием гипохлорной кислоты и далее хлораминов, поражающих микробы. Одновременно нейтрофилы секретируют лизоцим, лактоферрин, катионные белки, кислые и нейтральные гидролазы, поражающие фагоцитированные бактерии. Нейтрофилы в инфицированных тканях способны формировать внеклеточные бактериоцидные ловушки,представленные выделяемыми нейтрофилами нитями ДНК. Бактерии адгезируются к липким нитям ДНК, а бактерицидные соединения нейтрофилов - убивают их.
216 |
217 |
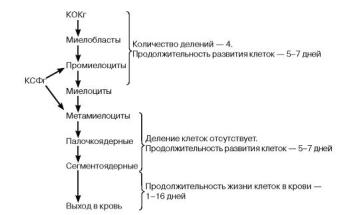
Рис. 9.6. Развитие нейтрофильных гранулоцитов. КОКг - колониеобразующая клетка гранулоцитарная. КСФг - колониестимулирующий фактор гранулоцитарный. Выделены отделы способных к делению (КОКг-миелоциты) и не размножающихся клеток (метамиелоциты-сегментоядерные) нейтрофильной линии лейкоцитов. КСФг активирует деление и усиливает функциональную активность нейтрофилов
Зрелые сегментоядерные нейтрофилы поступают из костного мозга в кровь (рис. 9.6) и составляют в ней до 50-70 %, палочкоядерные нейтрофилы - 1-5 %. Увеличение в крови последних - важный признак нарастания интенсивности нейтрофильного гранулопоэза, а также остроты воспалительного процесса. Под гранулоцитозом понимают увеличение количества нейтрофильных лейкоцитов в крови выше 10 x 109 л, под нейтропенией - снижение их числа ниже 1,5 x 109 л крови. Период полужизни циркулирующих в крови гранулоцитов составляет 6-8 часов, а полный - не более 30 часов.
Функции базофильных гранулоцитов Функции базофильных гранулоцитов таковы:
■поддержание кровотока в мелких сосудах секрецией в них гепарина;
■активация роста новых капилляров;
■секреция хемоатрактантов для эозинофилов, обеспечивающих их миграцию в
ткани;
■защита кишечника, кожи и слизистых при инфицировании гельминтами и клещами;
■участие в формировании аллергических реакций немедленного типа;
■способность к фагоцитозу.
Базофильные гранулоциты образуются в костном мозге из КОК базофильной. Базофилы могут синтезировать или накапливать в гранулах их цитоплазмы биологически активные вещества, очищая от них ткани, а затем и секретировать их. Постоянно присутствуют в клетках:
■кислые глюкозаминогликаны - хондроитинсульфат, дерматансульфат, гепарансульфат игепарин - основной антикогуляционный фактор;
■гистамин - антагонист гепарина, активатор внутрисосудистого тромбообразования
истимулятор фагоцитоза, оказывает провоспалительное действие на ткань; вызывает расширение просвета прекапилляров и артериол;
■«фактор, активирующий тромбоциты», - вызывает агрегацию тромбоцитов и освобождение их содержимого;
■ «эозинофильный хемотаксический фактор анафилаксии» и лейкотриен С4, способствующие выходу эозинофилов из сосудов в места скопления базофилов;
■ цитокины - фактор роста новых сосудов, активаторы кроветворения.
При повышении чувствительности организма к аллергенам в базофилах образуются биологически активные вещества - «медленно реагирующая субстанция анафилаксии», лейкотриен С4, - вызывающие спазм гладкой мускулатуры мелких бронхов, что имеет место при бронхиальной астме. Активаторами выброса хемоатрактантов для эозинофилов и других соединений из гранул базофилов являются иммуноглобулин Е, синтез которого стимулируется, например, в инфицированном паразитами организме. Базофилы способны мигрировать из крови в ткани, в зону накопления паразитарного антигена. Выходу базофилов из кровотока в ткань предшествует их адгезия к поверхности венул, усиливаемая поступлением из воспаленной ткани энтоксина и интерлейкина-4. Так, в местах локализации гельминтов (в кишечнике) или клещей (в коже) имеет место инфильтрация тканей базофилами, способствующими уничтожению этих паразитов. Основные хемотаксические факторы базофилов - лимфокины, секретируемые лимфоцитами в присутствии аллергена, а также калликреин, факторы комплемента С5, С6, С7. У здорового человека базофилы и тучные клетки, окружающие мелкие сосуды печени и легких, интенсивно секретируют гепарин, препятствующий образованию тромбов, что поддерживает нормальный кровоток в сосудах этих органов. В лейкоцитарной формуле доля базофилов составляет 0,25-0,75 %, или около 0,04 x 109/л крови.
Функции эозинофильных лейкоцитов Эозинофильные лейкоциты:
■защищают организм от паразитарной инфекции (шистозомы, трихинелы, гельминты, аскариды и др.);
■инактивируют и уменьшают концентрацию биологически активных соединений, образующихся при аллергических реакциях, секретируемых тучными клетками и базофилами;
■обладают фагоцитарной и бактериоцидной активностью.
Зрелый эозинофил имеет 2- или 3-дольчатое ядро и два типа гранул в цитоплазме.
Большие гранулы содержат «специфический основной белок», эозинофильный катионный белок, эозинофильный нейротоксин, токсичные для гельминтов; вещества, нейтрализующие гепарин, медиаторы воспаления; секретируют ферменты - фосфолипазу Д, инактивирующую «фактор, активирующий тромбоциты», синтезируемый базофилами, что предупреждает агрегацию тромбоцитов. Маленькие гранулы содержат кислую фосфатазу и арилсульфатазу В, нейтрализующую «медленно реагирующую анафилактическую субстанцию». Хемоатрактантами эозинофилов, вызывающими их накопление в инфицированных паразитами тканях, являются «лимфоцитарный хемоатрактивный фактор», хемокины - эотоксин и RANTES, секретируемые Т-клетками, и «эозинофильный хемотаксический фактор анафилаксии», секретируемый базофилами после контакта этих клеток с аллергенами. Основными стимулами, вызывающими выброс из гранул эозинофилов биологически активных веществ в кровь и межклеточную жидкость, являются IgE и фактор, активирующий тромбоциты, связывающиеся с рецепторами эозинофилов. Так, например, эозинофилы повреждают шистосомулу (молодая форма шистосомы), секретируя в нее токсичные в микроконцентрациях белки своих гранул: специфический основной белок, эозинофильный катионный белок и эозинофильный нейротоксин, и вызывают гибель паразита, обеспечивая антипаразитарную защиту организма. Однако при аллергических заболеваниях, например при бронхиальной астме, эти токсические белки эозинофилов накапливаются в тканях, участвующих в аллергических реакциях (перибронхиальная ткань легких при бронхиальной астме), поражают бронхиальные эпителиальные клетки, вызывая их слущивание, что делает более тяжелым течение заболевания. Эозинофилы образуются в костном мозге из КОК эозинофильной. В крови человека содержится 1-4 % эозинофилов, или 0,15-0,25 x 109/л крови. Увеличение их количества(эозинофилия) свидетельствует о
218 |
219 |
возможной паразитарной инфекции или аллергическом заболевании. В физиологических условиях эозинофилы накапливаются в тканях, контактирующих с внешней средой (легкие, желудочно-кишечный тракт, кожа, урогенитальный тракт), формируя тканевой барьер против паразитарной инфекции. В этих тканях их количество превышает содержание в крови в 100-300 раз.
Функции моноцитов-макрофагов Моноциты-макрофаги обеспечивают:
■фагоцитарную защиту организма против микробной инфекции;
■токсический эффект метаболитов макрофагов на паразиты в организме человека;
■участие в иммунном ответе организма и воспалении;
■регенерацию тканей за счет активации в них пролиферации фибробластов, гладкомышечных клеток сосудов и эндотелия; противоопухолевую защиту;
■регуляцию гемопоэза;
■фагоцитоз старых и поврежденных клеток крови; активацию продукции острофазных белков печенью, благодаря секреции макрофагами интерлейкинов, стимулирующих в ней их синтез.
В различных тканях тела человека моноциты дифференцируются в тканевые макрофаги, где продолжительность их жизни составляет не менее 3 недель. Моноцитымакрофаги имеют аэробный гликолиз, обеспечивающий энергией их фагоцитарную активность. Макрофаги функционируют также в анаэробных условиях (например, в полости абсцесса), используя для генерации энергии гликолитический путь. Макрофаги распознают микроорганизмы, поврежденные клетки, медиаторы, гормоны, лимфокины с помощью рецепторов своей плазменной мембраны. Цитотоксическое действие на опухолевые клетки, токсоплазмы (кокцидии, паразитические простейшие), лейшмании и возбудителей малярии макрофаги оказывают, генерируя свободные радикалы О2- супероксид, перекись водорода, гидроксильные радикалы и др. Макрофаги человека секретируют в кровь и тканевую жидкость более 100 биологически активных веществ с молекулярной массой от 32 (анион супероксида) до 440000 (фибронектин). Функция этих веществ: стимуляция пролиферации остеобластов и лимфоцитов, продукции фибробластами КСФгм, интерлейкина-1; активация гемопоэза (секреция КСФгм, КСФг, эритропоэтина), механизмов воспаления (простагландины, лейкотриены В, U, С, D, Е, тромбоксан); цитотоксический и цитостатический эффекты на опухолевые клетки (опухольнекротизирующий фактор (ОНФ); интерлейкин-1 и ОНФ повышают температуру тела через терморегуляторные центры гипоталамуса. Под моноцитозом понимают увеличение абсолютного их количества свыше 800 клеток/мкл.
Регуляция грануло- и моноцитопоэза Образование гранулоцитов (гранулоцитопоэз) и моноцитов (моноцитопоэз) у
человека протекает в костном мозге. Нейтрофилопоэз стимулирует колониестимулирующий фактор гранулоцитарный (КСФг), секретируемый моноцитами, макрофагами и Т-лимфоцитами, а угнетают функционирующие по принципу
отрицательной |
обратной связи |
секретируемые |
нейтрофилами кейлоны (тканево- |
||
специфические |
ингибиторы |
синтеза |
ДНК |
в |
клетках-предшественницах) |
и лактоферрин. Эозинофилопоэз стимулируют ИЛ-5, |
а |
также ИЛ-3; продукцию |
|||
базофилов - ИЛ-4 и ИЛ-3; моноцитопоэз - колониестимулирующий фактор моноцитарный (КСФмон). В результате под влиянием данных гемопоэтических цитокинов развивается эозинофильный, базофильный лейкоцитозы и моноцитоз. Моноцитопоэз тормозят простагландины серии Е, α- и β-интерфероны, секретируемые моноцитами, что снижает уровень моноцитов в крови.
9.4. ЛИМФОЦИТЫ. ЛИМФОПОЭЗ. РЕГУЛЯЦИЯ ЛИМФОПОЭЗА
Лимфоциты крови представлены группой морфологически сходных, но функционально различных лейкоцитов, общее количество которых составляет 1200-2800 клеток в 1 мкл крови. Количество лимфоцитов в крови примерно равно 2 % их общего количества (98 % лимфоцитов находится в ткани и лимфе). Продолжительность жизни различных видов лимфоцитов колеблется от нескольких часов до многих лет. По функциональным свойствам (по экспрессии различных антигенов в их мембране) выделяют субпопуляции Т- и В-лимфоцитов. В крови содержится 0,7-2,4 x 109/л Т- лимфоцитов и 0,1-0,6 x109/л В-лимфоцитов.
Функции лимфоцитов:
■обеспечение реакции иммунитета - специфической защиты от чужеродных и измененных собственных антигенов организма (аутоантигенов), которая осуществляется посредством выработки антител (гуморальный иммунитет) или контактным воздействием клеток-эффекторов иммунной системы (клеточный иммунитет);
■регуляция деятельности других клеток крови в иммунологических реакциях;
■регуляция процессов роста, дифференциации и регенерации тканей посредством контактных взаимодействий и секреции цитокинов (лимфокинов).
В постнатальном периоде у человека основные лимфоидные органы - костный мозг
итимус, в которых происходят размножение и дифференциация лимфоцитов до
воздействия |
антигена |
на |
иммунную |
систему. |
Данный |
процесс |
называется лимфопоэзом.Антигензависимый, продолжающийся |
после |
лимфопоэза |
||||
процесс дифференцирования лимфоцитов называется иммунопоэзом и рассматривается в главе 10.
Развитие В- и Т-клеток. В костном мозге КОК лимфоидная дифференцируется в про-В-клетки, которые в свою очередь быстро дают потомство пре-В-клеток. Образующиеся далее незрелые В-клетки дифференцируются в зрелые В-клетки. Зрелые В- клетки покидают костный мозг и заселяют вторичные лимфоидные ткани - селезенку, лимфатические узлы. Регуляция В-лимфопоэза в костном мозге осуществляется стромальными клетками, секретирующими цитокины, регулирующими рост и дифференциацию В-клеточной линии (фактор стволовой клетки, интерлейкин-11, 7, 4, 2 и др.). Угнетают В-лимфопоэз ИЛ-1α, ОНФ-α, интерферон-γ, стероидные гормоны. Если зрелые В-клетки в течение нескольких дней не встречаются с антигеном - они погибают. В случае же встречи и связывания антигена В-клетки пролиферируют и дифференцируются в короткоживущие плазматические клетки, секретирующие антитела против поступившего в организм антигена (чужеродного белка - микробного, вирусного и т. д.) или собственных антигенов - аутоантигенов, образовавшихся в тканях собственного организма, например, при ожоговой травме. Часть В-клеток дифференцируются в долгоживущие клетки, хранящие иммунную память о данном антигене.
Развитие Т-клеток также начинается от КОК лимфоидной, поступающей из периферической крови в ткань тимуса. Под влиянием цитокинов стромы тимуса КОК лимфоидная дифференцируется в про-Т-клетку, затем пролиферирует и дифференцируется в раннюю и далее - в позднюю пре-Т-клетку. Из последней
формируется CD4+/CD8+ - Т-клетки, |
дающие начало CD4+ Т-клеткам (хелперам) |
и |
CD8+ цитотоксическим Т-клеткам. В |
свою очередь CD4+ Т-клетки подразделяются |
на |
подгруппы Th-1 и Th-2, различающиеся функциональными свойствами. Дифференциация CD4+ Т-клеток в Th-1 развивается под влиянием ИЛ-12 и интерферона-у, а в Th-2 - ИЛ-4.
Развитие и функциональная активность Т- и В-линий лимфоцитов регулируется не только цитокинами, но и нервной и эндокринной системами. Нервные окончания, имеющие прямые синапсоподобные контакты с иммунными клетками, обнаружены в первичных и вторичных лимфоидных органах, на Т- и В-клетках имеются рецепторы субстанции Р (медиатор пуринергических волокон), β-адренорецепторы, мускаринчувствительные и никотинчувствительные холинорецепторы; на пре-В-клетках - α1-адренорецепторы. Сигналы, воспринимаемые данными рецепторами, усиливают
220 |
221 |

пролиферацию тимоцитов и преВ-клеток, иммунные клетки активируют секрецию цитокинов. На иммунных клетках имеются рецепторы глюкокортикоидов, гормона роста, эстрадиола и тестостерона и др., что делает функции этих клеток чувствительными к контролю эндокринной системы. Так, глюкокортикоиды, блокируя секрецию ИЛ-1, 2, 5, 6, 12 иммунными клетками, снижают провоспалительные эффекты данных цитокинов. Напротив, эстрогены, активируя клетки иммунной системы, повышают устойчивость организма женщин к инфекции.
9.5. ФУНКЦИИ ТРОМБОЦИТОВ. ГЕМОСТАЗ
Тромбоциты препятствуют внезапной потере крови, быстро закупоривая место повреждения кровеносных сосудов вначале временной, а затем постоянной тромбоцитарной пробкой. Они способствуют превращению фибриногена в фибрин в поврежденном участке кровеносного сосуда; поддерживают целостность стенки кровеносных сосудов; обладают антипаразитарной активностью, например, поражая шистосомы, трематоды (долгоживущие паразиты, вызывающие поражение внутренних органов человека - легких, печени и др.).
Тромбоциты имеют дисковидную форму, диаметр их от 2 до 5 мкм, объем 5-10 мкм3 (рис. 9.7). В тромбоците выделяют несколько зон, выполняющих разные функции: периферическую, золя-геля, внутриклеточных органелл. На наружной поверхности периферической зоны тромбоцита располагается слой толщиной до 50 нм, содержащий плазматические факторы свертывания крови, энзимы, рецепторы, необходимые для активации тромбоцитов, их адгезии (приклеивания к субэндотелию) и агрегации (приклеивания друг к другу). Периферическая зона мембраны тромбоцита содержит «мембранный фосфолипидный фактор 3» - «фосфолипидную матрицу», формирующую активные коагуляционные комплексы с плазменными факторами свертывания крови. Мембрана богата арахидоновой кислотой, из которой фермент мембраны - фосфолипаза А2 образует свободную арахидоновую кислоту для синтеза простагландинов, из метаболитов последних формируется короткоживущий агент - тромбоксан А2, вызывающий мощную агрегацию тромбоцитов. Фосфолипаза А2 активируется при контакте тромбоцита с адгезивными белками субэндотелия - коллагеном и с фактором Виллебранда, что имеет место при повреждении эндотелия кровеносных сосудов.
В липидный бислой мембраны тромбоцита «встроены» гликопротеины I (субъединицы Ia, Ib, Ic), II (субъединицы IIа, IIb), III (субъединицы IIIa, IIIb), IV, V, VI,
которые обусловливают адгезивные и агрегационные функции тромбоцитов. Ia - это рецептор адгезии (приклеивания) тромбоцитов к коллагену субэндотелия. Комплекс «Ib - фактор свертывания крови IX» на мембране тромбоцита обеспечивает его приклеивание к фактору Виллебранда, что необходимо для адгезии пластинок на поврежденный субэндотелий. Ic - взаимодействуя с адгезивным белком субэндотелия фибронектином, обеспечивает адгезию (приклеивание) пластинки к субэндотелию. IIa и IIb - необходимы для всех видов агрегации тромбоцитов. IIIa с гликопротеином IIb образуют Са2+- зависимый комплекс, связывающий на тромбоцитах фибриноген, что обеспечивает дальнейшую агрегацию тромбоцитов, рост тромбоцитарного тромба и его ретракцию (сокращение), уплотняющую сгусток.
Рис. 9.7. Ультраструктурная организация тромбоцита. Сечение, параллельное горизонтальной плоскости: ЕС - периферическая зона тромбоцита; СМ - трехслойная мембрана; SMF - субмембранный филамент; МТ - микротрубочки; Gly - гликоген. Зона органелл: М - митохондрии; G - гранулы; DB - плотные гранулы; DTS - система плотных трубочек; CS - система открытых канальцев
V - гидролизуется тромбином, поддерживает агрегацию тромбоцитов. Недостаток в мембране тромбоцитов различных субъединиц гликопротеинов I-V вызывает повышенную кровоточивость, связанную или с непрочным закреплением тромба, или с рыхлостью тромбоцитарного тромба, легко разрушаемого давлением крови. Агрегация тромбоцитов стимулируется также молекулами АДФ, активирующими в их мембране пуриновые рецепторы. Участки молекул гликопротеинов мембраны тромбоцитов содержат антигенные группы, формирующие тромбоцитарную систему антигенов HPA (от Human Platelet Antigens) и систему антигенов АВО, идентичную эритроцитарной.
К нижнему краю периферической зоны тромбоцита прилегает зона золя-геля гиалоплазмы,отделяющая зону внутриклеточных органелл. В указанной зоне вдоль края клетки располагается сократительный аппарат тромбоцита - краевое кольцо микротрубочек, контактирующее с микрофиламентом. При стимуляции тромбоцита кольцо микротрубочек, сокращаясь, смещает гранулы к центру тромбоцита («централизация гранул»), сжимает их, вызывая секрецию содержимого гранул через систему открытых канальцев в плазму крови. Сокращение кольца микротрубочек позволяет тромбоциту образовывать псевдоподии (выросты цитоплазмы), что увеличивает его способность к агрегации.
Зона органелл содержит плотные и α-гранулы I и II типа. Плотные гранулы содержат АДФ, АТФ, кальций, серотонин, норадреналин и адреналин. Кальций участвует в регуляции адгезии, сокращения, секреции тромбоцитов, активации его фосфолипаз и, следовательно, продукции в мембране тромбоцитов простагландинов, необходимых для образования тромбоксана А2. При адгезии тромбоцитов к стенке сосуда начинается секреция в больших количествах АДФ, которая усиливает приклеивание циркулирующих
222 |
223 |
