
6 курс / Кардиология / Миокардиты Дерюгин М.В
..pdf4.6.2. Сцинтиграфия сердца с различными радиофармпрепаратами
Для определения наличия лейкоцитарной инфильтрации в мышце сердца и выраженности перфузиомных нарушений, в клинической практике используется томосцинтиграфия сердца с различными радиофармпрепаратами (РФП). Для визуализации воспаления используют радиофармпрепараты, избирательно накапливающиеся в зоне воспаления: цитрат галлия-67 (<>7Оа); аутолейкоциты, меченные технецием-99 или ипдием-111- оксимом ("Чп) и антитела к миозину, меченные "Чп.
Использование одпофотоппой эмиссионной компьютерной томографии сердца (ОФЭКТ) позволяет получать качественные многомерные изображе-I шя миокарда с толщиной каждого томографического скана до 0,88 см. Таким образом, при анализе серии компьютерных срезов сердца можно определить наличие и протяженность лейкоцитарной инфильтрации в миокарде.
Помимо определения воспаления в миокарде необходимо проведение повторной томосцинтиграфии с перфузиониыми РФП. Для этого используют такие РФП, как "Тстехнетрил (или отТс-М1В1) и излучающие нуклиды таллия хлорида-201 (2ШТ1). Перфузионный РФП накапливается в интактной ткани сердечной мышцы, оставляя участки ишемии, некроза и кардиосклероза в виде «дефектов накопления». Для диагностики стенозирующего атеросклероза коронарных артерий необходимо проведение нагрузочных проб (велоэргометрия, тредмил, пробы с дофамином или дипиридамолом) и на высоте нагрузки, когда создаются условия несоответствия доставки кислорода в ткани и его повышенным потреблением, вводят перфузионный РФП, а затем проводят сцинтиграфию миокарда. Сцинтиграфия сердца с "Тс-М 1В1 или 2()1Т1, выполненная в покое, используется для оценки микроциркуляторного русла, а нарушение микроциркуляции при сохранении магистрального кровотока по венечным артериям чаще всего связано с миокардитическим кардиосклерозом.
Таким образом, проведение радиоизотопной диагностики в комплексе из двух исследований (определение воспалительной инфильтрации и перфузии миокарда) позволяет оценить наличие воспалительной инфильтрации в миокарде, а также определить нарушение перфузии, что связано с миокардитическим кардиосклерозом.
4.6.3. Магнитно-резонансная томография сердца
Воспалительную инфильтрацию в миокарде можно выявить посредством магнитнорезонансной томографии (МРТ) с контрастированием парамагнитными контрастирующими препаратами. Метод МРТ позволяет визуализировать участки внеклеточной воды, что характерно для отека ткани
миокарда. Для определения воспаления в миокарде сначала необходимо выполнить первичную МРТ сердца, затем внутривенно ввести парамагнитный контраст и через 10-30 минут провести повторное магнитно-резонансное исследование. Контраст избирательно накапливается в участках внеклеточной воды и изменяет резонансные свойства тканей, таким образом по серии изображений миокарда до и после контрастирования можно судить
олокализации и протяженности воспалительной инфильтрации в миокарде.
4.6.4.Ультразвуковая денситометрия миокарда
Самым доступным визуальным методом в кардиологической клинике является эхокардиография, которая позволяет оценить размеры камер сердца, толщину стенок, состояние клапанного аппарата, глобальную и локальную сократительную способность миокарда. Использование режима «асоизйс йегакотеи-у» позволяет определить плотность миокарда и сделать заключение о наличии отека и фиброза в сердечной мышце. Средние значения плотности миокарда в диастолу в норме составляют 11 ед. с колебаниями от 9 до 13 ед. При отеке в миокарде ЭХО-плотпость сердечной мышцы снижается, а при фиброзе - повышается. Второй показатель, позволяющий судить о наличии отека и фиброза в миокарде - расчетный коэффициент соотношения плотности миокарда в диастолу и в систолу (систолодиастолическое соотношение СДС). Это процентное соотношение ЭХО-плотности миокарда в конце диастолы и конце систолы. В норме показатель СДС составляет от +30 до +45%, у больных с отеком в миокарде (гипотиреоз, миокардит) систоло-диастолическое соотноше-
ние снижается от +5 до +10%, а у больных с фиброзом в миокарде (системная склеродермия, кардиосклероз) оно приобретает отрицательное значение от -19 до -31%.
5. ДИАГНОСТИЧЕСКИЙ АЛГОРИТМ МИОКАРДИТА
Несмотря на множество клинических симптомов заболевания, изменений лабораторных и инструментальных показателей, диагноз миокардита устанавливается после тщательного анализа результатов обследования, при этом существенное значение имеют опорные клиника-инструментальные критерии заболевания. Для первичной клинической диагностики целесообразно использовать диагностические алгоритмы, которые позволяют заподозрить у больного миокардит. В дальнейшем воспалительную инфильтрацию и кардиосклероз необходимо подтверждать морфометрическими методами. Наиболее известна схема клини-ко-инструменталыюй диагностики миокардита, рекомендованная Нью-Йоркской ассоциацией кардиологов (ЫУНА 1964, 1973) (табл. 5).
Таблица 5 Схема клинико-инструментальной диагностики миокардитов
Критерии диагностики: Связь с перенесенной инфекцией, доказанная клинически и лабораторными данными: выделение возбудителя, его антигенов, выявление антител к инфекционным патогенам, а также лейкоцитоз, ускорение СОЭ, появление С-реактивного белка. Признаки поражения миокарда. Большие признаки:
патологические изменения на ЭКГ (нарушения реполяризации, ритма и проводимости);
повышение концентрации кардиоселективных ферментов и белков (КФК, КФК-МВ, ЛДГ, тропонин Т);
увеличение размеров сердца по данным рентгенографии или эхокардиографии;
застойная недостаточность кровообращения;
кардиогенный шок. Малые признаки: тахикардия (или брадикардия), ослабление первого тона, ритм галопа.
По критериям ЫУНА (1964, 1973) появлению симптомов поражения сердца должна предшествовать инфекция (это обязательный признак, который должен быть доказан клиническими и лабораторными методами). Кроме инфекционного фактора у больных должны быть клинические и лабораторные признаки воспаления и синдромы поражения миокарда, которые разделены на «большие» и «малые» диагностические критерии. Диагноз миокардита наиболее обоснован, если после перенесенной инфекции (доказанной лабораторно и клинически), через 2-3 недели, выявляются 2-3 «больших» и 1-2 «малых» критерия. Позднее к большим критериям заболевания был добавлен еще один синдром - изменение иммунологических показателей. Перечисленные критерии не охватывают ни жалоб больных, ни клинических симптомов заболевания, а лишь констатируют изменения лабораторных и инструментальных показателей в связи с инфекционным заболеванием, чаще острым.
Следует учесть, что все клинико-лабораторные и инструментальные критерии, представленные в вышеизложенных диагностических алгоритмах, являются косвенными и встречаются при других заболеваниях сердечно-сосудистой системы. По набору вышеуказанных признаков невозможно судить о наличии и протяженности воспалительной инфильтрации и миокардитического кардиосклероза. Поэтому для установления правильного диагноза необходимо придерживаться современного алгоритма (рис. 1), который позволяет заподозрить миокардит по клиническим признакам и изменениям лабораторноинструментальных показателей, а затем необходимо
Анализ жалоб, анамнеза заболевания, результатов врачебного осмотра
Верификация воспаления и фиброзирования в миокарде:
•Эндомиокардиальная биопсия
•Томосцинтиграфия сердца с РФП, тройными к воспалению
•МРТ сердца с контрастированием
•Ультразвуковая денситомет-рия
•Ангиография коронарных артерий
Доказательство активности иммуновоспалительного процесса и повреждения кардиомиоцитов:
•Кардиоселективные ферменты и белки (КФК, ЛДГ, Тропонин-Т)
•Маркеры воспаления (фибриноген, С-реактивный белок, сывороточный амилоид А, адгезивные молекулы, интер-лейкины 1В, 6, 8, 10, ФНО-А)
•Иммунологические тесты (ЦИК, 1дМ, О, А, кардиальный антиген, антитела к миокарду, РТМЛ)
•
Выявление ремоделирования и дисфункции сердца:
•Электрокардиография (увеличение размеров сердца, систолическая и диастолическая дисфункции)
•Определение степени и стадии
хсн
Выявление этиологических факторов:
•Поиск возбудителей острых и хронических инфекций(вирусы, бактерии, спирохеты, простейшие и пр.) и антител к ним посредством культуральных методов, ПЦР, ИФА, НМФА и др.
•диагностика очагов хронической инфекции
доказать наличие воспаления прямыми методами, что позволяет дифференцировать миокардит с другими синдромосходными заболеваниями. Современный диагностический алгоритм включает:
1)оценку жалоб больных и данных объективного обследования;
2)изучение лабораторных и иммунологических показателей, характерных для повреждения кардиомиоцитов и для воспалительного процесса;
3)выявление электрической и механической дисфункции сердца;
4)выявление признаков хронической сердечной недостаточности и компенсаторных механизмов ее коррекции;
5)визуализацию воспалительной инфильтрации в миокарде и выраженности миокардитического кардиосклероза;
6)выявление инфекционных патогенов.
Реализация диагностических направлений не предполагает строго определенной последовательности. Но по каждому диагностическому направлению должна быть получена максимально исчерпывающая информация с последующим тщательным анализом.
6. МЕТОДИКА ПРОВЕДЕНИЯ ЭНДОМИОКАРДИАЛЬНОЙ
БИОПСИИ
Диагностическая ЭМБ должна проводиться только в кардиохирургических стационарах по направлению кардиологов. Перед определением показаний к проведению эндомиокардиальной биопсии всем больным необходимо провести стандартное клиническое и кардиологическое обследование, которое включает:
1)лабораторное исследование крови, мочи, кала;
2)исследование кардиоселективных ферментов, биохимических и иммунологических маркеров воспаления, показателей коагулограммы;
3)рентгенографию органов грудной полости в двух проекциях с контрастированием пищевода;
4)электрокардиографию в 12 стандартных отведениях;
5)суточное мониторирование ЭКГ;
6)эхокардиографическое исследование;
7)чреспищеводное электрофизиологическое исследование проводящей системы
сердца; 8) выполнение нагрузочных проб для исключения ИБС и, при необходимости, селек-
тивной ангиографии коронарных артерий сердца.
Больным молодого возраста (20-50 лет) биопсия миокарда должна проводиться только после исключения ишемической болезни сердца,
аномалий развития коронарных артерий сердца и соединительнотканных дисплазий. Показания к проведению ЭМБ следующие:
-прогрессирующие, стойкие к медикаментозному лечению бради-кардии;
-полная атриовентрикулярная блокада неизвестной этиологии, не связанная с ИБС (непосредственно перед имплантацией постоянного ЭКС);
-постоянно рецидивирующие суправентрикулярные тахиаритмии (перед проведением эндокардиального электрофизиологического исследования);
-идиопатическая дилатация камер сердца;
-идиопатическая систолическая дисфункция миокарда.
Премедикация осуществляется внутримышечным введением релани-
ума или сибазоиа в дозировках, соответствующих возрасту и массе тела пациентов. В клинической практике используются две различные методики эндомиокардиалыной биопсии. Первая методика предусматривает проведение биопсии электродом-биотомом ЭКППР-2 под контролем рентгена с записью эндограммы в момент диагностической процедуры, а вторая - забор биоптатов штатным биотомом американской фирмы «Согшз» под визуальным контролем ЭХОКГ.
Эндомиокардиальная биопсия электродом-биотомом ЭКППР-2 производится в рентгеноперационной с использованием рентгентелевизион-ного оборудования с обязательной регистрацией электрокардиограммы и эндоэлектрограммы на бумажном носителе или в памяти компьютера. Для введения в организм биотома ЭКППР-2 применяется доступ через правую бедренную вену, которую пунктируют по методике Сельдипгера и устанавливают в ее просвете иптродыосер диаметром 9 френч (Рг). В правом предсердии и правом желудочке положение биотома изменяют при помощи стилетов с различной степенью кривизны дисталыюго конца. Все внутрисердечные манипуляции производятся под контролем рентгентелевизионной установки. После проведения биотома в одну из правых камер сердца подключают проксимально расположенный штекер биотома к регистрирующей аппаратуре. При соприкосновении дис-тального конца биотома с эндокардом, на регистрирующей аппаратуре появляется характерная кривая эндоэлектрограммы. Руководствуясь ее параметрами, начинается вкручивание биотома в сердечную ткань, для этого производятся вращательные движения по часовой стрелке вокруг своей оси. Произведя 1-4 оборота (360-1440°), под контролем эндоэлектрограммы и флюороскопии производится тракция и извлечение биотома из организма пациента. Биоптат оказывается фиксированным между сер-
повидпыми окончаниями биотома, его аккуратно извлекают и сразу помещают в пробирку с фиксирующим раствором. При необходимости био-том вводят в полость сердца повторно, таким образом забирают 3-7 кусочков эндомиокарда из различных отделов правого предсердия и правого желудочка, из «зоны интереса». После получения необходимого количества биоптатов иптродыосер удаляют, и на место пункции вены накладывают давящую асептическую повязку.
При проведении ЭМБ штатным биотомом американской фирмы «СогсИз» возможно получение кусочков сердца, как из правых, так и из левых камер сердца, в зависимости от длины биотома. Дистальный конец биотома имеет плавный изгиб на 80° и рабочую часть в виде двухстворчатых кусачек. Все внутрисердечпые манипуляции производятся под контролем записи ЭКГ (для регистрации нарушений ритма). Нахождение биотома в сердечных полостях отслеживают по данным ЭХОКГ при положении ультразвукового датчика па верхушке сердца. Кусочки миокарда забирают из левого желудочка путем введения биотома в сердце через иптродыосер, установленный в бедренную артерию или из правого желудочка и межжелудочковой перегородки - при введении биотома через плечевую вену.
Получаемые в ходе операции биоптаты миокарда фиксируют в формальдегиде .и направляют для приготовления микропрепаратов в патологоанатомическое отделение.
7. МЕТОДИКА РАДИОИЗОТОПНОГО ИССЛЕДОВАНИЯ СЕРДЦА
Для выявления лейкоцитарной инфильтрации в мышце сердца используют следующие РФП:
•цитрат галлия-67 С'7Са), который обладает аффинностью к нейтро-фильпым лейкоцитам, моноцитам и активированным Т-лимфоцитам, поэтому накапливается клетками крови в воспалительных инфильтратах, делая их радиологически определяемыми;
•меченные аутолейкоциты, где в качестве радиоактивной метки используются индий- 111-оксим (ш1п) или комплекс Техпеция-99т с гек-саметилпропиленамипоксимом (препарат "Сеге1ес");
•антитела к миозину, меченные "Чп;
•антителами к гранулоцитам (препарат "Ьеисохсап"), меченные "Тс.
Однофотонная эмиссионная компьютерная томография сердца
(ОФЭКТ) позволяет получать качественные многомерные изображения миокарда с толщиной каждого томографического среза до 0,88 см. Таким образом по серии компьютер-
ных срезов сердца можно определить наличие и протяженность лейкоцитарной инфильтрации в миокарде.
При проведении радиоизотопного исследования, для точной.топической привязки очагов воспалительной инфильтрации к стенкам сердца, необходимо выполнение двух последовательных диагностических процедур - сначала томосцинтиграфии миокарда с воспалительным РФП и затем с кардиотропным РФП. Обязательным условием проведения повторной томосцинтиграфии миокарда с кардиотропными РФП является строгая фиксация пациента на столе для исключения вертикального и горизонтального смещения.
7.1.Методика томосцинтиграфии миокарда с мечеными "Тсаутолейкоцитами
Методика томосцинтиграфии миокарда с мечеными "Тс-аутолейко-цитами состоит из нескольких последовательных этапов: получения лейкоцитарного концентрата; проведения радиоактивной метки аутолей-коцитов; выполнения планарной сцинтиграфии тела и томосцинтиграфии миокарда с "Тсаутолейкоцитами.
7.1.1. Способ получения лейкоконцентрата
Все работы по забору крови и приготовлению лейкоконцентрата проводят с соблюдением правил асептики и антисептики в условиях отделений, оборудованных для забора и переливания крови. Для получения лейкоцитарной массы используют 200-400 мл крови, взятой из вены в стандартный контейнер «Гемакои 500/300», содержащий 90 г глюгицира (натрия гидрокарбопата 30 г, глюкозы безводной 30 г, воды для инъекций до 1 л). Проводят центрифугирование пеотстоявшейся крови на центрифуге «ОС-6М» или аналогичном аппарате со скоростью 2600 оборотов в мин. в течение 15 мин. при постоянной температуре 15-20°С. В результате эритроциты оседают в нижней части контейнера, плазма остается в верхней части контейнера, а лейкоциты оказываются в центре в виде тонкого слоя серо-желтого цвета. Аккуратно, не взбалтывая, вынимают контейнер из центрифужного стакана и устанавливают в плазмоэкстрактор. Присоединяют к контейнеру «Гемакои 500/300» еще один контейнер «Компо-пласт 300/300», куда переводят плазму. Лейкомассу собирают в свободный контейнер «Гемакои 500/300». На этом этапе необходимо добиться минимальной примеси эритроцитов в лейкоконцептрате. Удаляют из контейнера с лейкомассой воздух и проводят паспортизацию заготовленного лейкоконцентрата. Общее количество лейкоконцентрата должно составлять. 25-35 мл, а содержание лейкоцитов - от 25 до 40х 109/л, но не менее 20х 107л. Если существует необходимость хранения лейкоконцентрата, то его помещают в холодильник на срок до 16 ч (при I +4...+6 °С). Плазму и эритроциты возвращают обратно в кровеносное русло пациента.
7.1.2. Процедура мечения аутолейкоцитов
Мечение аутолейкоцитов производят в процедурном кабинете радиоизотопной лаборатории в стерильных условиях. В качестве радиоактивной метки используют комплекс "Тс с гексаметилпропиленами-нооксимом (препарат "Сегегес"). Этот препарат обладает выраженными липофильными свойствами и способен длительно удерживать "Тс на мем-
бране лейкоцитов. Флакон с «Церетеком» помещают в защитный свинцовый контейнер. Добавляют во флакон с реактивом 5 мл свежего элюата 99-технеция активностью 555-740 МБк (15-20 мКи). В шприце с элюатом не должно быть пузырьков воздуха! Встряхивают защитный контейнер с флаконом для полного растворения реагента. Допустимо разведение элюата стерильным физиологическим раствором для получения необходимой объемной активности. В контейнер с лей-коконцентратом добавляют 4 мл комплексного соединения "Тс с гекса-метилпропиленамииооксимом. Осторожно перемешивают вращательными движениями и инкубируют смесь в течение 10-15 мин при температуре не ниже 20°С. При температуре воздуха ниже 20°С время инкубации увеличивают до 25-30 мин. Затем лейкокоицеитрат центрифугируют при 150 § в течение 5 мин. Полностью удаляют суперпатапт, содержащий несвязанный "Тсгексаметилпропиленамипооксим. Для этой цели используют шприц с толстой тупой иглой. Добавляют 20 мл стерильного физиологического раствора, повторяют центрифугирование и удаление супернатанта. Разводят меченные "Тс лейкоциты в 10-15 мл физиологического раствора и вводят пациенту.
7.1.3. Проведение планарной сцинтиграфии тела и томосцинтиграфии миокарда с мечеными "Тсаутолейкоцитами и с "Тс-технетрилом
Распределение меченых "Тс-аутолейкоцитов в организме пациента визуализируют с помощью однофотонпого эмиссионного компьютерного томографа. Сначала проводят планарную сцинтиграфию через I, 3 и 24 часа после возвращения меченых лейкоцитов. При положе1 ши коллиматора во фронтальной плоскости регистрируют изображения передней и задней проекций тела. На полученных изображениях особое внимание обращают на места повышенного накопления РФП в области носоглотки, оргапах малого таза и в лимфатических коллекторах. Накопление аутолейко-цитов в этих областях через 24 часа после возвращения их в кровеносное русло следует расценивать как возможные очаги хронической инфекции, что требует осмотра соответствующих специалистов (стоматологов, оториноларингологов, урологов, гинекологов). Очаги воспаления в брюшной полости следует оценивать в первые 1-3 часа после введения препарата. Накопление РФП в области толстого кишечника, желчного пузыря и мочевого пузыря через 24 часа не следует рассматривать как очаги инфекции, т.к. это естественные пути элиминации РФП из организма.
Для определения воспалительной инфильтрации в миокарде пациентам выполняют одпофотогшую эмиссионную компьютерную томографию сердца. Диагностическая процедура должна быть выполнена через 20-24 часа после возвращения "Тс-аутолейкоцитов в кровяное русло. Режим регистрации показателей следующий: орбита - круговая или эллиптическая: дуга - 360 град.; шаг - 6 град.; время на кадр - 15-20 сек.; запись 1 кадра производится па энергетическом пике "Тс (140 КэВ). При компьютерной обработке используется Напшп§-фильтр. Томографические «срезы» сердца проводят по короткой оси сердца через каждые 0,88 см (толщина - 1 пиксел) от верхушки к основанию.
Для лучшей визуализации ткани миокарда и изучения перфузии сразу после ОФЭКТ сердца с мечеными ,,9Тс-аутолейкоцитами выполняется повторная томосциитиграфия миокарда с кардиотропными РФП -"Тс-технетрилом ("Тс-М1В1) или хлоридом таллия-201 (:01Т1) по общепринятой методике. Исследование выполняется в покое, без проведения пробы с физической нагрузкой. Снижение перфузии миокарда при сохранении магистрального кровотока по венечным артериям чаще всего связано с миокардитическим кардиосклерозом.
7.1.4. Методика томосцинтиграфии миокарда с цитратом галлия-67
При проведении сканирования с цитратом галлия-67 ("Оа), РФП вводят внутривенно в дозе 5-6 мКи (185-222 МБк) из расчета 0,08 мКи/ кг массы пациента (2,96 МБк/кг). Томосцинтиграфию с 67Оа проводят через 72 часа после введения препарата в следующем режиме: орбита -круговая или эллиптическая: дуга - 360 град, шаг - 6 град.; время на кадр - 15-30 сек. запись 1 кадра производится па трех энергетических пиках (93 КэВ, 184 КэВ и 296 КэВ), соответствующих (,7Оа. При обработке данных ОФЭКТ с "Оа используют фильтр ОАН5. Томографические «срезы» сердца проводят по короткой оси толщиной в 1 пиксел (0.88 см) от верхушки к основанию.
Затем выполняют повторную томосцинтиграфию с кардиотропными РФП (91,>|Тс-М1В1 или хлоридом таллия-201) в покое по общепринятой методике. Различие энергетических пиков радионуклидов позволяет получить качественное изображение сердца, провести
четкую топическую диагностику очагов воспаления и верифицировать перфузион-пые нарушения.
7.1.5. Оценка данных томосцинтиграфии миокарда с «воспалительными» и перфузионными РФП
После выполнения томосцинтиграфии проводят тщательный анализ серии изображений сердца по короткой оси, проведенных от верхушки к основанию через каждые 0,88 см (1 пиксел), на основании чего делают окончательное заключение о накоплении «воспалительного» РФП в миокарде. Результаты сцинтиграфии миокарда с «воспалительным» РФП совмещают с изображениями миокарда, полученными при перфу-зионной ОФЭКТ. Для топического проецирования внешние контуры левого желудочка обводят окружностью. На томограммах левый желудочек условно разделяют на 4 области (соответствующие стенкам): переднюю, боковую, заднюю и перегородочную. Отдельно проецируют изображения правого желудочка, правого и левого предсердия. В заключении радиолога должны быть проанализированы три показателя -наличие лейкоцитарной инфильтрации в миокарде, ее протяженность и наличие перфузионных нарушений. Наличие лейкоцитарной инфильтрации в миокарде определяют на каждом томографическом срезе полуколичественным способом по коэффициентам соотношения активности излучения в стенках сердца и окружающих тканях - фон (в качестве фона лучше использовать показатели активности излучения крови внутри полости ЛЖ на каждом «срезе»). Для этого в каждой стенке сердца по короткой оси и внутри полости ЛЖ (фон) определяют активность накопления РФП. Затем, отдельно для каждой стенки сердца, высчитывают коэффициент соотношения активности излучения миокарда и фона. Численное значение коэффициента излучения миокард/фои, равное 1,5 и более (т.е. превышение активности излучения миокарда над фоном па 50% и больше), расценивают как отчетливое накопление «воспалительного» РФП в этой стенке сердца, что является признаком лейкоцитарной инфильтрации сердечной мышцы в данной области.
Протяженность воспалительной инфильтрации в миокарде оценивают по серии томографических срезов. Если отчетливое накопление «воспалительного» РФП в миокарде прослеживается более чем в 3 смежных срезах
(что соответствует протяженности воспаления не менее 2,5 см) - это следует расценивать как достоверную лейкоцитарную инфильтрацию в мышце сердца. Во избежание диагностических ошибок, протяженность воспалительной инфильтрации менее чем в трех смежных «компьютерных срезах» подряд не следует рассматривать как отчетливое накопление РФП в миокарде. Лейкоцитарную инфильтрацию миокарда с вовлечением 1-2 стенок сердца расценивают как ограниченную. Распространенным считается поражение трех и более стенок сердца, например, при выявлении лейкоцитарной инфильтрации в области межжелудочковой перегородки, задней и боковой стенок левого желудочка (клинический пример 1).
Наличие перфузиоиных нарушений оценивают по снижению накопления "Тс-М1В1 или М|Т1 по отношению к условно интактному миокарду. Перфузия признается достаточной в тех случаях, когда процент накопления РФП в соответствующей стеике сердца составляет не менее 65% от максимального значения в миокарде. Снижение перфузии менее 64% расценивается как нарушение перфузии этой стенки левого желудочка. Для миокардитического кардиосклероза характерно диффузно-неоднородное снижение накопления кардиотропного РФП по нескольким стенкам ЛЖ одновременно. Сциптиграфическая картина миокарда с наличием миокардитического кардиосклероза неоднородна и связана с мозаичным захватом изотопа, при этом участки нормальной перфузии перемежаются с локальными очагами гипоперфузии, что.напоминает поражение, «изъеденное молью» (клинический пример 2).
Таким образом, проведение радиоизотопной диагностики в комплексе из двух исследований позволяет оценить выраженность и протяженность воспалительного процесса в миокарде, а также определить нарушение перфузии вследствие миокардитического кардиосклероза.
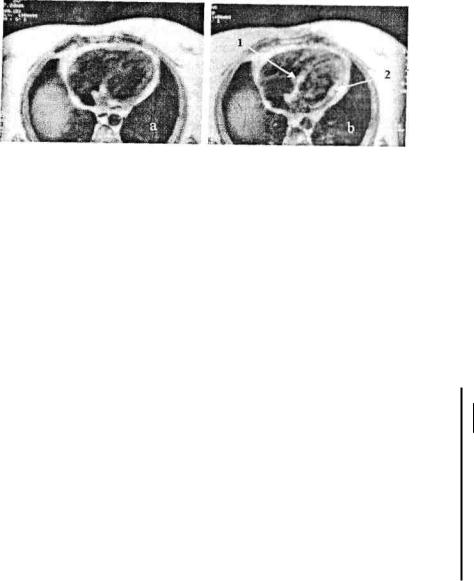
Клинический пример 1. У больной К., 32 лет, диагностирован миокардит по данным клинического и лабораторно-ииструментального обследования. Для определения наличия воспалительной инфильтрации в мышце сердца проведена томосцинтиграфия миокарда с

мечеными ^Тс-ау то лейкоцитами. Выявлено диффузное накопление меченых лейкоцитов в области правого предсердия, в области межжелудочковой перегородки, задней и боковой стенок левого желудочка (рис. 2), что позволило объективизировать клинический диагноз и определить локализацию воспалительного процесса.
Клинический пример 2. У больного С, 36 лет, после перенесенного миокардита остались стойкие нарушения ритма. Через год после лечения больной перенес острое респираторное заболевание и вновь отметил боли в области сердца, одышку, пастозпость стоп к вечеру. При обследовании пацм енту была проведена томосцинтиграфия миокарда с мечеными тТс-ауто лейкоцитами, и перфузионпая сцинтиграфия в покое с ""Тс-М1В1. Накоп М иия меченых лейкоцитов в миокарде не отмечено, выявлены перфуэиоиныв нарушения в области нижней стенки ЛЖ, межжелудочковой перегородки верхушки сердца и передней стенки (рис. 3). Сегментарного поражения миокарда, характерного для степозирующего атеросклероза коронарных артерий не выявлено, гипоперфузия носит мелкоочаговый характер с мозаичным захватом изотопа.
Рис. 2. Томосканы миокарда с '";Тс-аутолейкоцитами больной К., 32 лет. Компьютерные срезы проведены по короткой оси сердца от верхушки к основанию: а - через базальные отделы выше линии клапанного кольца; Ь - на уровне папиллярных мышц. Внешние контуры левого желудочка обведены окружностью. Стрелками указаны места скопления меченых аутолейкоцитов: 1 - в стенках правого предсердия; 2 - в области межжелудочковой перегородки; 3 - в области задней и боковой (4) стенок левого желудочка.
Рас. 3. Перфузионпая томосцинтиграфия миокарда с1;Тс-М1В1 в покое больного С, 36 лет. Реконструкция изобра-' жения по методике «бычий глаз». Отмечается неравномерное, мозаичное накопление кардиотропного РФП: / - в области нижней стенки ЛЖ; 2 - в межжелудочковой перегородке; 3 - в области верхушки сердца.
•8. МЕТОДИКА МАГНИТНО-РЕЗОНАНСНОЙ ТОМОГРАФИИ
•Магнитно-резонансную томографию сердца с контрастированием выполняют на томографе мощностью 0,5 Т и более, имеющем комплект кардиологических программ. В ходе исследования используют стандартные кардиологические протоколы. Для исключения артефактов, обусловленных дыхательными экскурсиями грудной клетки и сокращениями сердца, обязательно используют респираторный гейтииг и ЭКГ-синхронизацию (регистрация изображений производится в диастолу).
•На первом этапе исследования получают исходные (фоновые) Т1- и Т2взвешенные изображения в аксиальной, правой и левой косых плоскостях, и по короткой оси сердца. Затем, для усиления магнитно-резонансного (МР) сигнала, проводят внутривенное контрастирование парамагнитными контрастирующими препаратами, содержащими соли гадолиния - препараты «омнискан» или «магневист». Объем инфузии зависит от массы тела пациента и рассчитывается исходя из соотношения: 0,2 ммоль/мл на 1 кг веса пациента. Через 15-20 мин после внутривенного введения контраста проводят повторную МРТ сердца по тем же компьютерным программам и осям сердца, что и до введения препарата
(второй этап). Таким образом, получают парные изображения миокарда в одних и тех же плоскостях и срезах.
•Анализ полученных изображений включает оценку структур средостения (трахея
икрупные сосуды, лимфатические узлы), определение размеров камер сердца и толщины стенок миокарда. Определение в миокарде наличия воспалительной инфильтрации проводят полуколичественным методом. На каждом изображении сердца определяют интенсивность МР сигнала в каждой стенке сердца и в подкожном жировом слое (фон). Высчитывают соотношение интенсивности МР сигналов жир/ миокард для каждой стенки сердца па фоновых изображениях и после контрастирования. Дополнительно введенный контраст избирательно накапливается в очагах внеклеточной воды, чем более выражен отек в миокарде, тем больше накапливается контраст, изменяя показатели интенсивности МР сигнала. Уменьшение численного значения соотношения жир/миокард па постконтрастных изображениях на 40% и более расценивают как отчетливое накопление контраста в миокарде, которое соответствует наличию внеклеточного отека. Мпогопроекционные изображения сердца позволяют определить локализацию и протяженность воспалительной инфильтрации миокарда (клинический пример 3).
Для исключения диагностических ошибок, накопление контраста должно быть прослежено не менее чем на протяжении 3-4 компьютерных «срезов» подряд (что соответствует 2,5-3,0 см). Следует учесть, что МРТ нельзя проводить больным с нарушениями ритма до купирования аритмии. Нарушения ритма негативно отражаются на качестве изображений, снимки получаются нечеткими.
Клинический пример 3. Больная К., 32 лет. Для определения наличия воспалительного отека в миокарде проведена МРТ сердца с контрастированием (рис. 4). На постконтрастных Т1-изображениях выявлены участки повышенного МРТ-сигнала в области боковой стенки левого желудочка и межжелудочковой перегородки.
Рис. 4. Магнитно-резонансная томография сердца больной К.: и - до введения контраста, Ь - после контрастирования. Стрелками указано наличие отека в области межжелудочковой перегородки (1) и боковой стенки левого желудочка.
9. МЕТОДИКА УЛЬТРАЗВУКОВОЙ ДЕНСИТОМЕТРИИ МИОКАРДА
Эхокардиография, выполненная по стандартному протоколу, необходима для оценки размеров сердца, толщины стенок, состояния клапанного аппарата, глобальной и локальной сократимости. Использование режима эходепситометрии позволяет определить наличие отека и фиброза в миокарде левого желудочка. Однако для исключения диагностических ошибок необходимо строго придерживаться стандартных режимов проведения этой процедуры, а также подходов к настройке эходенситометрических режимов ультразвуковой аппаратуры и интерпретации показателей. В случаях неправильной настройки аппарата и пренебрежения стандартным протоколом велика вероятность получения ложноположительного или ложпоотрицателыюго результата.
ние лабораторных и иммунологических показателей, характерных для воспалительного процесса и поражения кардиомиоцитов; верификацию воспалительной инфильтрации в миокарде и кардиосклероза посредством морфометрических методик; поиск очагов хронической инфекции, инфекционных антигенов и антител к ним.
Дифференциальная диагностика должна проводиться постоянно, круг сипдромосходной патологии пе должен ограничиваться только заболеваниями сердца. Обязательно следует проводить обследование щитовидной железы для исключения тиреоидита, тирео-
токсикоза или гипотиреоза. Всем больным необходимо проводить ультразвуковое исследование железы, а при необходимости - определять концентрацию тироксина, трийодти- ро-иина, тиреотроппого гормона и антител к тиреоглобулину.
У лиц молодого возраста (от 14 до 35 лет) всегда необходимо исключать ревматизм, ревматические пороки сердца и соединительнотканные дисплазии сердца. В диагностике помогают тщательный сбор анамнеза заболевания, внимательный осмотр костносуставного аппарата, выявление критериев и синдромов ревматизма, определение концентрации антистрептолизипа-О, а также подтверждение патологии клапанного аппарата
иналичия малых аномалий сердца (при ЭХОКГ).
Убольных средней возрастной группы (35-50 лет) в ходе дифференциальной диагностики необходимо исключать гипертоническую болезнь, симптоматические гипертепзии
иишемическую болезнь сердца, для чего следует проводить суточное мопиторирование артериального давления, нагрузочные ЭКГ-пробы, а при необходимости - исследовать коронарные артерии сердца.
Кардиалгии, одышка, перебои в работе сердца и другие жалобы и изменения па ЭКГ могут быть и у больных с анемией, уремией, алкогольным поражением сердца, хроническим тонзиллитом и дисфункцией вегетативной нервной системы. Любой патологический процесс как инфекционной, так и не инфекционной природы может сопровождаться дистрофическими изменениями в клетках сердца. При проведении дифференциальной диагностики миокардита и дистрофии миокарда помогают следующие клипи-ко- ипструмептальпые показатели: быстрое купирование клинических признаков и нарушений ритма после устранения причин, вызвавших дистрофические изменения кардиомиоцитов и курса метаболической терапии; отсутствие в крови кардиалыюго антигена и антител к миокарду; нормальные значения концентрации фактора некроза опухоли-а; отсутствие дила-тации камер сердца и систолической дисфункции; отсутствие воспалительной инфильтрации и миокардитического кардиосклероза.
При настройке режима эходенситометрии на ультразвуковых аппаратах, имеющих соответствующую программу, и при проведении исследований, необходимо учесть следующие условия, обеспечивающие сопоставимость получаемых данных.
1.Диапазон плотностей исследуемых тканей сердца должен полностью перекрываться диапазоном ступеней яркости «серой шкалы» прибора.
2.Частоты зондирующего ультразвука, используемого для эходенситометрии, должны быть максимально возможными, обеспечивающими видимость «зоны интереса».
3.Участки эходенситометрических стандартов минимальной и максимальной плотностей должны присутствовать на изображении одновременно с изучаемой зоной. В качестве стандарта минимальной плотности следует использовать уровень плотности крови в полостях сердца, а в качестве стандарта максимальной плотности - плотность дис-тальных по отношению к датчику листков перикарда.
4.Регулировка мощности излучаемого сигнала должна осуществляться исходя из принципа преобладающей «серой шкалы» с максимальным приближением нижнего уровня яркости изображения к стандарту минимальной плотности ткани.
5.Для уменьшения фланговых искажений зону интереса целесообразно размещать на оси, перпендикулярной поверхности датчика.
6.Определение ЭХО-плотиосги миокарда необходимо проводить только в области задней стенки ЛЖ и межжелудочковой перегородки на срединном и базалыюм уровнях из парастерпалыюго доступа в продольном сечении с учетом фазы сердечного цикла (в конце систолы и конце диастолы).
7.Абсолютные показатели измерений ЭХО-плотности миокарда суммируются отдельно для систолы и диастолы, определяются средние значения, затем рассчитывается систо- ло-диастолическое соотношение (СДС) плотности каждой стенки ЛЖ в систолу и диастолу. Для расчета СДС используют формулу [(СЗПССд - СЗПССс)/СЗПССд] х 100, где СЗПССд - среднее значение ЭХО-плотности сердечной стенки в диастолу, СЗПССс - среднее значение плотности стенки в систолу.
8.Абсолютные значения ЭХО-плотности крови в полости ЛЖ должны составлять после калибровки аппарата 0-1 ед., а плотность перикарда - 26-32 ед.
