
4 курс / Дерматовенерология / От меланоцитов до меланомы
.pdf
Cancer Chameleon
ОБЗОРЫ ||
Перевод: Баранников Сергей, Яценко Антон Редактор: Яценко Антон, Кушнарев Владимир Изображения: Яценко Антон
От меланоцитов до меланомы
A. Hunter Shain and Boris C. Bastian
Абстракт | Меланомы располагающиеся на коже, связанные с солнечной инсоляцией — это гетерогенные опухоли, которые можно субтипировать по суммарному уровню воздействия на них УФ-излучения. Меланоцитарные опухоли можно также классифицировать в зависимости от их прогрессии — от доброкачественного новообразования, например невуса, до злокачественного новообразования, например метастатической меланомы. Каждый подтип меланомы развивается по различным эволюционным путям, проходя (а иногда и пропуская) различные стадии трансформации. В этом обзоре описаны некоторые из наиболее распространённых путей прогрессии, которые встречаются in vivo, и предложены модели эволюции опухоли, которые объединяют генетические, патоморфологические, клинические и биологические данные из исследований по меланоме.
Солнечный эластоз
Дегенеративное изменение эластичных волокон дермы, вызванное длительным воздействием УФ-излучения.
Поражения-предшественники
Меланоцитарные образования, которые имеют повышенный риск прогрессирования в меланому.
Доброкачественный невус
Ограниченная пролиферация меланоцитов в эпидермисе, дермо-эпидермальном соединении или в дерме.
Диспластический невус
Клинически увеличенный (большее 5 мм) плоский невус, или невус, с признаками тканевой или цитологической атипии.
Меланома in situ
Интрадермальная и /или парабазальная пролиферация атипичных меланоцитов с гнездным или педжетоидным распространением.
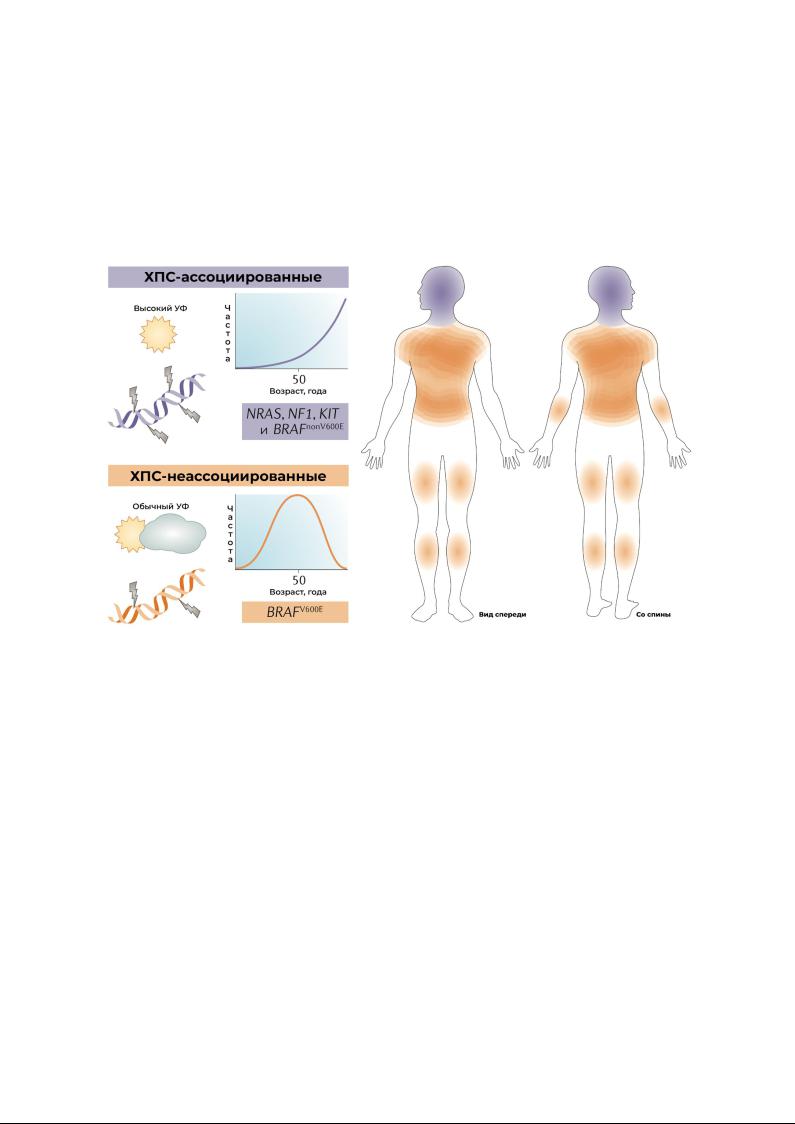
Меланоцитарные новообразования варьируют от доброкачественных (меланоцитарные невусы) до злокачественных поражений кожи — меланом. Все они развиваются из меланоцитов, происходящих из клеток нервного гребня, которые окрашивают нашу кожу, глаза, и, в меньшей степени, другие ткани по всему телу1. Меланоциты разных локализаций могут быть причиной разнообразных по фенотипу форм меланомы2. Наиболее распространённые типы меланомы встречаются у европейцев на коже, подвергающейся воздействию солнца. Эти кожные меланомы можно разделить на две группы: с хронической инсоляцией кожи и без инсоляции (ХПС- и неХПСмеланомы, соответственно; рис. 1). ХПС и неХПС-меланомы отличаются локализацией, степенью кумулятивного воздействия УФ-излучения, возрастом человека, мутационной нагрузкой и типами онкогенных мутаций 3-6. На коже возникают ХПС-меланомы, которые проявляют макро- и микроскопические признаки длительного воздействия УФ-излучения, например выраженный солнечный эластоз. Таким образом, ХПС-меланомы обычно возникают на голове, шее и задней поверхности ног пожилых людей (>55 лет).
Cancer Chameleon
Они имеют высокую мутационную нагрузку и ассоциируются с мутациями в нейрофибромине 1 (NF1), NRAS, BRAFnonV600E или мутациями KIT2 2.
неХПС-меланомы, как правило поражают туловище и руки у молодых людей (возраст менее 50 лет), и не сопровождаются выраженным солнечным эластозом. Они ассоциируются с умеренной мутационной нагрузкой и преобладанием BRAFV600E2 мутаций2.
Рисунок 1. ХПС- и не ХПС-меланомы являются различными подтипами меланом. Меланомы на коже, подвергающейся воздействию солнца, отличаются по клиническим, морфологическим и молекулярным аспектам в зависимости от степени солнечного повреждения кожи. ХПС-меланомы имеют более высокую мутационную нагрузку и поздний возраст появления, и возникают на анатомических участках с наиболее высоким уровнем солнечного облучения, например в области головы и шеи. Не ХПС-меланомы могут возникнуть в более раннем возрасте, часто связаны с невусами, имеют сравнительно более низкую мутационную нагрузку и появляются на тех участках тела, которые имеются средний уровень солнечной нагрузки. Каждый подтип меланомы характеризуется мутациями: BRAFV600E при неХПС-меланоме, и NRAS, нейрофибромин 1 (NF1), мутации KIT и BRAFnonV600E при ХПС-меланоме.
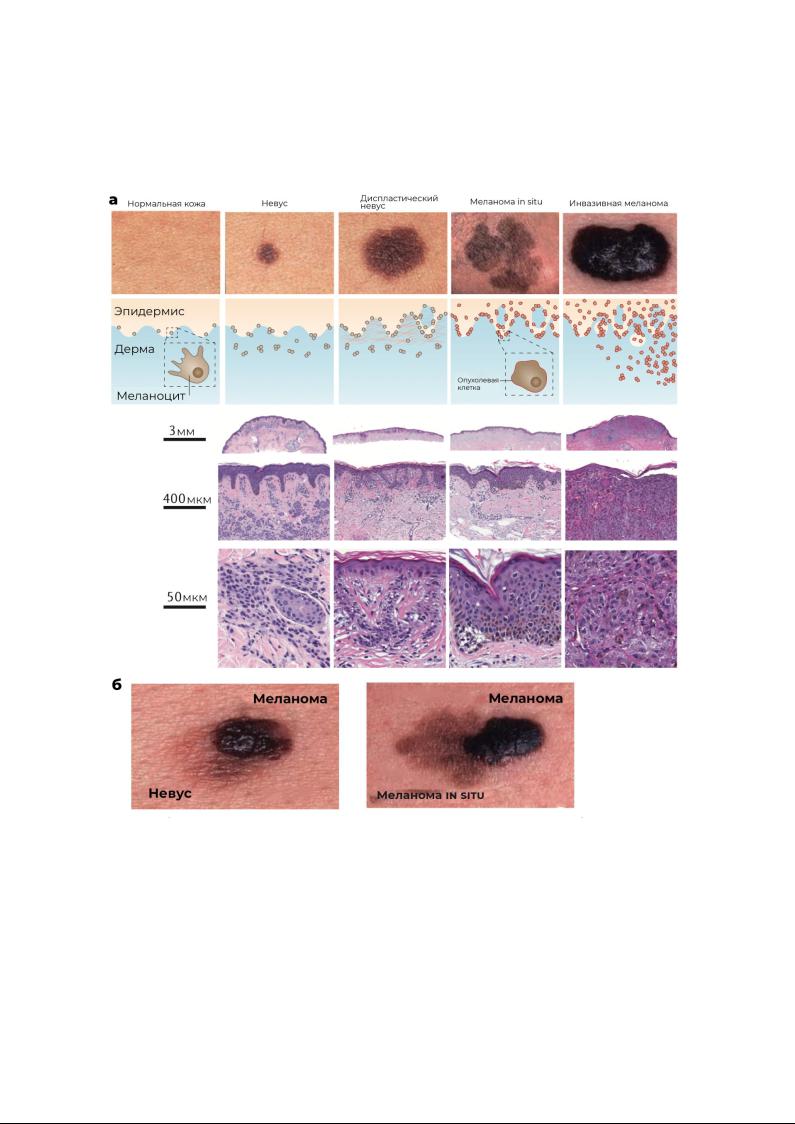
Первичные меланомы часто обнаруживают в сочетании с различными типами
поражений-предшественников, начиная от доброкачественных и диспластических
невусов и до меланомы in situ (рис. 2). Идеальные модели прогрессирования меланомы чаще всего предполагают единый путь эволюции опухоли от невуса к диспластическому невусу, а далее к меланоме in situ и к инвазивному варианту опухоли. Однако ситуация более сложная, так как существует несколько типов
Cancer Chameleon
меланом, которые могут быть связаны с различными вариантами поражений-предшественников (рис. 3).
Рисунок 2. Морфологический спектр меланоцитарных новообразований. а)
Верхний ряд: фотографии с отдельно расположенным невусом, диспластическим невусом, меланомой in situ и инвазивной меланомой. Второй ряд: схемы, иллюстрирующие особенности архитектоники каждого типа поражения, соответствующие описанию в основной части обзора. 3-5 ряд: фотографии микропрепаратов, иллюстрирующие репрезентативные морфологические особенности каждого типа поражений. б) Фотографии комбинированных новообразований. Важно отметить, что меланомы редко проходят через все морфологические стадии, что подробно описано в основном тексте.

Cancer Chameleon
Полностью сформированные меланомы несут в себе множественные патогенные мутации. Наиболее часто повторяющиеся соматические мутации в ХПС- и неХПС-меланомах влияют на гены в ключевых сигнальных путях, которые регулируют пролиферацию (BRAF, NRAS и NF1), рост и метаболизм (PTEN и KIT), клональность клеток (AT-богатый домен взаимодействия 2 (ARID2)), устойчивость к апоптозу (TP53), контроль клеточного цикла (ингибитор циклин-зависимой киназы 2A (CDKN2A), который кодирует p16INK4A и p14ARF), и способность к репликации (обратная транскриптаза теломеразы (TERT))7–10. Порядок нарушений в сигнальных путях не до конца изучен и может различаться у меланом от разных пациентов. Однако, так как в поражениях-предшественниках есть определённые патогенные мутации и они ассоциируются с конкретными типами меланомы, мы можем предположить, что существуют универсальные тенденции накопления этих мутаций (см. таблицу 1).
В этом обзоре мы обсудим наиболее распространенные типы меланомы у европеоидов, которые возникают на подвергшейся воздействию солнца коже, и предложим эволюционные модели прогрессирования опухоли на основе сопоставления генетических изменений на определенных этапах эволюции с соответствующей клинической и морфологической информацией. Таким образом, будут описаны пути прогрессирования меланомы, отражающие различные сценарии ее развития, обнаруженные у пациентов.
Меланоциты
На квадратный миллиметр эпидермиса человека приходится примерно 1500 меланоцитов, что соответствует почти 3 миллиардам меланоцитов в коже обычного человека11. Меньше всего меланоцитов расположено в базальном слое эпидермисе и делятся они нечасто - менее двух раз в год12. Их основная функция - обеспечение меланином окружающих их кератиноцитов13. Пролиферация меланоцитов и синтез пигмента стимулируются УФ-излучением, вызывающим повреждение ДНК кератиноцитов, которые секретируют α-меланоцит-стимулирующий гормон (αMSH) по p53-зависимому пути14. αMSH связывается с рецептором меланокортина 1 (MC1R), который экспрессируется на меланоцитах и индуцирует синтез меланина, который меланоциты доставляют к кератиноцитам.
Меланин представляет собой сложную макромолекулу, которая поглощает и рассеивает УФ-излучение. Эпидермальные кератиноциты используют его для защиты своего ядра от повреждений ДНК, вызванных УФ-излучением15. Таким образом, эпидермальные меланоциты являются частью системы защиты от повреждений ДНК, вызванных УФ-излучением.
Меланоциты находятся не только в эпидермисе. В коже их также можно найти в волосяных фолликулах, где они «добавляют» пигмент в стержень волоса1. Вне кожи меланоциты в значительном количестве присутствуют в увеальном тракте глаза, значительно меньше их в других тканях, таких как мозговые оболочки и аногенитальный тракт. Меланоцитарные новообразования, происходящие из этих меланоцитов, сильно отличаются по своему клиническому, гистопатологическому и генетическому составу от кожных меланом (подробный обзор см. в ссылке 2). Например, меланоциты слизистой оболочки аногенитальной области и придаточных пазух носа дают начало меланомам с низкой мутационной активностью, но с сильно

Cancer Chameleon
перестроенным геномом с многочисленными изменениями числа копий, включая множественные целенаправленные амплификации3.
Рисунок 3. Траектории прогрессирования меланомы. Взаимосвязь между клинически выраженными меланомами, их предшественниками и клетками их происхождения вытекает из морфологических, клинических и генетических исследований. Каждый выделенный пункт (тип меланомы, поражение-предшественник или меланоциты) подробно описаны в этом обзоре, где мы часто ссылаемся на этот рисунок, используя цифры-метки от 1 до 12, которые можно увидеть на иллюстрации (в круге). ХПС — хроническое повреждение солнцем (хроническая инсоляция).
Напротив, меланоциты сосудистой или радужной оболочки глаза вызывают увеальные меланомы, которые также имеют низкую мутационную активность, но характеризуются частыми активирующими мутациями в полипептиде гуанин-нуклеотид-связывающего белка α q(GNAQ) или GNA11, которые сопровождаются инактивацией мутаций гена-супрессора опухоли BRCA1-ассоциированного белка 1 (BAP1) или мутацией в субъединице 1 фактора сплайсинга 3b (SF3B1)16-18. Из этих примеров мы предполагаем, что эти новообразования возникают из клеток разного происхождения, которые различаются по молекулярным свойствам или могут иметь разное микроокружение, что меняет их функции и реакцию на внешние стимулы. Мы предполагаем, что эти отличия определяют различные соматические мутации, которые способствуют росту опухолей. Это частично подтверждается и экспериментальными данными. В модели на мышах экспрессия онкогенного варианта GNAQ209L в меланоцитах приводила к увеличению пролиферации этих клеток в увеальном тракте и мозговых оболочках, но имела противоположный эффект на эпидермальные меланоциты19.

Cancer Chameleon
Если меланоциты с разным происхождением предрасположены к определённым подтипам меланомы, возможно это играет роль и в случае меланоцитов на коже, подвергающейся хроническому солнечному воздействию. Нас поражает то, как своеобразно распределяются по возрасту новообразования с мутациями BRAFV600E (см. рисунок 1). Невусы с мутациями BRAFV600E возникают в первые десятилетия жизни20 и неХПС-меланомы, которые обычно содержат мутации BRAFV600E, показывают пик заболеваемости в возрасте 20-30 лет, постепенно снижаясь по частоте после шестидесяти лет21. Считается, что меланоциты кожи тела и верхних конечностей более восприимчивы к злокачественной трансформации после появления мутации BRAFV600E на ранних стадиях жизни, или по крайней мере, что такая восприимчивость ограничивается определённой субпопуляцией меланоцитов, такими как стволовые клетки или клетки-предшественники меланоцитов, которые не могут существовать и подвергаться мутагенезу на более поздних стадиях жизни2,22 (см. рисунок 3, шаг 1). Кроме того, связь мутагенеза с определёнными субпопуляциями меланоцитов может быть связана с детским возрастом, когда плотность меланоцитов в коже остаётся постоянной, но поверхность тела увеличивается, а значит, меланоциты в этот период активно пролиферируют. Мы думаем, что учёным очень важно продолжить исследовать то, какие уязвимости и/или предрасположенности к мутагенезу имеют меланоциты разной локализации и разных стадий развития. Это также следует учитывать при работе с первичными меланоцитами в лабораторных условиях. Например, меланоциты, полученные из неонатальной крайней плоти, который широко используется для исследований, могут не отражать биологию меланоцитов других участков кожи.
Меланоцитарный невус
Меланоцитарные невусы, называемые просто невусами — это доброкачественные образования с пролиферацией меланоцитов и низкой вероятностью прогрессирования до меланомы. Описано большое количество связей различных типов меланомы2 с разновидностями невусов, но в этом обзоре мы поговорим об обычном приобретённом невусе. У европейцев в среднем на коже имеется 25 подобных невусов, диаметр которых не менее 2 мм23,24. Обычные невусы возникают в первые два десятилетия жизни и регрессируют после 60 лет20. Хотя отдельные обычные невусы вряд ли станут причиной меланомы, но из-за их высокой распространённости они связаны со значительной частью случаев меланомы в популяции.
Ряд исследования показывает, что обычные невусы могут быть связаны с неХПС-меланомами (см. рисунок 3, шаг 2). Приблизительно 30% неХПС связаны с ранее существовавшим обычным невусом25, а некоторые исследования показывают, что до 90% меланом с поверхностным типом распространения (такая гистологическая картина характерна для неХПС-меланом) ассоциируются с невусами26. Напротив, предшествующий невус не встречается при ХПС-меланомах26,27. Эволюционная связь между обычными невусами и неХПС-меланомами проявляется и в высокой частоте мутаций BRAFV600E, обнаруживаемых в этих двух типах новообразований6,28, включая меланомы, которые специфически связаны с соседним невусным компонентом.
Морфология. Приобретённый невус может демонстрировать лентигинозный или врождённый паттерны роста. Важно отметить, что последний тип не обязательно означает, что невус присутствовал при рождении, а только показывает то, что он имеет похожую картину роста при которой меланоциты располагаются в глубоких слоях дермы, обрастая придатки кожи, например волосяные фолликулы.

Cancer Chameleon
Лентигинозный и врождённый невусы могут быть стратифицированы на пограничные, дермальные и сложные, в зависимости от того, находятся ли меланоциты в дермо-эпидермальном соединении, дерме или в обоих местах, соответственно. Мутации BRAFV600E по-видимому присутствуют в большинстве подобных невусов, независимо от их морфологический проявлений28, 30, 31. Однако важно более системно изучать генетику отдельных подтипов обычных невусов. Если генетических различий между подтипами невуса не обнаружено, то различные модели роста могут отражать различия по типу меланоцитов или различия в их источниках, например их первичное расположение в межфолликулярном эпидермисе или поверхностной части волосяных фолликулов (см. рисунок 3, шаг 1).
Формирование невусов. Хотя в предыдущих исследованиях было показано, что не все опухолевые меланоциты имеют BRAFV600E-мутацию32, недавние работы с использованием цифровой капельной ПЦР, иммуногистохимии или NGS-секвенирования указывают на то, что мутации BRAFV600E являются клональными, что согласуется с представлением об их основной роли в качестве инициирующего события30,33. Кроме того, пример эктопической экспрессии человеческого BRAFV600E в модели с рыбкой Данио-рерио, показал что это достаточно для формирования невусоподобных пролифераций34. Данные позволяют предположить, что мутации BRAFV600E достаточно для образования невусов. Наличие в экзоме и геноме патогенных мутаций, которые часто встречаются в меланомах, однако отсутствуют в невусах подтверждает эту точку зрения. Иногда даже даже одной патогенной мутации достаточно для того, чтобы инициировать формирование невуса.
Количество и размеры невуса очень сильно зависят от особенностей генотипа индивида. Это показали исследования моно- и дизиготных близнецов35, подтвердившие, что пенетрантность инициирующих мутаций, таких как мутация BRAFV600E зависят от зародышевой линии. Список локусов, важных в отношении восприимчивости к развитию невусов и меланомы получен в ходе популяционных исследований (см. ссылку 36). При этом можно выделить аллели с высокой и низкой пенетрантностью. Аллели с высокой пенетрантностью и низкой частотой выявления в популяции ассоциируются с более выраженным фенотипами, такими как более крупные невусы с заметно повышенным риском развития меланомы. Эти варианты, как правило, влияют на гены, связанные с молекулярными путями, характерными для спорадических меланом с частыми соматическими мутациями — например, в контрольной точке G1/S или теломеразе. Так как они ассоциируются с атипичными невусами, то их обзор будет в разделе, посвящённом промежуточным поражениям. Напротив, аллели с низкой пенетрантностью и высокой популяционной частотой ассоциируются с более «мягкими» фенотипами, такими как более светлый цвет кожи, сниженная способность к загару и сравнительно меньший риск меланомы. Эти аллели преимущественно связаны с генами пигментации, включая SLC45A2, тирозиназу (TYR), MC1R, OCA2 и Агути сигнальный белок (ASIP)36. Интересно, но ни один из этих вариантов не был связан у индивидов с бОльшим количеством невусов36, несмотря на то, что цвет кожи сильно ассоциируется с этим показателем37,38. Одним из факторов, частично объясняющих это несоответствие, может быть то, что носители аллели рыжих волос MC1R, как правило имеют светлый цвет лица и веснушки, но имеют меньше невусов, несмотря на повышенный риск развития меланомы на коже, подвергающейся воздействию солнца39-41.
Зародышевые отличия в генах, влияющих на цвет лица и реакцию на загар, могут по разному влиять на мутационную нагрузку клеток на поверхности кожи, что может

Cancer Chameleon
объяснить механизм с помощью которого их определённые варианты способствуют канцерогенезу. Снижение пигментации уменьшает УФ-экранирование, способствуя мутагенезу. Варианты генов, участвующих в сигнальных путях, связанных с пигментацией, могут влиять и на соотношение феомеланина и эумеланина42. Феомеланин — форма меланина с более выраженным красноватым оттенком, которая при воздействии УФ-излучения продуцирует образование реактивных форм кислорода (РОС). При недостатке чёрного эумеланина высокий уровень феомеланина может косвенно способствовать мутагенезу43-45. MC1R сигнальный путь не только индуцирует образование эумеланина, но и способствует репарации ДНК и снижению количества РОС. Поэтому при потери функции MC1R наблюдается эффект усиления количества мутаций у людей со светлой кожей и плохой способностью к загару46.
Приобретённые невусы чаще появляются на тех участках тела, которые подвергаются солнечному облучению. Использование средств защиты кожи от солнца снижает частоту невусов, уменьшая роль УФ-излучения в качестве патогенного фактора в образовании невусов47-50 (см. рисунок 4). Мутации BRAFV600E обычно возникают в результате трансверсии T → A, которая не является типичной мутацией, связанной с повреждением ДНК ввиду УФ-излучения. Однако сопутствующие мутации-пассажиры в невусах обнаруживают явные признаки вызванного УФ-излучением повреждения ДНК с преобладанием переходов C → T в дипиримидиновых сайтах, которые чувствительны к УФ-индуцированному повреждению30. Эти наблюдения предполагают, что УФ-излучение является инициирующим фактором образования невуса. На основании анатомического распределения приобретенных невусов и сигнатуры УФ-ассоциированных мутаций в большинстве их соматических мутаций, мы полагаем, что УФ-излучение также способствует формированию мутаций BRAFV600E. Прямые эффекты УФ-излучения включают образование димеров циклобутан-пиримидина [6–4] и аддуктов пиримидин-пиримидона, которые проявляются как CC → TT или (C / T) C → (C / T) T мутации51, но мутационная горячая точка BRAFV600E возникает в результате трансверсии T → A. Такие трансверсии являются побочным продуктом УФ-излучения и, таким образом, могут быть прямым, хотя и редким, последствием воздействия УФ-излучения52,53. Ошибки в работе ДНК-полимеразы также могут вносить эти мутации после воздействия УФ-излучения52,53. С другой стороны эти мутации могут быть результатом косвенного воздействия УФ-излучения, опосредованного АФК (активными формами кислорода). Хотя точный механизм еще предстоит выяснить, эпидемиологические и геномные данные свидетельствуют о том, что УФ-излучение - прямо или косвенно - способствует образованию мутаций BRAFV600E в кожных меланоцитах.
Жизнь невуса. После приобретения инициирующей мутации меланоциты претерпевают ограниченную пролиферацию с образованием невуса перед переходом в состояние, которое было описано как «подобное старению»54. Клеточное старение — неотъемлемая часть жизни клеток, приводящее к необратимой остановке клеточного цикла55,56. Однако в некоторых исследованиях как минимум несколько меланоцитов внутри невуса сохраняли способность к пролиферации, тем самым говоря о том, что старение не всегда строго предопределено. Так, часть клеток из культур эксплантатов невусов может пролиферировать в течение короткого периода времени57,58. Также клетки невуса имеют маркеры пролиферации59–61 и иногда среди них наблюдаются митозы62–64. Клетки невуса способны пролиферировать в ответ на определенные раздражители, включая УФ-излучение65,66, неполное удаление невуса67, беременность68 и иммуносупрессию69. Дермоскопический мониторинг невусов с течением времени также показывает, что невусы морфологически изменяются, а не полностью

Cancer Chameleon
стабильны70. Наконец, филогенетические данные исследований секвенирования показывают, что некоторые невусы эволюционируют в виде нескольких волн расширения, указывая на динамические изменения в меланоцитах, которые формируют невусы30.
В клинической практике большинство невусов не меняют размер в течение многих лет. Мы предполагаем, что низкие уровни пролиферации, которые наблюдаются в некоторых невусах, уравновешиваются дополнительными факторами, которые могут зависеть и не зависеть от самих клеток. Было показано, что апоптоз связанный с онкогенным стрессом происходит в меланоцитарных невусах71, что, возможно уравновешивает низкие уровни пролиферации. Кроме этого существуют доказательства того, что иммунная система является этим дополнительным фактором.. Определенные типы невусов характеризуются наличием хронического лимфоцитарного инфильтрата и фиброзных изменений, отражающих хроническое воспаление. Это может быть связано с тем, что клетки невуса несут в себе онкогенные мутации, которые, как известно, вызывают иммуностимулирующие сигналы и сигналы «фагоцитируй меня»72, которые привлекают иммунные клетки для их устранения73. Существует предположение, что помимо этих сигналов лимфоциты могут быть привлечены к частично трансформированным меланоцитам в невусах в ответ на образование неоэпитопов в результате их соматических мутаций. Также, связав иммунную систему с регулированием размера и количества невусов можно сказать о существовании варианта зародышевой линии с различиями в уровне фактора регуляции интерферона 4 (IRF4), который связан с увеличением количества невусов36,74. IRF4 высоко экспрессируется в невусах и регулирует воспаление, хотя взаимосвязь морфологии невусов от IRF4 плохо изучена. Кроме того, существует явление, известное как высыпание невусов, при котором многочисленные невусы внезапно увеличиваются в размерах или появляются de novo, и это часто происходит у пациентов, у которых ослаблен иммунитет в результате болезни или терапии75. Эти эруптивные невусы возникают на участках кожи, которые ранее подвергались воздействию солнца, и несут онкогенные изменения, подобные таковым при обычных невусах, указывая на то, что иммуносупрессия позволяет ранее существовавшим меланоцитам увеличиваться в количестве76. Наконец, обычные невусы имеют тенденцию к инволюции, а затем исчезают в возрасте 50 лет77, что, возможно, указывает на то, что баланс между медленной пролиферацией и истощением свидетельствует в пользу истощения клеток невуса.
Таблица 1 | Общие мутации и их роль в прогрессировании меланомы
Сигнальн |
Ген |
Мутация |
Подтип* |
Фаза |
Роль |
ый путь |
|
|
|
развития** |
|
|
|
|
|
|
|
MAPK |
BRAF |
V600E |
неХПС |
Невус |
Инициация |
|
|
|
|
|
|
|
BRAF |
V600K, K601E и G469A, и |
ХПС |
Промежуточная |
Инициация |
|
|
другие кластерные неV600E |
|
и MIS |
|
|
|
альтерации |
|
|
|
|
|
|
|
|
|
|
NRAS |
Q61R и Q61K и другие |
ХПС |
MIS |
Инициация |
|
|
альтерации, влияющие на |
|
|
|
|
|
кодон 61 или 12 |
|
|
|
|
|
|
|
|
|
|
NF1 |
Мутации на протяжении |
ХПС |
Промежуточная |
Инициация |
|
|
|
|
|
|

Cancer Chameleon
|
|
всего гена и делеции |
|
и MIS |
|
|
|
|
|
|
|
Теломераз |
TERT |
Мутации промотора, |
ХПС и |
Инвазивная |
Прогрессия |
а |
|
влияющие на hg19 с |
неХПС |
меланома |
|
|
|
координатами 1,295,228 или |
|
|
|
|
|
1,295,250 и близкие к этому |
|
|
|
|
|
мутации |
|
|
|
|
|
|
|
|
|
RB |
CDKN2A |
Делеции и мутации во всей |
ХПС и |
Инвазивная |
Прогрессия |
|
|
кодирующей области |
неХПС |
меланома |
|
|
|
|
|
|
|
Ремоделир |
ARID1A, |
Мутации, затрагивающие |
ХПС и |
Инвазивная |
Прогрессия |
ование |
ARID1B |
весь белок |
неХПС |
меланома |
|
хроматина |
и/или |
|
|
|
|
|
ARID2 |
|
|
|
|
|
|
|
|
|
|
PI3K |
PTEN |
Мутации, затрагивающие |
неХПС |
Толстая |
Продвинутая |
|
|
весь белок |
|
инвазиваная |
прогрессия |
|
|
|
|
меланома |
|
|
|
|
|
|
|
p53 |
TP53 |
Мутации, затрагивающие |
ХПС |
Толстая |
Продвинутая |
|
|
весь белок |
|
инвазиваная |
прогрессия |
|
|
|
|
меланома |
|
|
|
|
|
|
|
ARID, AT-насыщенный домен взаимодействия; CDKN2A, ингибитор циклин-зависимой киназы 2A; ХПС, хронически поврежденный солнцем; MIS, меланома in situ; NF1, нейрофибромин 1; TERT, обратная транскриптаза теломеразы. * Подтип относится к подтипу(-ам) меланомы, преимущественно связанному с мутацией. ** Фаза прогрессирования, относится к самой ранней фазе прогрессирования, на которой обычно возникает мутация.
Промежуточное новообразование, или диспластический невус
Существуют давние споры по поводу существования меланоцитарных новообразований со злокачественным потенциалом и неясным клиническим потенциалом, которые являются переходной стадией между обычным невусом и сформированной меланомой. Это серая зона в наших знания о новообразованиях включает в себя поражения с перекрывающимися доброкачественными и злокачественными морфологическими признаками (рис. 3, шаги 6 и 12), которые не позволяют патологам поставить однозначный диагноз и часто приводят к значительным расхождениям в диагнозе у разных специалистов. Также они включают в себя спорную категорию поражений, известную как диспластические невусы78,79, которые мы подробно обсудим.
