
2 курс / Гистология / Мышечная ткань ВолГМУ
.pdf
Z |
Вытянутая |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
ZZ lineлиния |
|
|
|
Вытянутая мышца |
|
|
|
|||||||||
|
Z line |
|
|
|
|
|
|
|
|
|
||||||||
лин. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Саркомер |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
Sarcomere |
|
|
|
|
|
|
|
СаркомерSarcomere |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
мышца |
|||||
|
|
|
Расслабленная мышца |
|||||||||||||||
|
|
|
|
|
|
|||||||||||||
|
|
|
|
Расслабленная |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Sarcomere |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
Sarcomere |
|
|
|
|
|||
|
|
|
Саркомер |
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Саркомер |
|
|
|
||
|
Cокращенная мышца |
|
|
|
|
|
|
|
||||||||||
|
|
|
Contracted Muscle |
|
|
|
|
|||||||||||
|
|
|
Contracted Muscle |
|
|
|
|
|
|
|
Сокращенная мышца |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
СаркомерSarcomere |
|
|
||
|
|
|
Саркомер |
|
|
|
|
|
|
|||||||||
|
|
|
Sarcomere |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Толстые (миозиновые) и тонкие (актиновые) нити лежат симметрично параллельно продольной оси миофибриллы. Толстые нити имеют 15 нм в диаметре и 1.5 мкм в длину. Они заполняют А- диск, занимающий центральную часть саркомера. Тонкие актиновые нити имеют 7 им в диаметре и 1 мкм в длину. Они идут параллельно толстым нитям и одним концом вплетаются в Z-линию. А-диск
делится М-линией пополам. М –линия – это место латеральных
21
соединений соседних толстых миозиновых нитей.
|
|
|
|
|
|
УЛЬТРАСТРУКТУРА САРКОМЕРА |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Во время мышеч- |
||||
|
|
|
|
|
|
|
|
ного |
сокращения |
|||
|
|
|
|
|
|
|
A диск |
|
миофиламенты |
|||
|
|
|
|
|
|
|
|
|
|
|
|
сарко- |
|
|
|
|
|
|
|
|
каждого |
|
|||
|
|
|
|
|
|
|
|
мера |
|
скользят |
||
|
|
|
|
|
|
|
I диск |
между |
|
друг |
||
|
|
|
|
|
|
|
другом |
и |
тянут |
|||
|
|
|
|
|
|
|
|
соседние |
|
Z- |
||
|
|
|
|
|
|
|
M линия |
полоски |
|
|
||
|
|
H диск |
|
|
навстречу |
друг |
||||||
|
|
|
||||||||||
|
|
|
|
|
|
|
|
другу, сближая их. |
||||
|
|
|
|
|
|
|
|
Во |
время |
этого |
||
актиновые |
|
|
|
|
||||||||
|
|
|
Z линия |
сближения |
|
|||||||
филаменты |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
ширина |
А-диска |
|||
|
|
|
|
|
|
|
|
|||||
миозиновые |
|
|
|
|||||||||
|
|
|
остается |
|
|
|||||||
филаменты |
|
|
|
неизменной, а I- |
||||||||
|
|
|
|
|
|
|
|
диск |
постепенно |
|||
|
миофиб- |
|
|
|
|
сужается |
|
и |
||||
|
риллы |
|
|
|
|
исчезает. Исчезает22 |
||||||
|
|
|
|
|
|
|
|
и H-полоска. |
|
|||
11

МОЛЕКУЛЯРНАЯ БИОЛОГИЯ АКТИНОВОГО МИКРОФИЛАМЕНТА
составные части тонких филаментов
|
|
|
|
|
|
|
актиновые мономеры |
|
|
|
|
|
|
|
|
|||
|
|
тропомиозин |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
T |
|
|
|
тропонин |
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
перекручиваю- |
|
|
|
|
|
|
|
||
|
тонкий |
|
миозин-связывающая |
|
|
|
|
|
|
|
|
|||||||
|
|
|
субчастицы тропонина |
|||||||||||||||
|
филамент |
часть филамента |
|
щаяся часть |
||||||||||||||
|
|
филамента |
|
Tn I |
|
|
|
|||||||||||
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Tn |
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Tn T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Тонкие филаменты состоят из 2-х цепочек F-актиновых филаментов, переплетенных между собой, и соединенных с тропомиозином и тропонином. Главный компонент каждого филамента – F актин, полимер, состоящий из G-актиновых мономеров. Сферические актиновые молекулы (G-актин) поляризованы и полимеризованы в одном направлении с образованием F–актиновых нитей. Пространственная организация филамента определяется 3-мя белками: актином23 ,
тропомиозином и тропонином.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
мышца |
|
|
|
|
|
|
|
||||
|
|
|
мышечный пучок |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
Мышечный |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
Muscle fasciculus |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
пучок |
|
|
|
|
|
|
|
|
|
|
|
Мышечное волокно |
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||
|
|
|
|
|
H полоска |
|
Z линияA |
диск I диск |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ГИСТОФИЗИОЛОГИЯ |
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
СКЕЛЕТНОЙ МЫШЦЫ |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Z саркомер |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
M линия |
миофибрилла |
|
|
||||||||||||||||||||||||||||||||||||||
|
|
G актиновые молекулы |
|
|||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
миофиламенты |
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
I |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
диск |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
F актиновый филамент |
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
Z- |
Z |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
линияline |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Миозиновый филамент |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Миозиновые |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
легкие цепочки |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Миозиновые |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
тяжелые цепочки |
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
12
ГИСТОФИЗИОЛОГИЯ СКЕЛЕТНОЙ МЫШЦЫ
В тонком филаменте 2 F-актиновые нити G- актиновых мономеров переплетаются друг с другом, образуя двойную нить. Каждый G – актиновый мономер содержит участок связывания миозина.
25
ГИСТОФИЗИОЛОГИЯ СКЕЛЕТНОЙ МЫШЦЫ
В тонком филаменте 2 нити G-актиновых мономеров ( F-актин) переплетаются друг с другом, образуя двойную нить. Каждый G-актиновый мономер содержит участок связывания миозина.
G актиновые молекулы
H
МИОФИЛАМЕНТЫ
F – АКТИНОВЫЙФИЛАМЕНТ
Z Z
МИОЗИНОВЫЙ ФИЛАМЕНТ
ЛЕГКАЯ
МИОЗИНОВАЯ
ЦЕПОЧКА
ТЯЖЕЛАЯ
МИОЗИНОВАЯ
ЦЕПОЧКА
13

|
компоненты тонких филаментов |
|
|
|
|
|
|
|
|
|
|
|
МОЛЕКУЛЯРНАЯ |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
БИОЛОГИЯ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
АКТИНОВОГО |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ФИЛАМЕНТА |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Тропомиозин – |
||||
|
|
|
|
|
|
|
актиновые мономеры |
|
|
|
|
|
|||||||||
|
|
тропомиозин |
|
|
|
|
|
|
|
||||||||||||
|
|
|
тропонин |
|
|
|
|
|
|
|
|
|
|
длинная моле- |
|||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
кула (около 40 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
нм |
длиной), |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
содержит |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
полипептид- |
||
|
|
|
|
миозин-связыва- |
|
|
|
|
тропонин |
ные |
цепи. |
Эти |
|||||||||
|
тонкий |
|
|
|
|
||||||||||||||||
|
|
|
TnI |
|
|
||||||||||||||||
|
филамент |
|
ющая часть |
|
|
|
|
|
TnC |
|
молекулы |
свя- |
|||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
TnT |
|
|
зываются меж- |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ду собой голо- |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
вой к хвосту. |
||
Образованные филаменты наматываются на актиновые филаменты по краю желобка, находящегося между скрученными актиновыми нитями. Тропонин – это комплекс, состоящий из 3-х субъединиц: ТnТ, который крепко прикрепляется к тропомиозину, ТnС, который связывает ионы кальция и ТnI, который ингибирует взаимодействия актина и миозина, механически предотвращая их связывание. В тонких филаментах каждая молекула
27
тропомиозина покрывает 7 G-актиновых молекул и соединяется с одним тропониновым комплексом на своей поверхности.
КОНТРОЛИРОВАНИЕ МЫШЕЧНОГО СОКРАЩЕНИЯ
Тропониновый комплекс
Тонкий
филамент
Актиновый филамент тропомиозин
Тропомиозин – длинная белковая молекула, которая расположена вокруг актинового филамента, стабилизируя и делая его жестким. Комплекс тропонина, который регулирует связь актина с миозином, прикрепляется к тропомиозину и состоит из 3 полипептидовтропонин Т, I, С.
28
14

ГИСТОФИЗИОЛОГИЯ СКЕЛЕТНОЙ МЫШЦЫ
|
|
|
|
|
|
|
|
Толстые |
филаменты |
в |
||
саркомер |
|
|
|
|
||||||||
|
|
|
|
|
|
основном |
состоят |
из |
||||
|
|
|
|
A диск |
|
|
миозина. |
|
|
|
||
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
H диск |
|
|
Актиновый филамент, |
так |
||||
Z диск |
|
|||||||||||
|
|
|
|
|
||||||||
|
|
|
M диск |
|
|
небулин титин |
же |
как |
и |
миозиновый |
||
|
|
|||||||||||
|
|
|
|
|
|
|
|
филамент, полярен. Два |
||||
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
миозиновых |
филамента |
|||
|
|
|
|
|
|
|
|
прикрепляются |
|
|||
|
|
|
|
|
|
|
|
хвостовыми концами так, |
||||
|
|
|
|
|
|
|
|
что |
их |
головные концы |
||
|
|
|
|
|
|
|
|
располагаются |
в |
|||
|
|
|
|
|
|
|
|
противоположных |
|
|||
|
|
|
|
|
|
|
|
направлениях |
(по |
|||
|
|
|
|
|
|
|
|
сторонам от М – линии). |
||||
|
|
|
|
|
|
|
|
Различные молекулярные |
||||
|
|
|
|
|
|
|
|
типы (изоформы) миозина |
||||
|
|
|
|
|
|
|
|
присутствуют |
в |
|||
|
|
|
|
|
|
|
|
различных типах волокон |
||||
|
|
|
|
|
|
|
|
скелетной мышцы. |
|
|||
|
|
|
|
|
|
|
|
|
|
|
29 |
|
|
|
|
|
Миозиновая |
||
МОЛЕКУЛА МИОЗИНА |
||||||
|
головка |
|||||
|
|
|
|
|||
|
|
|
|
|
||
|
|
|
|
Миозиновая |
|
|
|
|
|
|
легкая |
|
|
|
|
|
|
цепочка |
|
|
|
Сборка в толстые |
|
|
|
|
|
|
|
|
Миозиновая |
|
||
|
филаменты |
|
|
|
||
|
|
|
головка |
|
||
|
|
|
|
|
|
|
МОЛЕКУЛА
МИОЗИНА
Каждая молекула миозина состоит из 2-х тяжелых цепей по форме напоминающих головастиков, хвосты которых скручиваются друг с другом, а к головкам прикреплены 4 мелких легких цепи.
30
15

Молекула миозина |
|
Головкамиозина |
Легкие цепи миозина
Сборка в толстые
филаменты Головкамиозина
м
Завернутые в спираль, палочковидные хвостовые части многих миозиновых молекул объединяются и укладываются вместе в определенной последовательности, образуя филамент, в то время как головная часть выдается вперед. Толстые филаменты состоят из миозиновых молекул, выстроенных в линию «конец в конец». Каждый толстый филамент состоит из
31
200 – 300 миозиновых молекул.
ТЯЖЕЛЫЕ ЦЕПИМОГУТ РАЗДЕЛЯТЬСЯ ТРИПСИНОМ НА:
1.Легкиймеромиозин, хвостовой конец которого состоит в основном из 2-х полипептидных (палочковидных) цепей, завернутых вокруг друг друга.
2.Тяжелый меромиозин, две двойные головки в сопровождении с короткими проксимальными частями двух полипептидных цепей,
скрученных вокруг друг друга. Тяжелый меромиозин состоит из S1 и S2 сегментов. S1 связывается с АТФ и образует поперечный мостик между толстым и тонким филаментами. Легкие светлые цепи (не путать с легким меромиозином) бывают двух типов и каждый из них соединяется с
субфрагменгтом S1 миозиновой молекулы. Поэтому на каждую тяжелую цепь есть 2 легких цепи. Каждая молекула миозина состоит из 2 тяжелых цепей и 4 легких.
Легкая цепочка
|
|
|
|
|
|
|
|
МИОЗИНОВАЯ |
S1 |
|
|
S2 |
|
|
Легкий меро- |
молекула |
|
|
Тяжелый |
|
|
|
миозин |
|
||
|
|
|
||||||
|
меромиозин |
|
|
|
|
|||
32
16

Молекула миозина |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
миозин |
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
Каждая |
|
молекула |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
Поперечный |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
Связывающая часть |
|||||||||||||||||||||
миозина имеет 2 гибких |
|
|
мостик |
|
|
|
|
|
|
|
|
для |
миозина |
|
||||||||||||||||||
области: 1-я на границе |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
тропонин |
|
||||||||||
|
тропомиозин |
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
тяжелого меромиозина с |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
I |
|
|
|
|
|
C |
|
|
|
|
||||||
легким |
меромиозином, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
что позволяет |
каждой |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
молекуле |
|
миозина |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
актин |
|
|
|
|
|
|||||||||||||||||||
связываться |
с тонкими |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
филаментами, 2-я на |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
стыке |
S1 |
|
и |
S2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
субфрагментов, |
|
что |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
ADФ +Ф |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
позволяет тянуть тонкий |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ca |
||||||||||||||
филамент |
к |
центру |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
саркомера. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ca |
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
ATФ |
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ca |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
I |
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
C |
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ca |
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Мышечное |
|
сокращение |
|
|
|
|
|
|
|
|
|
|
|
|
миозин |
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
инициируется связыванием Са 2+ |
Поперечный |
|
|
Связывающая часть |
||||||||||||||||||||||||
с ТnC-фрагментом молекулы |
мостик |
|
|
для миозина |
||||||||||||||||||||||||
тропонина, что приводит к |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
тропонин |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
тропомиозин |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
обнажению участок |
связывания |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
миозина на молекуле актина. |
|
|
|
|
|
|
|
|
|
|
|
|
I |
|
|
C |
|
|
|
|
||||||||
Следующим |
шагом |
будет |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|||||||
связывание головки |
миозина с |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
актином, |
что |
сопровождается |
|
|
|
актин |
|
|
|
|
|
|
|
|
|
|
||||||||||||
распадом молекулы АТФ до АДФ, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
в |
результате |
|
чего |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
высвобождается |
|
|
энергия, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
обеспечивающая |
движение |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
головки миозина.. Этот процесс, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
ADФ+Ф |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ca 2+ |
|
|
|||||||||
повторяющийся |
много |
раз |
во |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
время |
одного |
сокращения, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
Ca 2+ |
|
|
|
|
|
|
|
|
|
|
|||||||||
приводит |
|
к |
полному |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
ATФ |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
перекрыванию |
актиновых |
и |
|
|
|
|
|
|
|
Ca 2+ |
|
|
|
|||||||||||||||
|
|
|
|
|
|
I |
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
миозиновых филаментов |
и, |
как |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
следствие, |
|
укорочению |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
T |
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
||||||||||
мышечного волокна. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
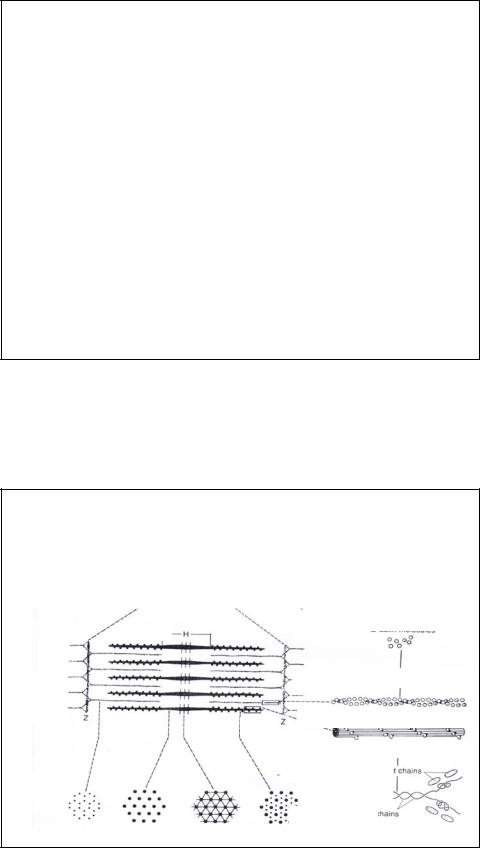
МЫШЕЧНОЕ СОКРАЩЕНИЕ
17
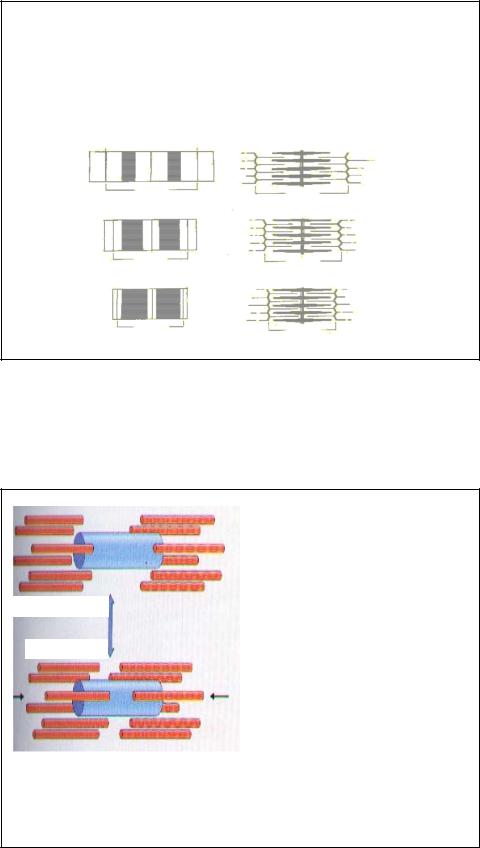
Во время сокращения не происходит укорочения отдельно тонких или толстых филаментов, а вместо этого тонкие филаменты скользят относительно толстых (теория скользящих нитей Хаксли), что приводит к сближению двух соседних Z-линий.
Таким образом, когда происходит сокращение, то движение тонких филаментов в направлении центра саркомера вызывает еще большее перекрывание между собой толстых и тонких филаментов, что приводит к заметному уменьшению ширины I- дисков и H-полосок.
Растянутая мышца |
|
|
|
Растянутая мышца |
|
||
Z линия |
Z линия |
|
|
САРКОМЕР |
САРКОМЕР |
||
Расслабленная мышца |
Расслабленная мышца |
||
МЫШЕЧНОЕ |
|
|
|
СОКРАЩЕНИЕ САРКОМЕР |
САРКОМЕР |
||
Cокращенная мышца |
Cокращенная мышца |
||
САРКОМЕР |
|
САРКОМЕР |
|
35
расслабление
сокращение
МЫШЕЧНОЕ
СОКРАЩЕНИЕ
Во время мышечного сокращения тонкие филаменты миофибрилл скользят относительно
толстых филаментов. При расслаблении мышцы
36
идет скольжение в противоположном направлении.
18

|
a |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ИСПОЛЬ- |
|
|
|
|
|
|
|
|
|
|
|
|
b |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ЗОВАНИЕ |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
АТФ ПРИ |
|
|
|
|
|
|
|
|
|
|
|
|
Миозиновая |
|
|
|
|||
Актиновый |
|
|
|
|
|
|
|
|
|
|
ADФ |
|||||||
|
|
|
ATФ |
|
|
|
|
СВЯЗЫВА |
||||||||||
|
h |
|
||||||||||||||||
филамент |
|
|
|
|
|
|
|
|
головка |
|
|
Ф |
НИИ |
|||||
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
МИОЗИНА |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ATФ |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
С |
|||||
|
|
|
|
ADФ |
|
|
|
|
|
|
|
|
|
АКТИНОМ |
||||
|
d |
|
|
c |
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
ADФ |
|
|
|
|
|
|
ADФ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ф |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Молекула миозина использует энергию АТФ для движения вдоль актинового филамента:
А) АТФ, связанная с миозином, гидролизуется с образованием АДФ и фосфата.
В) Это вызывает рыхлое связывание миозина с актином.
С) Фосфат высвобождается и миозин плотно связывается с актином.
Д) Это приводит к заворачиванию молекулы миозина, вызывая движение молекулы миозина по отношению к актиновому филаменту. АДФ высвобождается, новый АТФ связывается, а миозин возвращается в исходное несвязанное положение. Цикл повторяется и головка миозина37
«блуждает» вдоль актинового филамента.
Сокращение существенно укорачивает длину мышечного волокна по сравнению с состоянием в покое, и это укорочение представляет собой сумму укорочений, которые имеют место в каждом саркомере данного мышечного волокна. В соответствии с законом «все или ничего» в результате стимуляции каждое отдельное мышечное волокно либо сокращается полностью, либо вообще не сокращается.
Следующая последовательность событий ведет к сокращению скелетной мышцы:
1.Импульс, генерируемый вдоль сарколеммы, передается во внутреннюю часть волокна по Т-трубочкам, откуда он передается терминальным цистернам саркоплазматического ретикулума.
2.Ионы Ca++ покидают терминальные цистерны по кальций-
высвобождающим вольтаж-регулируемым ионным каналам, после чего кальций выходит в цитозоль и связывается с TnC-субъединицей тропонина, изменяя ее конфигурацию.
3.Конформационные изменения в тропонине изменяют положение
положение тропомиозина – последний ложится глубже в бороздку, образованную двумя F-актиновыми нитями, обнажая активнный участок на молекуле актина (участок, связывающий миозин).
4.ATФ, присутствующий в S1-субфрагменте молекулы миозина, гидролизуется, но и АДФ, и фосфат остаются соединенными с S1субфрагментом, и этот комплекс связывается с активным участком
актиновой молекулы.
38
19

5.Неорганический фосфат высвобождается, что приводит не только к возрастанию силы связи между актином и миозином, но и к конформационным изменениям субфрагментов S1.
6.АДФ также высвобождается, и тонкие филаменты тянутся к центру саркомера.
7.Новая молекула АТФ привязывается к S1-субфрагменту, что ведет к высвобождению связи между актином и миозином.
Описанное прикрепление и высвобождение повторяется многократно, пока сократительный цикл полностью не завершится. Каждый цикл требует превращения химической энергии в механическую энергию движения.
39
Сила мышечного сокращения передается экстрацеллюлярному матриксу через группу связывающих белков.
Цитоскелет каждого мышечного волокна связан с наружной пластинкой рядом связующих белков.
Актиновые филаменты внутри клетки связаны с белком дистрофином. Дистрофин связан с комплексом из нескольких гликопротеинов, которые соединяют его с поверхностью клетки. На наружной поверхности мышечной клетки гликопротеиновый комплекс связывается с мерозином, который является компонентом ламинина базальной пластинки. Так силы, генерируемые внутри мышечного волокна, передаются в экстрацеллюлярный матрикс наружной пластинки.
При наличии генетического дефекта, который связан с отсутствием того или иного связующего белка, мышечное волокно может разрываться при сокращении и у пациента развивается одна из многочисленных форм миодистрофий.
Все больше накапливается данных о том, что разные
формы мышечной дистрофии связаны со структурными
40
белками мышечных волокон, например дистрофия Дюшена.
20
