
6 курс / Гастроэнтерология / Клинические_перспективы_гастроэнтерологии,_гепатологии_2004_№03
.pdf
Научно практический журнал для клиницистов
№ 3, 2004
:
#.$. %
:
&.&. '
:
(. . ) ( ), -.%. ) , (.#. / , $.-. -, (.4. -, 5.#. 5 , (.#. , (. . $, (.(. "
:
6 7 ! ! ,
«% «5-# »
:
«% «5-# »
: 10 000 7 .
:
1 2 !
:
' ; «'-2004», I:
41727 – ;
41728 – !
82127 – «& . > »«6 » 1- 2004 .
> 5 64 ,
? ! 30.06.2000 .
('% № 77-3872)
:
125284, 5 , / 74 E-mail: rm-vesti@mtu-net.ru
F % 7 - http://www.m-vesti.ru
'
!
© «/7 , », 2004
Российская гастроэнтерологическая ассоциация Российское общество по изучению печени
Содержание
Редакционная
. . . . . . . .2
Никитин И.Г. |
|
: |
|
. . . . . . . . . . . . . . . . . |
10 |
Богомолов П.О., Шульпекова Ю.О.
:
. . . . . . . . . . . . . .20
Буторова Л.И.
! :
! . . . . . . . . . . . . . . . . . . . . . .28
" ! . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .33

Р е д а к ц и о н н а я
Клинические перспективы гастроэнтерологии, гепатологии ■ 3, 2004
Р е д а к ц и о н н а я
УДК 612.33.017.1
О роли антимикробных пептидов в механизмах врожденного иммунитета кишечника человека
На слизистую оболочку кишечника воздействуют разнообразные факторы, в числе которых рН, температура, осмолярность и продукты бактериальной жизнедеятельности, ко торые могут индуцировать местные и системные воспалительные реакции. Целость слизис той оболочки обеспечивается системой защиты, состоящей из конституциональных и приоб ретенных механизмов. К ним относятся барьерная функция, секреция в просвет кишечника некоторых факторов (муцина и антибактериальных веществ), иммунная система кишечника, а также способность слизистой оболочки к реконструкции при ее повреждении. Гомеостаз и сохранность слизистой оболочки желудочно кишечного тракта зависят от баланса между защитными возможностями и агрессивными факторами.
В то время как барьерная функция до недавнего времени считалась главным средст вом защиты слизистой оболочки от находящихся в просвете кишечника бактерий, то после недавних открытий в эпителии кишечника Toll подобных рецепторов (Toll like receptors) и ан тимикробных пептидов концепция защиты кишечника изменилась в сторону более активных механизмов, которые и будут предметом обсуждения в настоящем сообщении.
Ключевые слова: антимикробные пептиды, иммунитет, кишечник.
|
|
Введение |
|
|
бокаловидными |
клетками муцин, |
постоянно живущими видами и |
|||
|
|
|
|
|
|
|||||
|
|
|
|
|
|
оксид азота, лактоферрин, лизо |
разнообразными патогенами. |
|||
|
|
Единственный слой эпители |
цим, секретируемая фосфолипаза |
Известно, что контакт с пато |
||||||
альных клеток, выстилающий пище |
А2 и антимикробные пептиды – био |
генными бактериями активирует |
||||||||
варительный тракт человека, «обо |
химический барьер, контролирую |
адаптивную иммунную систему пу |
||||||||
рудован» определенными механиз |
щий микробную колонизацию |
и |
тем экспрессии провоспалитель |
|||||||
мами, |
позволяющими |
активно |
предупреждающий трансэпители |
ных генов и секреции цитокинов и |
||||||
абсорбировать питательные веще |
альную локализацию. |
|
хемокинов. Совместно эти меха |
|||||||
ства и активно защищать внутрен |
В просвете кишечника присут |
низмы расцениваются как «врож |
||||||||
нюю среду хозяина от содержимо |
ствуют более 500 разнообразных |
денная кишечная защита». |
||||||||
го просвета кишечника. Эта барь |
видов микробов. Они составляют |
Характеристика иммунологиче |
||||||||
ерная функция осуществляется фи |
нормальное |
микробиологическое |
ских свойств кишечного эпителия |
|||||||
зическими компонентами, такими, |
окружение, благотворно воздейст |
длительное время ограничивалась |
||||||||
как |
непроницаемые соединения |
вующее на питание и здоровье хо |
описанием сигналов, реализуемых |
|||||||
клеточных мембран, перистальти |
зяина. Однако |
эти «симбионты» |
из субэпителиального содержимо |
|||||||
ка и секреция пищеварительных и |
нуждаются |
в |
поддержании |
их |
го и последующим привлечением |
|||||
панкреатобилиарных соков, желч |
нормального окружения, в частно |
иммунокомпетентных клеток, то |
||||||||
ные кислоты, а также благодаря |
сти, патогенные |
микроорганизмы |
есть активацией адаптивной им |
|||||||
действию разнообразных факто |
должны быть элиминированы из ор |
мунной системы, гуморальной и |
||||||||
ров, |
имеющих конституциональ |
ганизма для стабилизации гомео |
цитотоксической реакциями В и |
|||||||
ную |
и |
приобретенную |
природу |
стаза указанной экосистемы. Эта |
Т лимфоцитов на специфический |
|||||
(табл. 1). |
|
|
важнейшая задача требует фор |
антиген. |
||||||
К |
ним относятся выделяемые |
мирования дискриминации между |
Выявленные недавно Toll по |
|||||||
2

|
Клинические перспективы гастроэнтерологии, гепатологии ■ 3, 2004 |
|||||
добные рецепторы (ТПР) и группа |
|
|
|
|
||
Таблица 1. Защитные механизмы желудочно кишечного тракта: |
||||||
антимикробных пептидов свиде |
гастроинтестинальный барьер |
|||||
тельствуют, однако, что и сам по се |
|
|
|
|
|
|
Кислота в желудочном соке |
|
|
|
|
||
бе кишечный эпителий играет важ |
Перистальтика |
|
|
|
|
|
ную активную роль в механизмах |
Слизь |
|
|
|
|
|
врожденного иммунитета. Узнава |
Лактоферрин |
|
|
|
|
|
ние патогена осуществляется с по |
Лизоцим |
|
|
|
|
|
мощью рецепторов, распознающих |
Дефенсины |
|
|
|
|
|
образы, – РРО (pattern recognition |
Желчные кислоты |
|
|
|
|
|
Секрет поджелудочной железы |
|
|
|
|||
receptors – PRRs), которые активиру |
|
|
|
|||
Антитела (IgA) |
|
|
|
|
||
ются сохраняемыми патогенассоци |
|
|
|
|
||
Сброс эпителиальных клеток |
|
|
|
|||
ированными молекулярными обра |
|
|
|
|||
Ассоциированная с кишечником лимфоидная ткань |
||||||
зами – ПАМО (pathogen associated |
||||||
Стойкая колонизация физиологической микрофлоры кишечника |
||||||
molecular patterns – PAMPs). Эти |
||||||
|
|
|
|
|
||
молекулярные модели совместно |
|
|
|
|
|
|
используются большой группой ми |
лот, которые быстро абсорбиру |
|
|
|
||
кроорганизмов. |
ются эпителием. |
|
|
|
|
|
У млекопитающих такая функ |
Короткоцепочечные |
желчные |
|
|
|
|
ция, как РРО и специфичность в от |
кислоты имеют большое значение |
|
|
|
||
ношении сохраняемых веществ, |
для эпителиального роста и целос |
|
1 |
|
||
имеющих уникальное значение для |
ти кишечника. Наибольшее коли |
|
|
|
||
метаболизма микробов, позволяет |
чество энергии для своей жизни |
|
|
|
||
ТПР выявлять инфекции и индуци |
эпителиальные колонии получают |
|
2 |
|
||
|
|
|
|
|
||
ровать воспалительную и антими |
за счет продуктов ферментативной |
|
|
|
||
кробную иммунные реакции. |
деятельности бактерий. Значение |
|
|
|
||
РРО присутствуют и в апикаль |
подобных трофических факторов |
|
|
|
||
ном, и в базолатеральном полюсах |
показано на больных, находящихся |
|
|
|
||
эпителиальных клеток кишечника. |
на парентеральном питании. |
|
3 |
|
||
Они интернализуются, рециркули |
Бактерии, освобожденные бла |
|
|
|||
|
|
|
||||
руют и подвергается трансцитозу |
годаря парентеральному питанию |
|
|
|
||
из краевых участков в базолате |
от необходимости снабжения энер |
|
4 |
|
||
ральный. В настоящее время изуча |
гией, не способны продуцировать |
|
|
|
||
ется функциональное значение это |
достаточное количество |
коротко |
|
|
|
|
го перемещения. Однако, как ока |
цепочечных жирных кислот для рос |
|
5 |
|
||
|
|
|
|
|
||
залось, экспрессия функциональ |
та колоний эпителия и обеспечения |
|
|
|
||
ных комплексов, локализованных |
целости эпителиального барьера. В |
|
|
|
||
на поверхности клеток, имеет ре |
результате слизистая оболочка ста |
|
|
|
||
шающее значение для активации |
новится более чувствительной к |
|
|
|
||
Рис. 1. Распределение колонизации |
||||||
рецептора и инициации сигнала. |
транслокации бактерий. В связи с |
|||||
микробов в пищеварительном тракте. |
||||||
Почти через 20 лет после выда |
этим короткоцепочечные |
жирные |
В желудочно кишечном тракте выде |
|||
ющегося исследования J.R. Warren |
кислоты стали использовать с хоро |
ляются четко разделяющиеся участки |
||||
с особой резидуальной микрофлорой, |
||||||
и B.J. Marshall, посвященного ха |
шим клиническим эффектом в лече |
|||||
состоящей из 500 видов, из которой |
||||||
рактеристике Helicobacter pylori и |
нии язвенного колита (ЯК). |
|
почти половина не культивируется: |
|||
связи этого микроорганизма с гаст |
У людей желудочно кишечный |
|
1) ротовая полость – местная мик |
|||
рофлора из 200 видов, в слюне содер |
||||||
ритом, была вновь открыта гастро |
тракт колонизируется микрофло |
|||||
жится 109 колониеобразующих единиц |
||||||
интестинальная микрофлора. По |
рой уже при рождении в родовых |
(КОЕ) в 1 мл, в зубах – 1011 КОЕ/г; |
||||
зднее она привлекла к себе при |
путях, а также микроорганизмами, |
|
2) пищевод – Streptococcus viridans, |
|||
Candida albicans; |
||||||
стальное внимание исследовате |
содержащимися в воздухе и пище |
|||||
|
3) желудок и двенадцатиперстная |
|||||
лей. Заселяющие толстую кишку |
вых продуктах. В возрасте 12– |
кишка – 101–103 КОЕ/мл Helicobacter |
||||
жизнеспособные бактерии в коли |
24 мес колонизация кишечника за |
pylori; |
||||
|
4) тощая и подвздошная кишка – |
|||||
честве 1012/г толстокишечного со |
канчивается. В итоге в нем содер |
|
||||
104–108 КОЕ/мл Lactobacillus spp., |
||||||
держимого и высокая метаболиче |
жится примерно 500 видов микро |
E. coli, Streptococcus spp., Bacteroi |
||||
ская активность, подобно другим |
организмов (рис. 1). |
|
des spp., Bifidobacteria spp., Fusobac |
|||
|
teria spp.; |
|||||
органам, обеспечивают питатель |
В желудке и верхних отделах |
|||||
|
5) ободочная кишка – 1010–1012 КОЕ/г |
|||||
ными веществами эпителиальные |
тонкой кишки колонизируется не |
Bacteroides spp., E. coli, Streptococ |
||||
клетки. Углеводороды ферментиру |
большое число микробов (103– |
cus spp., Сlostridium spp., Lactobacil |
||||
lus spp., Pseudomonas spp., Eubacteri |
||||||
ются в короткие цепи жирных кис |
104/мл), что связано с низким рН, |
|||||
um spp., дрожжи |
||||||
Р е д а к ц и о н н а я
3
Р е д а к ц и о н н а я
Клинические перспективы гастроэнтерологии, гепатологии ■ 3, 2004
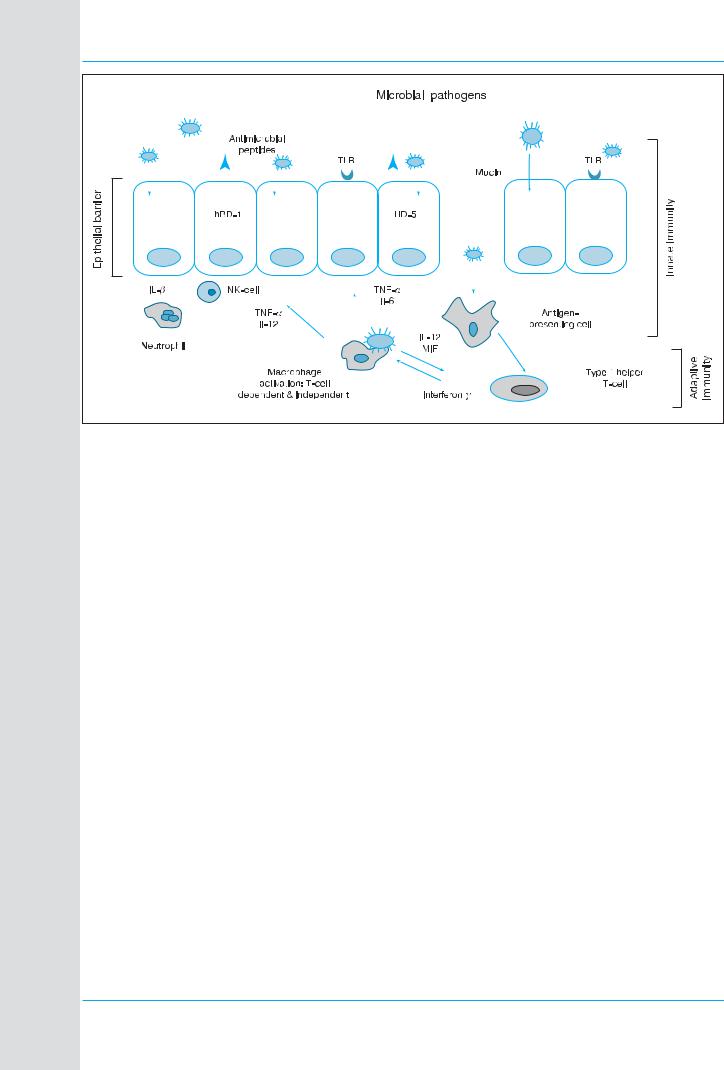
Рис. 2. Защитные механизмы кишечника: антимикробные пептиды. Дефенсины (hBD 1, HD 5) – часть врожденного имму нитета желудочно кишечного барьера, защищающего от бактериальной транслокации из просвета кишечника. Они взаи модействуют с другими участниками комплексной гастроинтестинальной защитной системы и, как недавно было показано, влияют на адаптивный иммунный ответ. TLR – Toll like receptor (ТПР – Тоll подобный рецептор); IL 8 – interleukin 8
(ИЛ 8 – интерлейкин 8); NK – natural killer (ЕК – естественный киллер); TNF α – tumor necrosis factor α (ФНО α – фактор не кроза опухоли α); MIF – macrophage migration inhibitory factor (ФИМ – фактор, ингибирующий миграцию макрофагов)
перистальтической пропульсаци |
естественные клетки киллеры. |
Позднее у них были обнаружены |
|||||
ей, секрецией желчи и панкреати |
В противоположность врожден |
антимикотические свойства. |
|||||
ческих ферментов и, по видимому, |
ным защитным механизмам адап |
ТПР характеризуются наличием |
|||||
присутствием α дефенсинов. В дис |
тивный иммунный ответ или приоб |
экстрацеллюлярного домена*, со |
|||||
тальной части тонкой кишки кон |
ретенный иммунитет заключается в |
держащего богатые лейцином по |
|||||
центрация микробов и их разнооб |
активации Т клеток и дифференци |
вторы (БЛП), и внутриклеточного |
|||||
разие увеличиваются. |
ровке В клеток с продукцией анти |
домена, включающего |
рецептор |
||||
За илеоцекальным клапаном |
тел, для чего необходимо распоз |
Тоll интерлейкина 1 (РТИЛ 1). БЛП |
|||||
микробная масса составляет при |
навание специфического антигена. |
найдены в разнообразных белках, |
|||||
мерно половину от ее общего ко |
Оба защитных механизма находят |
в которых они участвуют в распоз |
|||||
личества в |
просвете кишечника: |
ся во взаимодействии (рис. 2). |
навании лиганд** и сигнализируют |
||||
1012 бактерий на 1 г фекалий с до |
|
|
|
о трансдукции***. |
|
|
|
минированием анаэробов. |
|
Рецепторы, распознаю |
РТИЛ внутриклеточного домена |
||||
Для предупреждения трансло |
|
отличается высокой гомологичнос |
|||||
|
щие образы: Тоll подоб |
||||||
кации бактерий в лимфоцитзависи |
|
тью среди индивидуальных Тоll по |
|||||
|
ные рецепторы |
||||||
мую врожденную защитную систе |
|
добных рецепторов, а сохраняю |
|||||
|
кишечника |
||||||
му требуется активная и чрезвычай |
|
щиеся белок – белок взаимодейст |
|||||
|
|
|
|||||
|
|
|
|||||
но эффективная защитная система |
|
ТПР относятся к 1 му типу |
вия обнаруживаются |
в |
большом |
||
с широкой антимикробной актив |
трансмембранных РРО, которые в |
числе растительных |
и |
животных |
|||
ностью. Во врожденной реакции на |
процессе эволюции сохраняются |
трансмембранных и цитоплазмати |
|||||
указанные |
воздействия участвуют |
во всех биологических видах. Эти |
ческих протеинов. Из них большин |
||||
эпителий |
желудочно кишечного |
рецепторы у млекопитающих гомо |
ство участвует в защите хозяина. |
||||
тракта и лейкоциты – макрофаги, |
логичны Тоll протеину насекомых, |
К настоящему времени у раз |
|||||
дендритные клетки, гранулоциты и |
впервые описанному у дрозофилы. |
ных видов млекопитающих описа |
|||||
* Домен – гомологичные участки, состоящие из 110–120 аминокислот каждый, входящие в состав легких и тяжелых цепей молекулы иммуноглобулина и несущие специфические функции.
**Лиганд – молекула, связанная с ионом металла координационными связями.
***Трансдукция – перенос генетического материала от одной бактерии к другой.
4

Клинические перспективы гастроэнтерологии, гепатологии ■ 3, 2004
но 10 ТПР. Считается, что в дейст вительности их больше, однако все члены этого семейства неизвестны. После описания первого ТПР иден тифицировано много лиганд ТПР (рис. 3).
Они включают разнообразные эволюционно сохраняемые ПАМО с существенно отличающимися структурой и происхождением, по дают сигнал «инфекция» или «опас ность». Большинство ТПР, если не все, распознает несколько струк турно несвязанных лигандов, час тично за счет добавочных белков. Эти добавочные белки имеют большое значение в активации специфических рецепторов и адек ватной передаче сигналов, но они могли бы также разнообразить инициируемые иммунные ответы в качестве альтернативных путей.
Лиганды ТПР
ТПР 4 является главным сиг нальным рецептором для липопо лисахаридов (ЛПС) in vitro и in vivo. Ему помогают некоторые добавоч ные молекулы, включая белок, cвя занный с ЛПС (БСЛПС). Этот бе лок увеличивает связывание лиган да с рецептором CD14 и затем с MD 2. Последний формирует ком плекс с эктодоменом TПР 4 на мембране поверхности клетки. MD 2 необходим для распознава ния ЛПС с помощью ТПР 4, хотя точные молекулярные механизмы
Таблица 2. Экспрессия основных дефенсинов в желудочно кишечном тракте
Область |
Дефенсины |
|
|
Пищевод |
α Дефенсины – незначительное количество |
|
β Дефенсины hBD 1, hBD 2, hBD 3 |
Желудок |
α Дефенсины HD 5 |
|
β Дефенсины hBD 1, hBD 2 |
Kишка: |
α Дефенсины HD 5, HD 6 |
тонкая |
|
|
β Дефенсины hBD 1 |
толстая |
α Дефенсины HD 5, HD 6, но меньше, чем в тонкой кишке |
|
β Дефенсины hBD 1 |
этого взаимодействия неизвестны. |
на поверхности клеток для двухце |
|||||||||||||||
Помимо ЛПС ТПР 4 участвует в |
почечной РНК. Индукция продук |
|||||||||||||||
распознавании нескольких других |
ции цитокинов с помощью ТПР 3 |
|||||||||||||||
лиганд. Активность ТПР 2 обуслов |
реализуется независимо от факто |
|||||||||||||||
ливается |
воздействием разнооб |
ра миелоидной дифференцировки |
||||||||||||||
разных, |
структурно несвязанных |
(MyD88). |
||||||||||||||
лигандов, таких, как липотейховая |
Активность ТПР 5 стимулируется |
|||||||||||||||
кислота, пептидогликаны или липо |
флагеллином. Последний отличает |
|||||||||||||||
пептиды, как, например, грамполо |
ся стойко сохраняемой структурой |
|||||||||||||||
жительные бактерии, спирохеты и |
и является жизненно необходимым |
|||||||||||||||
микобактерии. Эта способность |
белком для бактериальной мобиль |
|||||||||||||||
частично объясняется образовани |
ности. TПР 5 обнаружен на базола |
|||||||||||||||
ем функциональных гетеродиме |
теральной стороне кишечного эпи |
|||||||||||||||
ров c помощью ТПР 2 и других чле |
телия, служит для распознавания |
|||||||||||||||
нов семейства ТПР. |
энтероинвазивных патогенов. |
|||||||||||||||
ТПР 1 и ТПР 6, образующие ге |
У небольшого числа антивирус |
|||||||||||||||
теродимеры с ТПР 2, экспрессиру |
ных препаратов, в частности у ими |
|||||||||||||||
ют значительное число клеток раз |
дазохинолинов, недавно обнару |
|||||||||||||||
ного типа, в то время как экспрес |
жена способность индуцировать |
|||||||||||||||
сия ТПР 2 более ограниченна и ре |
активность ТПР 7. Данный факт |
|||||||||||||||
гулируема. ТПР 3 играет ключевую |
свидетельствует о том, что этот ре |
|||||||||||||||
роль в созревании дендритических |
цептор может участвовать в проти |
|||||||||||||||
клеток и расценивается как рецеп |
вовирусной защите. Приведенные |
|||||||||||||||
тор – важнейший вирусный ПАМО |
данные свидетельствуют также о |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 3. Лиганды, активирующие Тоll подобные рецепторы (ТПР). Семейство Тоll рецепторов представляет собой транс мембранные молекулы, связывающие экстра и интрацеллюлярные структуры. Помимо бактериальных структур ТПР могут активировать небактериальные продукты, такие, например, как таксол, термические шоковые протеины – тшп (hsp 60 и hsp 70), или экстрацеллюлярный А домен фибронектина. LPS – lipopolysaccharide (ЛПС – липополисахарид); протеин F (fusion); RS – респираторно синцитиальный; PGN – пептидогликан (ПГН); GPI – гликозилфосфатидилинозитол (ГФИ); gramp. Bacteria – грамположительные бактерии; gramneg. Bacteria – грамотрицательные бактерии; Viral double stranded RNA – вирусная двойная скрученная РНК
Р е д а к ц и о н н а я
5

Р е д а к ц и о н н а я
Клинические перспективы гастроэнтерологии, гепатологии ■ 3, 2004
Рис. 4. Структура дефенсинов человека: N – термин «амино», SS – дисульфид ный мостик. Они представляют собой катионные, богатые аргинином (R) пепти ды, состоящие из 28–44 аминокислот. Молекулярная масса варьирует от 1 до
5 кДa. Дефенсины имеют типичную третичную структуру – 6 цистеиновых остат ков из 3 внутримолекулярных дисульфидных мостиков. Группировка α дефенси нов: С1–С6, С2–С4 и С3–С5. β Дефенсины сгруппированы цистеиновыми мости ками между С1–С5, С2–С4 и С3–С6
том, что и другие выделенные непа тогенные молекулы могли бы рас сматриваться как мощные лиганды ТПР.
Кроме того, ТПР, по видимому, активируются эндогенными лиганда ми, индуцируемыми в процессе вос палительной реакции. На рис. 3 представлены идентифицированные к настоящему времени лиганды ТПР.
Сигнализация ТПР
Благодаря структурному сход ству цитоплазматических участков потоковый каскад сигналов ТПР состоит из тех же самых молекул, которые используются рецептора ми интерлейкина 1 (ИЛ 1Р, или IL 1Rs). Эти общие элементы вклю чают цитоплазматический адаптер молекулы MyD88, протеин киназу ИРАК (ИЛ 1Р ассоциированная киназа, или IRAK – IL 1R associated kinase), Толлип (Тoll интерактивный протеин), или Tollip – Toll inter acting protein), адаптер протеина TRAF6 (TNF receptor associated fac tor) и ECSIT (evolutionary conserved signalig intermediate in Toll path
ways – эволюционно сохраняемое промежуточное сигнальное звено на Тоll путях), который связывает TRAF6 c членами семейства мито генактивированной протеин кина зой (МАРК), включая р38, р42/44 ERK 1/2 (экстрацеллюлярная сиг налрегулирующая киназа 1/2) и c Jun N терминальные киназы 1 и 2.
В дополнение к их общей акти вации с помощью MyD88 , IRAK , TRAF путей индивидуальные ТПР могут активировать различные альтернативные сигнальные пути. ТПР сигнальный каскад поэтому не идентичен, и некоторые специфи ческие пути могут определять вари ации в генной экспрессии, которые определяют различимые биологи ческие реакции после активации индивидуальных Тоll подобных ре цепторов.
Экспрессия генов может вклю чать провоспалительные цитокины, хемокины и другие стимулирующие молекулы для дальнейшего контро ля за адаптивным иммунным отве том. ТПР могут также индуцировать эффекторные молекулы, такие, как
антимикробные пептиды и индуци руемые синтазы оксида азота. Бла годаря этому они реализуют защи ту хозяина – разрушение внедрив шегося патогена.
Антимикробные
пептиды
Секреция клетками продук тов (помимо муцина) с прямым воз действием на микробы, а также с антимикотической и антивирусной активностью является ведущим фактором внешней барьерной функции пограничных эпителиаль ных клеток желудочно кишечного тракта. Секретируемые агенты, включающие компоненты компле мента, такие, как С3, С4, фактор В и другие специализированные мо лекулы с антимикробной активнос тью, называются антимикробными пептидами.
Идентифицировано более 100 основных видов пептидов, опреде лены биохимические эффекторные барьеры у растений, насекомых, земноводных и млекопитающих. Это свидетельствует не только о широком филогенетическом рас пределении, но также позволяет считать, что эти пептиды представ ляют собой важнейшую часть эво люции сохраняющихся врожденных иммунных механизмов.
Первичная структура антими кробных пептидов очень вариа бельна. Более крупные антими кробные пептиды напоминают преимущественно литические ферменты, связывающие белки пи тательных веществ или белки, со держащие связывающие участки, специфичные для микробных мак ромолекул. С другой стороны, мелкие (содержащие менее 100 аминокислот) антимикробные пеп тиды взаимодействуют с анионной частью прокариотной мембраны, вызывая ее катионный заряд.
Внедрение этих пептидов в мик робные мембраны сопровождает ся образованием пор, последую щей потерей энергии и ионного градиента, что в конченом итоге вызывает лизис клетки. Антими
6

|
|
|
Клинические перспективы гастроэнтерологии, гепатологии |
■ |
3, 2004 |
|||||
кробные пептиды в кишечнике про |
|
|
|
|
|
|
|
|
||
|
|
Просвет кишки |
|
|
|
|
|
|||
дуцируются как циркулирующими, |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||
так и эпителиальными клетками. |
|
|
|
|
|
|
|
|
||
Эпителий кишечника является пер |
|
|
|
|
|
|
|
|
||
вой линией защиты, в то время как |
|
|
|
|
|
|
|
|
||
клетки, участвующие в кровообра |
|
|
|
|
|
|
|
|
||
щении, выделяют антимикробные |
|
|
|
|
|
|
|
|
||
факторы после трансэпителиаль |
|
|
|
|
|
|
|
|
||
ной микробной инвазии. |
|
|
|
|
|
|
|
|
||
У человека главными классами |
|
|
|
|
|
|
|
|
||
антимикробных протеинов являют |
|
|
|
|
|
|
|
|
||
ся кателицидины и дефенсины. |
|
|
|
|
|
|
|
|
||
У последних выделяют α и β де |
|
|
|
|
|
|
|
|
||
фенсины. |
|
|
|
|
|
|
|
|
|
|
Дефенсины |
|
|
|
|
|
|
|
|
||
Дефенсины представляют со |
|
|
|
|
|
|
|
|
||
бой мелкие катионные пептиды мо |
|
|
|
|
|
|
|
|
||
лекулярной массой 3,5–4,5 кДa, |
Рис. 5. α Дефенсины локализуются в специализированных клетках на дне либер |
|||||||||
содержат 6 цистеиновых остатков. |
кюновых (кишечных) крипт в клетках Панета. В основном они находятся в тощей |
|||||||||
Примеры их аминокислотного со |
и подвздошной кишке и обычно отсутствуют в толстой кишке. β Дефенсины об |
|||||||||
наруживаются в дыхательных путях, эпителии десен, слюнных железах, поджелу |
||||||||||
става и структуры представлены на |
||||||||||
дочной железе и слизистой оболочке пищеварительного тракта |
|
|
|
|||||||
рис. 4. |
|
|
|
|
|
|
|
|
|
|
Дефенсины (α, β и 0) определя |
β дефенсина отличается большой |
ткани, вызываемой этой амино |
||||||||
ются по специфическому выравни |
индивидуальной вариабельностью |
кислотой. |
|
|
|
|
||||
ванию их дисульфидных связей. Ге |
в отношении отдельных пептидов, |
β Дефенсины, особенно hBD 2, |
||||||||
ны, кодирующие α и β дефенсины, |
их локализации и патогенных усло |
действуют как связующее звено с |
||||||||
локализуются в хромосоме 8р23. |
вий (табл. 2). |
|
адаптивной |
иммунной |
системой. |
|||||
α Дефенсины состоят из 29–35 |
α Дефенсин hBD 1 относитель |
hBD 2 соединяется с дендритными |
||||||||
аминокислотных остатков в длину и |
но постоянно экспрессирует на |
клетками, которые экспрессируют |
||||||||
образуют трехрядную β полоску. |
протяжении всего желудочно ки |
хемокиновый |
рецептор |
(CCR6) и |
||||||
Впервые α дефенсины выделены из |
шечного тракта и остается ста |
благодаря этому |
в результате |
|||||||
нейтрофилов, в которых идентифи |
бильным при воспалении или мик |
хемотаксиса |
мобилизуют |
денд |
||||||
цированы |
пептиды нейтрофилов |
робных |
атаках. |
Эпителиальные |
ритные клетки и Т клетки памяти в |
|||||
человека |
(ПНЧ) 1–4, или HNPs |
клетки желудка отвечают повышен |
инфицированные участки. |
|
||||||
(human neutrophil peptides). Эти че |
ной экспрессией hBD 2 после ин |
Кроме того, как показано на |
||||||||
тыре ПНЧ участвуют в кислородне |
фицирования Helicobacter pylori |
мышиных моделях, β дефенсины |
||||||||
зависимом уничтожении фагоцити |
или сальмонеллами. Однако вос |
могут регулировать функции денд |
||||||||
рованных микробов. α Дефенсины |
паленная, но не инфицированная |
ритных клеток с помощью ТПР. |
||||||||
HD 5 и HD 6 впервые выявлены в |
слизистая оболочка желудка также |
Известные в настоящее время |
||||||||
клетках Панета (эритроцитах с |
подвергается активному воздейст |
эффекты дефенсинов, направлен |
||||||||
ацидофильными гранулами) в крип |
вию hBD 2, по видимому, как реак |
ные на защиту кишечника, пред |
||||||||
тах тонкой кишки (рис. 5). |
ция на местную продукцию интер |
ставлены на рис. 6. |
|
|
|
|||||
Характер экспрессии α дефен |
лейкина 1α по пути нуклеарного |
Кателицидины |
|
|
|
|||||
синов тонкой кишки свидетельству |
фактора (NF) kВ. |
|
|
|
|
|||||
|
|
|
|
|
|
|||||
ет о важной роли этих пептидов в |
L изолейцин |
рассматривается |
Кателицидины |
представляют |
||||||
местной защите. HD 5 обладает |
как другой активный регулятор |
собой линейные α спиралевидные |
||||||||
антимикробной активностью в от |
hBD 2. Поскольку L изолейцин |
пептиды без цистеиновых остатков. |
||||||||
ношении |
Lactobacillus monocyto |
представляет собой важнейшую |
У человека выделен (из миелоид |
|||||||
genes, Escherichia coli и Candida |
аминокислоту и в нормальных ус |
ных клеток) только один кателици |
||||||||
albicans на фоне большого диапа |
ловиях |
отсутствует в организме |
дин – LL 37/ hCAP 18. В настоящее |
|||||||
зона концентрации солей и рН. |
человека, полагают, что генера |
время он идентифицирован на по |
||||||||
На фоне относительно стабиль |
лизованный защитный механизм |
верхности и в верхних участках |
||||||||
но высокой экспрессии α дефенси |
эпителиальных клеток заключает |
крипт нормальной толстой кишки |
||||||||
на в тонкой кишке и низкой экс |
ся в распознавании уникальных |
человека. |
|
|
|
|
||||
прессии в других участках желудоч |
молекулярных маркеров на нали |
Активная регуляция экспрессии |
||||||||
но кишечного тракта экспрессия |
чие патогенов |
или деструкции |
LL 37/hCAP 18 наблюдается при |
|||||||
Р е д а к ц и о н н а я
7

Р е д а к ц и о н н а я
Клинические перспективы гастроэнтерологии, гепатологии |
■ |
3, 2004 |
|
|
|
|||
|
|
|
|
|
тиков в лечении ВЗК сопровожда |
|||
|
|
|
|
|
лось положительными результата |
|||
|
|
|
|
|
ми только при БК, а при ЯК их бла |
|||
|
|
|
|
|
гоприятный эффект был весьма ог |
|||
|
|
|
|
|
раниченным. |
|
||
|
|
|
|
|
Установление важнейшей роли |
|||
|
|
|
|
|
кишечных микробов в дебюте и по |
|||
|
|
|
|
|
следующем развитии воспаления |
|||
|
|
|
|
|
кишечника свидетельствуют о том, |
|||
|
|
|
|
|
что они являются решающим фак |
|||
|
|
|
|
|
тором в патогенезе ВЗК. |
|||
|
|
|
|
|
Опыты с кишечной микрофло |
|||
|
|
|
|
|
рой, сопровождающиеся введени |
|||
|
|
|
|
|
ем непатогенных |
микроорганиз |
||
|
|
|
|
|
мов, – так называемых пробиоти |
|||
Рис. 6. Влияние дефенсинов на защиту кишечника. Помимо антимикробной актив |
ческих |
бактерий |
– может пред |
|||||
ставлять альтернативный подход в |
||||||||
ности дефенсины стимулируют приобретенный иммунный ответ с помощью хемо |
||||||||
лечении хронических ВЗК. Много |
||||||||
таксиса дендритных и Т клеток в дополнение к хемотаксису нейтрофилов |
||||||||
и дегрануляции тучных клеток. Кроме того, дефенсины тормозят фибринолиз, |
обещающие результаты исследо |
|||||||
который способствует развитию инфекции |
|
|
|
ваний пациентов, страдающих вос |
||||
|
|
|
|
|
||||
|
|
|
|
|
палительными |
заболеваниями |
||
сальмонеллезном энтерите и энте |
тельного процесса в кишечнике, в |
углублений, или карманов, в под |
||||||
роинвазии E. coli. Цитокины не вли |
частности воспалительных заболе |
вздошной области или активной |
||||||
яют на экспрессию LL 37/hCAP 18. |
ваний кишечника (ВЗК): болезни |
БК, свидетельствуют о необходи |
||||||
LL 37/hCAP 18 обладает бак |
Крона (БК) и ЯК. |
мости |
интенсификации изучения |
|||||
терицидной активностью в отноше |
Результаты |
исследований на |
эффективности пробиотиков. |
|||||
нии грамположительных и грамот |
животных свидетельствуют о важ |
В дополнение к новым тера |
||||||
рицательных бактерий. |
ном значении в сохранении толе |
певтическим подходам и обнару |
||||||
У некоторых бактерий, по ви |
рантности слизистой оболочки как |
жению новых генетических ассо |
||||||
димому, развиваются «механизмы |
воздействия бактерий, так и регу |
циаций: гипотеза о том, что изме |
||||||
спасения» (escape mechanisms), |
лирующего влияния клеточных и гу |
ненный иммунный ответ играет |
||||||
предохраняющие их от защитных |
моральных факторов. Кроме того, |
ведущую роль в патогенезе хро |
||||||
систем хозяина. Инфицирование |
ограниченные возможности в ре |
нического воспаления кишечника, |
||||||
человека Shigella spp. сопровож |
акциях врожденного иммунитета в |
в настоящее время приобрела |
||||||
дается на ранних этапах инфекции |
отношении |
спектра симбионтных |
много |
сторонников. Нарушения |
||||
в период транскрипции снижен |
организмов является необходимым |
экспрессии ТПР, а именно ТПР 3 |
||||||
ной регуляцией LL 37/hCAP18 и |
условием иммунной системы хозяи |
и ТПР 4, или секреции цитокинов |
||||||
hBD 2. |
|
на, ограничивающей аутодеструк |
или недавно открытого фактора |
|||||
LL 37/hCAP18 вызывает лизис |
цию, вызываемую стойко сохраня |
подавления миграции макрофа |
||||||
Shigella spp., поэтому сниженная |
ющимся системным воспалением. |
гов может быть одним из проявле |
||||||
регуляция |
антимикробных пепти |
Хотя не |
идентифицирован ни |
ний врожденных иммунных реак |
||||
дов имеет критическое значение в |
бактериальный продукт, ни целост |
ций при ВЗК. Кроме того, секре |
||||||
отношении воздействия на виру |
ный организм, которые могли бы |
ция и |
функция антимикробных |
|||||
лентный фактор. |
рассматриваться как причина ВЗК, |
пептидов, рассматриваемых как |
||||||
|
|
тем не менее очевидно, что в отсут |
часть врожденной системы защи |
|||||
Дисрегуляция кишечной |
ствие бактерий ЯК не развивается. |
ты, оцениваются |
в настоящее |
|||||
Более того, у генетически предрас |
время у больных с ВЗК. |
|||||||
защиты и иммунного |
||||||||
положенного |
хозяина дисрегуля |
К |
семейству |
антимикробных |
||||
гомеостаза |
||||||||
ция иммунного ответа на сим |
пептидов относятся дефенсины, об |
|||||||
|
|
|||||||
Изменения связей хозяин– |
бионтную микрофлору сопровож |
наруженные в клетках Панета, а |
||||||
микроб, нарушения взаимодейст |
дается развитием хронического |
также в нормальных и воспаленных |
||||||
вия врожденной и адаптивной им |
воспаления. Абактериальное ок |
тканях |
кишечника |
с характерной |
||||
мунных систем, как и влияние фак |
ружение не вызывает колита у |
экспрессией при БК и ЯК. Результа |
||||||
торов окружающей среды и гене |
животных с моделью ВЗК, включая |
ты этих исследований свидетельст |
||||||
тическая |
предрасположенность, |
некоторые |
породы с дефицитом |
вуют о том, что активная экспрессия |
||||
оказывают решающее влияние на |
специфических цитокинов. |
некоторых антимикробных пепти |
||||||
развитие |
хронического воспали |
Поэтому применение антибио |
дов, таких, как hBD 1, составляет |
|||||
8

Клинические перспективы гастроэнтерологии, гепатологии ■ 3, 2004
основную защиту кишечного эпите лия, предупреждает прикрепление микроорганизмов в отсутствие вос паления, в то время как экспрессия других, включая hBD 2, представля ет собой реакцию на инфекцион ные и воспалительные стимулы.
Кроме того, у человека наблю дается высокий уровень экспрес сии 1–3 дефенсинов нейтрофилов и лизоцима на поверхности клеток при обострениях БК и ЯК. Однако у здоровых и в неактивных случаях ВЗК экспрессия слабая.
Следует отметить, что экспрес сия α дефенсина HD 5 усиливает ся как при идиопатическом, так и неидиопатическом воспалении толстой кишки, в то время как ак тивная экспрессия HD 6 специ фична для ЯК и БК.
Хотя функциональное значение антимикробных пептидов при ВЗК требует доказательств, представ ляется весьма вероятным, что эти пептиды имеют решающее значе
ние в контроле за прикреплением
иинвазией микроорганизмов в ки шечнике. Освобождающиеся де фенсины притягивают Т клетки па мяти и дендритические клетки и в результате формируется адаптив ная фаза иммунного ответа.
Дальнейшие исследования должны быть посвящены вопросам дисрегуляции дефенсинов при ВЗК
ивозможности применения этих пептидов в качестве фармакологи ческих мишеней. Некоторые веще ства, участвующие в качестве по средников в развитии иммунной резистентности млекопитающих к инфекции, могут оказаться полез ными в качестве эталонов для но вых антибиотиков или иммуности муляторов.
Однако прежде чем будут при няты решения об использовании этих веществ в лечебных целях, мы должны глубже изучить механизмы «ускользания» различных бактерий
ивозможные побочные эффекты.
Кроме того, необходимо проведе ние фармакогенетических иссле дований.
У больных фиброкистозом на блюдается высокая экспрессия β дефенсинов с их инактивацией большими концентрациями катио нов, содержащимися в жидкости на поверхности дыхательных путей. Эта проблема, возможно, будет преодолена с помощью химиче ской модификации, создающей циклическую структуру из двух де фенсинов, лигированных по прин ципу «голова к хвосту». Указанная структура сохраняет антимикроб ную активность даже при высоких концентрациях ионов.
Обсуждаемые захватывающие открытия значительно расширяют современные представления о врожденном кишечном иммуните те и механизмах защиты. В буду щем они могут стать перспектив ными в лечении острых и хрониче ских ВЗК.
Р е д а к ц и о н н а я
9

Га с т р о э н т е р о л о г и я , б а з и р у ю щ а я с я н а д о к а з а т е л ь с т в а х
Клинические перспективы гастроэнтерологии, гепатологии ■ 3, 2004
УДК 612.35.014.2+611.36.018.1
Стволовые клетки печени: современное состояние проблемы
%.&.
( , )
Печень подвергается воздействию многочис ленных повреждающих факторов – различных
патогенов, токсинов, лекарств, ге патотропных вирусов. Поэтому для адекватной функции органа необ ходимы механизмы быстрой регене рации. В связи со значительным уве личением массы печени при повреждении ее ткани клетки, обес печивающие регенерацию, должны делиться несколько раз, что предпо лагает их клональную природу. Как показали экспериментальные ис следования, в печени имеется не сколько источников таких клеток. По видимому, это обусловлено раз нообразием и количеством действу ющих на нее патогенов.
Определенная часть гепатоци тов донорской печени при транс плантации проявляет клоновые свойства. Позднее могут пролифе рировать клетки желчного эпителия
исинусоидов. Более тяжелые по вреждения печени приводят к акти вации так называемых овальных кле ток, находящихся в мелких развет влениях желчных протоков. Третьим источником регенерации могут быть стволовые клетки костного мозга, способные дифференцироваться в зрелые гепатоциты. Необходимо, однако, выяснить, каковы конкрет ные механизмы регенерации печени
икак потенциальные стволовые клетки из разных источников взаи модействуют друг с другом.
Возможность выращивания
стволовых клеток in vitro имеет огромное значение для медицины, поскольку открывает перспективы применения их в трансплантологии и лечении острой печеночной не достаточности. Кроме того, воз можна индукция размножения стволовых клеток в организме больного. В связи с этим проведено достаточно большое число иссле дований, посвященных выделению стволовых клеток, их идентифика ции и выращиванию, а затем и пе ресадке полученной культуры и изучению ее свойств. Эти работы в основном проводят на экспери ментальных животных – мышах и крысах, хотя есть данные, касаю щиеся и человеческих стволовых клеток, полученных от взрослых лиц и эмбрионов.
Источники
регенерации
Гепатоциты. Прежде всего следует определить, какие именно клетки обеспечивают регенера цию печеночной ткани. В ряде работ была продемонстрирована высокая способность зрелых гепа тоцитов к многократному делению. Так, например, проведение серии трансплантаций показало, что в печени мыши находятся клетки, способные делиться более 60 раз [64]. Авторы вначале именно их считали печеночными стволовыми клетками (клетками предшествен никами), но в дальнейшем, при бо
лее тщательной идентификации, было установлено, что после пере садки интенсивно делились полно стью дифференцированные гепа тоциты, причем эта способность не ослабевала при последующих трансплантациях [63].
В работе Т. Mitaka и соавт. 1,5% клеток культуры зрелых гепа тоцитов формировали колонии под воздействием митогенов [58]. Высокая способность к пролифе рации зрелых гепатоцитов была продемонстрирована G.K. Micha lopoulos и соавт. [57], которые предположили, что стволовые клет ки могут не участвовать в регене рации печени. Напротив, было доказано существование клеток, называемых гепатобластами, спо собных восстанавливать как ба лочную структуру печени, так и желчные протоки, т. е. обладают бипотециальными свойствами. В настоящее время их считают на иболее вероятными кандидатами на роль клеток предшественников [2, 23, 49, 84].
Существует мнение, что у взрослого человека они начинают размножаться лишь в том случае, если гепатоциты или клетки желч ных протоков не могут пролифери ровать [81], хотя более вероятно, что эти процессы сосуществуют [45, 96].
Клетки с бипотенциальными свойствами. Эти клетки были впер вые обнаружены при моделирова нии канцерогенеза и повреждения
10
