- •Гликопротеины
- •Способ присоединения углевода к белку Функцией гликопротеинов являются:
- •Протеогликаны – характеризуется наличием крупных полисахаридов, состоящих из повторяющихся дисахаридных остатков.
- •Строение гиалуроновой кислоты и хондроитинсульфата
- •Выделяют четыре основных класса липопротеинов:
- •Фосфопротеины - это, как правило, ферменты
- •Способ присоединения фосфата к белку на примере серина и тирозина Фосфорная кислота может выполнять:
- •Изменение конформации белка в фосфорилированном и дефосфорилированном состоянии
- •Сравнение строения азотистого основания, нуклеозида и нуклеотида
- •Строение и функции рнк и днк
- •Гемопротеины: - гемоглобин
- •2. Магнийпорфирины: хлорофилл
- •3. Флавопротеины: ферменты, содержащие фад, фмн.
- •Замена аминокислоты на поверхности гемоглобина а
- •2. Изменения аминокислотного состава в области активного центра гемоглобина
Классификация и структура сложных белков
Свойства белков
Структура белков, типы связей
Классификация сложных белков
Нуклеопротеиды, хромопротеиды. Структура и функции.
Гемоглобин
К свойствам белков относят
амфотерность,
растворимость,
способность к денатурации,
коллоидные свойства.
Типы связей
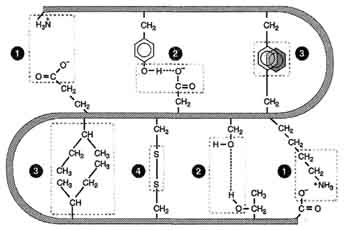
Типы связей, возникающих между радикалами аминокислот при формировании третичной структуры белка. 1 - ионные связи; 2 - водородные связи; 3 - гидрофобные связи; 4 - дисульфидные связи.
.

Супервторичная структура белков
Пространственная структура каждого белка определяется его первичной структурой. Однако сравнение конформаций разных по структуре и функциям белков выявило наличие у них похожих сочетаний элементов вторичной структуры. Такой специфический порядок формирования вторичных структур называют супервторичной структурой белков, формируется за счёт межрадикальных взаимодействий.
Они имеют специфические названия: "альфа-спираль-поворот-альфа-спираль" ( многие ДНК-связывающие белки), "структура альфа/бета-бочонка" (некоторые ферменты: триозофосфатизомераза), "лейциновая застёжка-молния" (гистоны), "цинковый палец" ( ДНК-связывающие белки ) и др.
Формирование трёхмерной структуры белков
- важнейший биологический процесс, так как от пространственной структуры белков зависит их биологическая функция.
Процесс сворачивания полипептидной цепи в правильную пространственную структуру получил название "фолдинг белков".
Однако в клетке концентрация белков настолько высока, что существует большая вероятность взаимодействия белков с несформированной конформацией. На их поверхности располагаются гидрофобные радикалы, склонные к объединению. Поэтому для многих белков, имеющих высокую молекулярную массу и сложную пространственную структуру, фолдинг протекает при участии специальной группы белков, которые называют "шапероны" (от франц. shaperon - няня).
Классификации шаперонов (Ш)
В соответствии с молекулярной массой все шапероны можно разделить на 6 основных групп:
высокомолекулярные, с молекулярной массой от 100 до 110 кД;
Ш-90 - с молекулярной массой от 83 до 90 кД;
Ш-70 - с молекулярной массой от 66 до 78 кД;
Ш-60;
Ш-40;
низкомолекулярные шапероны с молекулярной массой от 15 до 30 кД.
Конститутивные белки (синтез которых не зависит от стрессовых воздействий на клетки организма),
Индуцибельные ("белкам теплового шока"), синтез при стрессовых воздействиях на клетку резко увеличивается.
Ш-70 - высококонсервативный класс белков, который присутствует во всех отделах клетки: цитоплазме, ядре, ЭР, митохондриях. В области карбоксильного конца единственной полипептидной цепи шаперонов есть участок, образованный радикалами аминокислот в форме бороздки. Он способен взаимодействовать с участками белковых молекул и развёрнутых полипептидных цепей длиной в 7-9 аминокислот, обогащённых гидрофобными радикалами. В синтезирующейся полипептидной цепи такие участки встречают примерно через каждые 16 аминокислот.
Фолдинг многих высокомолекулярных белков, имеющих сложную конформацию (например, доменное строение), осуществляется в специальном пространстве, сформированном Ш-60. Ш-60 функционируют в виде олигомернoго комплекса, состоящего из 14 субъединиц. В специфической среде, в изоляции от других молекул клетки происходит перебор возможных конформаций белка, пока не будет найдена единственная, энергетически наиболее выгодная конформация.

Болезни, связанные с нарушением фолдинга белков
Некоторые растворимые в воде белки при изменении условий могут приобретать конформацию плохо растворимых, способных к агрегации молекул, образующих в клетках фибриллярные отложения, именуемые амилоидом (от лат. amylum - крахмал).
В результате отложения амилоида в органах и тканях нарушаются структура и функция клеток, наблюдают их дегенеративные изменения и разрастание соединительнотканных или глиальных клеток. Развиваются болезни, называемые амилоидозами. Для каждого вида амилоидоза характерен определённый тип амилоида. В настоящее время описано более 15 таких болезней.
Болезнь Альцгеймера - наиболее часто отмечаемый бета-амилоидоз нервной системы, как правило, поражающий лиц преклонного возраста и характеризующийся прогрессирующим расстройством памяти и полной деградацией личности. В ткани мозга откладывается бета-амилоид - белок, образующий нерастворимые фибриллы, нарушающие структуру и функции нервных клеток, бета-амилоид - продукт изменения конформаций нормального белка организма человека.
Прионы (proteinaceous infectious particle - белковая инфекционная частица) - особый класс белков, обладающих инфекционными свойствами. Попадая в организм человека или спонтанно возникая в нём, они способны вызывать тяжёлые неизлечимые заболевания ЦНС, называемые прионовыми болезнями.
Прионовый белок кодируется тем же геном, что и его нормальный аналог, т.е. имеет идентичную первичную структуру, но обладает другой конформацией: прионовый белок характеризуется высоким содержанием бета-слоёв, в то время как нормальный белок имеет много альфа-спиральных участков. Кроме того, прионовый белок обладает устойчивостью к действию протеаз и, попадая в ткань мозга или образуясь там спонтанно, способствует превращению нормального белка в прионовый в результате межбелковых взаимодействий. Куру - прионовая болезнь аборигенов Новой Гвинеи, эпидемический характер которой связан с традиционным каннибализмом в этих племенах и передачей инфекционного белка от одной особи к другой. Заражением людей прионами может происходить при употреблении мясопродуктов, полученных от животных, являющихся носителями прионов, вызывающих "бешенство коров" (болезнь Кройтцфельдта-Якоба).
Конформационная лабильность белков
- склонностью к небольшим изменениям конформации за счёт разрыва одних и образования других слабых связей.
Белки состоят из огромного числа атомов, находящихся в постоянном (броуновском) движении, что приводит к небольшим перемещениям отдельных участков полипептидной цепи, которые обычно не нарушают общую структуру белка и его функции.
Конформация белка может меняться при изменении химических и физических свойств среды, а также при взаимодействии белка с другими молекулами. При этом происходит изменение пространственной структуры не только участка, контактирующего с другой молекулой, но и конформации белка в целом.
Все белки с одинаковой первичной структурой, находящиеся в одинаковых условиях, приобретают одинаковую, характерную для данного индивидуального белка конформацию, определяющую его специфическую функцию. Функционально активную конформацию белка называют "нативная структура".
Потеря нативной конформации сопровождается утратой специфической функции белков. Этот процесс носит название денатурации белков.
Факторы, вызывающие денатурацию белков:
- высокая t0 (более 50 0 С),
-интенсивное встряхивание раствора,
- органические вещества (С2Н5ОН …),
- кислоты и щелочи,
- соли тяжелых металлов,
- детергенты (различные мыла).
Доменная структура белков
Если полипептидная цепь белка содержит более 200 аминокислот, как правило, её пространственная структура сформирована в виде двух или более доменов. Домен - участок полипептидной цепи, который в процессе формирования пространственной структуры приобрёл независимо от других участков той же цепи конформацию глобулярного белка (лёгкая цепь иммуноглобулина G состоит из двух доменов).
Четвертичная структура белка. Комплементарность протомеров.
Количество и взаиморасположение полипептидных цепей в пространстве называют "четвертичная структура белков". Отдельные полипептидные цепи в таком белке носят название протомеров, или субъединиц. Белок, содержащий в своём составе несколько протомеров, называют олигомерным (гексокиназа – 2 протомера, лактатдегидрогеназа – 4 протомера). Присоединение отдельных протомеров олигомерного белка происходят благодаря формированию на их поверхности контактных участков. Специфичность связывания контактных участков определяется их комплементарностью. Комплементарность - пространственное и химическое соответствие взаимодействующих поверхностей.
Функционирование белков.
У сложных белков, кроме белковой цепи, имеется дополнительная небелковая группа. Она называется лиганд (лат. ligo - связываю), то есть молекула, связанная с белком. В случае если лиганд несет структурную и/или функциональную нагрузку, он называется простетической группой.
В роли лиганда могут выступать любые молекулы:
молекулы, выполняющие в белке структурную функцию – липиды, углеводы, нуклеиновые кислоты, минеральные элементы, какие-либо другие органические соединения: гем в гемоглобине, углеводы в гликопротеинах, ДНК и РНК в нуклеопротеинах, медь в церулоплазмине,
переносимые белками молекулы: железо в трансферрине
субстраты для ферментов – любые молекулы и даже другие белки.
Узнавание лиганда обеспечивается:
комплементарностью структуры центра связывания белка структуре лиганда, иначе говоря, пространственным и химическим соответствием белка и лиганда. Они подходят друг к другу как ключ к замку: соответствие фермента и субстрата,
иногда узнавание может зависеть от реакционной способности атома, к которому присоединяется лиганд: связывание кислорода железом гемоглобина, или жирной кислоты с альбумином.
Функции лиганда в составе сложного белка разнообразны:
изменяет свойства белков (заряд, растворимость, термолабильность): фосфорная кислота в фосфопротеинах или остатки моносахаридов в гликопротеинах,
защищает белок от протеолиза вне и внутри клетки: углеводная часть в гликопротеинах,
в виде лиганда обеспечивается транспорт нерастворимых в воде соединений: перенос жиров липопротеинами,
придает биологическую активность и определяет функцию белка: нуклеиновая кислота в нуклеопротеинах, гем в гемоглобине, углевод в рецепторных белках,
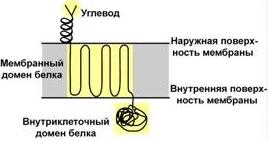
влияет на проникновение через мембраны, внутриклеточную миграцию, сортировку и секрецию белков. Это выполняет, как правило, углеводный остаток.
Взаимодействие белка с лигандом высокоспецифично, что определяется строением участка белка, называемого центром связывания белка с лигандом или активным центром.
Активный центр белков - определённый участок белковой молекулы, как правило, находящийся в её углублении ("кармане"), сформированный радикалами аминокислот, собранных на определённом пространственном участке при формировании третичной структуры и способный комплементарно связываться с лигандом. В линейной последовательности полипептидной цепи радикалы, формирующие активный центр, могут находиться на значительном расстоянии друг от друга.
Между функциональными группами лиганда и радикалами аминокислот, образующих активный центр, должны возникать связи, удерживающие лиганд в активном центре. Связи между лигандом и активным центром белка могут быть как нековалентными (ионными, водородными, гидрофобными), так и ковалентными.
Скорость взаимодействия белка с лигандом определяется концентрациями белка и лиганда в растворе, а также степенью комплементарности белка и лиганда.
Константа диссоциации - характеристика сродства активного центра лиганду.
Так как взаимодействие белка с лигандом - обратимый процесс, то его можно описать следующим уравнением:
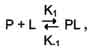
где Р - белок, L - лиганд, PL - комплекс белка с лигандом, К1 - константа скорости связывания белка с лигандом, К-1 - константа скорости распада комплекса PL.
Когда скорости образования и распада комплекса равны, говорят о том, что система находится в состоянии равновесия:
[P] [L] K1 = [PL] K-1.
Отсюда: Kдисс = K -1 / K1 = [P][L] / [PL]
Соотношение констант распада [PL] комплекса и его образования называется константой диссоциации (Кдисс) комплекса [PL]. Чем меньше Кдисс, тем больше молекул лиганда связано с белком, тем больше комплементарность между Р и L и тем больше сродство лиганда к белку. То есть между Кдисс и сродством лиганда к белку имеется обратно пропорциональная связь.
Иногда при описании процесса связывания белка с лигандом используют величину, обратную Кдисс, называемую константой связывания (Ксв) или ассоциации.
Kсв = 1 / Kдисс = [PL] / [P][L]
Между Ксв и сродством лиганда к белку существует прямо пропорциональная зависимость.
Сложный белок, состоящий из белковой части (апопротеин) и небелковой части (простетической группы), называют «холопротеин».
В зависимости от характера простетической группы все сложные белки подразделяются на 6 классов:
Гликопротеины (углевод + белок)
Липопротеины (липиды + белок)
Металлопротеины (металл+ белок)
Фосфопротеины (фосфор+ белок)
Нуклеопротеины (нуклеиновая кислота+ белок)
Хромопротеины (окрашенный компонент + белок)
ГЛИКОПРОТЕИНЫ.
Класс под названием гликопротеины или, более корректно, гликоконъюгаты – это белки, содержащие углеводный компонент, ковалентно присоединенный к полипептидной основе. Содержание углеводов в них варьирует от 1 до 85% по массе.
Выделяют два подкласса белков, содержащих углеводы: протеогликаны и гликопротеины. Между этими подклассами имеются существенные отличия:
Гликопротеины |
Протеогликаны |
|
|
Гликопротеины
Для собственно гликопротеинов характерно низкое содержание углеводов. Они присоединены либо N-гликозидной связью к амидному азоту аспарагина, либо О-гликозидной связью к гидроксигруппе остатка серина, треонина, гидроксилизина. Углевод имеет нерегулярное строение и содержит маннозу, галактозу, глюкозу, их аминопроизводные, N-ацетилнейраминовую кислоту.
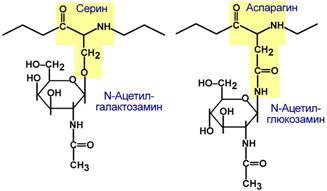
Способ присоединения углевода к белку Функцией гликопротеинов являются:
1. Структурная – клеточная стенка бактерий, костный матрикс, например, коллаген, эластин.
2. Защитная – например, антитела, интерферон, факторы свертывания крови (протромбин, фибриноген).
Схема строения белка-рецептора |
4. Гормональная – гонадотропный, адренокортикотропный и тиреотропный гормоны.
5. Ферментативная – холинэстераза, нуклеаза.
6. Транспортная – перенос веществ в крови и через мембраны, например, трансферрин, транскортин, альбумин, Na+,К+-АТФаза.
ЗАЩИТНЫЕ БЕЛКИ.
А. Интерфероны – ингибиторы размножения вирусов. Небольшие сложные белки с массой от 25 тысяч до 40 тысяч. Они образуются в клетке в ответ на вирусную инфекцию.
Б. Иммуноглобулины, или антитела, - специфические белки, вырабатываемые В-лимфоцитами в ответ на попадание в организм чужеродных структур, называемых антигенами. В организме человека вырабатывается около 107 клонов В-лимфоцитов, каждый из которых специализирован на выработке одного из 107 видов иммуноглобулинов.
Выделяют 5 классов иммуноглобулинов:
Ig G
Ig M
Ig A
Ig D
Ig E
Различаются по молекулярной массе, концентрации в крови, характеризуются общим планом строения. В количественном отношении IgG доминируют в крови и составляют около 75% от общего количества этих белков; секретируется активированными В-лимфоцитами в больших количествах при вторичном иммунном ответе, когда антиген повторно попадает в организм. IgG - единственный класс антител, способный проникать через плацентарный барьер и обеспечивать внутриутробную защиту плода от инфекций. Лучше изучена группа Ig G.
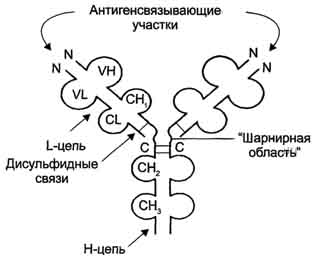
Молекула IgG состоит из четырёх полипептидных цепей: двух идентичных лёгких (L - от англ, light), содержащих около 220 аминокислотных остатков, и двух тяжёлых (Н - от англ. heavy), состоящих из 440 аминокислот каждая. Все 4 цепи соединены друг с другом множеством нековалентных и четырьмя дисульфидными связями. Поэтому молекулу IgG относят к мономерам. В шарнирной области располагается пролин.
Когда В-лимфоциты впервые встречаются в жидкостях организма с неизвестным ранее антигеном, они синтезируют и секретируют в кровь IgM. Если антиген расположен на поверхности микроорганизма, то как следствие, происходит нарушение целостности клеточной мембраны и гибель бактериальной клетки.
IgA - основной класс антител, присутствующий в секретах желёз организма (слюны, молока, пищеварительного сока, секретов дыхательных путей). В сыворотке крови его содержание не превышает 10-15% от общего количества иммуноглобулинов.Образующийся при взаимодействии IgA с антигеном препятствует прикреплению антигенов к поверхности эпителиальных клеток и проникновению их в организм.
IgЕ - содержание этого класса иммуноглобулинов в крови крайне мало, связываются с соответствующими рецепторами на поверхности тучных клеток и базофилов. В результате они становятся рецепторами антигенов на поверхности данных клеток. После присоединения антигена клетка получает сигнал к секреции биологически активных веществ (серотонина, гистамина), хранящихся в секреторных пузырьках. Выброс этих веществ в значительной мере ответственен за развитие воспалительной реакции, а также таких аллергических реакций, как бронхиальная астма, крапивница, сенная лихорадка. Увеличение количества IgE может предшествовать развитию аллергических реакций.
IgD обнаружены в крови в очень малых количествах. Мономерные белки играют роль рецепторов В-лимфоцитов; других функций у IgD пока не выявлено.