

биохимия биохимия биохимия биохимия
ферменты
биохимия биохимия биохимия биохимия

СОДЕРЖАНИЕ
оение ферментов |
3 |
Механизм и кинетика |
5 |
Номенклатура и классификация |
10 |
Изоферменты |
17 |
Регуляция активности ферментов |
18 |
Механизмы специфической регуляции |
20 |
Энзимопатии и энзимотерапия |
24 |
Привет! Представляем тебе нашу мини-методичку по биохимии ферментов. Почему мини? Этот материал – собрание наших постов, которые мы объединили, чтобы было удобнее читать и повторять.
Эта мини-методичка абсолютно бесплатная! Мы поддерживаем любое распространение и будем безумно рады, если ты поделишься со своими друзьями!
Еще больше классных материалов можно найти в наших соцсетях, так что подписывайся! Приятного чтения!
 lechteam
lechteam  *lechteam
*lechteam  lechteam
lechteam
ЛечTeam - ШКОЛА МЕДИЦИНЫ
первое издание
2022
ЛечTeam 2

СТРОЕНИЕ ФЕРМЕНТОВ
Ферменты (энзимы) – биологические катализаторы белковой природы Биологическая роль: катализ контролируемого протекания
всех метаболических процессов в организме
Строение фермента
Простые |
Сложные |
Состоят только из |
Аминокислоты (апофермент) |
аминокислот |
Ионы металлов (кофакторы) |
|
Орг. вещества небелковой |
|
природы (кофермент) |
Ферменты содержат активный и аллостерический центры:
Активный центр – часть молекулы фермента, которая специфически взаимодействует с субстратом и
принимает участие в катализе
Аллостерический центр:
 Находится за пределами активного центра
Находится за пределами активного центра
 Может присоединять активаторы, которые увеличивают активность ферментов
Может присоединять активаторы, которые увеличивают активность ферментов  Может присоединять ингибиторы, которые угнетают активность ферментов
Может присоединять ингибиторы, которые угнетают активность ферментов
3

Небелковую часть сложного фермента называют простетической группой, которая состоит из:
Коферментов: |
Кофакторов: |
||
Гемы |
ионы Калия |
|
|
Нуклеотиды |
ионы Магния |
|
|
Коэнзим Q |
ионы Кальция |
|
|
ФАФС |
ионы Цинка |
|
|
SAM |
ионы Меди |
|
|
Глутатион |
ионы Железа |
|
|
Производные |
Функции: |
|
|
водорастворимых |
Стабилизация молекулы |
||
витаминов: PP, B1, B2, B12 |
субстрата |
|
|
Функция: |
Стабилизация активного |
||
промежуточные |
центра |
и |
структур |
переносчики атомов и |
энзима |
|
|
функциональных групп |
Обеспечение катализа |
||
Холофермент - каталитически активная форма сложного белка
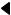
 Кофактор/кофермент
Кофактор/кофермент
4

МЕХАНИЗМ И КИНЕТИКА
Особенности действия ферментов:
 Ускорение только термодинамически возможных
Ускорение только термодинамически возможных
реакций  Ускорение достижение состояния равновесия
Ускорение достижение состояния равновесия
 Значительное ↑ скорости реакций
Значительное ↑ скорости реакций
 Действие в малых количествах
Действие в малых количествах
 Не расходуются в реакциях
Не расходуются в реакциях
 Активность ферментов регулируется как специфическими, так и неспецифическими факторами
Активность ферментов регулируется как специфическими, так и неспецифическими факторами  Действие только в мягких условиях (t = 36-37ºС,
Действие только в мягких условиях (t = 36-37ºС,
атмосферное давление)
 Обладание широким диапазоном действия, катализ
Обладание широким диапазоном действия, катализ
большинства реакций в организме
 Высоко специфичны
Высоко специфичны
Теории о механизмах действия ферментов:
 Теория специфичности действия фермента (модель ключ-замок): Геометрическая форма субстрата строго соответствует форме активного центра фермента
Теория специфичности действия фермента (модель ключ-замок): Геометрическая форма субстрата строго соответствует форме активного центра фермента
5

 Теория "индуцированного соответствия": Полное соответствие форм субстрата и активного центра наступает лишь в процессе их взаимодействия
Теория "индуцированного соответствия": Полное соответствие форм субстрата и активного центра наступает лишь в процессе их взаимодействия
 Теория переходных состояний (наиболее правильна
Теория переходных состояний (наиболее правильна
в современном представлении):
1.Фермент взаимодействует с субстратом, образуя
комплекс "энзим-субстрат"
2.В составе комплекса происходит изменение электронной плотности и пространственного строения и субстрат переходит в возбужденное состояние
3.↓ энергия активации → в активном центре происходит превращение субстрата в продукт реакции. Продукт реакции находится в возбужденном состоянии
4.Происходит стабилизация продукта
5.Продукт реакции отделяется от фермента
6
Влияние на скорость ферментативной реакции:
На скорость ферментативной реакции влияют:
1.Температура
2.pH
3.Концентрация фермента
4.Концентрация субстрата
1.Влияние температуры:
сток1 уча
у ча с т о к
2
36-38
Участок 1:
С ↑ температуры растет скорость реакции. Чем ↓ температура, тем ↑ значение энергетического барьера реакции.
Значение:сохранение биоматериала при ↓ температурах
Участок 2:
↓ активность до полной ее потери, так как происходит
необратимая денатурация Значение: термокоагуляция, прижигания
7
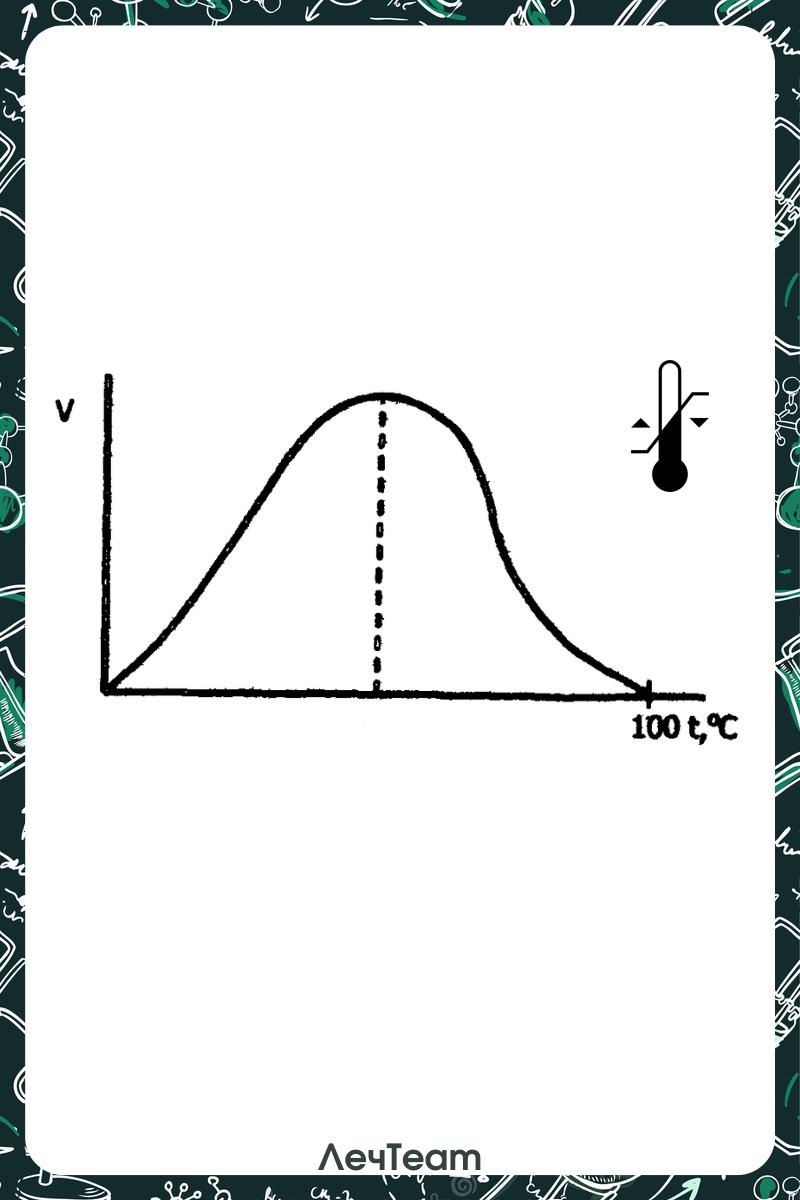
2. Влияние pH:
У каждого фермента свой уровень pH
Значение: стабилизация pH буферными системами, для поддержания гомеостаза
3. Влияние концентрации фермента:
Чем ↑ концентрация фермента, тем ↑ скорость реакции
8
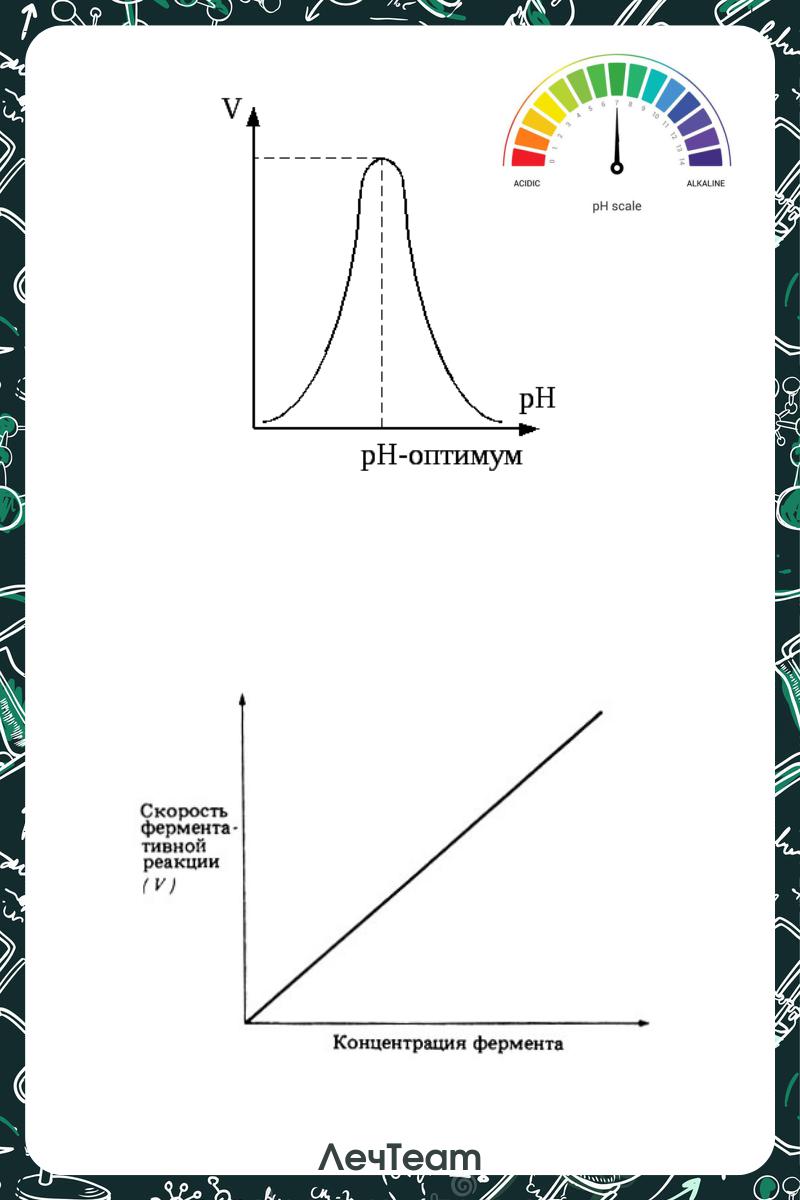
4.Влияние концентрации субстрата:
В 1913 году было предложено использовать константу Михаэлиса для оценки ферментативной активности:
Км= 1/2Vmax
Км - такая концентрация субстрата, при которой скорость реакции составляет 1/2 от Vmax
Чем ↑ константа Михаэлиса, тем ↓ скорость реакции
Скорость реакции
Концентрация субстрата
9
НОМЕНКЛАТУРА И КЛАССИФИКАЦИЯ
Номенклатура – это названия индивидуальных соединений, их групп, классов, а также правила составления этих названий.
Классификация – это группировка любых объектов по выбранным признакам.
Современная номенклатура ферментов – международная, переведенная на разные языки
Тривиальная |
|
Систематическая |
|
Названия сложились |
По |
названию |
можно |
исторически (пепсин, |
идентифицировать энзим |
||
трипсин) |
и |
катализируемую |
|
Рабочие названия: |
реакцию |
|
|
субстрат + "аза" |
В |
каждом |
классе |
субс. + хим. превр. |
название строится по |
||
+ "аза" |
определенному принципу |
||
В правилах названия ферментов нет единого подхода, так как в каждом классе - свои правила
10
