

Особенности классификации:
 Разделение ферментов на классы происходит на основании типа химической реакции (6 типов = 6 классов)
Разделение ферментов на классы происходит на основании типа химической реакции (6 типов = 6 классов)
1.Оксидоредуктазы
2.Трансферазы
3. |
Гидралазы |
6 классов |
4. |
Лиазы |
ферментов |
|
5.Изомеразы
6.Лигазы
 На основании субстратов, переносимых групп и т.п. энзимы разделяют на подклассы и подподклассы:
На основании субстратов, переносимых групп и т.п. энзимы разделяют на подклассы и подподклассы:
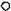 Оксидоредуктазы - 23 подкласса (основные 3)
Оксидоредуктазы - 23 подкласса (основные 3)
 Трансферазы - 10 подклассов (основные 5)
Трансферазы - 10 подклассов (основные 5)
 Гидралазы - 12 подклассов (основной 1)
Гидралазы - 12 подклассов (основной 1)
 Лиазы - 7 подклассов
Лиазы - 7 подклассов
 Изомеразы - 5 подклассов
Изомеразы - 5 подклассов  Лигазы - 6 подклассов
Лигазы - 6 подклассов
 У каждого фермента есть шифр КФ 1.1.1.1. Первая цифра обозначает класс, вторая - подкласс, третья - подподкласс, четвертая - порядковый номер фермента в его подподклассе (в порядке открытия)
У каждого фермента есть шифр КФ 1.1.1.1. Первая цифра обозначает класс, вторая - подкласс, третья - подподкласс, четвертая - порядковый номер фермента в его подподклассе (в порядке открытия)
Пример фермента:
Науч. название: АТФ:D–гексоза–6– фосфотрансфераза
Рабочее название: Гексокиназа
Класс: 2. Трансферазы Подкласс: 2.7.Переносящие фосфорсодержащие группы
Подподкласс: 2.7.1. Акцептор - спиртовая группа
Классификационный номер: КФ 2.7.1.1.
11

1.Оксидоредуктазы — всегда сложные белки
Функция: катализ* различных ОВР-реакций с участием
2 субстратов, т.е. перенос электронов или атомов Н с одного субстрата на другой
Подклассы:
1. Дегидрогеназы: реакции дегидрирования
2.Оксидазы: в реакциях акцептором** электронов является молекулярный кислород
3.Оксигеназы: в реакциях атом кислорода присоединяется к субстрату из молекулы кислорода
*Катализ - это процесс изменения скорости химической реакции при помощи катализаторов, в данном случае - ферментов **Акцептор - атом (или группа атомов), принимающий электроны.
Акцептор также предоставляет орбиталь для образования хим.связи.
12

2.Трансферазы — и простые, и сложные белки
Функция: катализ переноса функциональных групп от одного соединения-донора* к другому соединению-
акцептору
Виды: Аминотрансферазы, ацилтрансферазы, метилтрансферазы, гликозилтрансферазы, киназы – фосфотрансферазы
Примеры:
1)
2)
*Донор - атом, отдающий электроны для образования химической связи **АЛТ - Аланинаминотрансфераза: трансформирует аминокислоту аланин в пируват - основной продукт энергетического обмена клетки
13
3. Гидролазы - всегда простые белки
Функция: катализ реакций гидролиза - расщепления ковалентных связей с присоединением молекулы воды Специальные термины: эстеразы, фосфатазы (подкласс)
Примеры:
4. Лиазы — и простые, и сложные белки
Функция: катализ отщепления определенных групп (CO ; H O; —NH и т.д.) от субстратов негидролитическим
путем Пример:
14

5. Изомеразы — всегда сложные белки
Функция: катализ различных внутримолекулярных превращений, таких как взаимопревращения альдоз и кетоз, перемещения двойных связей внутри молекулы.
Когда изомеризация состоит во внутримолекулярном
переносе группы, фермент называют "мутазой"
Примеры:
1)
2)
3)
15

6. Лигазы (синтетазы) — всегда сложные белки
Функция: катализ реакций присоединения друг к другу двух молекул с образованием двойной связи.
Этот процесс сопряжен с разрывом фосфоэфирной связи в молекуле АТФ или макроэргических связей других соединений
Если источник энергии не АТФ, то ферменты называют
"синтазами"
Примеры:
1)
2)
16

ИЗОФЕРМЕНТЫ
Изоферменты — это множественные формы одного фермента, обладающие одинаковой специфичностью и катализирующие одну и ту же реакцию, но отличающиеся по физико-химическим свойствам Может отличаться сродство к субстрату. Чем больше
сродство, тем быстрее фермент узнает его и
происходит реакция
Функция: осуществление адаптации организма:
1.на разных стадиях жизни
2.при изменении физиологических условий
3.при развитии патологического процесса
Как правило, обладают четвертичной структурой
(2;4;6;8 - субъединиц)
Лактатдегидрогеназа (ЛДГ)
Фермент состоит из 4 субъединиц и представлен 2 различными третичными структурами.
Н-субъединица (heart) и M-субъединица (muscle)
1. |
ЛДГ-1 |
|
|
|
НННН |
|
|
|
Миокард и надпочечники |
|
|
|
|
|
|||||||
2. |
ЛДГ-2 |
|
|
|
НННМ |
|
|
|||
|
|
|
|
|
|
|||||
|
|
|
|
|
||||||
3. |
ЛДГ-3 |
|
|
|
ННММ |
|
|
|
Легкие, селезенка |
|
|
|
|
||||||||
|
|
|
|
|
|
|||||
4. |
ЛДГ-4 |
|
|
|
НМММ |
|
|
Скелетная мускулатура, печень |
||
|
|
|
|
|
||||||
5. |
ЛДГ-5 |
|
|
|
ММММ |
|
|
|||
|
|
|
|
|
||||||
|
|
|
|
|
|
|||||
Креатинфосфокиназа (КФК)
Состоит из 2 субъединиц: B-субъединица (brain) и M-
субъединица (muscle)
1.ММ - мышечная креатинкиназа
2.МВ - сердечная креатинкиназа
3.ВВ - нервная креатинкиназа
17

РЕГУЛЯЦИЯ АКТИВНОСТИ ФЕРМЕНТОВ
Ингибирование ферментативной реакции
Ингибирование — замедление ферментативной активности до полного ее прекращения Ингибитор — структурный аналог субстрата
В результате возникает конкуренция ингибитора и субстрата за активный центр фермента
 Конкурентное ингибирование: обратимое ↓ скорости реакции, вызванное ингибитором или пространственным аналогом
Конкурентное ингибирование: обратимое ↓ скорости реакции, вызванное ингибитором или пространственным аналогом
Конкурентный ингибитор повышает константу Михаэлиса для субстрата, следовательно, необходима бо́льшая концентрация субстрата для достижения Vмах 1/2
18

 Неконкурентное ингибирование: взаимодействие ингибитора с ферментом в участке, отличном от активного центра
Неконкурентное ингибирование: взаимодействие ингибитора с ферментом в участке, отличном от активного центра
Присоединение неконкурентного ингибитора вызывает
изменение конформации молекулы фермента, следовательно, нарушается взаимодействие субстрата с активным центром и падает скорость реакции
Происходит снижение Vmax ферментативной реакции и
уменьшение сродства субстрата к
ферменту, т.е. увеличением Кm
Вывод по ингибированию:
Конкурентное: постоянная Vmax, изменен Km Неконкурентное: постоянный Km, изменен Vmax
19

МЕХАНИЗМЫ
СПЕЦИФИЧЕСКОЙ
РЕГУЛЯЦИИ
Механизмы специфической регуляции каталитической активности ферментов
Аллостерическая |
Белок-белковое |
регуляция |
взаимодействие |
|
|
Регуляция через ковалентную модификацию
Путем |
Регуляция частичным |
|
(де)фосфорилирования |
||
протеолизом |
||
фермента |
||
|
Суть специфической регуляции: под действием специфических активаторов и ингибиторов изменяется активность регуляторных ферментов, которые контролируют интенсивность метаболических процессов в организме
20
