

ФЕРМЕНТЫ
ИЛЛЮСТРИРОВАННАЯ БИОХИМИЯ
(формулы, схемы, термины и алгоритм познавания предмета)
Учебное пособие для конспектирования лекций и самостоятельной подготовки к занятиям по биохимии
Тверь, 2018 г.
История энзимологии
—Реомюр и Л. Спалланцани (XVIII в.— изучение ферментов пищеварительных соков).
—К. С. Кирхгофф (Россия, 1814 г. — экстракты из солода, проросшего ячменя, способны осахаривать крахмал с превращением его в мальтозу).
—Л. Пастер (Франция, конец XIX в. — спиртовое брожение — результат обмена веществ в живых микроорганизмах).
—Д. Самнер и Д. Нортон (США, начало ХХ в. — впервые выделены ферменты в кристаллическом виде. Доказано, что ферменты – это белки).
—Л. Мехаэлис, М. Ментен (начало ХХ в. — теория ферментативной кинетики: при катализе образуется промежуточный фермент-субстратный комплекс).
Химическая природа ферментов (докажите, что это белки)
—молекулярная масса,
—денатурация,
—кристаллизация,
—электрофорез,
—диализ,
—высаливание,
—коллоидные свойства,
—специфичность действия,
—продукты гидролиза,
—искусственные ферменты (осуществлен синтез фермента рибонуклеазы).
Ферменты - простые и сложные белки
—используя схему, опишите химическую природу и структурную организацию составных частей энзимов и объясните их функции
|
ФЕРМЕНТ |
|
СЛОЖНЫЙ БЕЛОК |
ПРОСТОЙ БЕЛОК |
|
(ХОЛОФЕРМЕНТ) |
|
|
АПОФЕРМЕНТ |
КОФАКТОР |
|
МЕТАЛЛ |
КОФЕРМЕНТ |
|
НЕВИТАМИНЫЙ ВИТАМИНЫЙ
Классификация коферментов
Коферменты витаминной природы (после изучения коферментов впишите в таблицу витамин и дайте краткую характеристику биологической функции кофермента):
Название |
Витамин, входящий в |
Биологическая |
коферментов |
кофермент |
функция |
Тиаминовые |
|
|
|
|
|
Пантотеновые |
|
|
|
|
|
Никотинамидные |
|
|
|
|
|
Флавиновые |
|
|
|
|
|
Фолиевые |
|
|
|
|
|
Пиридоксиновые |
|
|
|
|
|
Кобамидные |
|
|
|
|
|
Биотиновые |
|
|
|
|
|
Липоевые |
|
|
|
|
|
Хиноновые |
|
|
|
|
|
Карнитиновые |
|
|
|
|
|
КОФЕРМЕНТЫ ВИТАМИННОЙ ПРИРОДЫ
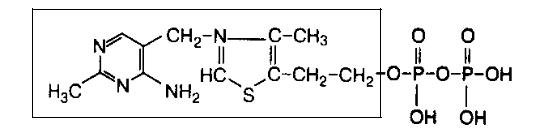
1. Тиаминовые коферменты (основа–витамин В1, тиамин; кофермент ТДФтиаминдифосфат):
Химическая структура ТДФ:
Выделите отдельные фрагменты этой структуры и покажите пиримидиновые и тиазоловые кольца, пирофосфат, витамин и кофермент.
Функции ТДФ (в составе энзимов участвует в окислительном декарбоксилировании α-кетокислот, в трансальдолазных и транскетолазных реакциях пентозофосфатного пути).
2
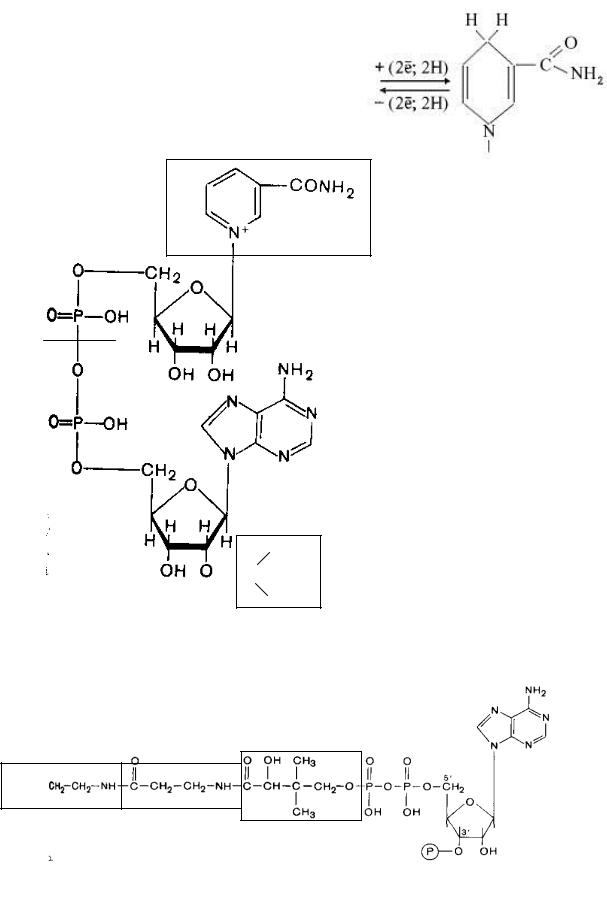
2. Никотинамидные коферменты (основа–витамин В5, РР, ниацин, никотинамид и АМФ; кофермент НАД(Ф)-никотинамидадениндинуклеотид(фосфат)):
Химическая структура НАД(Ф):
+
|
|
покажите витамин В5, АМФ. |
|
|
. |
|
|
энзимов участвует в окислительно- |
|
ОН |
|
|
— Р = О |
Ф) присоединяются е- и Н+ |
Различия в функциях НАД иОННАДФ (реакции катаболизма и анаболизма).
3.Пантотеновые коферменты (основа–витамин В3-пантотеновая кислота и АДФ;
кофермент – КоА-SН-коэнзим-А):
—Химическая структура Коэнзима А:
H - S -
3
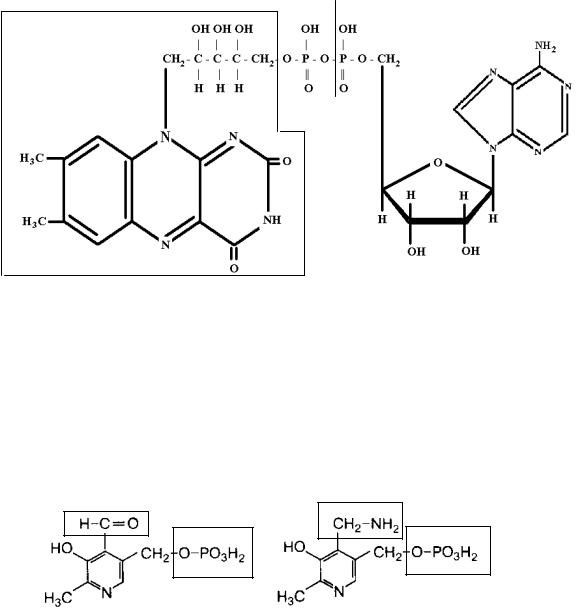
Выделите фрагменты в этой структуре и покажите: АДФ, пантотеновую кислоту, -аланил, α,γ-дигидрокси, β,β -диметилбутирил, тиоэтаноламин.
Назовите функции НS-КоА (в составе энзимов участвует в образовании ацил-КоА).
Покажите активную часть в структуре кофермента.
4.Флавиновые коферменты (витамин В2, рибофлавин)
Химическая структура ФАД и ФМН:
Дайте полное название ФМН и ФАД
Выделите в написанной структуре ФМН, ФАД. Покажите его фрагменты: витамин, изоаллоксазиновое кольцо, рибитол, АМФ).
Функции ФМН и ФАД (в составе энзимов участвует в окислительновосстановительных реакциях).
Покажите, куда присоединяются е- и Н+.
5.Пиридоксиновые коферменты (витамин В6, пиридоксин):
Химическая структура коферментов:
Покажите: витамин, кофермент.
Объясните названия написанных коферментов (пиридоксальфосфат, пиридоксаминфосфат)
Перечислите функции этих коферментов (в составе энзимов участвуют в реакциях трансаминирования и декарбоксилирования аминокислот).
4
6.Фолиевые коферменты (витамин В9, фолиевая кислота):
Химическая структура:
Н
Н
Н
Н
Дайте название написанной структуры (ТГФК).
Покажите фрагменты, входящие в эту структуру: птеридин, n- аминобензойная кислота и глутамат.
перечислите функции этого кофермента (в составе энзимов участвует в переносе одноуглеродных фрагментов – формильной –СНО, метильной –
СН3, метиленовой –СН2-, метенильной –СН=, оксиметильной –СН2ОН, формиминовой –СН=NН).
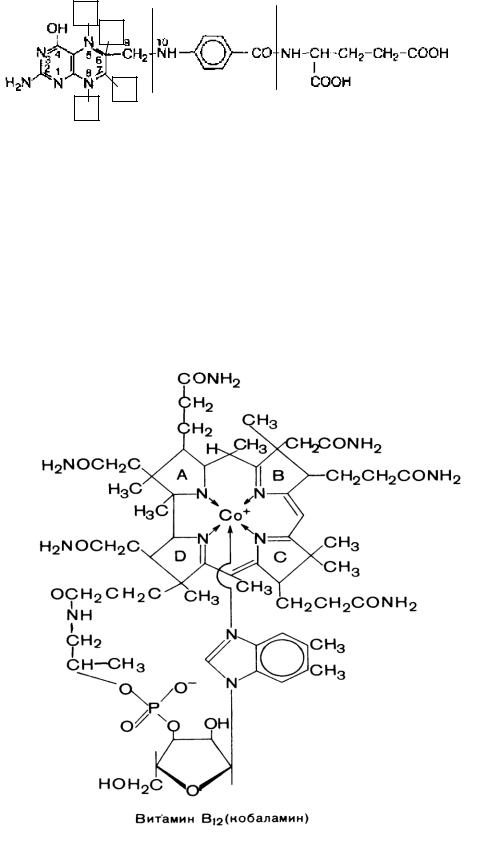
7.Кобамидные коферменты (витамин В12, кобаламин):
Химическая структура:
5

Покажите основные составляющие фрагменты молекулы: пирролльные кольца, корриновое ядро, центральный атом кобальта, нуклеотидный лиганд.
Кобамидные коферменты: метилкобаламин (СН3—В12), дезоксиаденозилкобаламин (дезоксиаденозил—В12). В чем их химическое различие?
Функции кобамидных коферментов - в составе энзимов участвуют в:
-реакциях трансметилирования (совместно с ТГФК):
этаноламин |
СН3—В12 |
холин |
|
|
|
|
|
||
- реакциях изомерации: |
|
|
|
|
ВЖК (нечет. ат. С) -окисление метилмалонил-КоА |
Дезоксиаде-сукцинил-КоА |
ЦТК |
||
|
|
нозил-В12 |
||
Факторы Касла (внешний – В12, внутренний – гастромукопротеид).
8.Биотиновые коферменты (витамин Н, биотин):
Химическая структура:
Покажите фрагменты, входящие в эту структуру: тиофен, мочевину, валериановую кислоту.
Функции биотиновых коферментов (в составе энзимов участвуют в реакциях карбоксилирования при биосинтезе глюкозы и ВЖК).
Объясните образование активной формы СО2 (карбоксибиотина).
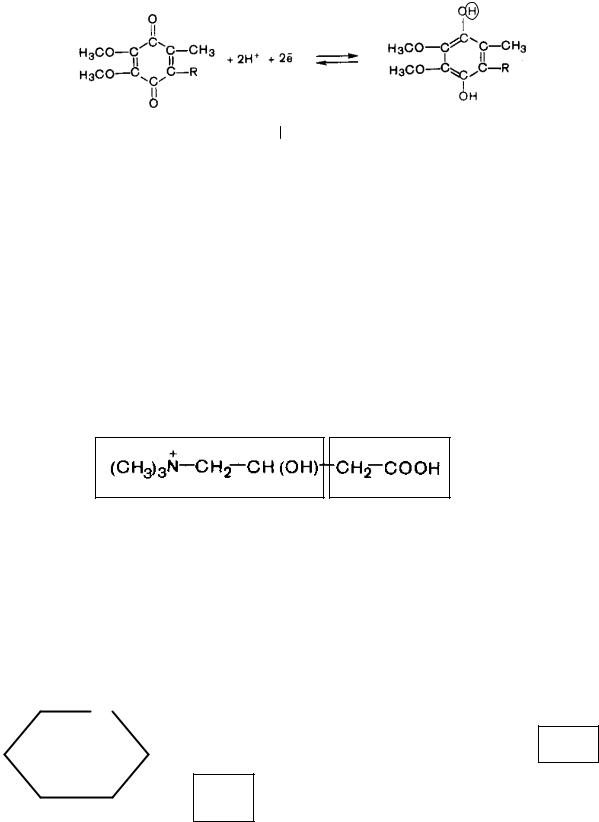
9.Липоевые коферменты (витамин N):
Химическая структура:
|
|
+ 2Н+ + 2е |
- |
|
|
|
|
||
S |
|
|
НS |
|
|
ЛК |
|
|
ЛК |
S |
|
|
НS |
|
Функции липоевых коферментов (в составе энзимов участвуют в окислительном декарбоксилировании α-кетокислот: пирувата до ацетил-КоА и α-кетоглутарата до сукцинил-КоА).
6
10.Хиноновые коферменты (убихинон, коэнзим-Q):
Химическая структура:
СН3
R = — (СН2 – СН = С – СН2)n – Н (изопрен, n= 6-10)
Покажите фрагменты, входящие в эту структуру (хинон и изопреновую цепь).
—Что обозначают Ко-Q6 и Ко-Q10?
Функции хиноновых коферментов - обязательный компонент дыхательной цепи:
коллектор электронов и протонов в дыхательной цепи
перенос 2е- на цитохромы
передача 2Н+ в митохондриальный матрикс
11.Карнитиновые коферменты (витамин Вт, карнитин):
Химическая структура:
Покажите основные компоненты, входящие в эту структуру (холин и ацетат).
Функции карнитиновых коферментов (в составе энзимов участвуют в переносе ВЖК через мембрану митохондрий).
КОФЕРМЕНТЫ НЕВИТАМИННОЙ ПРИРОДЫ
1. Нуклеотидные коферменты
|
|
НОСН2 |
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
||||
|
|
О |
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
Н |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
Н |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
| |
|
|
|||||||
|
Н |
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H3C – N - CH2 |
– CH2 |
– O – ЦДФ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
ОН |
|
Н |
|
|
|
|
|
|
|
|
|
| |
|
|
||
|
НО |
|
|
|
|
|
|
|
|
|
|
О |
|
|
|
УДФ |
CH3 |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Цитидиндифосфатхолин |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
Н |
ОН |
|
|
|
|
|
|
|
|
|
(ЦДФ-холин) |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Уридиндифосфатглюкоза
(УДФ-глюкоза)
7
2.Металлопорфириновые коферменты цитохромов
3.Пептидные коферменты: глутатион (Глу-Цис-Гли, см. раздел «Обмен белков»)
4.Дифосфаты моносахаридов
6
СН2ОРО3Н2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Н |
|
|
|
|
|
|
О |
|
|
|
|
|
|
|
|
||
СООН |
|
|
|
|
|
|
|
|
|
Н |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|2 |
|
|
|
|
|
Н |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
НС — О — РО3Н2 |
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|||
|
|
|
|
|
ОН |
|
|
|
|
|
|
|
|
||||||
|3 |
|
|
|
|
|
|
|
Н |
|
|
|
|
|
|
|
||||
Н2С — О — РО3Н2 |
|
НО |
|
|
|
|
|
|
|
|
|
|
О |
|
|
РО3Н2 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
2,3-дифосфоглицерат |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Н |
|
ОН |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Глюкозо-1,6-дифосфат
Опишите химическую структуру каждого кофермента.
Охарактеризуйте биологическую роль каждого кофермента
-перенос глюкозы в синтезе гликогена (УДФ-глюкоза),
-перенос холина в синтезе фосфатидилхолина (ЦДФ-холин),
-перенос электронов по дыхательной цепи (металлопорфириновые коферменты),
-является донором водорода в окислительно-восстановительных реакциях (глутатион),
-2,3-дифосфоглицерат — кофермент фосфоглицеромутазы, обеспечивает превращение 3-фосфоглицерат 2-фосфоглицерат,
-глюкозо-1,6-дифосфат — кофермент, обеспечивает превращения глюкозо-1-фосфат глюкозо-6-фосфат.
КОФАКТОРЫ ФЕРМЕНТОВ - ИОНЫ МЕТАЛЛОВ:
Na+, K+, Mg2+, Mn2+, Ca2+, Zn2+, Cu2+, Fe2+, Mo6+ и другие
Функции ионов металлов в ферментах:
-стабилизируют третичную и четвертичную структуры энзимов,
-входят в состав активного центра фермента и способствуют присоединению субстрата к активному центру,
-образуют с субстратом комплекс, на который действует энзим,
-выполняют коферментные функции:
Na+, K+, Mg2+, Ca2+ - входят в состав АТФ-аз, которые транспортируют соответствующие ионы,
Zn2+ - входит в состав угольной ангидразы (карбоангидразы), катализирующей биосинтез и распад угольной кислоты,
8
Ионы металлов с переменной валентностью (Fe2+, Cu2+) - входят в состав цитохромоксидаз и катализируют перенос электронов на кислород.
-Кофермент выступает в роли акцептора или донора химических группировок атомов, электронов.
-Апофермент обеспечивает специфичность действия энзима.
ОРГАНИЗАЦИЯ СТРУКТУРЫ ФЕРМЕНТА
Аллостерический
центр
Активный центр 
Первичная, вторичная, третичная, четвертичная структуры
апофермента (линейная последовательность аминокислот, преимущественно α-спираль, глобула, объединение субъединиц в олигомерную структуру)
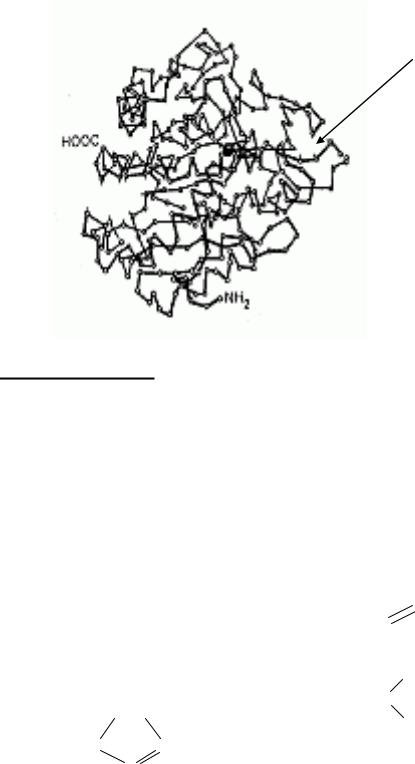
Активный центр фермента (уникальная комбинация функциональных групп аминокислотных остатков полипептидной цепи, обеспечивающая прикрепление субстрата и акт катализа):
-акцепторный участок,
-каталитический участок.
функциональные группы активного центра фермента (уникальная комбинация 12-16 радикалов аминокислот из различных участков полипептидной цепи):
Сер R—CН2— ОН |
О |
Глу — С
 О—
О—
Цис R—CН2— SН
Н
Гис R—CН2— С = СН |
Лиз — N+ — Н |
|
Н |
||
|
||
NН N: |
|
СН Гидрофобные группы Фен, Лей, Вал и др.
9
