

Лапки в лабке Ферменты как лекарства и яды
Ферменты – белковые катализаторы, обладающие всеми свойствами белков. Ферменты подчиняются общим законам катализа.
Для ферментов характерна
1. Специфичность – взаимодействие фермента с одним или несколькими субстратами по типу ключ к замку.
2.Каталитическая эффективность - ускоряют
реакции до 1014 раз.
3.Конформацмонная лабильность – способность изменять свою конформацию за счет разрыва одних и образования других слабых связей под действием внешних эффектов.
Простой фермент
Без присоединения кофактора
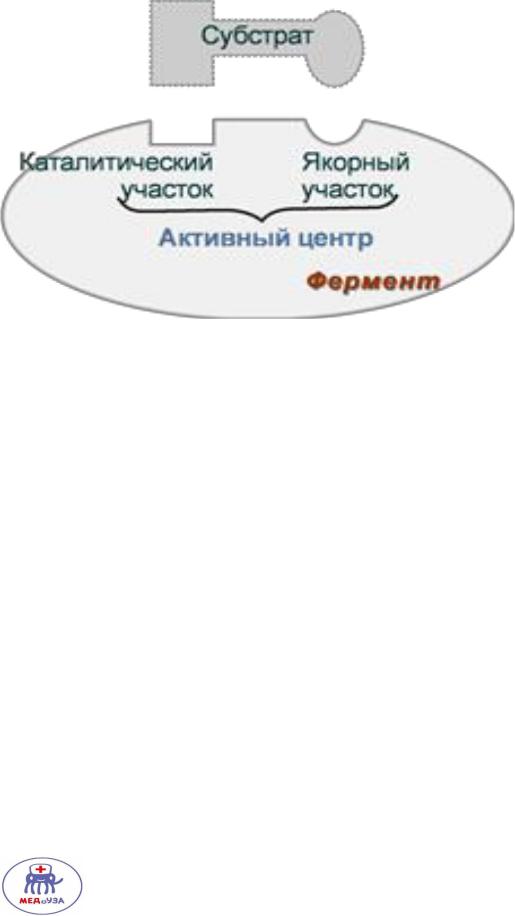
И в простых и в сложных ферментах выделяют два участка
1. Якорный участок – удерживает субстрат в активном центре
2.Каталитический участок – катализирует субстрат.
Сложный фермент
Фермент с кофактором в активном центре, кофактор довершает формирование активного центра фермента.

Ферменты как факторы патогенности бактерий
Helicobacter pylori – грамм отрицательная бактерия, возбудитель гастрита типа Б.
Обладает ферментом – уреазой, ускоряющий распад мочевины в 1013 раз.
Образуя аммиак в желудке, бактерия защищает себя от кислой среды, нейтрализуя соляную кислоту.
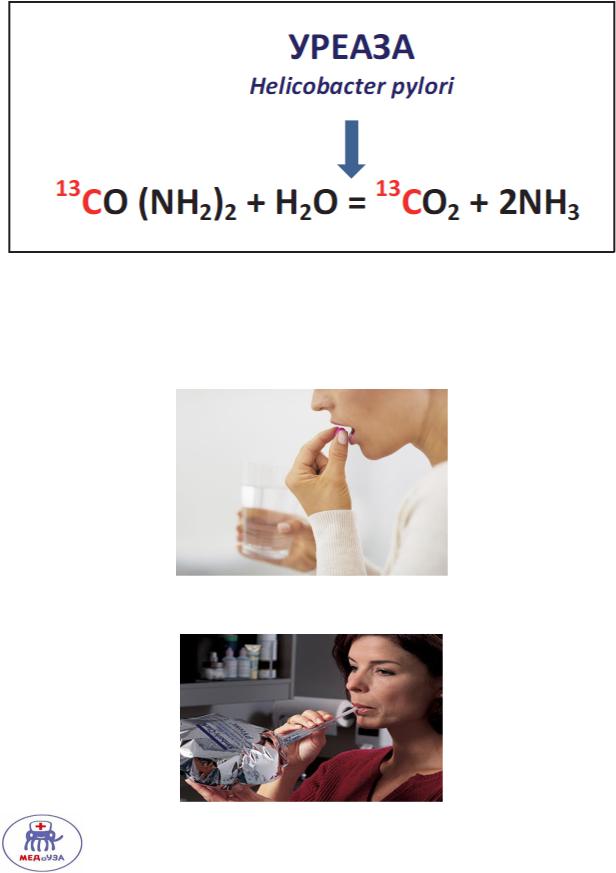
Урезанный тест основан на способности уреазы бактерии разрушать мочевину
Меченный углерод С13 выводится с СО2 и фиксируется прибором.
На основании наличия С13 подтверждают гастрит типа Б.
Оптимальные условия для функционирования ферментов
РН = 6,9 – 7,7
Температура = 37-38 градусов
Давление = 100 к.Па = 760 мм.рт.ст.
Ферментативный катализ
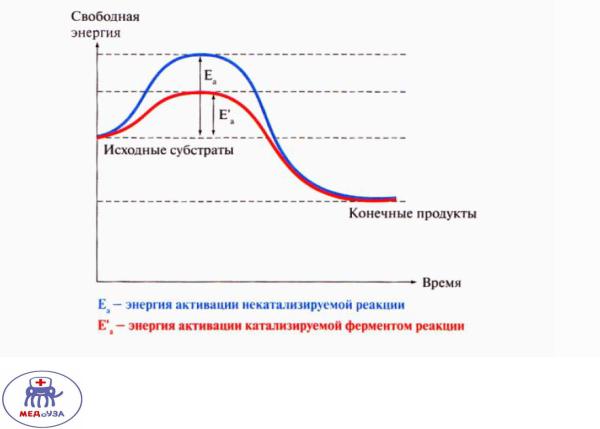
Для вступления в химическую реакцию вещества должны преодолеть энергетический барьер. Величина энергетического барьера равна энергии активации(Еа).
Ферменты снижают энергию активации (соответственно меньше энергии нужно передать веществам для вступления этих веществ в реакцию).
Этапы ферментативного катализа
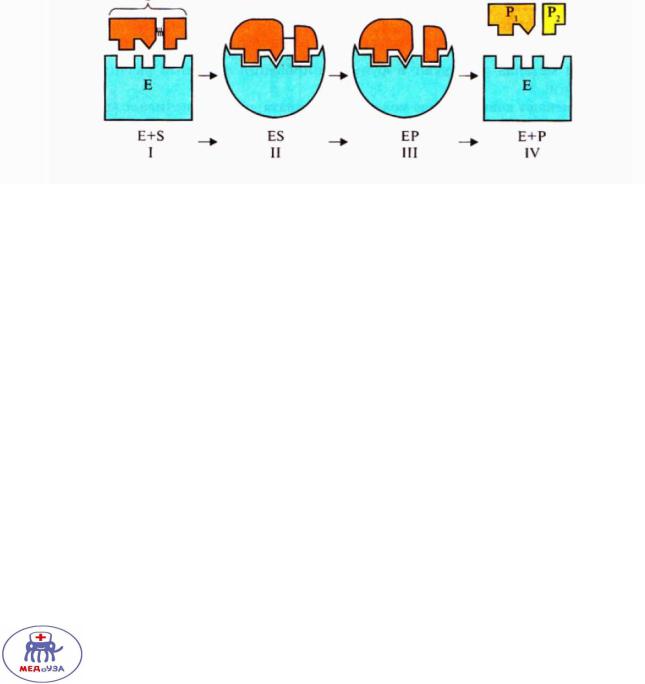
1. Сближение субстрата и фермента.
2.Образование фермент – субстратного комплекса.
3.Образование нестабильного комплекса фермент-продукт.
4.Высвобождение продукта.
Кинетика ферментативного катализа
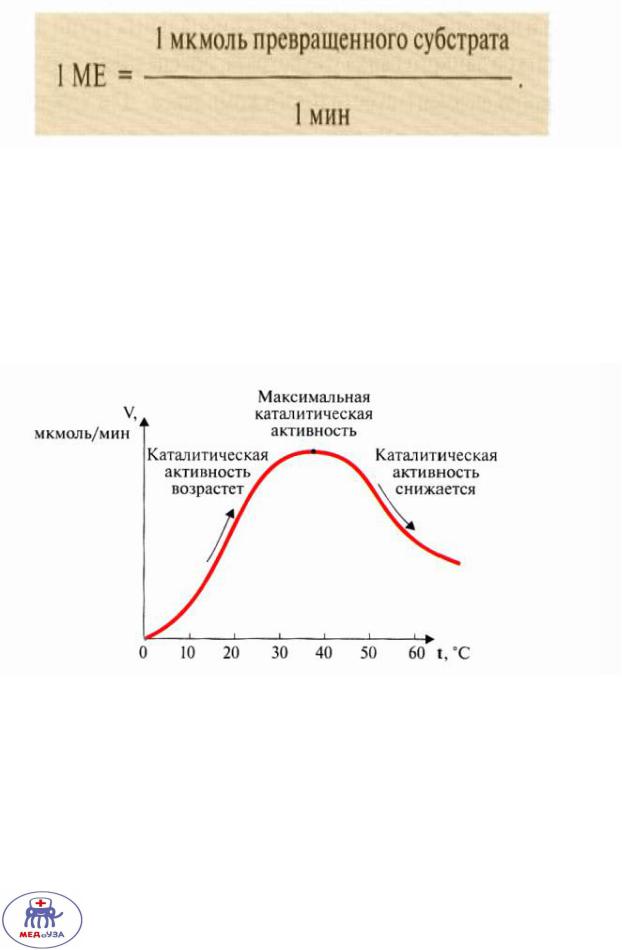
Международную единицу активности используют для оценки скорости ферментативной реакции.
Зависимость скорости реакции от температуры
До 38 градусов скорость реакции возрастает, после 38 начинается денатурация ферментов и скорость химической реакции начинает постепенно падать.
Зависимость скорости реакции от кислотности среды
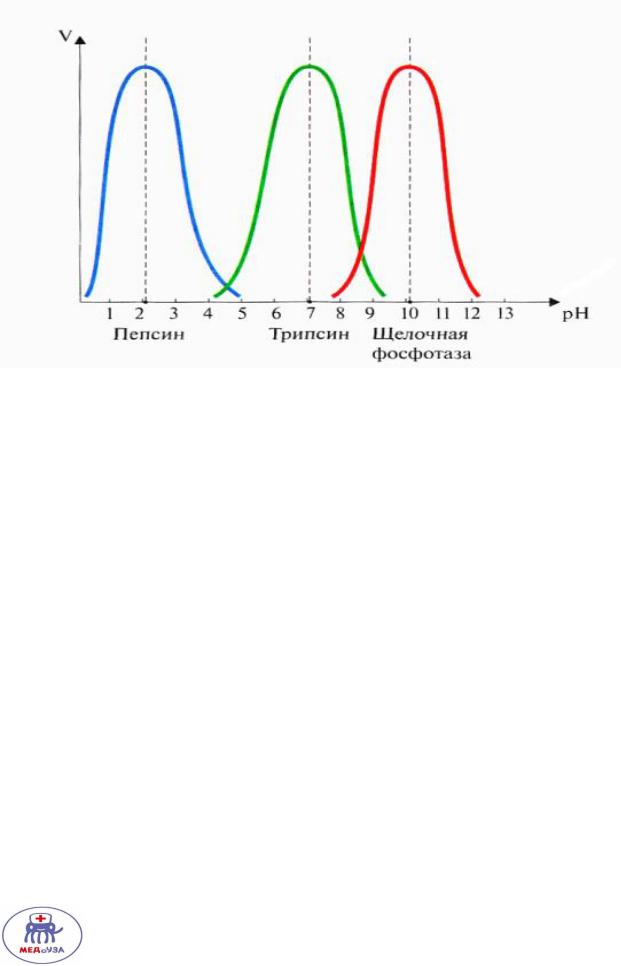
У многих ферментов свой оптимум РН , в зависимости от отрицательно и положительно заряженных аминокислот в строении фермента.
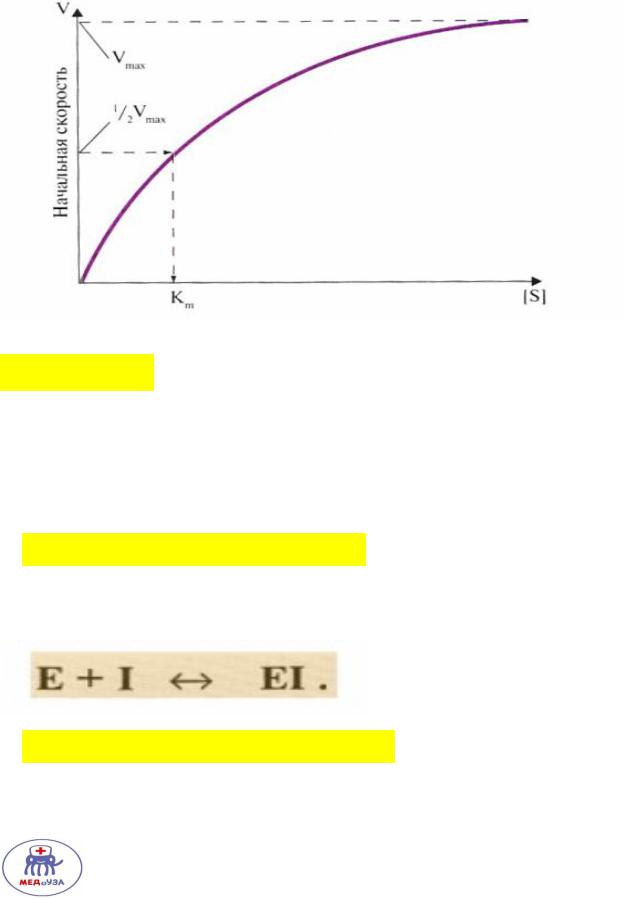
От концентрации реагирующих веществ
При добавлении субстрата происходит увеличение скорости реакции. Однако, когда весь фермент связался с субстратом, добавление нового субстрата не увеличить скорость реакции.
Константа Михаэлиса – равна концентрации субстрата, при которой достигается половина максимальной скорости. Чем ниже константа Михаелеса – тем выше сродство фермента к субстрату.
Ингибиторы активности ферментов
Ингибиторы – вещества, подавляющие
активность фермента
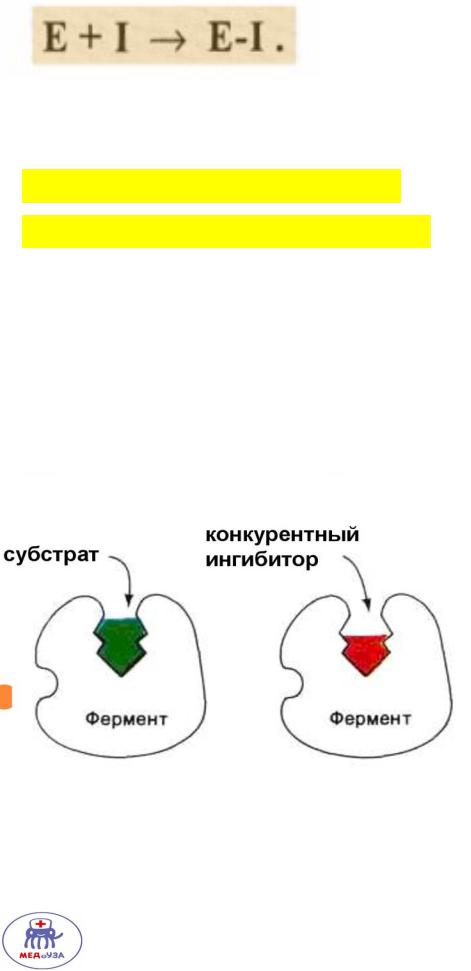
По прочности связывания различают:
1.Обратимое ингибирование – ингибиторы связываются с ферментом слабыми нековалентными связями.
2.Необратимое ингибирование - ингибиторы связываются с ферментом прочными ковалентными связями.
По механизму действия обратимое ингибирование делится на:
1.Конкурентное ингибирование
2.Неконкурентное ингибирование
1)Конкурентное обратимое ингибирование –
конкуренция молекул субстрата и ингибитора за активный центр. Ингибитор – структурный аналог субстрата.
2.Неконкурентное обратимое ингибирование –
ингибитор не является структурным аналогом субстрата, присоединяется не в активном центре.
