
1. Регуляция местного кровотока
а) Электролитные изменения в клетках эндотелия, эластических и мышечных волокнах оказывают влияние на базальный тонус сосудов.
Накопление Nа внутри клеток эндотелия и отек их (с увеличением высоты клеток направленным внутрь сосуда) уменьшают внутренний диаметр сосуда, величину кровотока, увеличивают сосудистое сопротивление. Направление Mg в мышечных волокнах и вытеснение им Са в соответствии с законом Шайна
 уменьшает
напряжение мышечных волокон,
сопротивление сосудов, увеличивает
их внутренний диаметр, кровоток.
уменьшает
напряжение мышечных волокон,
сопротивление сосудов, увеличивает
их внутренний диаметр, кровоток.
б) Метаболические факторы: АТФ, АДФ, АМФ, особенно аденозин и молочная кислота, а также накопление Н+ оказывают выраженное местное сосудорасширяющее действие.
2. Нейрогуморальная регуляция.
При этой регуляции импульсы с афферентных волокон на эфферентные переключаются в сосудодвигательных центрах продолговатого мозга.
С этим видом регуляции связывают:
- механизмы кратковременного действия;
- механизмы промежуточного действия;
- механизмы длительного действия.
1) К механизмам кратковременного действия относят:
а) барорецепторные рефлексы;
б) хеморецепторные рефлексы:
в) рефлекс на ишемию ЦНС.
Все эти рефлексы могут реализовываться в течение нескольких секунд. Однако при постоянном раздражении (в течение нескольких дней) они либо полностью исчезают (барорецепторные рефлексы), либо ослабевают (хеморецепторные рефлексы, рефлекс на ишемию ЦНС).
Барорецепторные рефлексы.
А) Это рефлексы с аорты и ее верхних ветвей.
Рецепторы, активизирующие эти рефлексы, расположены в стенке дуги аорты (связаны с левым депрессорным нервом), плечеголовного ствола и общих сонных артерий (связаны с правым и левым депрессорным нервом), в каротидном синусе (связаны с правым и левым синокаротидным нервом).
Депрессорные нервы связаны с Х парой, а синокаротидные нервы с IX парой черепно-мозговых нервов.
Рецепторы возбуждаются при увеличении напряжения и растяжения стенки сосуда при повышении внутрисосудистого давления или механическом воздействии (хирургические манипуляции). Частота импульсов с этих рецепторов прямо пропорциональна изменению систолического артериального давления (САД) от 80 до 180 ммНg. Импульсы поступают к сосудодвигательному и кардио-депрессному центрам. При этом тормозятся симпатические и возбуждаются парасимпатические центры, уменьшается сужение сосудов преимущественно скелетных мышц, а также сила и частота сердечных сокращений.
Барорецепторы обладают свойством адаптироваться к повышенному давлению. Однако при этом их функция не нарушается, то есть при еще большем повышении давления они реагируют, по окончанию их раздражения давление возвращается не на исходный, а на предыдущий, уровень и т.д.
Б) Это рефлексы с крупных вен и предсердий.
Рецепторы расположены в стенке около устья вен и в стенке обоих предсердий. Различают два типа рецепторов:
- А-типа возбуждаются при сокращении предсердий и усиливают влияние симпатического отдела нервной системы. При усилении напряжения и растяжения стенки предсердия, обусловленные его перегрузкой объемом крови, при сокращении предсердия часто (но не всегда) возникает приступ тахикардии - рефлекс Бейнбриджа.
- В-типа возбуждаются при чрезмерном растяжении предсердия до начала его сокращения. При этом усиливается влияние парасимпатического отдела сосудодвигательного центра, которое приводит к брадикардии. Одновременно с ней (особенность реакции) возникает сужение сосудов почек. Кроме всего этого, раздражение рецепторов крупных вен и предсердий через центры осморегуляции в гипоталамусе уменьшает секрецию гормона вазопрессина.
Рефлексы с артериальных хеморецепторов.
Они расположены в дуге аорты, синокаротидных зонах. Их раздражителями являются снижение напряжения кислорода в артериальной крови (РаО2) и повышение напряжения углекислоты (РаСО2) или увеличение концентрации Н+ в артериальной крови. От этих рецепторов импульсы поступают и в сосудодвигательный, и в дыхательный центры в продолговатом мозге. В итоге возникают прямо противоположные реакции. Если исключить влияние изменения механики дыхания на кровообращение посредством ИВЛ, то возбуждение хеморецепторов приводит к сужению сосудов и уменьшению ЧСС.
При этом эффект сужения сосудов преобладает над эффектом уменьшения ЧСС.
Реакция на ишемию ЦНС
Заключается в возбуждении сосудодвигательного центра продолговатого мозга. Она сопровождается сужением сосудов и повышением АД. Она возникает при снижении кровоснабжения головного мозга, нарушениях при сосудистой патологии головного мозга, при снижении содержания кислорода в артериальной крови и повышении содержания СО2 и Н+.
При этом повышение содержания СО2 и Н+ возбуждает центры продолговатого мозга либо через ретикулярную формацию, либо путем раздражения внеклеточно расположенными Н+ хеморецепторов поверхности ствола мозга (увеличение кислотности ликвора). Эта реакция (по наблюдениям у пилотов) кратковременна и быстро становится не эффективной при не устранении причины.
2). К механизмам промежуточного действия относят:
а) Изменения транскапиллярного обмена;
б) Реакцию ренин-ангиотензивной системы;
в) Релаксацию напряжения.
Последнее мало известно врачам.
Различают прямую релаксацию напряжения. Суть её состоит в следующем: при внезапном увеличении объёма крови в сосуде, давление крови вначале резко повышается. При этом эластические волокна сосуда растягиваются, а мышечные волокна сокращаются. Затем, хотя объём крови в сосуде не изменяется и эластические волокна остаются в прежнем состоянии, мышечные волокна расслабляются, приводя свой тонус в соответствие со степенью растяжения эластических волокон. Давление в сосуде понижается.
Различают обратную релаксацию напряжения. При внезапном снижении объёма крови в сосуде давление крови вначале резко понижается. При этом усиливается напряжение эластических волокон сосуда, а мышечные волокна расслабляются. Затем хотя объём крови в сосуде не изменяется и эластические волокна остаются в прежнем состоянии, мышечные волокна сокращаются, приводя свой тонус в соответствие со степенью напряжения эластических волокон. Давление в сосуде повышается.
3). Механизмы длительного действия касаются регуляции связи: внутрисосудистый объём - ёмкость сосудистой системы - внеклеточный объём жидкости. Эта сложная регуляция осуществляется посредством:
а) почечной регуляции объема жидкости;
б) вазопрессина;
в) альдостерона.
В центральной регуляции кровообращения выделяют три уровня регуляции:
1. Стволовые "центры".
В ретикулярной формации продолговатого мозга, бульбарных отделах моста имеются образования, объединяющиеся в так называемые медуллярные и ромбэнцефальные центры. От них начинаются симпатические сосудосуживающие, сердечные положительно хроно- и инотропные нервы. Здесь же берёт начало блуждающий нерв.
2. "Центры" гипоталамуса.
В каудальных отделах "эрготропные зоны". Раздражение сопровождается ↑ АД, ↑ ЧСС, ↑ СВ, ↑ активности других отделов ЦНС, вызывающих "состояние тревоги" (возбуждение и настороженность) и в крайних случаях - ярость, агрессию, страх.
В ростральных отделах располагаются "трофотропные зоны". Раздражение сопровождается торможением сердечно-сосудистой системы и реакциями внутренних органов, способствующими восстановлению организма (потребление и переваривание пищи, активизируются меридианы: желудка - поджелудочной железы - селезенки, тонкого кишечника - сердца, печени - желчного пузыря).
3. Влияние коры.
Здесь две области:
А. Палеокортекс: медиальные поверхности полушарий и базальные поверхности лобных и теменных долей. Их раздражение вызывает разнонаправленные сердечно-сосудистые реакции (прессорные, депрессорные).
Б. Неокортекс: наружная поверхность полушарий, особенно премоторная и моторная зоны. Их раздражение вызывает также разнонаправленные сердечно-
сосудистые реакции (прессорные, депрессорные). Преимущественно прессорные. При раздражении двигательных зон возникает "состояние тревоги", но без аффективных проявлений (без ярости, агрессии, страха). В целом исследования центральной регуляции кровообращения труднодоступны, поэтому мало изучены.
Определение показателей центральной гемодинамики
Чтобы определить величину ИПК и ИПО2 необходимо знать величину сердечного индекса (СИ). Чтобы знать величину СИ, надо определить величину СВ (т.е. МСВ) или УО (УСВ). К настоящему времени предложено более 30 методов определения величины СВ или УО. Из них наиболее главными считаются следующие:
1. Основан на принципе A.Fick. Метод, основанный на принципе или гемодинамическом законе A.Fick исторически признан эталонным. Для специальности анестезия и интенсивная терапия методически он ценен тем, что его можно многократно использовать у одного и того же больного. Однако практически он пока считается достаточно трудоёмким.
2. Метод гемодилюции, предложенный W.F.Hamilton в 1928 г. Мало пригоден для отделения интенсивной терапии, так как обладает эффектом накопления вводимого в вену вещества (краситель), поэтому при повторном использовании метода у того же больного еще не выведенная часть вещества будет влиять на точность измерения. Разновидностью этого метода является радиологический метод.
3. Метод термодилюции, предложенный в 1968г. M.A.Brauthweite, K.D.Bredley и усовершенствованный в 1971-1972 гг. W.Ganz, H.Swan. Это инвазивный метод, требующий введения многоканального катетера так, чтобы окончание одного канала было в полости правого предсердия, а другого (с высокоточным термистором в конце) - в легочной артерии. Кроме специального катетера в комплекс входит прибор, регистрирующий изменение температуры крови после введения "навески" раствора в правое предсердие, и рассчитывающий величину СВ. Метод многократный, так как не обладает эффектом накопления. При соблюдении технологии использования достаточно точный, по сравнению с методом, основанным на принципе A.Fick. Но требует определенных умений, пока всё ещё дорогостоящий, немаловажно и то, что он инвазивный. В целом он считается опасным и неприемлимым для большинства больниц.
4. Электрофизиологические методы: эхо-кардиографический, доплер-кардиографический, импедансный или реографический. В этой группе методов наибольшей точностью обладает реографический. Он наименее дорогостоящий, неинвазивный, его можно использовать многократно у одного и того же больного. Этот метод доступен для отделения интенсивной терапии больницы любой мощности. Даже в США, где наибольшее распространение получил метод термодилюции, начинает обосновываться предпочтение импедансному методу.
Этим методом можно определить УО с ошибкой не более 10%, что приемлемо для клиники. Следует отметить, что один их наиболее распространенных методов (термодилюции) позволяет определить величину СВ, второй (импедансный или реографический) - величину УО. Исходя из их величин можно получить величины других показателей центральной гемодинамики, которые именуются производными от СВ или от УО.
Итак, посредством ипедансного метода определили величину УО в см3. Далее можно определить величины следующих показателей.
СВ (МСВ) = УО * ЧСС в см3/мин.
Этот показатель принято описывать в л/мин (после деления произведения на 1000). Надо отметить, что этот классический показатель сам по себе не обладает достаточной информативностью (рисунок 6)

Рисунок 6 - Информативность МСВ (СВ).
Из рисунка видно, что при нормальных величинах ЧСС (Х1) и УСВ (УО) (У1) мы имеем нормальную величину СВ (это площадь прямоугольника). Такую же площадь прямоугольника (такую же величину СВ) можно получить при брадикардии (Х2) с увеличенным УО (У2) и при выраженной тахикардии (Х3) со сниженным УО (У3). Все это качественно различные состояния организма, хотя во всех случаях СВ одинаков (площади всех трёх прямоугольников равны друг другу).
Из СВ исходит другой показатель – объёмный поток крови (ОПК):
ОПК = СВ см3/мин / 60 с в см3/с
Видимо не совсем полная удовлетворенность МСВ заставила клиницистов ввести (Kirklin, 1948 г.) другой показатель - СИ.
СИ = СВ / S в л/мин/м2
где S - площадь тела человека в м2, ее можно определить по номограмме Дюбуа или Оркина, можно вычислить: S = m 0,423 * l 0,725 * 0,007184 (где: m - масса тела человека в кг., l - рост человека в м.).
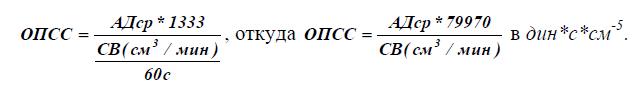
Где АДср или СДД – среднединамическое давление определяется как 1/3*(САД-ДАД)+ДАД).
В соответствии с уравнением Л.З. Полонецкого (1985 г.) можно определить давление наполнения левого желудочка.
ДНЛЖ = 742 * Тр - 19 в мм Hg,
где: Тр - период расслабления левого желудочка в секунду (определяется из реограммы).
В.И.Лищук в соответствии с уравнениями Е.Старлинга ввел такие показатели, как насосный коэффициент (НК) левого (НКл) и правого (НКп) желудочков для характеристики производительности каждого желудочка как насоса.
НКл = СИ / ДНЛЖ *10 в Г*см/с.
Аналогично можно получить приближенное к классическому виду уравнение:
НКп = СИ / ЦВД *10 в Г*см/с.
В связи с тем, что известна величина СИ и, следовательно, величина ИПО2, становится возможным объективно определить энергетические возможности больного (ЭВБ), исходя из величины его аэробных способностей (ИПО2): ЭВБ = 7,2 * ИПО2 * S в ккал/сут.
Дело в том, что тяжелым больным с целью обеспечения их энергией назначаются средства, имеющие соответствующую калорическую ценность (глюкоза и т.д.). При их назначении обычно исходят из того, что в условиях основного обмена (то есть когда человек в покое и не выполняет никакой физической нагрузки) энергетические потребности организма (в среднем) составляют приблизительно 1800-2000 ккал/сут. В соответствии с этим подбирается количество и состав "питательных" растворов, которые вводятся больному в вену или через зонд в желудочно-кишечный тракт. Все это правильно, но с затаившейся ошибкой. Назначенные растворы являются всего лишь энергоносителями и не более. Чтобы из энергоносителя получить энергию, энергоноситель надо окислить (сжечь). Однако никто не определяет и не вычисляет: хватит ли фактически потребляемого больным кислорода на окисление
назначенного количества энергоносителей? Если количество назначенных энергоносителей будет избыточным, то организм постарается в лучшем случае вывести избыточную часть энергоносителей. В худшем случае введенные энергоносители из-за недостатка окислителя (кислорода) окислятся до промежуточных продуктов. А это, как правило, кислоты. Они и становятся дополнительной причиной метаболического ацидоза у больного. Из этого можно сделать очень важный вывод: при гипоксемии энтеральное или особенно парэнтеральное питание неэффективно и может наносить вред!
Варианты кровообращения
Принято классифицировать варианты центральной гемодинамики исходя из величины СИ и ОПСС. Используя наиболее удачное название каждого варианта, приводим эту классификацию.
Вариант центральной гемодинамики |
СИ в л/мин/м2 |
ОПСС дин*с*см-5 |
Гиперциркуляторный Нормоциркуляторный Гипоциркуляторный |
>4 3 - 4 <3 |
↓ нормы
1200-1700 ↑ нормы |
В более поздних публикациях часто используются другие названия этих вариантов кровообращения – гиперкинетический, нормо- или эукинетический и гипокинетический.
В некоторых клинических ситуациях, в зависимости от эффективности работы сердца, могут наблюдаться неклассические варианты кровообращения.
Например, при гипертоническом кризе – при первичном повышении ОПСС и достаточной мощности сердца, СИ может быть нормальным или повышенным.
Однако, будет иметь место гипоперфузия – гипоциркуляция с повышенной постнагрузкой и, по нашему мнению, такой вариант кровообращения следует относить к гипоциркуляторному. Поэтому и термины «–кинетический» не совсем соответствуют предлагаемой классификации.
Клиническая диагностика вариантов кровообращения
Для врача чрезвычайно важно дифференцировать вариант кровообращения у тяжёлого больного. Однако не всегда и не везде есть возможность определения параметров ЦГ. Поэтому очень важно уметь по клиническим признакам определить состояние кровообращения.
Очень просто написать, что у больного есть сердечно-сосудистая недостаточность (более точно – дисфункция), сложнее обосновать это утверждение, оценить степень компенсации и уточнить что превалирует – сердечная или сосудистая недостаточность (дисфункция). Термин дисфункция более применим в практике интенсивной терапии, т.к. гипертонический криз нелогично называть недостаточностью, хотя он и приводит к её развитию.
Клинические признаки дисфункции сердечно-сосудистой системы: - Предположить наличие сердечно-сосудистой дисфункции можно, в первую очередь, на основании ненормальных АД, ЧСС, ЦВД. Однако нормальные величины этих показателей могут быть и при наличии скрытых – ещё компенсированных нарушений. - Состояние кожных покровов – холодные или горячие - являются признаком изменённого сосудистого тонуса. - Диурез – снижение или повышение мочеотделения также могут быть признаком дисфункции кровообращения. - Наличие отеков и влажных хрипов в лёгких. Функциональные показатели для оценки состояния кровообращения. - Физиологический прирост АД к ЧСС – в норме зависимость величины САД от ЧСС отражается следующим уравнением:
САД = ЧСС + 40(±10)
Это значит, что при ЧСС 80 в минуту САД должно быть от 110 до 130 мм рт.ст.
Соответственно при ЧСС 120 в минуту САД должно быть как минимум 150 мм рт.ст. - Индексы кровообращения (индексы Туркина). Первый из них определяется отношением СДД и ЧСС. Если это отношение равно 1 или близко к 1 (0,9-1,1), то СВ в норме. Второй определяется отношением СДД в мм рт.ст и ЦВД в мм вод.ст. Если это отношение равно 1 или близко к 1 (0,9-1,1), то артериальные и
венозные потоки крови равны.
Исходя из этих положений можно выявить, и на основании имеющихся данных необходимо попытаться диферинцировать вид дисфункции сердечно- сосудистой системы. Главное попытаться, а не просто констатировать клинические данные.
Гипоциркуляторный вариант кровообращения
Наиболее распространённый в практике интенсивной терапии. Характерен для «холодных» шоков (централизация), потерь жидкости, сердечной недостаточности, стресса. Опасен повышенной постнагрузкой и увеличением потребности в кислороде сердца. Клинически может проявляться отсутствием прироста САД к ЧСС при холодных кожных покровах. При этом САД может быть нормальным или сниженным, обычно на фоне тахикардии.
При гипертоническом кризе и высоком АД, кожные покровы могут быть и тёплыми.
Опасность этого варианта кровообращения не только в дисбалансе между высокой нагрузкой на сердце и его возможностями (у больных с скомпроментированным сердцем возможна декомпенсация), но и в том, что при гиперкоагуляции и длительном периоде централизации возможен необратимый блок микроциркуляции – патогенетическая основа развития полиорганной недостаточности.
Уровень САД можно считать критерием наличия или отсутствия сердечной недостаточности: если при повышенной постнагрузке (ОПСС>1700) и холодных кожных покровах отсутствует физиологический прирост САД к ЧСС, то однозначно имеет место сердечная недостаточность – сердце не способно продавливать кровь через спазмированную периферию с достаточной силой. Подтверждением наличия сердечной недостаточности является нормальное или повышенное ЦВД.
Если сердце способно прокачать повышенную постнагрузку, то САД повышено (гипертонический криз) и потребность миокарда в кислороде высокая. Величина ЦВД будет зависеть от ЧСС и волемии. При тахикардии нормальное или повышенное ЦВД сигнализирует о скорой декомпенсации.
Особенно «опасны» больные, имеющие отеки и нарушения ВСО. При контроле сатурации плетизмограмма имеет низкую амплитуду, особенно при низком АД.
В любом случае – первоочередная задача врача – устранить причину повышенной постнагрузки и нормализовать ОПСС - снизить его, используя вазодилятаторы: изокет, магнезию, β-блокаторы, ганглиоблокаторы.
Применение вазодилятаторов на фоне низкого давления выглядит «не логичным и опасным». Но в этом есть патогенетическая логика – уменьшить нагрузку и дать сердцу развить возможную мощность, так же как логично разгрузить машину, чтобы она заехала на гору. Необходимо понимать, что при гипоциркуляции (и так повышенном ОПСС) введение вазопрессоров с целью поднять давление – кривая и тупая «логика», свойственная безграмотным врачам, не знающим патофизиологию. При такой тактике машину еще больше загружают, что неизбежно приводит к перегреву и остановке двигателя, его поломке, а применительно к сердцу – к смерти больного.
Для уточнения наличия этого варианта нарушения кровообращения можно провести пробу с магнезией или изокетом. Магнезию (при отсутствии противопоказаний – см.инструкцию по применению) вводят в количестве 5-10 мл болюсно в/в, контролируя ЧСС и АД. Изокет – 0,5мл 0,1% р-ра разводят до 20 мл физ.р-ром и вводят в/в 0,5-1мл под контролем ЧСС и АД. Проба считается положительной, если на фоне введения магнезии или изокета ЧСС уменьшается, а АД приближается к норме – исходно сниженное поднимается, а исходно повышенное снижается, улучшается состояние и кожных покровов.
На фоне стресса обязательно применение седативных или обезболивающих препаратов. При отсутствии артериальной гипертензии обязательно введение кардиотоника – дофамина в почечной или кардиотонической дозировке. Мочегонные препараты только при признаках гипергидратации – при наличии отёков и гемодилюции, и то после снижения постнагрузки и стабилизации АД. Очень частая ошибка терапевтов и невропатологов – применение мочегонных при ОКС, гипертонических кризах и инсультах на фоне гемоконцентрации – данная тактика только ухудшает состояние больных за счёт ухудшения реологии крови и свидетельствует о полном непонимании патогенеза критических состояний.
Вопрос о необходимости объемной инфузии решают, ориентируясь на:
- наличие потерь жидкости или крови (плазмы), особенно острых-быстрых, предшествующих развитию критического состояния;
- комплексные признаки дегидратации – гемоконцентрация, снижение тургора и сухость кожных покровов, языка;
- низкое ЦВД или его снижение после начала вазодилятационной терапии;
- снижение артерио-венозной разницы по кислороду и увеличение лактата за счет нарушения капиллярной перфузии.
- пробу на инфузию – быстро (10-20мл в минуту) вводят 200-400мл физ.р-ра под контролем ЧСС и АД. Если при этом уменьшается тахикардия и нормализуется АД, то это говорит в пользу объемной инфузии.
Проведение объёмной инфузии при отсутствии вышеперечисленного комплекса клинических и лабораторных признаков или до начала вазодилятации приведет к выдавливанию всей инфузии в интерстиций. При наличии признаков нормо- и гипергидратации объёмная инфузия не показана, так как необходимо вернуть жидкость из интерстиция в сосудистое русло, а не продолжать его переполнять. Необходимо понять, что сосуды не «резиновые», чтобы воспринимать объемную инфузию и вмещать ее без предварительного изменения тонуса – нужно сначала расслабить артериолы, увеличить количество функционирующих каппиляров, т.е. увеличить емкость «сосудистого вместилища». Резервная емкость венозной системы определяется изменением конфигурации вен из «сплющенных» до округлых и ориентировочно составляет не более 800-1000мл у взрослого человека и не может оправдать инфузионную терапию в несколько литров.
Нормоциркуляторный вариант кровообращения
Чаще всего свидетельствует о нормальном функционировании ССС. Однако при разной производительности сердца при разных условиях, но при нормальном ОПСС может быть и выраженная дисфункция ССС. Например, если достаточная производительность сердца и достаточный уровень АД поддерживается за счет тахикардии. Могут наблюдаться и клинические варианты, когда может иметь место артериальная гипотония или гипертензия на фоне любых нарушений ритма. В этих случаях имеет место отсутствие физиологического прироста АД к ЧСС, или его избыточный прирост. Состояние кожных покровов зависит от уровня АД.
Тактика коррекции будет зависеть от первопричины, которую необходимо устранить в первую очередь, и вида нарушений ритма. Необходимо учитывать воздействие на ОПСС препаратов, которые решено применять для лечения, чтобы не усугубить гемодинамическую ситуацию.
Гиперциркуляторный вариант кровообращения
Патологический вариант кровообращения, более «легкий» для сердца, но чрезвычайно опасный, т.к. обычно развивается на фоне нарушения регуляторных механизмов сосудистого тонуса, связанных с тяжелыми нарушениями КЩС, ВСО, интоксикацией или выраженной дисфункцией ЦНС или надпочечников. Этот вариант кровообращения сопровождает анафилаксию, септический шок.
Опасен снижением скорости кровотока, особенно на фоне гиперкоагуляции (ДВС синдрома), когда развиваются массивные генерализованные микротромбозы, блокирующие микроциркуляцию во всех органах и приводящие к необратимой полиорганной недостаточности. Также, за счет снижения скорости кровотока, уменьшается доставка кислорода к тканям, прогрессирует метаболический ацидоз, что еще больше нарушает регуляцию сосудистого тонуса. В конечном итоге, за счет блока микроциркуляции и повышения ОПСС, гиперциркуляция сменяется гипоциркуляцией, предвещая печальный исход.
Клинически характеризуется хорошим периферическим кровотоком даже при низком АД. Сопровождается компенсаторной тахикардией и высокой амплитудой плетизмограммы при контроле сатурации, опять же, несмотря на низкое АД. Обычно сопровождается повышенным диурезом. Диурез сохраняется даже при АД, меньшим, чем «почечный порог» - САД ниже 80 мм.рт.ст.
Подтвердить данный вариант кровообращения можно «мезатоновой пробой» (Туркин В.Ф.) - мезатон 0,5мл (5мг) разводят до 10-20мл и начинают дробно (по 1-2мл р-ра) вводить в/в с интервалами в 1-2 минуты под контролем ЧСС и АД. Проба считается положительной, если при введении мезатона значимо снижается ЧСС и увеличивается АД. Это подтверждает наличие сосудистой недостаточности и определяет показания для дозированного введения мезатона.
Дозу мезатона подбирают с учетом величины ЧСС и АД. Обычно достаточно введение 2-5мг мезатона в час (4мл мезатона на 20мл физ.р-ра, скорость перфузора – 1-3мл в час). Необходимо контролировать и состояние кожных покровов, чтобы со временем не перевести сосудистую недостаточность в периферический спазм. По мере стабилизации состояния, дозу мезатона уменьшают, опять же, ориентируясь на ЧСС, АД и состояние кожных покровов.
Удобно введение мезатона подкожно (0,5-1мл 1%р-ра), когда срабатывает «автоматизм резорбции» - при расслабленных сосудах резорбция хорошая и доза мезатона, попадающего в кровоток высокая, по мере спазмирования периферии степень резорбции уменьшается и доза «автоматически» уменьшается.
Следует подчеркнуть, что обычно развивающаяся при гиперциркуляции тахикардия носит компенсаторный характер и лечить ее антиаритмическим препаратами непатогенетично и опасно – устранение механизма компенсации при неустраненной причине приводит к сердечной недостаточности или к ее декомпенсации. Тем более, что практически все антиаритмические препараты еще более уменьшают ОПСС.
Гиперциркуляция достаточно часто сопровождает регионарные методы анестезии за счет симпатического блока и регионарной вазодилятации. В таких случаях, при отсутствии гемоконцентрации и явного дефицита жидкости, протекает благоприятно, так как хорошо коррегируется введением симпатомиметиков (эфедрин или мезатон дозировано или подкожно). Однако, в таких ситуациях достаточно часто применяют и объемную инфузию, заполняя дилятированные сосуды.
При решении вопроса о необходимости применения вазопрессоров или объемной инфузии при регионарной анестезии, необходимо учитывать несколько факторов и представлять отдаленные последствия - через несколько часов прекратиться действие анестетика и восстановиться сосудистый тонус – емкость сосудистой системы уменьшиться. Если сердце здорово и почки функционируют нормально, то организм достаточно быстро избавиться от избыточной инфузии. При неполноценной же функции почек и наличии хронической сердечной недостаточности вся инфузированная жидкость (за исключением коллоидов) не уйдет через почки, а выдавиться в интерстиций, прежде всего в ткань мозга, в легкие и в кишечник. Последствия понятны и достаточно часто наблюдаются в послеоперационном периоде у пациентов преклонного возраста с сопутствующими заболеваниями – энцефалопатия с головными болями (отек ГМ), которую принимают за токсическое действие анестетиков или «подкол»; развитие или декомпенсация сердечно-легочной недостаточности, которую принимают за пневмонию; парез кишечника, который воспринимают как послеоперационный.
При необоснованном применении коллоидов ситуация усугубляется тем, что коллоиды могут «добить» скомпроментированные почки (см.инструкцию по применению), либо, уходя рано или поздно в интерстиций, поддерживать отеки.
Особенно быстро коллоиды уходят в интерстиций при любой интоксикации – синдроме капиллярной утечки.
Влияние медикаментов на показатели кровообращения
Необходимо помнить, что практически любой препарат в той, или иной мере воздействует на показатели кровообращения, иногда регионарного. В настоящее время такая информация пока ещё не всегда указывается в инструкции по применению. Обычно изучается действие фармаколгических средств на организм с использованием параметров ЦГ. Основоположником таких детальных исследований можно считать Крис Р.Манк. Им предложено целенаправленно изучать действие лекарственных средств на ДНЛЖ, СИ и ОПСС.
Во всяком случае, необходимо стараться учитывать известное влияние препаратов на гемодинамику, особенно нарушенную, чтобы не усугубить ситуацию.
Кардиотоническая поддержка
Кардиотоническая (инотропная) поддержка в условиях отделения интенсивной терапии может быть обеспечена введением дофамина.
Суть и эффект кардиотонической поддержки определяется фармакологическим действием дофамина на сердечно-сосудистую систему.
Дофамин в кардиотонической дозировке повышает производительность и выносливость сердца за счет оптимизации сердечного выброса – увеличения его скорости без повышения потребности в кислороде и без увеличения ОПСС. За счет этого уменьшается ЧСС, повышается АД.
Также дофамин обладает мягким диуретическим эффектом. В почечной дозировке за счет дилатации почечных сосудов, а в кардиотонической и за счет повышения скорости общего кровотока и активизации эффекта Бернулли – жидкость из интерстиция начинает более интенсивно поступать в сосудистое русло, а далее выводиться через почки.
Показанием для начала кардиотонической поддержки являются любые нарушения кровообращения, за исключением тех, которые сопровождаются артериальной гипертензией. Показанием для введение дофамина являются признаки задержки жидкости в интерстиции, хроническая или острая почечная недостаточность, особенно при олигоанурии. Хотя доказано, что дофамин не улучшает прогноз при ренальной ОПН, но улучшение почечного кровотока никому не помешает.
Есть литературные данные, что рутинное-профилактическое назначение дофамина у больных в критических состояниях или после объемных вмешательств, даже при отсутствии клинических признаков нарушений кровообращения, значимо уменьшает количество осложнений и летальность.
Дофамин особенно показан при тахикардии, обусловленной хронической или острой сердечной недостаточностью. Мнение, что дофамин противопоказан при тахикардии, основано на безграмотном его применении в слишком высокой дозе. Так же безграмотен отказ от применения дофамина со ссылкой на нормальное АД, несмотря на отсутствие прироста АД к ЧСС или наличие отеков, в т.ч. и интерстициальных.
В то же время следует помнить об опасности дофамина, а точнее опасности для жизни пациента при его передозировке. Именно дофамином добивают больных в шоковых состояниях, пытаясь поднять АД без устранения причины гипотонии - не устраняя высокую постнагрузку или не восполняя кровопотерю. Только безграмотный врач вводит ампулу дофамина (200мг – 5 мл 4%р-ра) в чистом виде или даже в разведении за несколько минут или за два-три часа. Такой дозой можно убить абсолютно здорового человека! 200 мг дофамина вводятся как минимум 5-8 часов!
Дозировка дофамина рассчитывается исходя из веса пациента: почечная – 3-5мкг/кг в минуту, кардиотоническая – 5-10 мкг/кг в минуту.
Расчет может производиться следующим образом: больному 70 кг при кардиотонической дозе в 5 мкг/кг в минуту, за минуту необходимо вводить 350 мкг (70кг*5мкг), за час 21000мкг (350мкг*60мин) или 21 мг. Одной ампулы – 200мг хватит почти на 10 часов (200мг/21мг). Скорость введения будет зависеть от способа введения. Если 200мг развести до 20мл и вводить перфузором (шприц-дозатором), то скорость будет составлять примерно 2мл в час. Если 200мг развести на 400мл физ.р-ра, то этот флакон будет капаться примерно 10 часов, т.е. 40 мл в час = примерно 0,65 мл в минуту(40мл/60минут). Если в одном мл 18 капель (количество капель в 1 мл обычно пишут на упаковке системы), то скорость будет составлять примерно 12 капель за минуту. Если во флакон на 400 мл добавить 2 ампулы дофамина (400мг), то скорость соответственно уменьшиться в 2 раза – примерно 6 капель за минуту.
Такой расчет, так же как и рекомендованные дозы, достаточно относительны. После начала введения, минут через 10-15, необходимо оптимизировать скорость введения с учетом клиники. При недостаточной дозе клинического эффекта в виде уменьшения тахикардии или подъема АД не будет, а при передозировке тахикардия увеличиться. Таким образом, необходимую кардиотоническую дозу можно подобрать, изменяя – повышая скорость введения до повышения ЧСС, а затем уменьшив скорость введения на 20-25%.
Одним из условий эффективного и безопасного применения дофамина является правило его введения через отдельный катетер или через отдельный просвет многопросветного катетера. Суть такой рекомендации в том, что если просвет катетера будет заполнен раствором дофамина, а это 2-3мл раствора, и в это время через катетер начать вводить другой раствор или препарат, то в кровоток попадет сразу несколько мг дофамина. Это, обычно, вызывает тахикардию, аритмию, артериальную гипертензию и может стать причиной остановки сердца. Именно поэтому также рекомендуется использовать растворы дофамина с низкой концентрацией – 1-2 ампулы (200-400мг) разводят в 250-500 мл физ.р-ра.
Список использованных источников
1 Fick A. Mechanische Arbeit und Warmeentwicklung bei der Muskeltatigkeit.- Leipzig, 1982.- 273 S.
2 Putterman C. The Swan-Gans catheter: A decade of hemodynamic monitoring. //J.Crit. Care.- 1989. - №4. - Р.127-146.
3 Swan H.J. Balloon flotation catheters: their use in hemodynamic monitoring in clinical practic// J.A.M.A. – 1975.-Vol.233-P.865
4 Багатурия Д.Ш. Допплер-эхокардиографическое определение степени легочной гипертензии и давления в правом желудочке у больных с дефектами межжелудочковой перегородки. //Кардиология.-1991.-№6.-С.67-70.
5 Дерябин И.И., Насонкин О.С. Травматическая болезнь. – Л.: Медицина, 1987. – 246 с.
6 Карпман В.Л. Физиология сердечного выброса. -Киев, 1970. –С.175-180.
7 Кассиль В.Л. Искусственная вентиляция лёгких в интенсивной терапии. -М.: Медицина, 1987. -255 с.
8 Кедров А.А. Электроплетизмография как метод объективной оценки кровообращения: дис.канд.мед.наук., Л., 1949.
9 Костантинов Б.А., Сандриков В.А., Яковлев В.Ф. Оценка производительности и анализ поцикловой работы сердца. – Л.: Медицина, 1986. – 98 с.
10 Крис Р.Манк. Новые инотропные препараты, применяемые в интенсивной терапии. // Вестник интенсивной терапии. – 1992. - №1. – С.43-44.
11 Лебедева Р.Н. Осложнения в системе кровообращения после хирургических вмешательств. – М., 1989. – 176 с.
12 Лищук В.А. Математическая теория кровообращения. – М.: Медицина, 1991. – 256 с.
13 Лынёв С.Н. Оценка кислородтранспортной функции крови. //Анестез. и реаниматол. - 1986. - №2. - С.57-59.
14 Малышев В.Д., Острая дыхательная недостаточность. М.: Медицина, 1989.- 240 с.
15 Маршалл Р.Д., Шеферд Д.Т. Функция сердца у здоровых и больных /пер. с англ./.- М., 1972.- 391 с.
16 Митьковская Н.П., Пименова Т.Н. Ультразвуковая оценка состояния сердца и давления в легочной артерии у больных ревматическими заболеваниями. //Тер.архив. – 1992. - №12.- С.37-41.
17 Морган Дж.Э., Мэгид С.М. Клиническая анестезиология. Книга вторая. -М.: Бином, 2000г.- 365 с.
18 Мухарлямов Н.М., Беленков Ю.Н. Ультразвуковая диагностика в кардиологии. – М.: Медицина, 1981. -188 с.
19 Плесков Л.П., Мазурина О.Г. Гемодинамический мониторинг: современные тенденции развития. //Анестез. и реаниматол. - 1998. - №3. - С.44-48.
20 Полонецкий В.Г. Клиническая реография. //Кардиология. -1985. - №3. - С.50-52.
21 Пушкарь Ю.Т. и др. Определение сердечного выброса методом тетраполярной грудной реографии и его метрологические возможности. //Кардиология.- 1977. -№7. - С.85-90.
22 Рябов Г.А. Гипоксия критических состояний. – М.: Медицина, 1988. – 288 с.
23 Рябов Г.А. Синдромы критических состояний.- М., 1994. - 368 с.
24 Старлинг Э. Основы физиологии человека /пер. с англ./. – М. 1933. - Т.2. – С. 168-214.
25 Фолков Б., Нил Э. Кровообращение /пер. с англ./. –М.: Медицина, 1976. - 214 с.
26 Чурсин В.В. Моделирование центральной гемодинамики в интенсивной терапии у больных с хирургическими заболеваниями. Дисс к.м.н. – Алматы 2007.
27 Шанин В.Ю. Патофизиология критических состояний. - С.-Петербург, 2003. - С.161-185.
28 Шмидт Р., Тевс Г. Физиология человека /пер. с англ./.- М., 1986.- Т.3.- 425 с.
